氮硫互作提高大蒜氮、硫含量及其关键同化酶活性
许建,贾凯,朱君芳,胡梅,王娜,高杰*
(1 新疆农业大学林学与园艺学院,乌鲁木齐 830052;2 新疆农业职业技术学院园林科技学院,新疆昌吉 831100)
氮硫互作提高大蒜氮、硫含量及其关键同化酶活性
许建1,2,贾凯1,朱君芳1,胡梅1,王娜1,高杰1*
(1 新疆农业大学林学与园艺学院,乌鲁木齐 830052;2 新疆农业职业技术学院园林科技学院,新疆昌吉 831100)
【目的】从生理学角度研究氮、硫两种营养元素配施对大蒜氮硫关键同化酶的影响,揭示氮硫关键同化酶与植株氮、硫同化能力的关系,以期为大蒜合理施肥与提质增效提供理论参考。 【方法】采用蛭石-珍珠岩盆栽方式,研究了不同浓度氮 (5、10、20 mmol/L)、硫 (2、4、8 mmol/L) 配施条件下,大蒜在幼苗期、花茎伸长期、鳞茎膨大初期和中期大蒜植株氮、硫含量,以及氮、硫关键同化酶活性的动态变化。 【结果】大蒜植株氮含量总体呈上升趋势,在鳞茎膨大期达到最高水平,而硝酸还原酶 (NR)、谷氨酰胺合成酶 (GS) 活性变化呈先上升后下降趋势,在花茎伸长期至鳞茎膨大初期活性较高。硫含量总体呈先上升后平稳趋势,ATP-硫酸化酶(ATPS) 活性在花茎伸长期达到最大值,而半胱氨酸合成酶 (OAS-TL) 活性则呈先下降后上升趋势,在花茎伸长期酶活性总体最低。鳞茎膨大期前,氮硫交互作用对氮、硫同化量有影响显著,而单因素影响不明显;鳞茎膨大期,单因素影响明显。硝酸还原酶、谷氨酰胺合成酶活性整体呈先升高后降低趋势。氮素对于 NR 活性影响显著,而对 GS 影响不显著;硫素仅在花茎伸长期和鳞茎膨大初期对NR活性有显著影响,而氮硫交互作用对NR、GS 均有显著或极显著影响。氮素、硫素对 ATP-硫酸化酶、半胱氨酸合成酶活性无显著影响,而氮硫交互作用对其影响极显著。NR 活性在花茎伸长期、鳞茎膨大初期与植株氮呈显著正相关关系,ATPS 活性在花茎伸长期、鳞茎膨大初期与植株硫含量呈显著正相关关系,Pearson 系数分别为 0.690、0.847 和 0.662、0.816。鳞茎膨大初期和中期,GS 活性与氮含量呈显著负相关,相关系数分别为 -0.857、-0.693。OAS-TL 活性与硫含量整体呈负相关,而在鳞茎膨大初期为 0.646,呈显著正相关。 【结论】大蒜生长过程中,氮、硫两元素间存在互作关系。NR、ATPS 等酶活性的提高增加了植株氮、硫同化能力,而 GS 则通过降低酶活性而促进氮的同化。在大蒜鳞茎膨大期前,氮、硫配施能够通过调控关键同化酶活性而影响氮、硫同化,进而影响植株生长;鳞茎膨大阶段,可以通过单一施肥达到调控大蒜植株氮或硫含量的目的。
大蒜;氮;硫;酶活性;同化;Pearson 相关系数
Pearson correlation coefficient
氮和硫都是植物的必需营养元素,氮是组成蛋白质、核酸、叶绿素、辅酶、植物激素和次生代谢物的必需组成元素[1-2]。硫对植物蛋白质合成、叶绿体构成和功能维持、辅酶,以及小分子物质合成、生长、抗逆调节等方面均有重要作用[3-5],更是含硫氨基酸 (半胱氨酸、甲硫氨酸等) 和次级代谢物 (十字花科的芥子油苷和葱属植物的风味前体物质 S-烃基半胱氨酸亚砜) 的组成成分[6]。硫的代谢与氮的代谢密切相关,如半胱氨酸的合成需要硫和氮同时参与,施用硫肥和氮肥可以提高 CSOs 的含量[7-8]。
研究证实小麦、玉米、大豆等作物生长过程中氮、硫元素间存在交互、协同作用[9-12],大蒜 (Allium sativum L.) 为百合科葱属植物,需硫量较大,氮、硫元素及交互作用对葱属植物生长与栽培品质均有重要的影响。孔灵君等[13],刘忠松等[14]分别研究了氮硫互作对大葱品质、主要元素吸收分配特性以及硫同化关键酶活性的影响,结果表明氮、硫水平及其互作效应对大葱 N、P、K、S 积累分配有显著影响,但硫的影响不及氮明显;低氮或者高氮条件下均抑制硫同化酶活性,而硫水平的提高则显著抑制 ATPS和 OASS 活性。为此,本文研究了不同浓度氮、硫元素互作对大蒜不同生长期氮硫关键同化酶活性与植株氮、硫含量的影响,从生理角度阐述氮硫互作对大蒜氮、硫同化的影响机制,以期为大蒜栽培中氮、硫元素合理配施提供技术参考。
1 材料与方法
1.1 试验设计
试验用大蒜品种为新疆白皮蒜,经地窖保藏越冬后,于 2015 年 4 月 18 日播种。栽培基质为蛭石、珍珠岩,配制比例 6∶4,蛭石粒度大小为 0.3~0.5 cm,栽培前先经蒸馏水充分淋洗。选用塑料栽培盆,盆高 20 cm,直径 15 cm,蛭石装载高度为盆高 4/5。每盆栽 2 株大蒜,置于塑料防雨棚下浇灌营养液培养。
营养液成分采用 Hoagland 营养配方,在大量元素、微量元素一致的基础上,采用缺素配方,分别设置 3 个氮素水平、3 个硫素水平,其中氮素水平调节使用硝酸铵,硫素水平调节使用硫酸钠。氮素水平分别为 5、10、20 mmol/L (记作 N1、N2、N3);硫素水平分别为 2、4、8 mmol/L (记作 S1、S2、S3),另设置空白对照组,即在其他营养元素一致基础上不施加氮素和硫素。采用二因素三水平完全随机区组设计,每组分别处理 30 盆。栽培期间,幼苗期每7天浇灌一次营养液,至花茎伸长期后每 3 天浇灌一次营养液。每浇灌 3 次营养液用蒸馏水清洗一次,清除积累的盐分。
分别在大蒜植株长至幼苗期 (6 月 1 日)、花茎伸长期 (6 月 29 日)、鳞茎膨大初期 (7 月 23 日)、鳞茎膨大中期 (8 月 28 日),随机选取 6 株植株,剪取最大功能叶,液氮处理后置于 -30℃ 冰箱中保存。
1.2 测定项目与方法
硝酸还原酶 (NR) 活性参照李合生等方法,采用活体法测定[15],酶活单位为 μg/(g·h),FW。
谷氨酰胺合成酶 (GS) 活性参照赵世杰等方法[16],以 540 nm 处吸光值大小间接表示酶活性,单位为OD/(mg·h),protein。
ATP 硫酸化酶 (ATPS) 活性测定参照 Ahmad 等方法[17],以 660 nm 处吸光值大小间接表示酶活性,单位为 OD/(mg·h),protein。
半 胱 氨 酸 合 成 酶(OAS-TL) 活 性 测 定 参 照Demosthenis 等方法[18],以半胱氨酸做标曲,酶活单位为 μmol/(g·min),FW。
干 样 经 超 微 粉 碎 后 , 过100 目 筛 , 准 确 称 取0.20 g 混合样分别用于测定全氮、全硫含量。其中全氮参照 GB50095-2010 采用分光光度法测定[19],全硫测定采用 BaSO4比浊法[20]。
1.3 数据处理
采用 DPS7.05 软件进行数据统计分析,方差分析采用 LSD (最小显著性差异) 进行差异显著性检验(α=0.05),Pearson 系数采用 SPSS18.0 进行计算,采用 SigmaPlot12.5 制图。
2 结果与分析
2.1 氮硫互作对大蒜植株氮、硫含量的影响
2.1.1氮素含量 由图 1 可见,大蒜植株中氮素含量总体呈上升趋势,特别是在大蒜鳞茎膨大期,氮素含量显著升高。在幼苗期,氮素含量集中在 1.36%~1.66%,以 N2S3、N3S3 处理含量最低,分别为0.98%、0.88%。在花茎伸长期,氮素含量以 N2 处理组最高,在此处理下随硫素浓度升高而降低;在 N3条件下整体氮素含量较低,随硫浓度升高有显著升高,但以对照组最低,为 0.70%。鳞茎膨大初期大蒜植株以 N1 处理氮素含量最高,硫素增加则降低了植株氮素含量;N2 处理条件下,以 S2 处理最高,为4.78%;N3 与 CK 处理氮素含量差异不显著。鳞茎膨大中期,不同氮素水平条件下均以 S2 水平处理氮素含量最高,随着硫素水平的升高而降低氮素吸收利用率,且 CK 最低,为 3.42%。
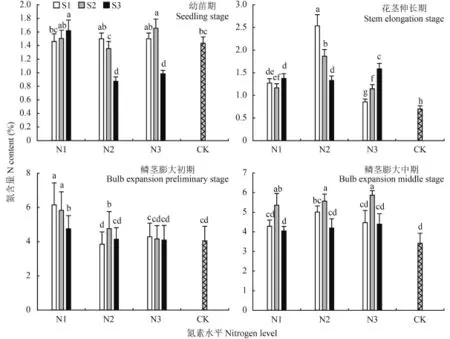
图1 氮硫互作对大蒜植株氮含量的影响Fig. 1 Influence of nitrogen and sulfur interaction on N contents of garlic plants[注(Note):柱上不同小写字母表示不同处理间差异达到 0.05 显著水平Different small letters above the bars mean significant difference among treatments at the 0.05 level.]
2.1.2硫素含量 由图 2 可见,大蒜植株硫含量总体呈先上升后平稳的趋势,且不同生长时期表现不一。幼苗期时在 N1、N3 条件下,随着硫素水平升高,植株硫素含量表现为先上升后下降,而在 N2 水平下则呈上升趋势,由 0.25% 升高到 1.08%。花茎伸长期 N1 处理组间差异较小,硫素施用越多则植株硫含量越小;随着氮水平的升高,硫素配施量的增加能够提高硫的吸收,而变化规律受到氮素水平影响,N2 条件下以 S2 最高,为 0.82%;N3 条件下以S3 最高,为 0.79%。鳞茎膨大初期与中期,氮硫互作对植株硫含量的影响较为一致,在同一氮素水平下均以 S2 处理最高,且在鳞茎膨大中期增施氮素或硫素均能够促进植株硫含量。
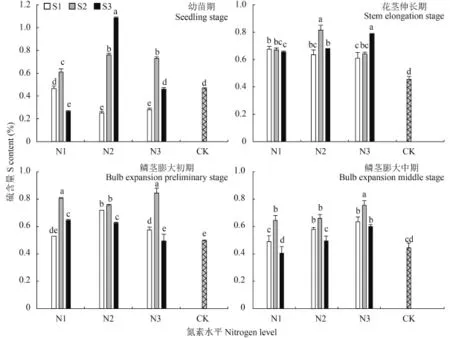
图2 氮硫互作对大蒜植株硫含量的影响Fig. 2 Influence of nitrogen and sulfur interaction on S contents of garlic plants[注(Note):柱上不同小写字母表示不同处理间差异达到 0.05 显著水平Different small letters above the bars mean significant difference among treatments at the 0.05 level.]
2.2 氮硫互作对大蒜叶片中氮关键同化酶活性的影响
2.2.1硝酸还原酶 (NR) 图 3 显示,不同生育时期大蒜叶片 NR 活性差异显著,整体呈先升高后降低趋势,处理组间差异显著。幼苗期,适当提高氮水平能够显著增加 NR 活性;低氮条件下 (N1) 硫的增施能够刺激酶活性升高,N2 时配施硫浓度达到 8 mmol/L时则显著抑制该酶活性;而高氮 (N3) 条件下则显著抑制酶活性的升高,各处理组与 N2 组比较分别降低40.74、54.57、25.64 μg/(g·h)。花茎伸长期与鳞茎膨大初期均以对照最低,为 32.31、41.31 μg/(g·h),随氮素水平升高 NR 活性整体呈上升趋势;各处理组酶活性均以 S2 处理最高,且该生长时期酶活性较稳定,变化趋势较一致。鳞茎膨大中期酶活性整体降低,硫施用量增加降低了酶活,以 N1S2 活性最高,为 67.21 μg/(g·h);N3S3 处理最低,为 24.04 μg/(g·h)。2.2.2谷氨酰胺合成酶 (GS) 由图 4 可见,在大蒜生长过程中,GS 活性整体呈先升高后降低趋势,在花茎伸长期该酶活性最高,随后各处理组的酶活性均有不同程度的降低。在大蒜不同生长时期,N1S2 处理在大蒜幼苗期、花茎伸长期 GS 活性最高,分别为2.65、14.08 OD/(mg·h),protein。可见在该过程中酶活性急剧升高。幼苗期时,以 N2 水平下 GS 活性最低,在相同氮素水平条件下,随着硫素浓度升高 GS 活性呈先上升后下降趋势。花茎伸长期,以 N3 水平下 GS活性最低,且处理组间差异不显著;随着氮素水平升高,在低硫 (S1) 条件下 GS 活性先升高后降低,在 S2、S3 条件下则呈下降趋势。在大蒜鳞茎膨大初期、中期,空白对照的酶活性则最高,分别为 6.89、4.74 OD/ (mg·h),protein;鳞茎膨大初期除对照外,其它处理组间酶活性差异较小,介于 4.71~5.55 OD/(mg·h),protein;在鳞茎膨大中期,以 S2 水平下酶活性差异最大,随氮素水平升高 GS 活性显著降低,由 4.51 OD/(mg·h),protein 降至 2.98 OD/(mg·h),protein。

图3 氮硫互作对大蒜叶片中 NR 活性的影响Fig. 3 Influence of nitrogen and sulfur interaction on NR activities of garlic leaves[注(Note):柱上不同小写字母表示不同处理间差异达到 0.05 显著水平Different small letters above the bars mean significant difference among treatments at the 0.05 level.]
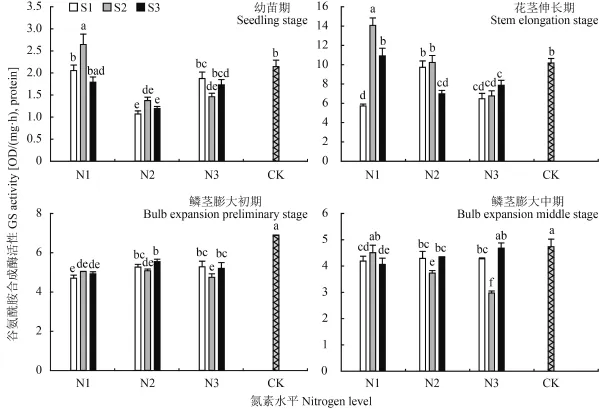
图4 氮硫互作对大蒜叶片中 GS 活性的影响Fig. 4 Influence of nitrogen and sulfur interaction on GS activities of garlic leaves[注(Note):柱上不同小写字母表示不同处理间差异达到 0.05 显著水平Different small letters above the bars mean significant difference among treatments at the 0.05 level.]
2.3 氮硫互作对大蒜叶片中硫关键同化酶活性的影响
2.3.1ATP硫酸化酶(ATPS) 由图 5 可见,ATPS 活性在大蒜不同生长时期表现各不相同,总体呈先上升后下降趋势,且处理组间存在显著性差异。在大蒜幼苗期不同氮素水平下,N2 处理组酶活性整体偏低,其中 N2S1 最低,为 2.77 OD/(mg·h);在高氮(N3) 条件下,S1 时酶活性最高,为 6.47 OD/(mg·h),S2 时酶活性最低,为 3.99 OD/(mg·h)。花茎伸长期,ATPS 活性较幼苗期整体升高;随氮素水平的提高,S1 时呈先上升后下降,S2 时呈上升趋势,而S3 水平下呈下降趋势。可见硫素水平对 ATPS 的影响与氮素水平有密切关系,两元素之间有显著的互作关系。大蒜鳞茎膨大初期在高氮 (N3) 时 ATPS 活性较低,其中 N3S1 为 1.58 OD/(mg·h);在中度氮素(N2) 条件下,酶活性较高,N2S3 为 11.13 OD/(mg·h),可见在此时期氮素的过量供给能够降低 ATPS 活性,而硫的增施能够相应刺激酶活性应答。鳞茎膨大中期,酶活性变化趋势较为一致,在试验氮素水平范围内,酶活性随硫素施用水平升高而升高;在高氮条件下,N3S3 酶活最高,为 7.38 OD/(mg·h)。

图5 氮硫互作对大蒜叶片中 ATPS 活性的影响Fig. 5 Influence of nitrogen and sulfur interaction on ATPS activities of garlic leaves[注(Note):柱上不同小写字母表示不同处理间差异达到 0.05 显著水平Different small letters above the bars mean significant difference among treatments at the 0.05 level.]
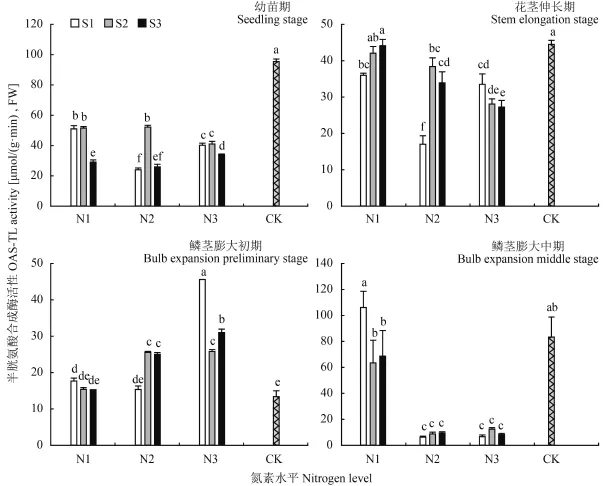
图6 氮硫互作对大蒜叶片中 OAS-TL 活性的影响Fig. 6 Influence of nitrogen and sulfur interaction on OAS-TL activities of garlic leaves[注(Note):柱上不同小写字母表示不同处理间差异达到 0.05 显著水平Different small letters above the bars mean significant difference among treatments at the 0.05 level.]
2.3.2半 胱 氨 酸 合 成 酶(OAS-TL) 乙 酰 丝 氨 酸裂解酶 (OAS-TL,又称半胱氨酸合成酶) 能够催化乙酰丝氨酸与硫化物反应,生成半胱氨酸,是硫同化的关键合成酶。由图 6 可见,在幼苗期和花茎伸长期均以对照组 OAS-TL 活性最高,分别为 95.49、44.50 μmol/(g·min),FW。该时期 N、S 交互作用对酶活性影响有所差异,低氮条件下在幼苗期时,随着硫素水平增加酶活性呈下降趋势,而花茎伸长期则表现为上升趋势;N2 条件下,低硫 (S1) 与高硫(S3) 对 OAS-TL 活性均有所抑制;N3 条件下,硫供给水平的升高则显著抑制该酶活性,分别比 S1 水平下降低17.96%、22.89%。鳞茎膨大初期,N1 条件下 OAS-TL活性对硫供给水平响应不显著,处理间差异不明显;随氮素水平升高,该酶活性呈升高趋势,但在 N3 水平下,硫水平提升反而抑制 OAS-TL 活性。鳞茎膨大中期,对照组与低氮处理组的 OAS-TL 活性显著升高,而 N2、N3 处理组叶片酶活性急剧降低。
2.4 氮硫互作对大蒜植株氮、硫含量影响的方差分析
由表 1 可见,大蒜植株氮、硫含量对氮硫互作水平的响应情况,大蒜在幼苗期、花茎伸长期 N、S对大蒜植株氮含量没有显著影响,而 N × S (交互作用) 对其影响极显著;鳞茎膨大初期 N 对氮含量有显著影响,而 S、N × S 均无显著影响;在鳞茎膨大中期,N、S 对氮含量有显著或极显著影响,N × S 效应不明显。较氮含量而言,植株硫含量对氮硫互作响应有所差异,在幼苗期、花茎伸长期时仅 N × S 对其有显著影响;鳞茎膨大初期,S、N × S 分别有显著、极显著影响,而 N 无显著影响;鳞茎膨大中期时 N、S 均有极显著影响,而 N × S 作用不明显。
2.5 氮硫互作对大蒜叶片中氮硫关键同化酶影响的方差分析
氮硫互作对不同生长期大蒜叶片中 NR、GS、ATPS、OAS-TL 活性影响的方差分析结果见表 2。对于氮合成关键酶分析可知,NR 与 GS 在不同生长时期对氮硫互作水平响应不一,NR 对氮素供应较为敏感,仅在鳞茎膨大中期氮素对其无显著影响,硫在花茎伸长期、鳞茎膨大初期对其也有显著影响;且 N × S 交互作用对 NR 活性有显著或极显著影响。GS 仅在幼苗期对氮素供给有显著响应,硫素对其影响不显著,而 N × S 交互作用对其多有极显著影响。
通过对 ATPS 与 OAS-TL 酶活性方差分析可知,单独施用氮肥或硫肥对提升这两种酶活性的影响不显著,在大蒜生长过程中 N × S 交互作用对幼苗期后大蒜叶片的 ATPS 活性,以及鳞茎膨大中期之前的 OAS-TL 活性均有极显著影响。

表1 氮硫互作对大蒜植株氮、硫含量影响的方差分析 (F 值)Table 1 ANOVA analysis of N and S interaction on activities of nitrogen and sulfur contents in garlic plants (F value)
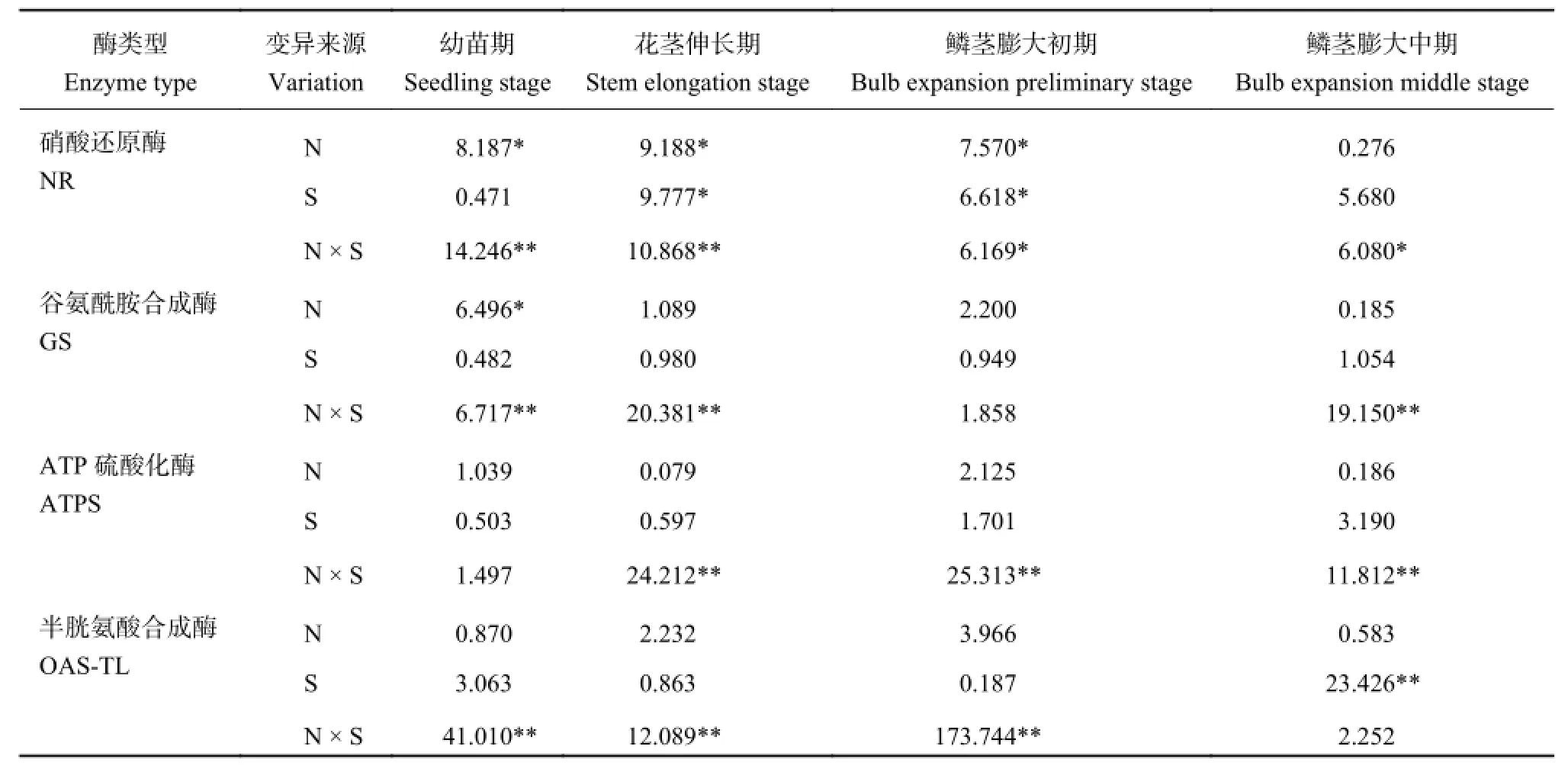
表2 不同处理对大蒜叶片中氮硫关键同化酶影响的方差分析 (F 值)Table 2 ANOVA analysis of the N and S treatments on activities of key enzymes in garlic leaves (F value)
2.6 氮、硫同化关键酶与氮或硫同化关系分析
由表 3 可见,大蒜生长过程中,NR 活性与氮含量呈正相关关系,而 GS 整体为负相关关系。幼苗期,NR 活性与植株氮含量相关性不显著,相关系数仅为 0.027,在花茎伸长期与鳞茎膨大初期为显著性相关,Pearson 系数分别为 0.690、0.847。在幼苗期和花茎伸长期,GS 活性与氮含量相关性不显著,鳞茎膨大初期、中期为显著性关系,相关系数分别为-0.857、-0.693。由此可知,NR 对大蒜植株氮同化为正向调控,GS 表现为负向调控。
由表 4 可见,大蒜幼苗期 ATPS、OAS-TL 与植株硫含量间无显著关系,ATPS 活性与硫含量整体呈正相关关系,而 OAS-TL 整体为负相关关系。ATPS在花茎伸长期与鳞茎膨大初期为显著性相关,Pearson 系数分别为 0.662、0.816。OAS-TL 在鳞茎膨大初期为显著性关系,Pearson 系数为 0.646;虽然在花茎伸长期未呈现显著性关系,但相关性系数较高,且为负相关关系。
3 讨论与结论
硝酸还原酶 (NR) 作为氮同化的第一个步骤,是氮同化的关键限速酶之一[21]。植物硫素同化过程先由ATP 提供能量,ATP 硫酸化酶催化 SO42-生成 APS (5’-腺苷磷酸硫酸) 是硫同化的第一步[22]。OAS-TL 催化硫化物与乙酰丝氨酸 (OAS) 反应合成 Cys;半胱氨酸合成是硫同化的最后一个步骤[23-24]。
由结果分析已知,氮素总体呈上升趋势,以鳞茎膨大期上升幅度最大;而 NR 与 GS 活性在大蒜生长过程中均呈先上升后下降趋势,且在花茎伸长期、鳞茎膨大初期酶活性整体水平最高。硫含量整体呈先上升后平稳特征,ATPS 活性在花茎伸长期最大,而 OAS-TL 活性变化则相反,以该时期酶活性最低。分析认为 NR、ATPS 等酶活性的提高增加了植株氮、硫同化能力的提升,而 GS、OAS-TL 则可能是通过降低酶活性促进硫的同化。

表3 不同生长时期 NR、GS 活性与植株氮含量线性拟合方程及其相关系数Table 3 Liner fitting equation and Pearson correlation coefficient between the NR and GS activities and nitrogen contents

表4 不同生长时期 ATPS、OAS-TL 活性与植株硫含量的线性拟合方程及 Pearson 系数Table 4 Linear fitting equation and Pearson correlation coefficient between the ATPS and OAS-TL activities and sulfur contents at different growth stages of garlic
氮硫的供应显著影响植株对氮、硫的同化,以及相关代谢酶活性。研究表明,硫素的施用不仅能够激活 ATP 硫化酶的活性,而且能够增强硝酸还原酶活性,同时增加叶片中的可溶性蛋白与叶绿素含量[25]。Fazili 等[26]研究氮硫交互作用对油菜氮同化的影响,认为与仅施用氮肥相比,增加硫的施用量能够通过提高 NR 活性而增强氮素同化能力。刘忠松等[14]认为,大葱在低硫和氮素充足供应条件下 ATPS和 OAS-TL 活性最大,高硫条件下硫关键同化酶活性则相对减小。
在大蒜生长过程中,叶片中氮、硫关键同化酶活性整体呈先上升后下降趋势,且在各生长阶段,氮硫互作对酶活性影响不一。提高氮素供给量,可以 提 高 NR 活 性 , 但 在 高 氮 条 件 下 则 抑 制 该 酶 活性;增加硫的供给,也提高 NR 活性。氮、硫单一元素对 GS 活性无显著影响,而两元素间交互作用影响甚为明显。氮、硫单一元素对硫关键同化酶无显著影响,而交互作用则起到显著作用。氮硫之间交互协同作用的分子机制尚不完全明晰。Koprivova 等[27]认为氮-硫同化途径存在密切交互作用,试验证实在营养液中增加 NH4+能够提高合成蛋白质的氨基酸合成量;OAS 是合成半胱氨酸限速步骤,被认为是联系氮硫互作关系路径的重要中间产物,OAS 在硫酸盐和硝酸盐同化过程中起到协调作用。OAS 增加不仅 能 够 提 升 硫 的 吸 收 , 而 且 提 高APR 活 性 以 及mRNA 水平,OAS 在此过程中具有重要作用[28]。
氮、硫两元素间互作关系复杂,若明晰这一机制,尚需从关键中间产物合成量、关键酶基因表达量着手,特别是转录水平与代谢组学方面进行系统阐述。综合分析可知,大蒜在鳞茎膨大期前,能够通过氮、硫配施的互作关系调控关键同化酶活性而影响氮、硫同化;而在鳞茎膨大期,可以通过单一施肥达到调控大蒜植株氮或硫含量的目的。
[1]Marschner H. Mineral nutrition of higher plants [M]. Amsterdam:Elsevier Press, 2012.
[2]吴魏, 赵 军. 植物对氮 素 吸 收 利用的研 究 进 展[J]. 中国农 学 通 报, 2010, 26(13): 75-78.Wu W, Zhao J. Advances on plants’ nitrogen assimilation and utilization [J]. Chinese Agricultural Science Bulletin, 2010, 26(13):75-78.
[3]李 国 强, 朱云集, 沈学善. 植 物 硫 素 同 化 途 径 及 其调控[J]. 植物生理学通讯, 2005, 41(6): 699-704. Li G Q, Zhu Y J, Shen X S. Plants sulphur assimilation pathways and its regulation [J]. Plant Physiology Communications, 2005, 41(6):699-704.
[4]吴 宇, 高 蕾, 曹 民杰, 等. 植物硫营养代谢、调控 与 生 物 学功能[J].植物学通报, 2007, 24(6): 735-761. Wu Y, Gao L, Cao M J, et al. Plant sulfur metabolism, regulation, and biological functions [J]. Chinese Bulletin of Botany, 2007, 24(6):735-761.
[5]谢 瑞 芝, 董树亭, 胡昌浩. 植 物 硫 素 营 养 研 究 进 展[J]. 中国农学通报, 2002, 18(2): 65-69. Xie R Z, Dong S T, Hu C H. Research progress in sulfur plant nutrient [J]. Chinese Agricultural Science Bulletin, 2002, 18(2):65-69.
[6]许真, 严永哲, 卢钢, 等. 葱属蔬菜植物风味前体物质的合成途径及调节机制[J]. 细胞生物学杂志, 2007, 29(4): 508-512. Xu Z, Yan Y Z, Lu G, et al. The biosynthetic pathways of flavor precursors and its control in alliums [J]. Chinese Journal of Cell Biology, 2007, 29(4): 508-512.
[7]Salvagiotti F, Julio M, Miralles D J, et al. Sulfur fertilization improves nitrogen use efficiency in wheat by increasing nitrogen uptake [J]. Field Crops Research, 2009, 113(2): 170-177.
[8]Tatjana B, Zdenko R. Nitrogen and sulfur uptake and remobilization in canola genotypes with varied N- and S-use efficiency differ at vegetative and maturity stages [J]. Crop and Pasture Science, 2011, 62(4): 299-312.
[9]蔡 铁, 王振林, 尹燕枰. 氮硫 配施对小麦籽 粒 谷蛋白大聚合 体 含量及粒度分布的影响[J]. 作物学报, 2011, 37(6): 1060-1068. Cai T, Wang Z L, Yin Y P. Combined effects of nitrogen and sulphur fertilization on content and size distribution of glutenin macropolymer in wheat grain [J]. Acta Agronomica Sinica, 2011, 37(6): 1060-1068.
[10]朱云集, 李国强, 郭天财, 等. 硫对不同氮水平下小麦旗叶氮硫同化关键酶活性及产量的影响[J]. 作物学报, 2007, 33(7): 1116-1121. Zhu Y J, Li G Q, Guo T C, et al. Effects of sulfur on key enzyme activities involved in nitrogen and sulphur assimilation in flag leaves and grain yield under different nitrogen levels in winter wheat (Triticum aestivum L.) [J]. Acta Agronomica Sinica, 2007, 33(7):1116-1121.
[11]谢瑞芝, 董树亭, 胡昌浩, 等. 氮硫互作对玉米籽粒营养品质的影响[J]. 中国农业科学, 2003, 36(3): 263-268. Xie R Z, Dong S T, Hu C H, et al. Influence of nitrogen and sulfur interaction on grain quality of maize [J]. Scientia Agricultura Sinica, 2003, 36(3): 263-268.
[12]Al-Redhaiman K N, Helal M I D, Shahin R R. Effect of sulfur blended N-fertilizers and nitrogen use efficiency and quality of lettuce yield [J]. Pakistan Journal of Biological Science, 2003, 6(16):1408-1412.
[13]孔灵君, 徐坤, 何平, 等. 氮硫互作对大葱氮、磷、钾、硫吸收分配特性的影响[J]. 植物营养与肥料学报, 2014, 20(1): 172-178. Kong L J, Xu K, He P, et al. Influence of interaction between nitrogen and sulfur on N, P, K and S absorption and distribution of Chinese spring onion [J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(1): 172-178.
[14]刘松忠, 陈清, 冯固, 等. 氮硫供应对大葱含硫有机物及其代谢关键酶活性的影响[J]. 西北农业学报, 2010, 19(6): 148-152. Liu S Z, Chen Q, Feng G, et al. Effects of nitrogen and sulfur supply on sulfur-containing compounds and activities of key enzymes for sulfur metabolism in Chinese spring onion [J]. Acta Agriculturae Boreali -occidentalis Sinica, 2010, 19(6): 148-152.
[15]李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. Li H S, Sun Q, Zhao S J, et al. The experiment principle and technology of plant physiology[M]. Beijing: Higher Education Press, 2000.
[16]赵世杰, 刘华山, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科技出版社, 1998. Zhao S J, Liu H S, Dong X C. Techniques of plant physiological experiment [M]. Beijing: China Agricultural Science and Technology Press, 1998.
[17]Ahmad S, Fazli I S, Jamal A, et al. Interactive effect of sulfur and nitrogen on nitrate reductase and ATP-sulfurylase activities in relation to seed yield from Psoralea corylifolia L. [J]. Journal of Plant Biology, 2007, 50(3): 351-357.
[18]Demosthenis C, Krishnan B. Sulfur assimilation in soybean:Molecular cloning and character of O-acetylserine(thiol)lyase (cysteine synthase)[J]. Crop Science, 2003, 43(9): 1819-1827.
[19]GB50095-2010. 食品中蛋白质的测定[S]. GB50095-2010. Determination of protein in foods [S].
[20]中国土壤学会农业化学专业委员会. 土壤农业化学常规分析方法[M]. 北京: 科学出版社, 1983. Agricultural Chemistry Committee of Chinese Soil Society. Analysis methods of soil and agricultural chemistry [M]. Bejing: Science Press, 1983.
[21]Hewitt R H. Crop physiology [M]. Wageningen, The Netherlands:Pudoc Press, 1980.
[22]Leustek T, Martin M N, Bick J A, et al. Pathways and regulation of sulfur metabolism revealed through molecular and genetic studies[J]. Annual Review of Plant Physiology and Plant. 2000, 51: 141-159.
[23]Saito K. Regulation of sulfate transport and synthesis of sulfurcontaining amino acids [J]. Current Opinion in Plant Biology, 2000, 3: 188-195.
[24]Luo J, Wu W J, Zhou B J, et al. Expression and purification of ATP sulfurylase from Saccharomyces cerevisias in Escherichia coli and its application in Pyro-sequencing [J]. Chinese Journal of Biotechnology, 2007, 23 (4): 623-627.
[25]Arshad J, Inayat S F, Saif A, et al. Effect of sulfur on nitrate reductase and ATP sulfurylase activities in groundnut (Arachis hypogea L.)[J]. Journal of Plant Biology, 2006, 49(6): 513-517.
[26]Fazili I S, Jamal A, Ahmad S, et al. Interactive effect of sulfur and nitrogen on nitrogen accumulation and harvest in oilseed crops differing in nitrogen assimilation potential [J]. Journal of Plant Nutrition, 2008, 31(7): 1203-1220
[27]Koprivova A, Suter M, Opden C R, et al. Regulation of sulfate assimilation by nitrogen in Arabidopsis [J]. Physiologia Plantarum, 2000, 122(3): 737-746.
[28]Hesse H, Trachsel N, Suter M, et al. Effect of glucose on assimilatory sulphate reduction in Arabidopsis thaliana roots [J]. Journal of Experiment Botany, 2003, 54(388): 1701-1709.
Nitrogen and sulfur interaction increase their assimilation and activities of key enzymes in garlic
XU Jian1,2, JIA Kai1, ZHU Jun-fang1, HU Mei1, WANG Na1, GAO Jie1*
( 1 College of Forestry and Horticulture, Xinjiang Agricultural University, Urmuqi 830052, China; 2 Garden Science and Technology College, Xinjiang Agricultural Vocational Technical College, Changji, Xinjiang 831100, China )
【Objectives】Researching physiological effects of nitrogen and sulfur application on related enzymes activities involved their assimilation will provide theoretical reference for garlic fertilization and improving product quality. 【Methods】A pot experiment using perlite and vermiculite as cultural substrate was performed. Two factors and three levels of the complete design were included. N was applied in levels of 5, 10 and 20 mmol/L and S in levels of 2, 4 and 8 mmol/L. Leaves and plants were sampled at the seedling stage, stem elongation stage, and bulb expansion preliminary and middle stages. 【Results】The nitrogen content of garlic was on the rise, and achieved the highest level at the bulb expansion stage. The nitrate reduction (NR) activity and glutamine synthetase (GS) activity were increased at first and then dropped later, and the enzymatic activities were higher from the stem elongation stage to bulb expansion preliminary stage. The sulfur content of garlic showed a trend of rise and then steady. At the stem elongation stage, the ATP sulfurylase (ATPS) activityreached its maximum value, while O-acetylserine thiollyase (OAS-TL) activity tended to rise after declining and reached its minimum level at the stem elongation stage. The nitrogen and sulfur interaction affected the N and S assimilation significantly before the bulb expansion stage, compared with the N or S alone. On the contrary, single factor effect was obvious at all the growth stages. The NR and GS activities showed increased first and then decreased in the development of garlic. N affected NR activity significantly. S affected NR activity significantly just at stem elongation stage and bulb expansion preliminary stage, while there was a significant interaction between N and S for NR and GS. The activities of key enzymes involved nitrogen and sulfur metabolism showed a minor impact with the N or S single fertilizer, but extremely significant with the N and S interaction. There were significantly positive correlations between the NR activities and N contents at the stem elongation stage and bulb expansion early stage and the Pearson correlation coefficients were 0.690 and 0.847, respectively, and the Pearson correlation coefficients between ATPS activities and S contents were 0.662 and 0.816. At the bulb expansion early and middle stages, the GS activities and N contents existed negative correlations, and the Pearson correlation coefficients were -0.857 and -0.693, respectively. The negative correlation was observed as a whole between the OAS-TL activity and S content, the Pearson correlation coefficient was 0.646 at the bulb expansion early stage. 【Conclusions】There is an interaction relationship between nitrogen and sulfur at growth stages of garlic. With the increase of activities of NR and ATPS, nitrogen and sulfur assimilation ability of garlic plant is promoted. On the contrary, GS accelerates nitrogen assimilation when the enzyme activity tends to decrease. Under the combined application of N and S, the nitrogen and sulfur assimilation is regulated by key enzymes before the bulb expansion stage, and the plant growth is stimulated. At the bulb expansion stage, the single application of nitrogen or sulfur fertilizer can affect the nitrogen or sulfur contents in garlic plants.
garlic (Allium sativum L.); nitrogen; sulfur; enzyme activities; assimilation;
2016-06-14 接受日期:2016-12-06
新疆研究生科研创新项目(XJGRI2014075);新疆维吾尔自治区园艺学重点学科基金项目资助。
许建(1982—),男,江苏铜山人,博士,主要从事蔬菜栽培及生理研究。E-mail:xujay1982@163.com
* 通信作者 E-mail:13999803260@163.com

