基于化学荧光法的双黄连口服液神经氨酸酶抑制活性测定
简 瑶
(成都市公共卫生临床医疗中心, 四川 成都 610106)
基于化学荧光法的双黄连口服液神经氨酸酶抑制活性测定
简 瑶
(成都市公共卫生临床医疗中心, 四川 成都 610106)
建立流感病毒神经氨酸酶体外活性荧光检测法测定双黄连口服液的NA抑制生物活性.采用化学荧光法测定双黄连口服液对神经氨酸酶的抑制率.结果表明,反应后溶液荧光强度与产物4-MU浓度在0.1~1.2 μg/mL内成良好的线性相关系(Y=39482X-254.05(r=0.9994)),该测定方法的精密度与重复性良好,反应后溶液在4 ℃条件下4 h内稳定,双黄连口服液对流感病毒神经氨酸酶的抑制率高达64.20%.该方法可用于测定双黄连口服液对神经氨酸酶抑制活性测定.
化学荧光法;神经氨酸酶抑制剂;活性测定
0 引 言
流感病毒属于正黏病毒科成员,为单分子负链RNA病毒,能引起上下呼吸道疾病[1],是流感的主要病源体[2].而神经氨酸酶是一个呈蘑菇状的四聚体糖蛋白,具有水解唾液酸的活性[3],当成熟的流感病毒经出芽的方式脱离宿主细胞之后,病毒表面的血凝素会经由唾液酸受体与宿主细胞膜保持联系,神经氨酸酶可将唾液酸水解,切断病毒与宿主细胞的最后联系,使病毒能顺利从宿主细胞中释放,继而感染下一个宿主细胞.因此,神经氨酸酶也成为流感治疗药物的一个作用靶点.
在我国,中成药在流感的预防和治疗中的应用非常广泛[4-7],其中双黄连口服液是由黄芩、金银花、连翘3味药组成[8],通过传统水提醇沉工艺精制而成,表里双解、气血两清,具有良好的清热解毒作用,为目前各大中医院急诊科的常用抗菌、抗病毒中成药,临床主要用于细菌或病毒引起的上呼吸道感染,也是儿童感冒治疗的常用中成药之一.此外,由于中成药的物质基础复杂,相关作用机制尚不明确,且缺乏准确的实验数据,限制了其临床使用.基于此,本研究拟对双黄连口服液对流感病毒神经氨酸酶活性的抑制效果进行研究,并在体外进行了抗流感病毒活性验证.
1 材料与仪器
1.1 药材与试剂
实验所用药材与试剂包括:双黄连口服液10批(批号,20120719、20130824,河南太龙药液股份有限公司;批号,20130920、20140427,东莞市亚洲制药有限公司;批号,20140612、20141009,黑龙江瑞格制药有限公司;批号,20150216、20150610,河南福森药液有限公司;批号,20160215、20160518,哈药集团三精制药有限公司);MDCK细胞、流感病毒(A/PR8/34),由军事医学科学院微生物传染病研究所保存;神经氨酸酶底物,4-methylumbelliferyl-N-acetyl-α-D-neuraminic acid(MUNANA),购于美国Sigma公司.
1.2 仪 器
实验所用仪器包括:Fluostar galary微板光学测定仪及配套荧光测定96孔板(德国BMG公司).
1.3 神经氨酸酶的制备
参照文献[8]所述方法对培养的MDCK细胞接种流感病毒(A/PR8/34标准株),待完全感染病变后取滤除细胞的病毒液,加NP-40灭活,用0.22 μm滤器滤过后分装,作为神经氨酸酶的储备液,-70 ℃冻存,备用.
1.4 缓冲溶液与反应终止液的配制
1)缓冲液的配制.称取0.64 g MES,0.044 g CaCl2溶于100 mL超纯水中,配成浓度为33 mmol/L MES,4 mmol/L CaCl2的缓冲溶液,并用盐酸调节pH值至6.5.
2)反应终止液的配制.称取0.08 g NaOH溶于1 000 mL超纯水中,配置成0.002 mol/L的溶液,备用.
2 方法与结果
2.1 神经氨酸酶的体外检测原理
化合物MUNANA是神经氨酸酶的特异性底物,在神经氨酸酶作用下的产物4-MU(7-Hydroxy-4-methylcoumarin,C10H8O3)在355 nm入射波长激发下,可以产生460 nm荧光,采用荧光检测器测定该波长荧光强度的变化,可灵敏地反映神经氨酸酶活性.在反应体系中加入能够抑制神经氨酸酶活性的药物,则相同条件下产物4-MU的量会相应减少,荧光强度会相应减弱,该药物的神经氨酸酶抑制活性就能通过荧光强度的变化被表征.
2.2 神经氨酸酶的体外活性实验
神经氨酸酶的体外活性实验在96孔荧光酶标板孔内进行,先加入20 μL待测药物配制溶液,加入适量稀释的神经氨酸酶30 μL混匀,室温静置10 min后加入反应物50 μL MUNANA(浓度为20 μmol/L),37 ℃温孵60 min,立即加入150 μL终止液NaOH(0.034 mol/L),测定荧光强度值,激发波长355 nm,发射波长460 nm.设置酶对照组与空白对照组,酶对照组用相同体积的超纯水代替待测样品,空白对照组用相同体积的超纯水代替待测样品,且用相同体积的缓冲液代替神经氨酸酶.抑制率计算公式为,
2.3 方法学考察
2.3.1 线性关系.
将神经氨酸酶储备液稀释至不同的浓度,在96 孔荧光酶标板孔内,各神经氨酸酶稀释液浓度值平行3组,按酶对照组进行实验,同时进行空白组实验,反应完后测定荧光强度(见图1),并用HPLC法测定各孔内4-MU的生成量(见图2).同时,采用统计学方法对2种测定方法所得结果进行相关性分析(见图3).
结果表明,溶液荧光强度与HPLC法测定的产物4-MU浓度在0.1~1.2 μg/mL内呈良好的线性相关系(Y=39482X-254.05(r=0.9994)),表明荧光强度测定所得结果能准确反映产物生成量.

图1 不同稀释比例反应后溶液荧光强度值
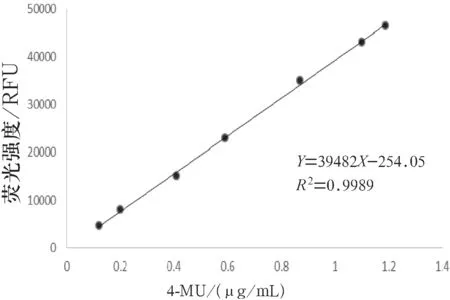
图3 4-MU浓度与荧光强度的关系
2.3.2 精密度.
取双黄连口服液于96孔板中,按待测药物组同时进行酶对照组与空白对照组实验,反应完成后连续重复测定溶液的荧光强度6次.计算抑制率的RSD值为1.68%,表明仪器的精密度良好.
2.3.3 重复性.
取同一批双黄连口服液6份于96孔板中,按待测药物组同时进行酶对照组与空白对照组实验,反应完成后分别测定溶液的荧光强度.计算抑制率的RSD值为2.42%,表明本方法的重复性良好.
2.3.4 稳定性.
取双黄连口服液于96孔板中,按待测药物组同时进行酶对照组与空白对照组实验,反应完成后立即于4 ℃冷藏,分别于0、1、2、3、4 h测定溶液的荧光强度.计算抑制率的RSD值为3.29%,表明本方法所制备的溶液于4 h内稳定.
2.4 多批样品流感病毒神经氨酸酶抑制率测定
取10批双黄连口服液分别于96孔板中,按待测药物组同时进行酶对照组与空白对照组实验,反应完成后立即测定溶液的荧光强度.分别计算10批双黄连口服液的抑制率,结果见表1.
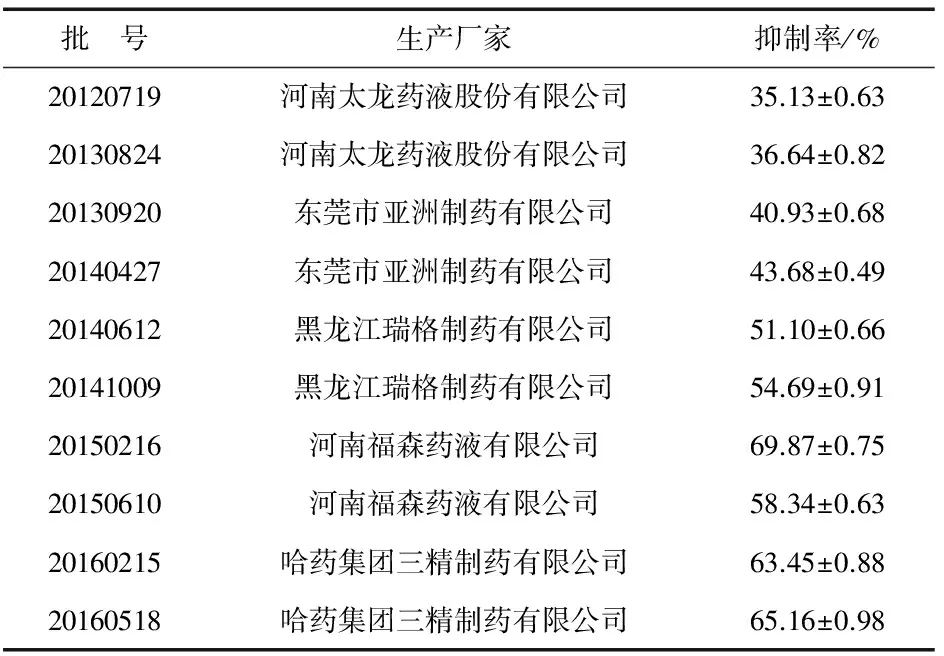
表1 10批双黄连口服液对流感病毒神经氨酸酶抑制率的测定结果(n=3)
表1数据显示,不同批次的双黄连口服液对流感病毒神经氨酸酶的抑制率存在差异,其范围为35.13%~69.87%,高低相差近2倍.通常,双黄连口服液的有效期为2年,其中批号为20120719、20130824、20130920、20140427、20140612、20141009,已经过了规定的有效期,其对流感病毒神经氨酸酶的抑制率明显低于批号为,20150216、20150610、20160215、20160518的双黄连口服液.实验表明,有效期内的双黄连口服液对流感病毒神经氨酸酶的抑制率达64.20%.
3 讨 论
本研究在前期实验中,详细考察了酶用量、底物MUNANA的用量、反应时间等因素,确定了化合物MUNANA与神经氨酸酶的反应条件.
化合物MUNANA在神经氨酸酶的作用下的产物4-MU在355 nm入射波长激发下,可以产生460 nm荧光,4-MU在溶液中的浓度与荧光强度呈良好的线性关系,且测定荧光强度快捷迅速,准确度与精密度良好,HPLC测定产物4-MU比较费时,故本研究采用测定荧光强度的方法来计算双黄连口服液对神经氨酸酶的抑制率.
双黄连口服液由黄芩、金银花、连翘组成.相关的体内实验研究表明,黄芩苷能通过影响细胞的凋亡受体途径FAS/FASL,激发病毒感染小鼠肺组织细胞的凋亡系统,发挥抗流感病毒感染的作用[9];体外实验研究表明,黄芩苷在病毒感染后24~48 h有抗病毒作用,基本上可以抑制流感病毒在细胞造成的损伤[10].此外,段林建等[11-12]的研究还表明,连翘具有抗甲型流感病毒的作用,在应对甲型及其他两型流感病毒引发的流行性感冒方面效果显著.本研究结果与以上文献研究结论一致.
[1]周汉良,陈季强.呼吸药理学与治疗学[M].北京:人民卫生出版社,1998.
[2]Belshe R B.Human Virology[M].Massachusetts,USA:PSG publishing Company,Inc,1984.
[3]曹鸿鹏,套佩珍,杜冠华.流感病毒神经氨酸酶抑制剂筛选模型的建立和应用[J].药学学报,2002,37(12):930-933.
[4]何维英,高荣梅,李兴琼,等.10种中成药体外抗病毒活性研究[J].药学学报,2010,45(3):395-398.
[5]申理,孟现民,张永信,等.常用抗流感口服中成药制剂[J].上海医药,2014,35(3):7-10.
[6]祖勉,周丹,高丽,等.临床常用中成药的体外抗流感病毒活性评价[J].药学学报,2010,45(3):408-412.
[7]中华中医药学会肺系病分会,中国民族医药药学会肺病分会.普通感冒中医诊疗指南(2015版)[J].中医杂志,2016,57(8):716-720.
[8]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2015.
[9]万巧凤,顾立刚,殷胜骏,等.黄芩苷对FM1肺炎小鼠肺组织细胞凋亡FAS/FASL系统的影响[J].中国药理学通报,2012,28(2):208-212.
[10]刘晓婷,张沂,顾立刚,等.黄芩苷体外抗流感病毒作用的研究[J].天津中医药,2015,32(4):229-233.
[11]段林建,张清,王农荣.连翘苷对甲型流感病毒核蛋白基因表达的影响研究[J].中国全科医学,2012,15(18):2082-2084.
[12]段林建,胡伶清,张清.不同连翘制剂对甲型流感病毒NP基因转染后表达的影响[J].中医学报,2015,30(1):71-73.
NA Inhibiting Activity Determination of Shuanghuanglian Oral Liquid Based on Chemical Fluorescence
JIANYao
(Public Health Clinical Center of Chengdu, Chengdu 610106, China)
The paper is going to establish the influenza virus neuraminidase(NA) activity in vitro fluorescence assay to determine the NA inhibition of biological activity of Shuanghuanglian oral liquid.The chemical fluorescence spectrometry is used to determine the inhibitory rate of Shuanghuanglian oral liquid on neuraminidase.The results show that the solution fluorescence intensity after reaction and the intensity of 4-MU of the product is in a good linear phase relationship within 0.1 to 1.2 μg/mL.This determination method has good precision and repeatability.The solution after reaction is stable under the condition of 4 ℃ within 4 hours and the inhibition rate of Shuanghuanglian oral liquid on influenza virus neuraminidase is as high as 64.20%.The conclusion drawn from the study is that this method can be used for the determination of neuraminidase inhibitory activities of Shuanghuanglian oral liquid.
chemical fluorescence;neuraminidase inhibitors;activity determination
2017-01-14.
简 瑶(1980 — ), 女, 主治医师, 从事临床医疗与科研工作.
R285.5
A

