一氧化氮参与调节PEG渗透胁迫下白三叶抗氧化酶活性及其基因表达
吴星,王晓娟,彭燕(四川农业大学动物科技学院草业科学系,四川 成都 611130)
一氧化氮参与调节PEG渗透胁迫下白三叶抗氧化酶活性及其基因表达
吴星,王晓娟,彭燕*
(四川农业大学动物科技学院草业科学系,四川 成都 611130)
以 ‘拉丁诺’ 白三叶为材料,采用药理学实验,研究15%PEG-6000渗透胁迫下,离体叶片内源NO荧光产生及NO含量动态变化,NO清除剂及合成抑制剂对白三叶叶片抗氧化酶活性及其基因表达量的影响以及外源NO供体(SNP)对渗透胁迫的缓解效应。渗透胁迫可诱导白三叶叶片NO荧光产生,NO含量升高,提高抗氧化酶活性,上调抗氧化酶基因表达水平,而Hb、NR、NaVO3和L-NAME则显著抑制了胁迫诱导的NO含量、抗氧化酶活性及其基因表达水平的提升;外源根施50 μmol/L SNP促进了胁迫下叶片抗氧化酶活性的提高,并有效减缓了相对含水量的下降,抑制电解质渗透率(EL)和MDA含量的升高。以上结果表明,NO是白三叶响应渗透胁迫的重要信号分子,并可能通过调控氧化酶基因表达和提高抗氧化酶活性,以减轻渗透胁迫对白三叶幼苗的过氧化伤害。
白三叶;干旱胁迫;NO;荧光现象;抗氧化酶;基因表达
当前,全球气候变暖和生态环境破坏导致水资源匮乏的总趋势越来越明显,干旱已成为影响农业可持续发展的重要胁迫因素,其危害相当于其他自然灾害之和,严重威胁作物产量和人类生存环境,是当今人类面临的最严峻的危机之一[1]。因此,深入理解作物抗旱机理,提高作物抗旱性显得尤为重要。白三叶(Trifoliumrepens)属于豆科(Leguminosae)三叶草属(Trifolium),又称白车轴草,是我国广泛栽培应用的优良豆科牧草之一,具有产量高,牧草品质优良,生长适应性强,为各种畜禽所喜食等特点[2]。由于白三叶有匍匐生长、扩展能力强、再生速度快等习性,使其成为温带地区观赏性草坪和绿地建植的主要草种,在国内外城镇绿化、水土保持等方面起着不可替代的重要作用[3]。然而,白三叶属浅根型作物,喜冷凉湿润气候,抗旱性较差是其栽培应用中面临的主要问题[4]。
一氧化氮(nitric oxide, NO)是一种广泛存在于动植物和微生物体细胞内与细胞间的信号分子,参与植物的各个生理过程,包括种子萌发,根系和叶片的生长发育,根系重力感应,光形态建成,呼吸作用,气孔关闭,细胞程序性死亡,组织的成熟和衰老以及各种逆境胁迫响应等[5-9]。植物体内NO的合成途径主要包括一氧化氮合酶途径(NOS),硝酸还原酶(NR)途径以及其他非酶促生成途径[10]。研究表明,环境胁迫尤其是干旱胁迫能够诱导植物体内NO合成,促进气孔关闭,从而使蒸腾作用降低[11]。外源NO处理亦可显著提高干旱胁迫下水稻(Oryzasativa)种子的发芽率[12];黑麦草(Loliumperenne)的抗盐性、耐碱性[13-14];小麦(Triticumaestivum)、玉米(Zeamays)等作物的抗旱性[15-16]。也有研究表明,NO在植物体内主要依赖于cGMP和不依赖于cGMP两条途径介导信号传导。依赖于cGMP的信号途径中,NO与受体鸟苷酸环化酶(GC)结合并激活其活性,导致cADPR、cGMP生成量增加,调节Ca2+浓度,激活依赖于cGMP的蛋白激酶,最终调控植物对病原体的防御反应[17];不依赖于cGMP的信号转导途径中,NO通过抑制顺乌头酸酶等含非血红素铁类酶活性来参与植物抗逆反应[18]。然而,渗透胁迫下NO的作用机制在白三叶上的研究还未见报道。本研究利用药理学试验,结合激光共聚焦显微技术和分子生物学方法,探讨了渗透胁迫下白三叶叶片对内源NO信号的感应,及外源NO对渗透胁迫下白三叶叶片的保护作用,以期深入理解白三叶的抗旱性机制,对探寻提高白三叶抗旱性栽培措施奠定基础。
1 材料与方法
1.1 试验材料
本试验于2013年7月-2014年8月进行,以‘拉丁诺’白三叶(Trifoliumrepenscv. ‘Ladino’)品种为供试材料,采用石英砂基质培养。选取籽粒饱满、大小一致的白三叶种子,经0.1% HgCl2消毒后,均匀播种在装有石英砂的白色育苗盘(长35 cm,宽25 cm,高10 cm)中,24 ℃光照培养箱中(光强2000 lx)进行发芽,待发芽7 d后用Hoagland全营养液继续培养,温度为白天23 ℃,夜晚19 ℃,时长各为12 h,相对湿度为70%,培养23 d, 每2 d更换一次营养液。取成熟的第2叶进行测试。
1.2 试验设计与处理
1.2.1 渗透胁迫下叶片NO信号的产生及NO含量的变化 用蒸馏水(对照,CK)和15%PEG溶液分别浸泡白三叶叶片,在0、10、20、30、45、90、120 min后取样,经NO特定荧光染料3-氨基,4-氨甲基化-2′,7′-荧光素(3-amino,4-aminomethyl-2′,7′-difluorescein,DAF-FM)染色30 min后,测定样品中NO荧光强度的变化。浸泡的叶片在0、1、1.5、2、4、6 h后取样,测定样品中NO含量的变化。
1.2.2 渗透胁迫下NO信号对叶片抗氧化酶活性及其基因表达的调控 剪取白三叶叶片,于蒸馏水中浸泡1 h以洗脱伤害,然后分别置于含有以下5种处理液的离心管中。处理液分别是1)CK(对照,蒸馏水);2)PEG(15%的PEG-6000溶液);3)PEG+Hb(Hb,NO 清除剂牛血红蛋白50 μmol/L);4)PEG+NaVO3(NaVO3,硝酸还原酶抑制剂偏钒酸钠5 mmol/L);5)PEG+L-NAME(L-NAME,一氧化氮合酶抑制剂NG-硝基-L-精氨酸甲酯盐酸盐200 μmol/L)。各处理重复6次。在处理后第2 h测定NO含量及抗氧化酶基因表达,在处理后第8 h测定抗氧化酶活性。
1.2.3 NO供体对渗透胁迫下白三叶抗氧化胁迫的影响 分别用浓度为0、10、25、50、75、100、150 μmol/L的外源NO供体硝普钠(sodium nitroprusside,SNP),对上述培育30 d的白三叶幼苗进行为期一周的预处理,期间根施3次,每次间隔1 d,每浓度处理设4次重复,然后用20%的PEG-6000进行渗透胁迫,在胁迫的第8 天分别取样测定不同处理白三叶叶片相对含水量(relative water content,RWC)和电解质渗透率(electrolyte leakage,EL), 以筛选出SNP的最适浓度。为研究NO供体对消除渗透胁迫下白三叶过氧化伤害的效应,试验设以下4个处理:1)CK(Hoagland全营养液处理);2)SNP(含有50 μmol/L SNP的Hoagland全营养液);3)PEG[20%(W/V)PEG-6000的Hoagland全营养液进行渗透胁迫];4)PEG+SNP[在20%(W/V)PEG-6000的Hoagland全营养液中加入50 μmol/L的SNP]。每处理重复4次,在处理后的第4、8、12、16 天分别取样测定SOD、POD、CAT和APX活性及相对含水量、电解质渗透率和丙二醛(MDA)含量。
1.3 测定指标与方法
1.3.1 NO荧光和NO含量 参照Corpas等[19]方法检测在白三叶幼苗叶片叶肉细胞中NO的荧光发生。所用NO特定荧光探针为3-amino,4-aminomethyl-2′,7′-difluorescein(DAF-FM)。在各处理液处理白三叶幼苗叶片的相应时间,取出10片叶片,迅速吸干表面液体,滴加 1 mL 2 μmol/L DAF-FM置于黑暗中染色 30 min,然后轻轻地取出叶片,用专用缓冲液冲洗数次,立即吸干水分后置于激光共聚焦显微镜(IX71, OLYMPUS CO., Ltd, 日本)下拍照。在激发光波长495 nm和发射波长515 nm条件下检验叶片荧光显色效果。NO含量采用试剂盒测定[20],试剂盒购自南京建成生物工程研究所。
1.3.2 叶片相对含水量 采用烘干法测定[21]。剪取叶片0.3 g,用普通吸水纸将其包裹好,放入装满水的50 mL离心管中,盖好盖子,放置于避光处静置24 h叶片吸水饱和后,取出叶片,擦干表面水分,称量饱和鲜重,然后置于鼓风烘箱中在105 ℃下杀青45 min,然后75 ℃下烘至恒重,称其干重,重复4次,取平均值。计算公式:
相对含水量(%)=[(鲜重-干重)/(饱和鲜重-干重)]×100
1.3.3 电解质渗透率 采用电导率仪测定法[22]。称取0.1 g叶片,用自来水、去离子水冲洗4次,用洁净滤纸吸去浮水,然后加10 mL去离子水,真空渗入半小时使叶段完全浸入,于室温放置4 h,用电导仪测其电导率(S1),然后在沸水浴中煮15 min,冷却至室温后测煮后电导率(S2)。
相对电导率(%)=(煮前电导率S1/煮后电导率S2)×100
1.3.4 抗氧化酶活性(antioxidant enzyme activty)和丙二醛(malondialdehyde,MDA)含量 粗酶液的提取,称取植物鲜重0.4 g放入研钵中,放入液氮研磨组织破碎后,待液氮完全挥发后加入2 mL预冷的磷酸缓冲液和0.1 g聚乙烯吡咯烷酮(PVP)在冰上充分研磨,然后转入离心管中,再用2 mL缓冲液充分清洗研钵,一并转入离心管中。4 ℃下15000 r/min离心20 min,上清液即为粗酶提取液。将粗酶液分装入各管中进行MDA含量和抗氧化酶的活性测定。MDA含量采用硫代巴比妥酸法测定[23];超氧化物歧化酶(superoxide dismutase,SOD)活性采用核黄素-NBT法测定[24];过氧化氢酶(catalase,CAT)活性采用紫外吸收法测定[25];过氧化物酶(peroxidase,POD)活性采用愈创木酚显色法测定[25];抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性参照Nakano等[26]的方法测定。
1.3.5 基因表达水平 采用qRT-PCR 的方法分析白三叶叶片中的抗氧化酶转录水平,总RNA提取与引物的设计参照王晓娟等[27]的方法,所用引物设计如表1。
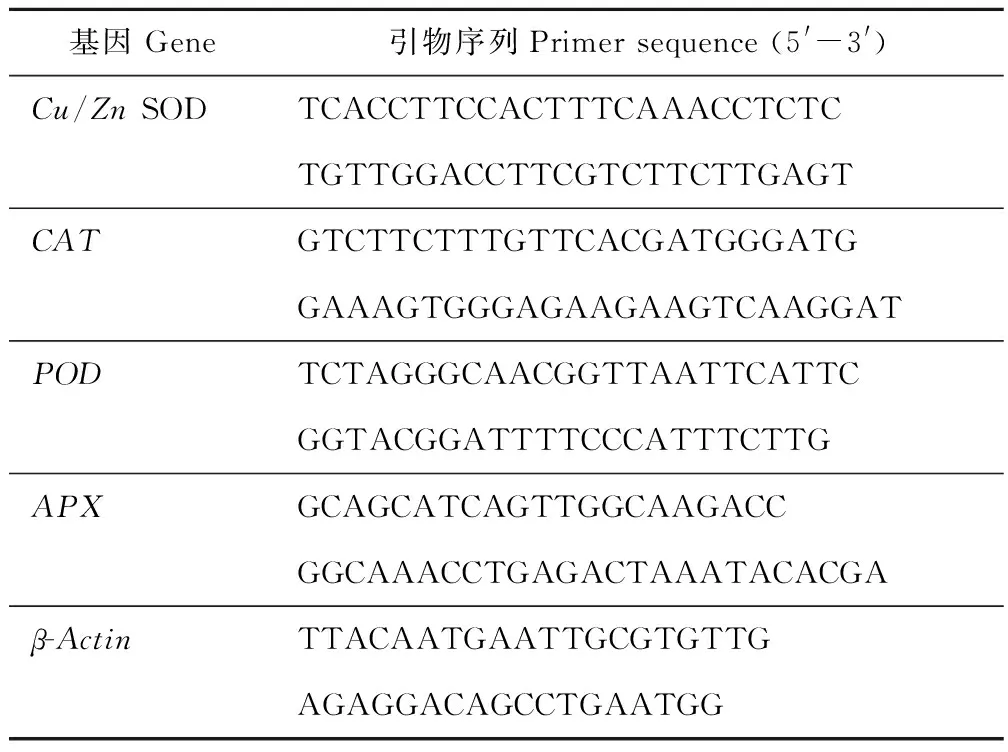
表1 试验中所用到的引物Table 1 All primers used in this experiment
1.4 数据分析
采用Excel 2003进行绘图与数据处理;SAS 8.0软件进行方差分析和显著性检验(P<0.05)。
2 结果与分析
2.1 PEG诱导NO荧光产生变化动态及对NO含量的影响
如图1所示,分别用蒸馏水和15%PEG浸泡的白三叶离体叶片经NO特定荧光染料DAF-FM染色30 min,在激光共聚焦显微镜下观察发现,渗透胁迫可诱导叶片DAF-FM荧光快速产生,荧光现象在处理后10 min开始产生并在45 min时达到最大值,随后荧光现象逐渐消失,并在120 min时荧光现象几乎消失殆尽,而蒸馏水浸泡的叶片没有荧光产生。如图2所示,在不同时间点PEG处理诱导的白三叶叶片NO含量逐步升高,第2 h时达到最大值,尔后开始下降,在处理的1、1.5、2、4 h时与对照差异显著(P<0.05)。
2.2 NO清除剂及产生抑制剂对PEG诱导NO含量的影响
如图3所示,PEG渗透胁迫能显著(P<0.05)提高白三叶叶片内源NO含量,而PEG处理下NO清除剂Hb、 NR抑制剂NaVO3和NOS抑制剂L-NAME则分别降低NO含量22.99%、20.10%、11.00%,与PEG处理差异显著。

图1 PEG处理对白三叶叶肉细胞NO荧光产生时间的影响Fig.1 Time course of nitric oxide (NO) production as affected by PEG treatment in mesophyll cells of white clover leaves

图2 PEG处理在不同时间点对白三叶叶肉细胞NO含量的影响Fig.2 Effects of NO content of white clover leaves in response to PEG treatment at different time points
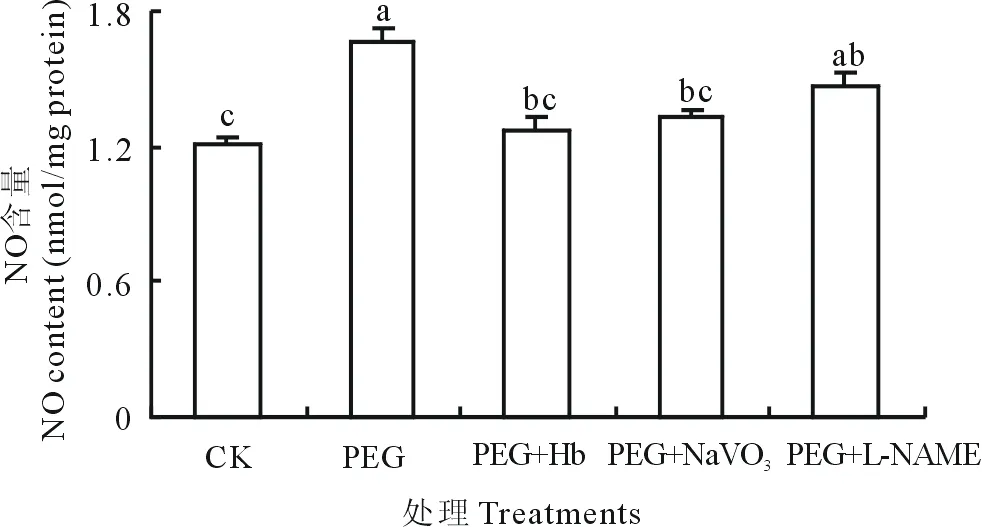
图3 NO清除剂及产生抑制剂对PEG诱导NO含量的影响Fig.3 Effects of NO scavenger and inhibitor on NO content in white clover leaves under PEG stress
不同小写字母表示差异显著(P<0.05),下同. The different small letters mean the significant differences atP<0.05, the same below.
2.3 NO清除剂及产生抑制剂对PEG诱导抗氧化酶活性及其基因表达的影响
如图4、图5所示,PEG诱导的渗透胁迫使SOD,POD,CAT和APX酶活性分别提高35.42%、155.96%、71.88%、33.05%,且编码它们的基因相对表达量分别提高69.21%、110.41%、117.11%、54.44%,与对照处理间差异显著。而Hb,NaVO3和L-NAME处理则显著降低了PEG诱导的4种抗氧化酶活性及基因相对表达量。表明NO信号参与调控渗透胁迫下白三叶叶片抗氧化酶基因的表达及其活性的提高。
2.4 不同浓度SNP对渗透胁迫下白三叶叶片RWC及EL的影响
图6A显示,20% PEG胁迫下, 10、25和50 μmol/L的外源SNP预处理可以显著提高白三叶叶片相对含水量,而75、100和150 μmol/L的SNP处理则与对照差异不显著。不同浓度SNP处理下的EL如图6B所示,除150 μmol/L外,其余浓度处理均显著降低了PEG胁迫下的EL值,且在50 μmol/L时,EL值最小。综合相对含水量的变化值,确定PEG渗透胁迫下白三叶的最适外源根施SNP浓度为50 μmol/L。
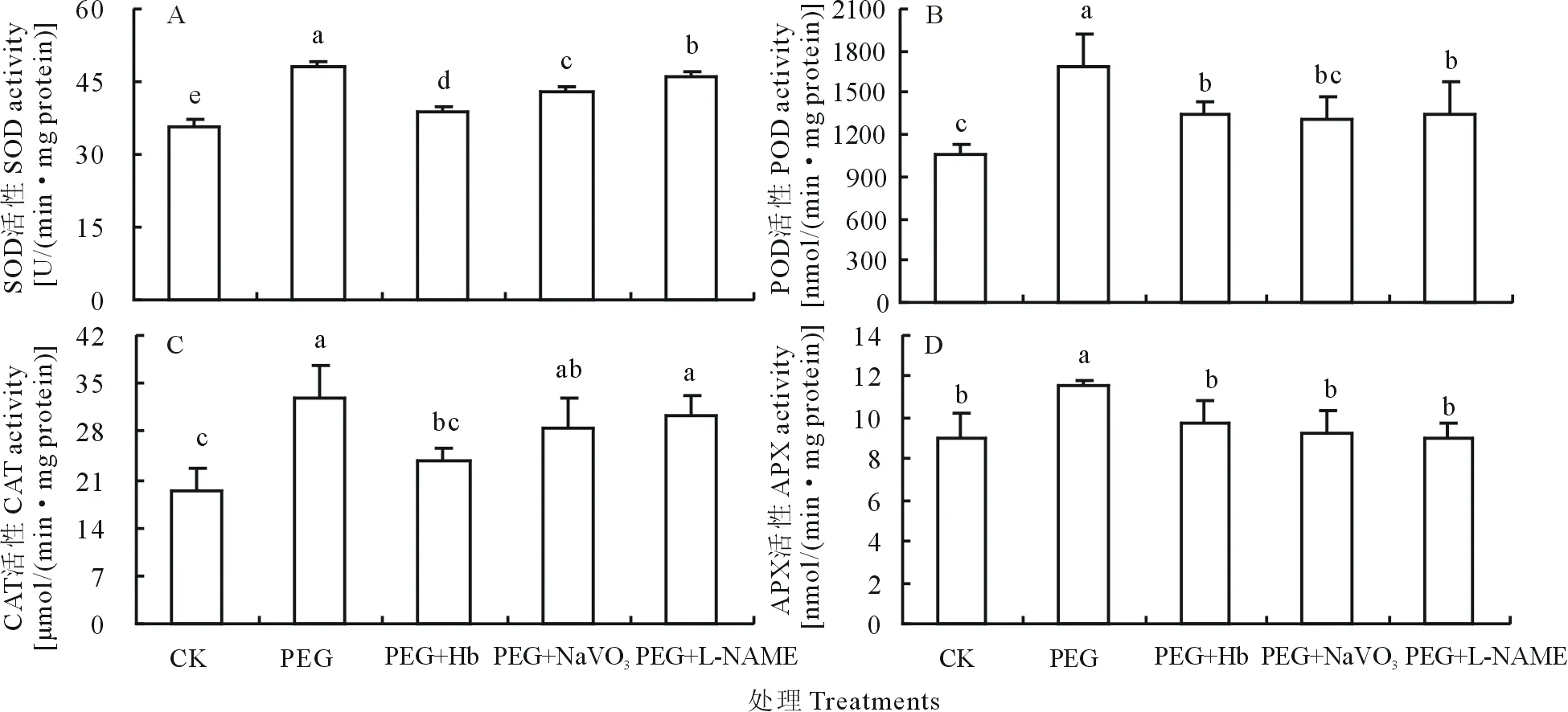
图4 NO清除剂及产生抑制剂对PEG诱导的抗氧化酶活性的影响Fig.4 Effects of NO scavenger and inhibitor on antioxidative enzyme activities of white clover leaves under PEG stress
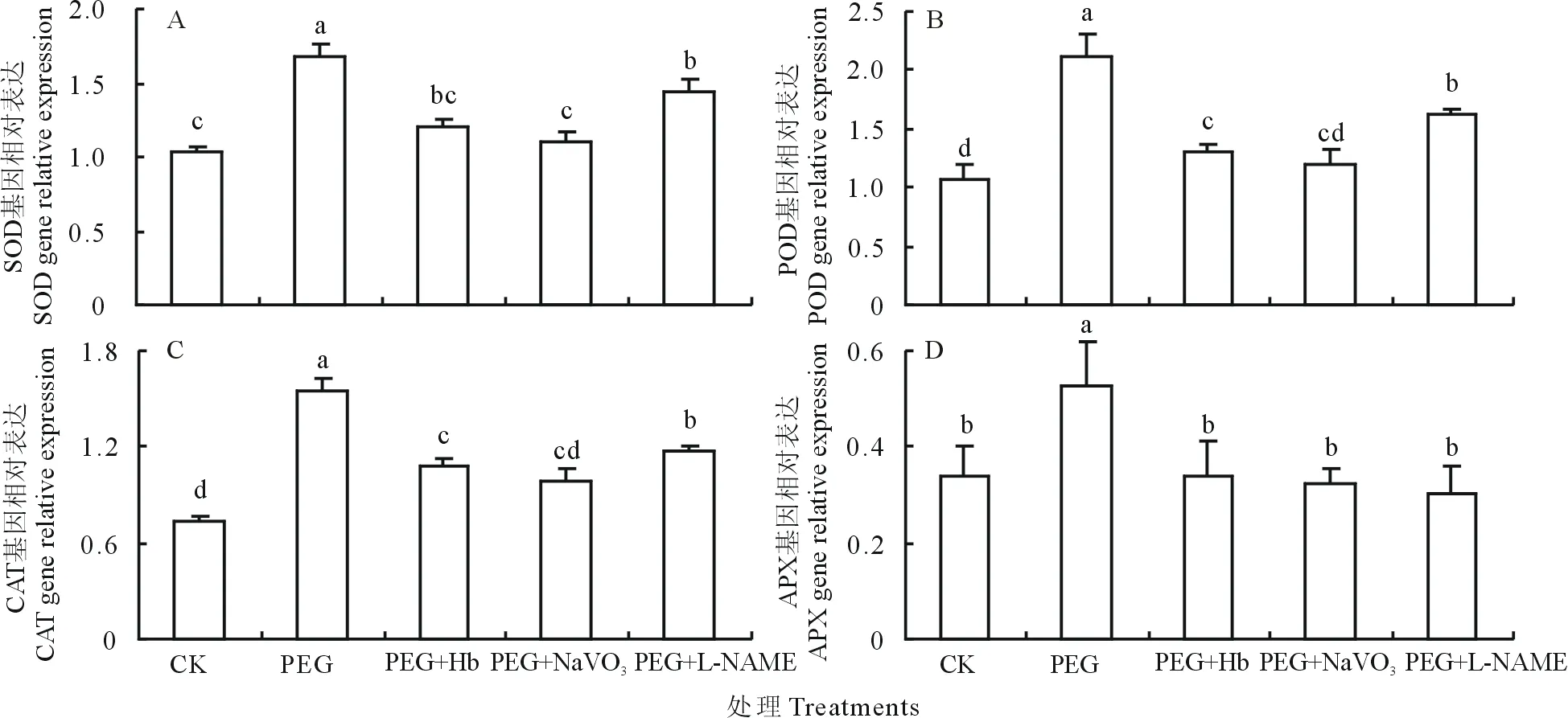
图5 NO清除剂及产生抑制剂对PEG诱导的抗氧化酶基因表达的影响Fig.5 Effects of NO scavenger and inhibitor on antioxidative enzyme gene expression of white clover leaves under PEG stress
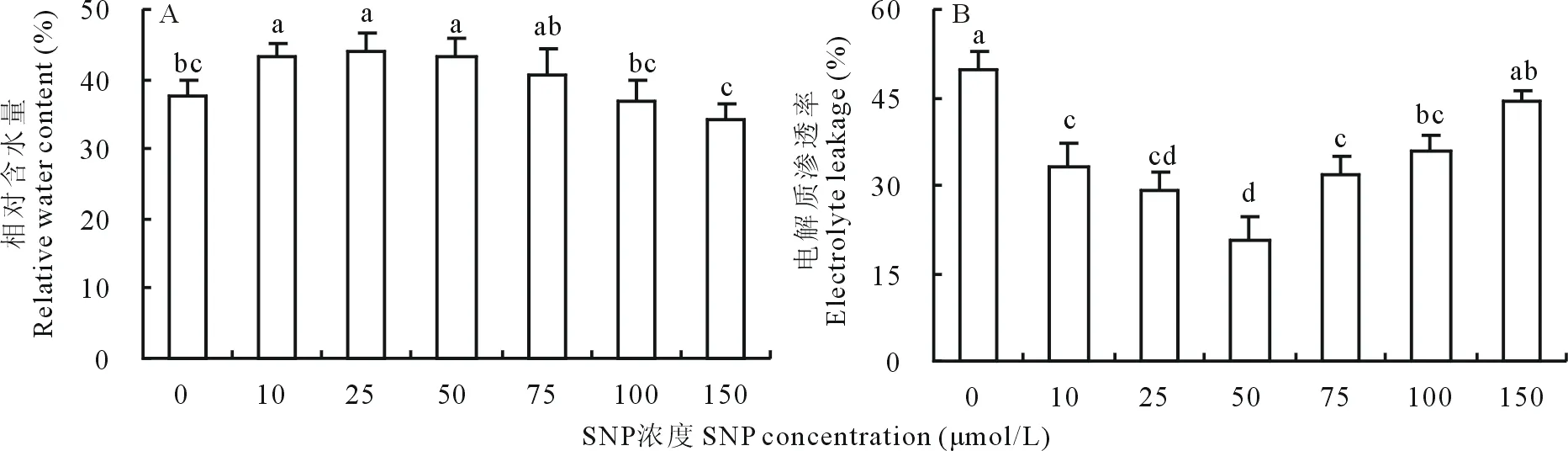
图6 不同浓度SNP处理对PEG渗透胁迫下白三叶叶片RWC及EL的影响Fig.6 Effects of different concentrations of SNP on RWC and EL in white clover leaves under PEG stress
2.5 SNP对PEG渗透胁迫下白三叶叶片抗氧化酶活性的影响
与CK相比,正常水分条件下根施SNP处理,测试期间白三叶叶片的4种抗氧化酶活性均处于较稳定状态,无显著变化。在PEG胁迫下,白三叶叶片SOD和APX酶活性随时间延长而逐步升高,而PEG+SNP处理的SOD活性在胁迫的第8和16天显著高于PEG处理,但对APX酶活性影响不明显(图7A、D)。PEG胁迫使白三叶叶片POD活性持续下降,在胁迫第8、12和16天,SNP+PEG处理的POD活性比PEG处理分别提高62.68%、27.61%、45.66%,两处理间差异显著(图7B)。在整个PEG胁迫过程中,叶片CAT活性呈先升后降的趋势,PEG+SNP处理对CAT活性具有一定的促进作用,但仅在胁迫第8天显著高于直接PEG处理(图7C)。
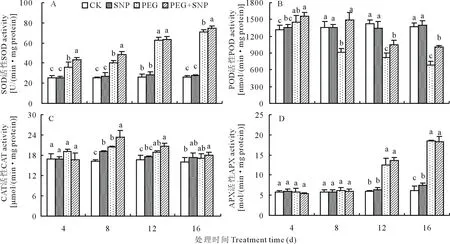
图7 外源SNP对PEG渗透胁迫下白三叶叶片抗氧化酶活性的影响Fig.7 Effects of SNP on antioxidant enzyme activities of white clover leaves under PEG stress
2.6 SNP对PEG渗透胁迫下白三叶叶片RWC、EL和MDA含量的影响
如图8A所示,在试验期间,正常水分条件下SNP处理的白三叶叶片相对含水量与对照间无显著差异,在PEG处理的第4天,白三叶叶片RWC明显降低,并且随着处理时间的延长持续下降,与PEG相比,PEG+SNP处理显著减缓了RWC的下降趋势,在处理的第4、8和12天时,叶片相对含水量比直接PEG胁迫分别高10.0%、21.2%和17.3%,两处理间差异显著。由图
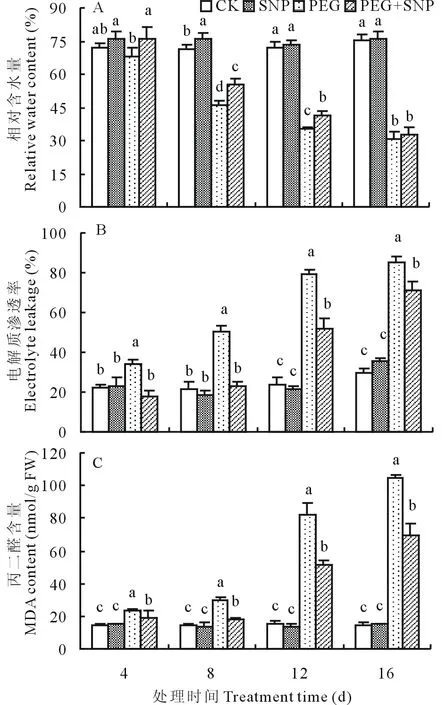
图8 SNP对PEG渗透胁迫下白三叶叶片RWC、EL及MDA含量的影响Fig.8 Effects of SNP on RWC, EL and MDA content of white clover leaves under PEG stress
8B和图8C可以看出,正常水分条件下根施SNP处理,在整个试验期间白三叶叶片EL和MDA含量均处于稳定状态,与对照相比,均无显著变化。与CK相比,在PEG处理的第4天,白三叶叶片EL和MDA含量明显升高,并且随着处理时间的延长持续上升。胁迫的第4、8、12和16天, 与CK相比,PEG处理的EL分别提高了55.1%、135.9%、229.5%、189.5%,MDA含量分别提高了63.99%、110.92%、444.53%、614.12%,差异均显著,表明叶片细胞的细胞膜过氧化和受伤害随渗透胁迫时间延长而不断加剧。而PEG+SNP处理的叶片EL和MDA含量均比直接PEG胁迫显著降低,说明外源SNP处理对PEG渗透胁迫所造成的伤害具有明显的缓解作用。
3 讨论
3.1 内源NO参与调控抗氧化酶活性及其基因表达
前人研究表明,植物在逆境胁迫下可诱导NO产生,NO的合成有利于植物抵抗干旱胁迫所造成的伤害。本试验也发现,PEG渗透胁迫可诱导白三叶离体叶片内源NO特殊荧光产生,并促进NO含量的升高,NO清除剂Hb及NR抑制剂NaVO3和NOS抑制剂L-NAME处理均能使白三叶叶片内源NO含量有所降低,表明渗透胁迫诱导NO的产生可能通过NR和NOS两条途径,这与Arasimowicz-Jelonek等[11]的研究结果类似。进一步研究显示,渗透胁迫可诱导白三叶叶片抗氧化酶活性的提高及其基因的表达,而Hb,NaVO3和L-NAME可不同程度地逆转渗透胁迫诱导的抗氧化酶活性及其基因表达。NO本身是一个活性氮中间体(RNS), 它对细胞要么起保护作用(抗氧化),要么毒害细胞(氧化强化剂),这取决于NO浓度[28-29]。渗透胁迫促进NO含量升高,对细胞造成过氧化伤害,从而诱导抗氧化酶活性及其基因表达;而Hb,NaVO3和L-NAME可抑制NO含量升高,避免细胞过氧化伤害,从而逆转抗氧化酶活性及其基因表达。以上结果表明, NO信号参与了调控渗透胁迫下白三叶抗氧化酶基因的表达进而提高抗氧化酶活性,以促进白三叶的抗氧化防护能力。
3.2 外源SNP能有效缓解PEG胁迫伤害,且有浓度效应
SNP常被用作NO供体,且具有浓度效应[16,30]。本研究结果显示,在渗透胁迫条件下,较低浓度SNP(10~50 μmol/L)可显著增加白三叶叶片相对含水量,降低电解质渗透率,而高浓度SNP(100~150 μmol/L)处理则效果不明显,甚至加重胁迫效应。表明SNP对渗透胁迫下白三叶的保护作用存在明显的剂量效应,当SNP浓度为10~75 μmol/L时,发挥保护作用,而SNP浓度过高时(≥100 μmol/L),SNP释放的过多NO可能对白三叶产生自由基毒害作用。García-Mata等[30]研究发现,外源NO预处理可以提高干旱胁迫条件下植物叶片的保水能力,降低EL及MDA含量,诱导气孔关闭。本试验结果显示,PEG渗透胁迫使白三叶叶片相对含水量明显降低,EL和MDA含量迅速升高, 50 μmol/L外源SNP可有效减缓PEG渗透胁迫下白三叶叶片EL和MDA含量,提高叶片相对含水量。研究表明,100 μmol/L外源SNP对干旱胁迫下小麦、高羊茅(Festucaarundinacea)叶片的缓解作用最强[31-32]。这可能是由于物种差异、PEG渗透胁迫与干旱胁迫区别造成。总而言之,适量外源SNP对提高白三叶抗渗透胁迫能力具有较好的效果。
3.3 不同抗氧化酶调节机制存在时间差异
非生物胁迫常导致植物细胞内活性氧(ROS)含量增加,引起膜系统氧化损伤,最终导致细胞死亡[33-36]。植物在长期的进化过程中,形成了一套完整的抗氧化胁迫防御系统,使其自身可以抵抗外界不良环境,使植物细胞内活性氧代谢处于动态平衡中,避免植物受到伤害[28-39]。例如SOD、POD 、CAT和APX作为植物体内常见的抗氧化保护酶,可以清除体内过多的ROS。本试验结果显示50 μmol/L外源SNP处理能不同程度提高持续渗透胁迫下白三叶叶片抗氧化酶活性,对POD的活性及其基因表达最为显著。渗透胁迫4 d时,POD活性及其基因表达水平达到最大值,随后持续降低,但50 μmol/L外源SNP仍能显著提高POD活性及其基因表达。CAT活性及其基因表达水平在8 d达到最大值,而SOD、APX则持续升高,且50 μmol/L外源SNP对APX活性及其基因表达的影响不显著。这可能是因为不同抗氧化酶在生理调节机制上存在时间上的差异,可以延长胁迫时间,做进一步研究。以上数据表明不同抗氧化酶在响应胁迫上协同作用,以提高渗透胁迫下白三叶幼苗抗氧化保护能力。
4 结论
PEG渗透胁迫可诱导白三叶离体叶片内源NO信号产生,并增强抗氧化酶活性及其基因表达,而NO清除剂及抑制剂能不同程度消除这种效应,所以可以推测NO信号参与渗透胁迫下白三叶叶片抗氧化酶活性及其基因表达的调控。外源添加NO供体SNP可提高渗透胁迫下白三叶叶片的抗氧化酶活性和相对含水量,降低EL和MDA含量,从而表明NO是白三叶响应渗透胁迫的重要信号分子,并可能通过调控氧化酶基因表达和提高抗氧化酶活性,以减轻渗透胁迫对白三叶幼苗的过氧化伤害。
References:
[1] Zhang Z B, Zhang J H. Water-saving agriculture: an urgent issue. Journal of Integrative Plant Biology, 2007, 49(10): 1409.
[2] Li Z, Peng Y, Shu X Y. Physiological responses of white clover by different leaf types associated with anti-oxidative enzyme protection and osmotic adjustment under drought stress. Acta Prataculturae Sinica, 2013, 22(2): 257-263. 李州, 彭燕, 苏星源. 不同叶型白三叶抗氧化保护及渗透调节生理对干旱胁迫的响应. 草业学报, 2013, 22(2): 257-263.
[3] Jin Z M, Sha W. Study on drought resistance ofTrifoliumrepenslinn seedlings. Northern Horticulture, 2010, 18: 50-52. 金忠民, 沙伟. 白三叶抗旱生理的研究. 北方园艺, 2010, 18: 50-52.
[4] Mercer C F, Watson R N. Effects of nematicides and plant resistance on white clover performance and seasonal populations of nematodes parasitizing white clover in grazed pasture. The Journal of Nematology, 2007, 39: 298-304.
[5] Beligni M V, Lamattina L. Nitric oxide stimulates seed germination and deetiolation, and inhibits hypocotyls elongation, three light-inducible responses in plants. Planta, 2000, 210(2): 215-221.
[6] Zhang W L, Shen W B, Xu L L. Signal functions of nitric oxide in plants. Chemistry of Life, 2002, 22(1): 61-62. 张文利, 沈文飚, 徐朗莱. 一氧化氮在植物体内的信号分子作用. 生命的化学, 2002, 22(1): 61-62.
[7] Chandok M R, Ytterberg A J, Wijk van K J,etal. The pathogen-inducible nitric oxide synthase (iNOS) in plants is a variant of the protein of the glycine decarboxylase complex. Cell, 2003, 113(4): 469-482.
[8] Tu J, Shen W B, Xu L L. Regulation of nitric oxide on the aging process of wheat leaves. Acta Botanica Sinica, 2003, 45(9): 1055-1062. 屠洁, 沈文飚, 徐朗莱. 一氧化氮对小麦叶片老化过程的调节. 植物学报, 2003, 45(9): 1055-1062.
[9] Xiong J, Fu G F, Yang Y J,etal. Roles of nitric oxide in growth of plant root. Journal of Huazhong Agricultural University, 2011, 30(3): 375-383. 熊杰, 符冠富, 杨永杰, 等. 一氧化氮在植物根系生长发育过程中的作用研究进展. 华中农业大学学报, 2011, 30(3): 375-383.
[10] Qiao W H, Yang Q W. Nitric oxide synthesis in plant and responses to abiotic stress. Journal of China Agricultural University, 2009, 14(3): 1-6. 乔卫华, 杨庆文. 植物体内一氧化氮的合成及其对非生物胁迫响应的研究进展. 中国农业大学学报, 2009, 14(3): 1-6.
[11] Arasimowicz-Jelonek M, Floryszak-Wieczorek J, Kubis J. Interaction between polyamine and nitric oxide signaling in adaptive responses to drought in Cucumber. Journal of Plant Growth Regulation, 2009, 28(2): 177-186.
[12] Li J, Wu H M, Chen H P. Exogenous carbon monoxide and nitric oxide alleviate the oxidative damage in rice seed germination under drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(4): 731-738. 李江, 吴黄铭, 陈惠萍. 外源CO和NO对水稻种子萌发过程中干旱胁迫损伤的缓解效应. 西北植物学报, 2011, 31(4): 731-738.
[13] Sun L R, Hao F S, Lü J Z,etal. Effects of exogenous nitric oxide on growth and physiological characteristics of ryegrass seedlings under salt stress. Acta Ecologica Sinica, 2008, 11(28): 5714-5722. 孙立荣, 郝福顺, 吕建洲, 等. 外源一氧化氮对盐胁迫下黑麦草幼苗生长及生理特性的影响. 生态学报, 2008, 11(28): 5714-5722.
[14] Liu J X, Wang X, Wang R J,etal. Effects of exogenous nitric oxide donor sodium nitroprusside on alkali resistance ofLoliumperenneseedlings. Chinese Journal of Ecology, 2011, 30(10): 2173-2178. 刘建新, 王鑫, 王瑞娟, 等. 外源一氧化氮供体硝普钠对黑麦草幼苗耐碱性的影响. 生态学杂志, 2011, 30(10): 2173-2178.
[15] Qiu Z B, Li J T, Guo J L. Effect of exogenous nitric oxide on seedling growth and physiological characteristics of wheat under drought stress. Journal of Anhui Agricultural Sciences, 2008, 36(17): 7095-7097. 邱宗波, 李金亭, 郭君丽. 外源一氧化氮对干旱胁迫小麦幼苗生长和生理特性的影响. 安徽农业科学, 2008, 36(17): 7095-7097.
[16] Wang F, Zhao Y J, Wang H N. Regulation of membrane lipid preoxidation by nitric oxide in maize seedlings under drought stress. Agricultural Research in the Arid Areas, 2015, 33(5): 75-79. 王芳, 赵有军, 王汉宁. 外源NO对干旱胁迫下玉米幼苗膜脂过氧化的调节效应. 干旱地区农业研究, 2015, 33(5): 75-79.
[17] Zhao C Y, Wang Y J, Liu H,etal. Research progress of nitric oxide signal transduction in plant. Food Research and Development, 2015, 36(22): 180-183. 赵朝宇, 王亚喆, 刘慧, 等. 植物一氧化氮信号转导的研究进展. 食品研究与开发, 2015, 36(22): 180-183.
[18] Jian Z, Han H, Zhang T,etal. Mechano chemotransduction during cardiomyocyte contraction is mediated by localized nitric oxide signaling. Science Signaling, 2014, 317(7): 1-20.
[19] Corpas F J, Barroso J B, Carreras A,etal. Constitutive arginine-dependent nitric oxide synthase activity in different organs of pea seedlings during plant development. Planta, 2006, 224(2): 246-254.
[20] Liu G H, Liu Q, Hou L X. NO may function in the downsream of Ca2+in ethylene induced stomatal closure inViciafabaL. Journal of Molecular Cell Biology, 2009, 42(2): 145-147.
[21] Barrs H D, Weatherley P E. A re-examination of the relative turgidity techniques for estimating water deficits in leaves. Australian Journal of Biological Sciences, 1962, 15(3): 413-428.
[22] Blum A, Ebercon A. Cell membrane stability as a measure of drought and heat tolerance in wheat. Crop Science, 1981, 21(1): 43-47.
[23] Dhindsa R S, Dhindsa P P, Thorpe T A. Leaf senescence: correlated with increased leaves of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase. Journal of Experimental Botany, 1981, 32(1): 93-101.
[24] Giannopolities C N, Ries S K. Superoxide dismutase: I. Occurrence in higher plants. Plant Physiology, 1977, 59(2): 309-314.
[25] Chance B, Meahly A C. Assay of catalase and peroxidase. Methods in Enzymology, 1955, 136(2): 764-775.
[26] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant and Cell Physiology, 1981, 22(5): 867-880.
[27] Wang X J, Li Z, Peng Y. The antioxidant enzyme activities and gene expression induced by spermidine in leaves of white clover. Acta Prataculturae Sinica, 2015, 24(4): 140-147. 王晓娟, 李州, 彭燕. NO参与Spd诱导白三叶抗氧化酶活性及其基因表达. 草业学报, 2015, 24(4): 140-147.
[28] Beligni M, Lamattina L. Is nitric oxide toxic or protective. Trends in Plant Science, 1999, 4(8): 299-300.
[29] Li H P, Zhou Q P, Yan H B,etal. Effects of sodium nitroprusside on physiological characteristics of oat seedling under salt stress. Pratacultural Science, 2014, 31(9): 1739-1745. 李海萍, 周青平, 颜红波, 等. 硝普钠对燕麦幼苗苗期盐胁迫缓解作用的生理机制. 草业科学, 2014, 31(9): 1739-1745.
[30] García-Mata C, Lamattina L. Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress. Plant Physiology, 2001, 126(3): 1196-1204.
[31] Li H, Zhao W C, Zhao H J,etal. Effects of exogenous nitric oxide donor sodium nitroprusside on ATPase activity and membrane lipid peroxidation in wheat (TriticumaestivumL. cv. ‘Luohan 6’) seedling leaves under drought stress. Plant Physiology Communication, 2009, 45(5): 455-458. 李慧, 赵文才, 赵会杰, 等. 外源一氧化氮供体硝普钠对干旱胁迫下小麦幼苗叶中ATP酶活性和膜脂过氧化的影响. 植物生理学通讯, 2009, 45(5): 455-458.
[32] Hui Z L, Li Z L, Li C Z,etal. Influences of exogenous nitric oxide donor SNP on seed germination and seedling resistance physiology inFestucaarundinaceaunder PEG simulated drought stress. Acta Agriculturae Boreali-Sinica, 2013, 28(4): 86-92. 回振龙, 李自龙, 李朝周, 等. 外源NO供体SNP对PEG模拟干旱胁迫下高羊茅种子萌发及幼苗抗性生理的影响. 华北农学报, 2013, 28(4): 86-92.
[33] Asada K. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50(4): 601-639.
[34] Reddy A R, Ramachandra R K, Chaitanya V,etal. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. Journal of Plant Physiology, 2004, 161(11): 1189-1202.
[35] Sharma P, Jha A B, Dubey R S,etal. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. Journal of Botany, 2012, http: //dx.doi.org/10.1155/2012/217037.
[36] Ashraf M, Harris P J C. Photosynthesis under stressful environments: an overview. Photosynthetica, 2013, 51(2): 163-190.
[37] Foyer C H, Deascouveries P, Kunert K J. Protection against oxygen radicals: important defense mechanism studied in transgenic plants. Plant Cell and Environment, 1994, 17(5): 507-523.
[38] Moller I M, Jensen P E, Hansson A. Oxidative modifications to cellular components in plants. Annual Review of Plant Biology, 2007, 58(1): 459-481.
[39] Bian S M, Jiang Y W. Reactive oxygen species, antioxidant enzyme activities and gene expression patterns in leaves and roots of kentucky bluegrass in response to drought stress and recovery. Scientia Horticulturae, 2009, 120: 264-270.
Nitric oxide is involved in regulating antioxidant enzyme activity and expression of their encoding genes in white clover under PEG osmotic stress
WU Xing, WANG Xiao-Juan, PENG Yan*
CollegeofAnimalScienceandTechnology,SichuanAgriculturalUniversity,Chengdu611130,China
The aim of this study was to evaluate the role of endogenous nitric oxide (NO) in regulating antioxidant enzyme activity in white clover (Trifoliumrepenscv. Ladino) under osmotic stress. We investigated endogenous NO fluorescence, dynamic changes in NO content, antioxidant enzyme activity, and the transcript levels of genes encoding antioxidant enzymes in white clover treated with an NO scavenger or NO synthesis inhibitors, and also evaluated the mitigating effects of the exogenous NO donor, sodium nitroprusside (SNP). Leaves of white clover were subjected to osmotic stress (15% PEG-6000). Compared with the leaves in the control, those in the osmotic stress treatment showed higher NO-dependent fluorescence, increased NO content, enhanced activity of antioxidant enzymes, and higher transcript levels of genes encoding antioxidant enzymes. Under osmotic stress, bovine hemoglobin (Hb), sodium vanadate (NaVO3), and LNG-nitro-L-arginine methyl ester hydrochloride (L-NAME) inhibited the accumulation of NO, leading to inhibition of antioxidant enzyme activity and reduced transcript levels of their encoding genes. The NO donor SNP (50 μmol/L) significantly alleviated the decline in the relative water content (RWC), reduced electrolyte leakage, decreased malondialdehyde accumulation, and promoted antioxidant enzyme activities under osmotic stress. These results suggested that NO is an important signaling molecule in response to osmotic stress, and that it plays a role in regulating gene expression and antioxidant enzyme activity to reduce peroxidation injury in white clover.
white clover; osmotic stress; NO; fluorescence phenomenon; antioxidant enzyme; gene expression
10.11686/cyxb2016190
http://cyxb.lzu.edu.cn
2016-05-09;改回日期:2016-08-11
国家自然科学基金(31372371)和四川省支撑项目(2013NZ0013)资助。
吴星(1992-),女,四川南充人,在读硕士。E-mail: wuxings2015@163.com*通信作者Corresponding author. E-mail: pengyanlee@163.com
吴星, 王晓娟, 彭燕. 一氧化氮参与调节PEG渗透胁迫下白三叶抗氧化酶活性及其基因表达. 草业学报, 2017, 26(4): 178-187.
WU Xing, WANG Xiao-Juan, PENG Yan. Nitric oxide is involved in regulating antioxidant enzyme activity and expression of their encoding genes in white clover under PEG osmotic stress. Acta Prataculturae Sinica, 2017, 26(4): 178-187.

