卵巢去细胞生物支架的制备及鉴定
兰莉,王严,付养华,刘帅良,黎婷,王志斌,习海涛,杨运俊,梅劲
(1.温州医科大学附属第一医院 超声科,浙江 温州 325015;2.温州医科大学附属第一医院 放射科,浙江 温州 325015;3.温州医科大学附属第一医院 生殖中心,浙江 温州 325015;4.温州医科大学基础医学院 生物支架移植与免疫研究所,浙江 温州 325035;5.温州医科大学附属第二医院 生殖中心,浙江 温州 325027)
卵巢去细胞生物支架的制备及鉴定
兰莉1,王严2,付养华3,刘帅良2,黎婷4,王志斌4,习海涛5,杨运俊2,梅劲4
(1.温州医科大学附属第一医院 超声科,浙江 温州 325015;2.温州医科大学附属第一医院 放射科,浙江 温州 325015;3.温州医科大学附属第一医院 生殖中心,浙江 温州 325015;4.温州医科大学基础医学院 生物支架移植与免疫研究所,浙江 温州 325035;5.温州医科大学附属第二医院 生殖中心,浙江 温州 325027)
目的:通过浸泡加震荡法制备猪部分卵巢组织去细胞生物支架,并对其进行鉴定。方法:健康未成年猪卵巢30个,横切成厚为6 mm的切片,室温条件下,1% SDS溶液浸泡,同时平板震荡器震荡,最后用去离子水清洗其内残留SDS及DNA碎片。获得去细胞卵巢生物支架后,对其进行组织化学染色、DNA残留量定量测定、扫描电镜检查及免疫荧光染色,观察细胞去除情况、支架的三维结构以及细胞外基质中胶原与蛋白质的保留情况。结果:DNA定量分析得出仅15.4%的DNA残留;HE染色、扫描电镜及免疫荧光染色提示支架内未见细胞核残留,并且支架的结构、胶原成分保留较完整。结论:运用浸泡加震荡法能够有效地去除卵巢组织中的细胞成分,并且较完整地保持细胞外基质的支架结构,不同程度地保留一些胶原成分及蛋白质。
去细胞;卵巢;组织支架;细胞外基质;卵泡
据统计卵巢早衰在40岁之前发病率为1%,30岁之前发病率约为0.1%[1]。以往文献报道卵巢癌合计发病率为8.28/10万,占我国女性恶性肿瘤发病的3.49%[2]。同时其他部位的肿瘤或疾病如乳腺癌、免疫系统疾病等的放疗、化疗或药物治疗也会不同程度地影响卵巢的功能[3-5]。目前治疗卵巢功能部分或完全丧失的手段包括自体或异体卵巢移植及激素替代治疗。然而,这些手段都会导致一定的不良后果[6-7],因此如何修复卵巢损伤和重建卵巢功能,是当前妇科及生殖医学领域面临的巨大挑战。2008年OTT等[8]利用灌注法成功制备小鼠离体心脏去细胞生物支架,并重新注入新生小鼠细胞,体外培养后使心脏复跳,这一研究使体外器官组织再生成为可能。随后,有不少学者对各器官去细胞化技术进行探索,使之逐渐成为组织工程研究领域的热点。本研究利用浸泡加震荡法制备猪卵巢去细胞生物支架,并对其进行鉴定,以期为组织工程和再生医学提供帮助。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康未成年长白猪卵巢取自温州瑞安市塘下镇一屠宰场。
1.1.2 主要试剂:十二烷基硫酸钠(SDS);小鼠来源
I型胶原抗体(英国Abcam ab6308);小鼠来源纤维粘连蛋白抗体(fibronectin,FN,英国Abcam ab6328);兔来源IV型胶原抗体(英国Abcam ab6586);兔来源层粘连蛋白抗体(Laminin,LN,英国Abcam ab11575);4’,6-二脒基-2-苯基吲哚(DAPI);HE染色液(美国Invitrogen公司);DNA试剂盒(美国Omega公司)。
1.2 方法
1.2.1 去细胞卵巢生物支架的制备:卵巢离体后均放入肝素生理盐水中浸泡3~4 h,然后放入-80 ℃冰箱中保存。每个卵巢横切成2~3个厚为6 mm的组织块,留取一块作为正常对照组,其余为实验组,然后浸入浓度为1%的SDS溶液中,同时放在平板震荡器上震荡,转速为120 r/min,保持温度为20~25 ℃。间断换液,36 h后将SDS换成去离子水,继续震荡,以清洗里面残留的DNA及SDS。
1.2.2 去细胞卵巢生物支架的鉴定:①大体观察及HE染色:观察去细胞过程中0、4、8、12、20、28及36 h 7个时间点卵巢的颜色及形态变化;去细胞支架及正常对照组用4%多聚甲醛4 ℃固定24 h以上,用酒精梯度脱水、二甲苯透明,石蜡包埋后切成5 μm厚度切片,脱蜡后行HE染色。②DNA残留量测定:卵巢支架及相应的正常对照组织小块用真空冻干器冻干过夜、称重;按照DNA试剂盒中的说明进行DNA的提取,然后利用分光光度计测量OD值后进行计算,分别测出每个支架及正常组织的DNA含量(ng/mg)。③扫描电镜:支架及正常对照组织用2.5%戊二醛4 ℃固定,切成6~9 mm3小块;0.9%氯化钠溶液清洗3次,每次15 min;锇酸固定1 h;70%、80%、90%酒精梯度脱水,每个梯度15 min,再用100%酒精脱水2次,每次15 min;临界点干燥仪干燥40 min后贴在黏附有碳带的铜片上,然后抽去真空,用真空镀膜仪镀膜喷金,用扫描电镜观察组织三维结构。④免疫荧光:组织4%多聚甲醛4 ℃固定24 h,20%蔗糖脱水2 d后换成30%蔗糖继续脱水2 d以上。OCT包埋,切片,支架为12 μm厚,正常组织为10 μm厚。所有一抗均按1:200比例稀释,二抗也以同样比例稀释;荧光显微镜观察其内胶原表达及分布,DAPI染色判断有无细胞核残留。
1.3 统计学处理方法 采用SPSS20.0软件进行统计学分析。计量资料均以±s表示,2组间比较用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 去细胞支架与正常组织的HE染色比较 随着去细胞时间的延长,卵巢组织切片的颜色逐渐变白、变透,而且体积也慢慢变得饱满,见图1A。HE染色示所有的支架均未见明显蓝染的细胞核成分,细胞外基质中的胶原成分红染。不同发育阶段的卵泡大体结构完整,血管腔仍然存在,见图1B-E。
2.2 去细胞支架与正常组织的DNA残留量比较 去细胞支架内残留DNA量为(214.97±21.47)ng/mg,远低于正常组织内的含量(1 394±317.05)ng/mg(P<0.01);去细胞支架内DNA残留量占正常组织中的15.4%,见图2和表1。
2.3 去细胞支架与正常组织的扫描电镜比较 正常组织三维结构完整,可以观察到细胞突起,卵泡腔内可以见到松散的卵丘细胞团;去细胞支架三维结构完整,卵泡壁完整,血管腔结构连续,高倍镜下胶原纤维遍布细胞外基质且未见明显断裂,见图3。
2.4 去细胞支架与正常组织的免疫荧光比较 正常组织及去细胞支架内均可见到IV型胶原阳性表达,主要分布于卵泡壁周围,见图4A-D(白色箭头);I型胶原无论在去细胞支架还是在正常组织中都广泛分布在卵巢间质中,且呈条带样,但在卵泡壁上仅见模糊表达,见图4E-F(红色箭头);LN主要分布在皮质区卵泡壁周围,尤其是较小的卵泡,见图4G-H(黄色箭头);FN在卵巢间质中有阳性表达,但含量较少,见图4J-K(蓝色箭头)。DAPI染色正常组织中细胞核布满整个视野,而去细胞支架中未见明显阳性表达,见图4M-N。
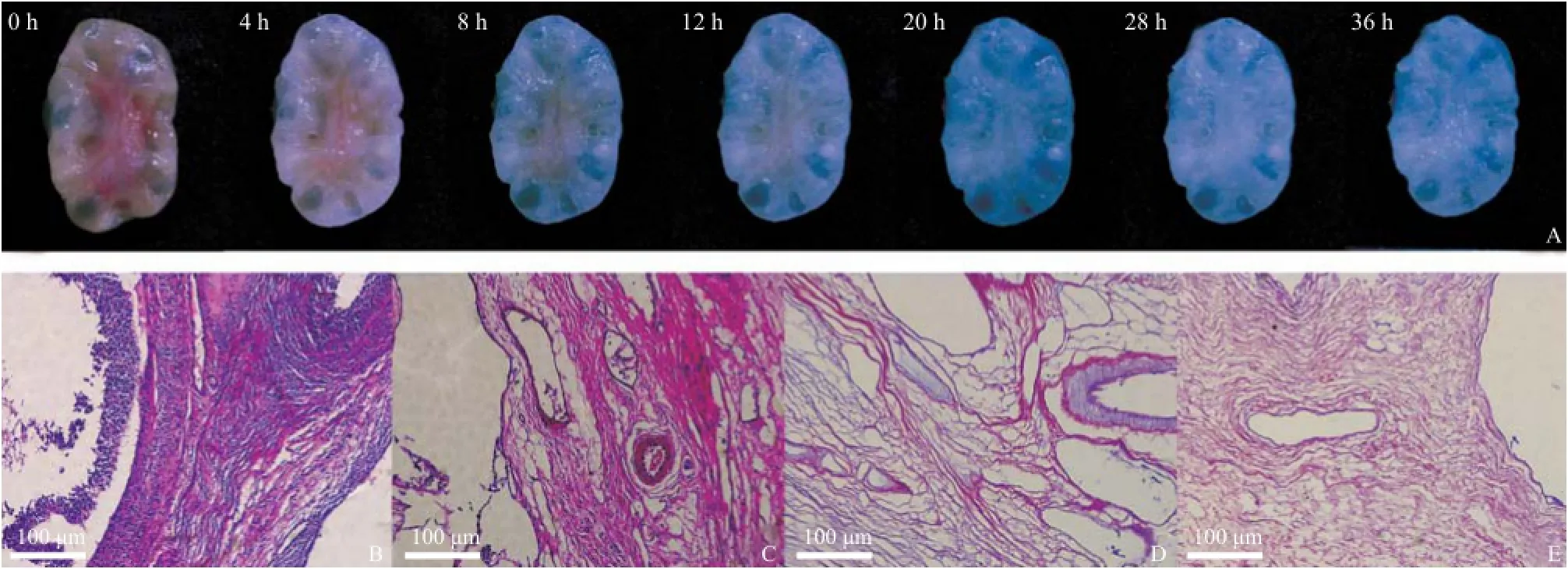
图1 卵巢去细胞过程大体观察及HE染色

图2 去细胞支架和正常组织内DNA含量曲线图
表1 去细胞支架与正常组织DNA含量对比(n=5,±s)

表1 去细胞支架与正常组织DNA含量对比(n=5,±s)
与正常组织比:aP<0.01

图3 去细胞支架和正常组织的扫描电镜观察
3 讨论
去细胞生物支架是利用化学法、机械法或灌注法将组织或器官中的所有细胞去除,只保留细胞外基质及其三维结构的一种组织工程材料。因为去除了大部分细胞,大大降低了免疫排斥反应,所以较人工组织或器官更具生物相容性[9]。近年来,去细胞生物支架已实现于多种组织或器官,而应用于卵巢者仅见一篇文献报道,且实验对象是牛[7]。不同的组织器官,去细胞的方法也不尽相同,如肾脏、肝脏、肺、胰腺及心脏[10-14]等血供丰富的器官多采用灌注法,而脊髓[15]则采用震荡法。在本实验中利用阴离子去污剂SDS浸泡加平板震荡器震荡,对SDS的作用浓度、作用时间等条件进行反复摸索,成功制备了卵巢去细胞生物支架,并且对其特征进行了一系列鉴定。-80 ℃储存的卵巢避免反复冻融,因为SOLEIMANI等[16]研究表明反复冻融会影响卵泡的生存,且对蛋白质的结构有一定的破坏。严格控制组织厚度、换液时间及实验温度则是尽量控制SDS去细胞作用的影响因素。本实验中虽然DNA含量未达到支架的标准,即50 ng/mg[17],但是残留率(为15.4%)较文献中的15.01%基本相当[7],而在该文献中已经证实无明显的免疫排斥反应。
组织或器官的三维结构对于细胞的黏附、迁徙具有重要作用[18];而细胞外基质中的蛋白质组成成分对于组织器官的生理病理过程有重要影响。LU等[19]研究表明成釉蛋白细胞外基质分子能够加强骨折阻力,并能促进骨折的快速愈合;LI等[20]研究表明Yes蛋白的表达下调与主动脉瘤中细胞外基质紊乱密切相关。本实验中扫描电镜显示卵巢支架的三维结构保存较完整;免疫荧光显示细胞外基质中的胶原及蛋白质有阳性表达,这些无疑为后面的研究打下了坚定基础。
目前干细胞与支架的共培养以及支架与化学试剂的交联是在去细胞生物支架上发展起来的两大热点[21-26]。将干细胞种植在支架上,能够诱导干细胞朝着组织细胞分化,甚至部分或完全恢复器官的功能,起到器官再生的作用;将支架与化学试剂交联,再包埋于体内,能够减缓支架的降解,提高支架的机械强度。

图4 去细胞支架和正常组织的免疫荧光染色图(×100)
[1] FENTON A J. Premature ovarian insuff ciency: Pathogenesis and management[J]. J Midlife Health, 2015, 6(4): 147-153.
[2] 杨念念, 严亚琼, 龚洁, 等. 中国2003~2007年卵巢癌发病与死亡分析[J]. 中国肿瘤, 2012, 21(6): 401-405.
[3] PÉREZ-ANDÚJAR A, NEWHAUSER W D, TADDEI P J, et al. The predicted relative risk of premature ovarian failure for three radiotherapy modalities in a girl receiving craniospinal irradiation[J]. Phys Med Biol, 2013, 58(10): 3107-3123.
[4] MAYORGA J, ALPÍZAR-RODRÍGUEZ D, PRIETO-PADILLA J, et al. Prevalence of premature ovarian failure in patients with systemic lupus erythematosus[J]. Lupus, 2016, 25(7): 675-683.
[5] MEATTINI I, SAIEVA C, MEACCI F, et al. Impact of age on cytotoxic-induced ovarian failure in breast cancer treated with adjuvant chemotherapy and triptorelin[J]. Future Oncol, 2016, 12(5): 625-635.
[6] JORDAN S J, WILSON L F, NAGLE C M, et al. Cancers in Australia in 2010 attributable to and prevented by the use of menopausal hormone therapy[J]. Aust N Z J Public Health, 2015, 39(5): 434-440.
[7] LARONDA M M, JAKUS A E, WHELAN K A, et al. Initiation of puberty in mice following decellularized ovary transplant[J]. Biomaterials, 2015, 50: 20-29.
[8] OTT H C, MATTHIESEN T S, GOH S K, et al. Perfusiondecellularized matrix: using nature’s platform to engineer a bioartif cial heart[J]. Nat Med, 2008, 14(2): 213-221.
[9] BADYLAK S F, GILBERT T W. Immune response to biologic scaffold materials[J]. Semin Immunol, 2008, 20(2): 109-116.
[10] 张建色, 王辉, 邵培刚, 等. 去细胞全肾生物支架的制备与鉴定[J]. 解剖学报, 2012, 43(2): 253-257.
[11] MAZZA G, ROMBOUTS K, RENNIE H A, et al. Decellularized human liver as a natural 3D-scaffold for liver bioengineering and transplantation[J]. Sci Rep, 2015, 5: 13079.
[12] 陈婵, 王志斌, 翁杰, 等. 全肺去细胞生物支架的制备与鉴定[J]. 温州医科大学学报, 2016, 46(2): 88-91.
[13] 林贤丰, 邵营宽, 王辉, 等. 离体大鼠胰腺去细胞生物支架的制备与鉴定[J]. 解剖学报, 2012, 43(5): 717-722.
[14] 彭蒙蒙, 林贤丰, 邵培刚, 等. 灌注法制备离体大鼠心脏脱细胞基质[J]. 解剖学报, 2012, 43(4): 559-563.
[15] JIANG T, REN X J, TANG J L, et al. Preparation and characterization of genipin-crosslinked rat acellular spinal cord scaffolds[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(6): 3514-3521.
[16] SOLEIMANI R, HEYTENS E, OKTAY K. Enhancement of neoangiogenesis and follicle survival by sphingosine-1-phosphate in human ovarian tissue xenotransplants[J]. PLoS One, 2011, 6(4): e19475.
[17] CRAPO P M, GILBERT T W, BADYLAK S F. An overview of tissue and whole organ decellularization processes[J]. Biomaterials, 2011, 32(12): 3233-3243.
[18] WANG X, CUI J, ZHANG B Q, et al. Decellularized liver scaffolds effectively support the proliferation and differentiation of mouse fetal hepatic progenitors[J]. J Biomed Mater Res A, 2014, 102(4): 1017-1025.
[19] LU X, LI W, FUKUMOTO S, et al. The ameloblastin extracellular matrix molecule enhances bone fracture resistance and promotes rapid bone fracture healing[J]. Matrix Biol, 2016, 52-54: 113-126.
[20] LI H, JIANG W, REN W, et al. Downregulation of the Yesassociated protein is associated with extracellular matrix disorders in ascending aortic aneurysms[J]. Stem Cells Int, 2016, 2016: 6786184.
[21] JIANG W C, CHENG Y H, YEN M H, et al. Cryo-chemical decellularization of the whole liver for mesenchymal stem cells-based functional hepatic tissue engineering[J]. Biomaterials, 2014, 35(11): 3607-3617.
[22] LECHT S, STABLER C T, RYLANDER A L, et al. Enhanced reseeding of decellularized rodent lungs with mouse embryonic stem cells[J]. Biomaterials, 2014, 35(10): 3252-3262.
[23] YU Y L, SHAO Y K, DING Y Q, et al. Decellularized kidney scaffold-mediated renal regeneration[J]. Biomaterials, 2014, 35(25): 6822-6828.
[24] ZHANG J, WANG Z, LIN K, et al. In vivo regeneration of renal vessels post whole decellularized kidneys transplantation[J]. Oncotarget, 2015, 6(38): 40433-40442.
[25] MEI J, YU Y, LI M, et al. The angiogenesis in decellularized scaffold-mediated the renal regeneration[J]. Oncotarget, 2016, 7(19): 27085-27093.
[26] LÜ X, ZHAI W, ZHOU Y, et al. Crosslinking effect of Nordihydroguaiaretic acid (NDGA) on decellularized heart valve scaffold for tissue engineering[J]. J Mater Sci Mater Med, 2010, 21(2): 473-480.
(本文编辑:吴彬)
Preparation and identification of ovarian decellularized biologic scaffold
LAN Li1, WANG Yan2, FU Yanghua3, LIU Shuailiang2, LI Ting4, WANG Zhibin4, XI Haitao5, YANG Yunjun2, MEI Jin4.
1.Department of Ultrasound, the First Aff liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Radiology, the First Aff liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 3.Department of Reproductive Center, the First Aff liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 4.Institute of Bioscaffod Transplantation and Immunology, Basic Medical College of Wenzhou Medical University, Wenzhou, 325035; 5.Department of Reproductive Center, the Second Aff liated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective:To prepare decullularized biologic scaffolds of part of porcine ovarian tissue by soaking with rotating, and then indentify their characteristics.Methods:Thirty ovaries were excised from healthy immature pigs, and then cut transversely into pieces at the thickness of 6 mm uniformly. At room temperature, they were soaked into 1% SDS solutions and rotated on a tablet oscillator at the speed of 120 r/min for 36 h. At last they were washed with deionized water to get rid of residual SDS and DNA fragments. After decellularization, histochemical staining was done, the residual DNA was quantitative determined, examined under scanning electron microscope examination and did immunof uorescence to observe the removal of cells, the three-dimensional structure of the scaffolds, and the reservation of collagens and proteins in the extracellular matrix.Results:Quantitative analysis showed that only 15.4% DNA remained in the decellularized scaffolds compared to the normal control tissues; HE straining, scanning electron microscope and immunof uorescence showed there were no cells left in the scaffolds, at the same time, the three-dimensional structure and the collagens in the extracellular matrix kept intact. Conclusion:The method of soaking with rotating can remove all cells from the ovarian tissue, maintain the supporting structure of extracellular matrix relatively completely, and reserve collagens and proteins at a certain degree.
decellularization; ovary; tissue scaffolds; extracellular matrix; ovarian follicle
R322.6
A
10.3969/j.issn.2095-9400.2017.03.006
2016-11-01
浙江省自然科学基金资助项目(LQ16H040002)。
兰莉(1975-),女,湖北武汉人,主治医师,硕士。
梅劲,副教授,硕士生导师,Email:tibetcn@email.com。

