猪苓菌核2种热激蛋白基因的克隆及其表达分析
刘蒙蒙+邢咏梅+郭顺星

[摘要] 该研究采用 RT-PCR技术从中国野生猪苓菌核Polyporus umbellatus中克隆得到 2种热激蛋白基因,其中PuHsp90基因的开放阅读框2 091 bp,编码696个氨基酸,推导的蛋白质相对分子质量约78.9 kDa;PuHsp70基因的开放阅读框 1 944 bp,编码647个氨基酸,推导的蛋白质相对分子质量约70.5 kDa;蛋白质结构预测及同源比对分析表明,这2个基因编码的核苷酸序分别具有Hsp90,Hsp70蛋白的保守结构域。进化树分析表明,PuHsp90与变色栓菌Hsp90 聚为一类,PuHsp70与肝色牛排菌Hsp70聚为一类。qRT-PCR 分析表明,蜜环菌侵染的情况下,这2个基因在猪苓菌核中均上调表达。这2个基因在蜜环菌侵染猪苓菌核的状态下有相同的表达模式,预示这2个基因其可能在抗生物胁迫中起重要作用。
[关键词] 猪苓;热休克蛋白;基因克隆;表达分析
[Abstract] With RT-PCR approaches,the full-length cDNA of two heat shock protein genes were cloned from total RNA of the Polyporus umbellatus sclerotium. The full open reading frame cDNA sequence of the Hsp90 was 2 091 bp,encoding 696 amino acid residues with a predicted molecular mass of 78.9 kDa. The full open reading frame cDNA sequence of the Hsp70 was 1 944 bp,encoding 647 amino acid residues with a predicted molecular mass of 70.5 kDa. The Hsp90 and Hsp70 protein contained the conservative structure domain,respectively. Phylogenetic analysis showed that Hsp90 and Hsp90 from Trametes versicolor were clustered into one group,Hsp70 and Hsp70 from Fistulina hepatica were clustered into one group. Real-time PCR analysis showed that,the expression of Hsp90 and Hsp70 in the infected part by Amillariella mellea was upregulated. The expression profiling of Hsp90 and Hsp70 showed same patterns underbiotic stress. The results indicate that these two genes may play an important role in response to Amillariella mellea infection.
[Key words] Polyporus umbellatus;heat shock protein;gene clone;gene expression
doi:10.4268/cjcmm20162411
熱激蛋白(heat shock proteins,简称Hsp)是在生物体遇到高温、高盐、干旱、营养缺乏、重金属离子等非生物胁迫下应激合成的蛋白,它的主要功能之一是通过与非蛋白质互相作用来预防未折叠蛋白变性和调节变性蛋白溶解复性[1-4]。温度变化是诱导Hsp合成的主要因子[5]。热休克蛋白广泛存在于从低等的原核生物到高等动植物各等种生物体内[6],根据相对分子质量的不同,可将热激蛋白分为Hsp110s,Hsp90s,Hsp70s,Hsp60s,小分子sHsps和泛素蛋白这6个家族[7]。其中,Hsp90蛋白可与其他分子伴侣共同调节参与各类非生物胁迫应激,如高热、干旱、高盐、有机物污染胁迫等[8]。Hsp70家族的功能研究的最为清楚,它参与了生物体的许多代谢调控[9]。有趣的是,Hsp70与植物抵抗病害关系密切。但是Hsp90与Hsp70在其他物种尤其是真菌中的功能研究报道迄今还很少。
猪苓是我国重要的药用真菌资源,其菌核是有效的药用部位。猪苓菌核在生长过程中会与蜜环菌形成特殊的共生关系。蜜环菌菌索侵入猪苓菌核,为其提供生长发育所必须的营养元素。蜜环菌通过猪苓菌核表皮侵染菌核时,菌核表皮下层的菌丝具有特异的拮抗性反应[10]。到目前为止,猪苓菌核的拮抗分子机制研究尚属空白。研究和揭示Hsp70及Hsp90基因在猪苓菌核抗逆反应中的作用,对猪苓菌核的防御反应分子机制的研究提供重要参考,同时对丰富Hsp功能研究奠定基础。
在研究室前期构建猪苓菌核的转录组文库中发现2个特异表达的热休克蛋白基因的全长开放读码框。本研究中应用RT-PCR技术从猪苓菌核中分离得到2种热休克蛋白基因的开放读码框全长序列,并就这2个基因的结构特征和功能进行初步分析,并应用实时荧光定量PCR技术分别对蜜环菌侵入菌核后这两个基因的表达模式进行了检测,以期为这两个基因在猪苓菌核抵抗蜜环菌侵染过程中的分子机理研究提供理论基础。
1 材料
猪苓菌核于2014年7月在山西省古县猪苓场采集,分别切取猪苓菌核被蜜环菌侵染的部分(CT)与未被侵染的部分(CK)放入液氮中速冻(图1),之后放入干冰中保存,运回实验室待提RNA。每个样品采集3个重复。
2 方法
2.1 总RNA提取及检测 应用EASYspin Plus 植物RNA快速提取试剂盒(艾德莱,中国)并按照操作说明提取各样品RNA,用分光光度计测定总RNA的A260,A280,根据A260/A280≈2.0 判断 RNA 的质量,用1.2%琼脂糖凝胶电泳检测 RNA 的完整性。以Oligo d(T)18为反转录引物,用 M-MLV 反转录酶试剂盒(Promega,USA)合成cDNA 第一链,放于-20 ℃保存备用。
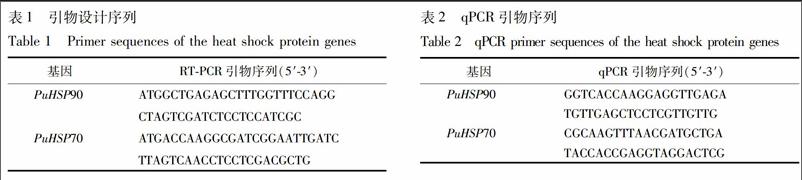
2.2 基因克隆 在本课题组测得的猪苓转录组文库中检索到2个热休克蛋白基因的全长unigene序列,利用引物设计软件Primer5分别从起始密码子与终止密码子开始设计2对引物(表1),用RT-PCR方法从猪苓菌核中克隆这2个基因的全长开放读码框。以合成的猪苓cDNA为模板,加入ExTaq聚合酶反应缓冲液5 μL(含Mg2+),正、反向引物各1 μL(10 mmol·L-1),dNTP 4 μL(2.5 mmol·L-1),ExTaq聚合酶0.25 μL(10 U·μL-1),加ddH2O至50 μL,轻微涡旋混匀并离心(1 000 r·min-1,10 s)后进行PCR扩增。反应程序为:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,40个循环;72 ℃延伸10 min。
PCR产物经回收纯化后连接Zero Background pTOPO-Blunt Simple Cloning Kit (艾德莱,中国),进一步转化到感受态大肠杆菌 DH5α中,挑取任意菌落进行扩大培养重组质粒,抽提质粒DNA,由江苏金唯智公司进行序列测定。获得测序结果后用Bioeditor与转录组测序结果进行比对,并通过GenBank进行 BLAST 搜索比对。
2.3 基因生物信息学分析 这2个基因的核苷酸序列和推导的氨基酸序列分别在NCBI 网站(http://www.ncbi.nim.nih.gov/)进行核苷酸序列比对(BLASTn)、氨基酸序列比对(BLASTp)和保守域预测(http://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml);利用ClustalW2(http://www.ebi.ac.uk /Tools /msa /clustalw2/)软件对其氨基酸序列进行比对;利用MEGA6 软件采用邻近法(N-J法)构建系统发育树;用ProtParam程序(http://au.expasy.org/tools/protparam.html)预测该氨基酸序列的相对分子质量和理论等电点(pI);利用SignalP(http://www.cbs.dtu.dk/services/SignalP/)在线分析蛋白质的信号肽。
2.4 基因表达分析 利用在线引物设计软件primer3(http://bioinfo.ut.ee/primer3-0.4.0/)设计荧光定量PCR引物 (表2),利用实时荧光定量 PCR 方法分析2种热休克蛋白基因在猪苓菌核不同部位的表达量,qPCR分析以猪苓 β-tublin基因作为内参基因。qRT-PCR 反应采用专用荧光检测管在 C1000 Thermal Cycler 荧光定量 PCR 仪(BioRad公司)上进行。每个反应重复 3 次,实验重复 3 次。20 μL 反应体系中包括 9 μL 2.5×SYBR Green mix,9 μL ddH2O,1 μL cDNA,1 μL 引物混合物(正向引物和反向引物,10 μmol·L-1)。反应程序为:95 ℃ 3 min,95 ℃ 20 s,60 ℃ 30 s,72 ℃ 20 s,循环 40 次,65 ℃ 30 s,95 ℃后保温 1 min,反应结束后采集C (cycle threshold) 值,采用2-ΔΔCt法進行数据分析[11]。
3 结果
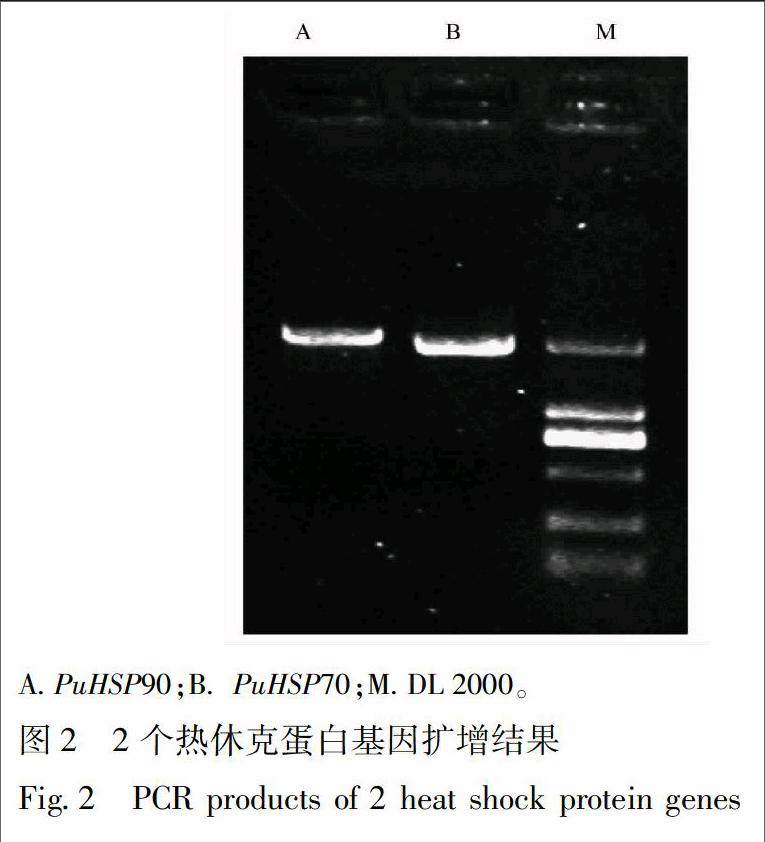
3.1 猪苓2个热休克蛋白基因的克隆 以未被蜜环菌侵染的猪苓菌核的RNA所反转录的 cDNA 为模板,利用表1中的2对引物通过RT-PCR 方法得到相应的2个热休克蛋白基因的目的片段(图2),目的片段经胶回收、克隆、测序分析后得到完整的ORF序列。与转录组文库中的序列比对后,发现其与文库中的unigene序列的ORF区一致,进而验证分离得到的这2个热休克蛋白基因的全长读码框序列是正确。其中PuHSP90基因的开放读码框为2 091 bp,PuHSP70基因的开放读码框为1 944 bp。
3.2 猪苓2个热休克蛋白基因编码蛋白的序列分析 ProtParam程序预测PuHSP90基因编码氨基酸序列相对分子质量为78.9 kDa,理论pI4.91。推测该蛋白分子式为C3522H5607N905O1109S18。核苷酸序列比对结果分析表明,该基因的核苷酸序列与变色栓菌Trametes versicolor同源性为91%,与肝色牛排菌Fistulina hepatica同源性为88%,将推测的氨基酸序列提交到 NCBI 的保守域数据库(conserved domain database,CDD)进行搜索,部分结果(图3)。结果显示该基因的核苷酸序具有Hsp90的保守结构域。推测克隆的该基因为猪苓菌核的 Hsp90 基因。NCBI登陆号为KU179150,用SignalP 4.1 Server 检测不含信号肽序列,无分泌蛋白。信号肽和跨膜结构分析表明,该 Hsp90蛋白N 端无信号肽,且整条肽链位于细胞膜外,也无跨膜结构。
ProtParam程序预测PuHSP70基因编码氨基酸序列相对分子质量为70.5 kDa,理论pI 5.02。推测该蛋白分子式为C3097H4938N856O997S13。核苷酸序列比對结果分析表明,该基因的核苷酸序列与毛韧革菌Stereum hirsutum同源性为91%,与污叉丝孔菌Dichomitus squalens同源性为 90%,将推测的氨基酸序列提交到NCBI的保守域数据库(Conserved Domain Database,CDD)进行搜索,部分结果(图4)。结果显示该基因的核苷酸序具有Hsp70的保守结构域。推测克隆的该基因为猪苓菌核的Hsp70基因。NCBI登陆号为:KU179151,用SignalP 4.1 Server检测不含信号肽序列,无分泌蛋白。同样信号肽和跨膜结构分析表明,该Hsp70蛋白N 端无信号肽,且整条肽链位于细胞膜外,也无跨膜结构。
3.3 2个热休克蛋白同源序列比对和系统进化分析 利用Clustal W2软件将猪苓的PuHsp90与其他真菌Hsp90氨基酸序列比对表明,该PuHsp90基因编码的蛋白与肝色牛排菌Fistulina hepatica、变色栓菌Trametes versicolor等多种真菌的Hsp90高度同源,其中与肝色牛排菌(登录号KIY50993)氨基酸序列同源性高达 92.1%,与变色栓菌(登录号EIW51690)氨基酸序列同源性高达91.56%;同样将PuHsp70与其他真菌的Hsp70氨基酸序列比对表明,该PuHsp70基因与Punctularia strigosozonata、毛韧革菌Stereum hirsutum等多种真菌的Hsp70高度同源,其中与P. strigosozonata(登录号EIN07501)氨基酸序列同源性高达93%,与毛韧革菌(登录号EIM90125)氨基酸序列同源性高达90.2%,与肝色牛排菌F. hepatica(登录号KIY50928)氨基酸序列同源性高达92%。充分说明真菌体内Hsp90及Hsp70的高度保守性。从氨基酸序列系统进化树(图5)可以得出,Hsp90基因与变色栓菌T. versicolor Hsp90亲缘关系最近,与肝色牛排菌F. hepatica Hsp90亲缘关系较远;Hsp70基因与肝色牛排菌F. hepatica Hsp70亲缘关系最近,与毛韧革菌S. hirsutum Hsp70亲缘关系较远。
3.4 猪苓热休克蛋白表达特性分析 实时荧光定量 PCR 数据显示,猪苓菌核β-tublin基因在各个样品中表达量比较稳定,可作为内参基因。实时荧光定量 PCR 分析表明,猪苓菌核不同部位的这2种热休克蛋白基因均有表达。在蜜环菌侵染的部位,这2种基因均为表达上调:其中PuHsp90,PuHsp70在蜜环菌侵染发部分的转录水平分别是未侵染部位的13,16倍左右(图6)。
4 讨论
本研究采用RT-PCR方法从猪苓菌核中克隆得到2个新的猪苓热休克蛋白基因,即PuHsp70,PuHsp90,这2个基因具有Hsp70,Hsp90家族基因的保守结构域。序列分析表明,这2个热休克蛋白基因编码的蛋白与NCBI中已有的担子菌的热休克蛋白序列有较大的相似性,说明这2个热休克蛋白基因隶属于担子菌。
大量植物抗逆转录组学研究表明,植物受到不同生物胁迫或非生物胁迫后许多抗逆基因的转录被激活。Hsp90与Hsp70与植物抵抗病害有密切关系。研究发现沉默本氏烟草的胞质HSP70,其会植株表现矮小;在INF-1 蛋白和假单胞杆菌侵染后均无拮抗反应发生;植株对假单胞杆菌的抗性减弱;其体内与发病机制相关的蛋白基因表达水平减弱。这说明烟草胞质HSP70 是INF-1 介导的敏感应答和对假单胞杆菌非宿主抗性产生的重要组分,在植物拮抗信号传导中扮演重要角色[12]。另有研究认为在拟南芥中,其胞质HSC70和核HSC70可与SGT1 的相互作用,完成对拟南芥的免疫应答的调控,植株受病原菌侵染后,拟南芥HSC70 的2个亚型表达均显著上调,缺失胞质HSC70的植株丧失了对病原菌的免疫能力[13]。Hsp90不仅能调控植物的生长发育,而且也参与植物的防御反应,在小麦中发现了3种定位于细胞质的HSP90蛋白,在TaHsp90.1的缺乏的情况下,小麦秧苗生长会受到抑制,而TaHsp90.2 与TaHsp90.3则参与小麦抗条锈病[14]。本研究中,在蜜环菌侵入猪苓菌核后,PuHsp90及PuHsp70基因在转录水平表达急剧上升,表明这2个基因在猪苓菌核防御蜜环菌侵染的应激过程中起到了一定的调节作用。
猪苓菌核热激蛋白基因应对蜜环菌侵染胁迫表达模式的研究为猪苓对抗逆境时内在基因表达的变化提供了一个线索,作为分子伴侣的 Hsp90 参与了许多蛋白的激活和运输等过程,从而参与生物体的抗逆过程。Hsp70蛋白在生物体内主要起分子伴侣作用,参与新生肽链的折叠、损伤蛋白的降解,还负责某些前体蛋白向内质网的转运[15],多数研究证明 Hsp70 的过表达可以提高生物对病害的耐受性[16]。Hsp90与Hsp70 作为生物体响应外源性病原菌的一个因子,其在应激网络上的作用(如与热激转录因子如何互相作用增强生物抗逆性)等有待于进一步研究。
[参考文献]
[1] Boston R S,Viitanen P V,Vierling E. Molecular chaperones and protein folding in plants[M]//Witold Filipowicz,Thomas Hohn.Post-transcriptional control of gene expression in plants. Berlin:Springer,1996: 191.
[2] Miernyk J A. Protein folding in the plant cell[J]. Plant Physiol,1999,121(3): 695.
[3] Mukhopadhyay I,Nazir A,Saxena D,et al. Heat shock response: Hsp70 in environmental monitoring[J]. J Biochem Mol Toxic,2003,17(5): 249.
[4] Timperio A M,Egidi M G,Zolla L. Proteomics applied on plant abiotic stresses: role of heat shock proteins (HSP)[J].J Proteomics,2008,71(4): 391.
[5] Sun W,Van Montagu M,Verbruggen N. Small heat shock proteins and stress tolerance in plants[J].BBA-Gene Struct Expr,2002,1577(1): 1.
[6] Lindquist S. The heat-shock response[J]. Annu Rev Biochem,1986,55(1): 1151.
[7] Carper S W,Duffy J J,Gerner E W. Heat shock proteins in thermotolerance and other cellular processes[J]. Cancer Res,1987,47(20): 5249.
[8] Pearl L H,Prodromou C. Structure and mechanism of the Hsp90 molecular chaperone machinery[J]. Annu Rev Biochem,2006,75,271.
[9] Georgopoulos C,Welch W. Role of the major heat shock proteins as molecular chaperones[J]. Annu Rev Cell Biol,1993,9(1): 601.
[10] 郭順星,徐锦堂. 蜜环菌侵染猪苓菌核的细胞学研究[J]. 植物学报,1993,35(1): 44.
[11] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4): 402.
[12] Kanzaki H,Saitoh H,Ito A,et al. Cytosolic HSP90 and HSP70 are essential components of INF1-mediated hypersensitive response and non-host resistance to Pseudomonas cichorii in Nicotiana benthamiana[J]. Mol Plant Pathol,2003,4(5): 383.
[13] No L L D,Cagna G,Stuttmann J,et al. Interaction between SGT1 and cytosolic/nuclear HSC70 chaperones regulates Arabidopsis immune responses[J]. Plant Cell,2007,19(12): 4061.
[14] Wang G F,Wei X,Fan R,et al. Molecular analysis of common wheat genes encoding three types of cytosolic heat shock protein 90 (Hsp90): functional involvement of cytosolic Hsp90s in the control of wheat seedling growth and disease resistance[J]. New Phytol,2011,191(2): 418.
[15] Miernyk J A,Duck N B,Shatters R G,et al. The 70-kilodalton heat shock cognate can act as a molecular chaperone during the membrane translocation of a plant secretory protein precursor[J]. Plant Cell,1992,4(7): 821.
[16] Cronj M J,Weir I E,Bornman L. Salicylic acid-mediated potentiation of Hsp70 induction correlates with reduced apoptosis in tobacco protoplasts[J]. Cytom Part A,2004,61(1): 76.
[责任编辑 吕冬梅]

