枸杞多糖热浸提工艺研究
王玉霞,尹旭敏,张超
(1.固态发酵资源利用四川省重点实验室,四川宜宾644000;2.宜宾学院生命科学与食品工程学院,四川宜宾644000;3.重庆市农业科学院,重庆九龙坡401329)
枸杞多糖热浸提工艺研究
王玉霞1,2,尹旭敏3,张超1,2
(1.固态发酵资源利用四川省重点实验室,四川宜宾644000;2.宜宾学院生命科学与食品工程学院,四川宜宾644000;3.重庆市农业科学院,重庆九龙坡401329)
为了探索枸杞多糖安全有效提取工艺,本实验分别运用单因素实验和正交实验对多糖的提取量进行考察。料液比、提取温度、提取时间和浸提液pH值都对多糖提取量影响很大。经过单因素实验,选取1∶10(w/v)、1∶15(w/v)、1∶20(w/v)料液比,50℃、60℃、70℃的提取温度,提取时间分别采用1.5 h、2.0 h、2.5 h,浸提液pH值为7、8、9作为正交实验的处理因素和水平。4因素3水平正交实验对热水浴法提取枸杞多糖工艺进行优化,得出对多糖提取量影响作用大小的因素顺序为提取温度>pH值>料液比>提取时间。正交实验方差分析结果显示,各因素均对多糖提取量有显著性影响(p<0.05),且当料液比为1∶25时、提取温度控制在60℃条件下、水浴浸提时间保持在2.0 h、pH值为8时,多糖提取量能达到0.4978 g±0.036 g,提取率为9.96%。
枸杞;多糖;热浸提;工艺研究
枸杞(Lycium barbarum L.)为茄科落叶灌木植物枸杞的成熟果实,味甘、性平、有滋肾补髓、养肝明目和祛风的作用,是传统中药滋补品,也是具有药用价值的优良食材[1]。李时珍在其药学著作中指出,枸杞具有“补肾生精、养肝、明目、坚精骨、去疲劳、易颜色、变白、明目安神、令人长寿”的功效[2]。枸杞含有枸杞多糖(Lycium barbarum polysaccharides,LBP)、胡萝卜素、VB族、VC和微量元素钙、磷、铁等多种活性成分[3]。其中,枸杞多糖是枸杞最重要的保健因子,许多学者的研究都已证实其在增加免疫[4-6]、抗肿瘤[7-8]、抗氧化[9-10]、抗衰老[11-12]、降血脂[13]、降血糖[14]、保护肝脏与生殖系统[15-16]、促进发育、防治老年性白内障[17]等方面具有的多种药理作用和生理功能。
正是由于枸杞多糖具有的多种营养保健和药用价值,枸杞多糖已经成为众多国内外学者关注和研究的焦点。多糖得率、纯度和功效很大程度上取决于提取条件,因此其提取方法以及最优工艺条件的研究就显得尤为重要。枸杞多糖的提取方法很多,如超声/微波提取法[18-19]、水提醇沉法[20]、碱液提取法[21]和酶解提取法[22]等。这些研究虽都取得了良好效果,但酶法提取需消耗大量的酶,提取成本较高;超声和微波提取虽较酶法提取成本低,但需要特殊的设备,而碱液和醇沉等方法涉及到石油醚、乙醇、丙酮等多种有机试剂的使用,在安全无毒方面存在一定负面影响,影响了枸杞多糖在食品或药用领域的使用范围。
本实验以热水浴法对枸杞多糖的提取工艺参数进行考察,分别对枸杞多糖提取的料液比、提取温度、提取时间、浸提液pH值进行探究,采用正交实验进一步优化工艺参数,确定了热水浴法枸杞多糖提取的最佳工艺条件,以期为安全快捷的枸杞多糖提取研究打下基础,并为研发新型青梅枸杞果酒、柑橘枸杞果露酒等新酒种做好前期材料准备和实验铺垫。
1 材料与方法
1.1 材料、试剂与仪器
实验材料:枸杞,购自超市(产地宁夏中卫)。
试剂:氢氧化钠、乙醇、苯酚、浓硫酸、葡萄糖、丙酮、盐酸(均为AR,成都科龙化工试剂厂)。
仪器:分析天平(瑞士Mettler-Toledo公司);精密pH计Delta 320-S(瑞士Mettler Toledo公司);电热恒温水浴锅HH-600(苏州威尔实验用品有限公司);Spectra MaxM 2酶标仪(Molecular Devices));DHG-9240A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);TDL-50B台式离心机(上海安亭科学仪器厂制造);RE-52A旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 实验方法
1.2.1 材料的预处理
称取500 g的枸杞洗净晾干,再放入烘箱中50℃烘至干透,冷却后粉碎,密封备用。
1.2.2 枸杞多糖热水浴法提取工艺
准确称取枸杞粉末5 g,加入温水,搅拌后于水浴锅内保温浸提,3000 r/m in离心20 m in,收集上清液。重复浸提2次,合并滤液,减压蒸发浓缩,得到枸杞多糖提取浓缩液。
1.2.3 标准曲线与枸杞多糖测定
准确称取25mg无水葡萄糖,置于250m L容量瓶中,少量蒸馏水溶解后定容,摇匀即得0.1mg/m L的标准葡萄糖溶液。分别准确吸取标准葡萄糖溶液0、0.2 m L、0.4 m L、0.6 m L、0.8 m L、1.0 m L于具塞试管中,分别补加蒸馏水至2.0m L,加入5%苯酚溶液1m L,摇匀后,迅速滴入浓硫酸5m L,充分混匀,放置10m in,于40℃水浴中保温15min后,取出并迅速冷却至室温,以不加葡萄糖液为对照,以紫外-可见分光光度法在490 nm波长处测定吸光度,并绘制标准曲线(如图1)。实验采用苯酚-硫酸法,将粗多糖提取液进行适当稀释,按照葡萄糖标准曲线方法进行测定,结合葡萄糖标准曲线、公式1和提取液体积以及测定稀释度,换算枸杞多糖提取糖量。

式中,c为糖浓度,mg/m L;v为提取液体积,m L;n为稀释倍数。
1.2.4 热水浴提取枸杞多糖单因素实验

图1 葡萄糖标准曲线
1.2.4.1 料液比对枸杞多糖提取效果的影响
称取预处理后的枸杞粉末5 g,设置料液比(w/v)为1∶5、1∶10、1∶15、1∶20、1∶25共5个水平,自然pH值,于70℃下提取2次,每次2 h,合并浸提液减压蒸发浓缩,测定多糖含量,实验进行3次重复。
1.2.4.2 提取时间对枸杞多糖提取效果的影响
称取预处理后的枸杞粉末5 g,设置提取时间为1.0 h、1.5 h、2.0 h、2.5 h、3.0 h 5个水平,自然pH值,采用料液比(w/v)为1∶15于70℃下提取2次,合并浸提液减压蒸发浓缩,测定多糖含量,实验进行3次重复。
1.2.4.3 pH值对枸杞多糖提取效果的影响
称取经预处理后的枸杞粉末5 g,设置浸提液pH值为7、8、9、10、11共5个水平,采用料液比(w/v)为1∶15于70℃下提取2次,每次2.0 h,合并浸提液减压蒸发浓缩,测定多糖含量,实验进行3次重复。
1.2.4.4 提取温度对枸杞多糖提取效果的影响
称取经预处理后的枸杞粉末5 g,设置提取温度为40℃、50℃、60℃、70℃、80℃5个水平,自然pH值,采用料液比(w/v)为1∶15提取2次,每次2.0 h,合并浸提液减压蒸发浓缩,测定多糖含量,实验进行3次重复。
1.2.5 热水浴提取枸杞多糖正交实验
在单因素实验的基础上,采用L9(34)正交表,以料液比、提取温度、提取时间、pH值进行正交实验。正交实验因素及水平见表1。
1.3 数据统计
实验数据应用SPSS 19.0数据处理系统和Excel进行处理分析。

表1 热水浴法提取枸杞多糖工艺研究正交实验因素水平表
2 结果与分析
2.1 料液比对枸杞多糖提取效果的影响
提取液与枸杞粉的比例,直接影响着提取液中多糖的浓度。料液比太高,提取液中多糖含量过浓,反而会影响提取效果;太低,则增加浓缩工作,会延长整个提取时间。在实验条件下,枸杞多糖提取量与料液比的关系见图2。
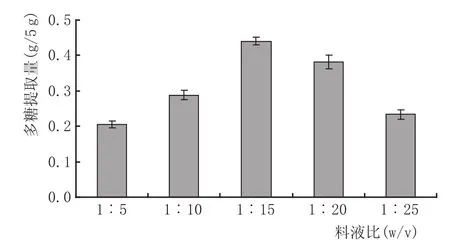
图2 料液比对枸杞多糖提取量的影响
由图2可知,在一定范围内,随着提取蒸馏水用量的逐渐增加,提取得到的枸杞多糖的量也在不断增大。提取量最高的料液比是1∶15,提取量为0.44 g,提取率达到8.80%;其次是1∶20的料液比,为0.40 g枸杞多糖。而提取效果最差的是1∶5,为0.21 g枸杞多糖,只有最高提取量(料液比1∶15)的46.82%。随着料液比的进一步提高,枸杞多糖的提取量反而呈现出下降趋势。
2.2 提取时间对枸杞多糖提取效果的影响
在一定的提取温度、提取料液比条件下,提取时间对枸杞多糖的提取量也有很大影响。提取时间过短,枸杞多糖溶解不完全,过长,则延长了整个提取时间,而且在较高温度保温条件下,已经溶解的多糖,也会与提取体系中的其他物质发生反应或形成溶解性较低的大分子类物质而被离心除去,反而降低提取量。实验设定了一系列提取时间梯度,以探究提取时间对枸杞多糖提取效果的影响。在提取时间为1.0 h、1.5 h、2.0 h、2.5 h、3.0 h,在自然pH值、浸提温度70℃条件下保温浸提2.0 h,重复提取2次,合并提取液并减压蒸发浓缩,提取得到的多糖量见图3。

图3 浸提时间对枸杞多糖提取效果的影响
由图3可知,提取得到的枸杞多糖量最高的是提取时间为1.5 h的处理,提取量为0.41 g,提取率达到8.29%;其次是2.0 h,提取的枸杞多糖量为0.34 g,再次是2.5 h,为0.30 g枸杞多糖。而提取效果最差的是1.0 h,只有0.27 g枸杞多糖,比最大提取量的1.5 h减少了0.14 g。实验结果表明,在一定范围内,随着提取时间的逐渐增加,提取得到的枸杞多糖的量也在不断增加;随着提取时间的进一步延长,枸杞多糖的提取量反而呈现出一定程度的下降趋势。
2.3 pH值对枸杞多糖提取效果的影响
实验分别在料液比为1∶15(w/v)、浸提温度70℃、保温浸提2.0 h条件下,考察提取液pH值对枸杞多糖提取量的影响。设定的pH值梯度为7、8、9、10、11,在此条件下枸杞多糖的提取结果见图4。
由图4可知,在一定范围内,随着浸提液pH值的逐渐增大,提取得到的枸杞多糖的量也在不断增加,但随着提取液pH值的进一步增大,枸杞多糖的提取量反而呈现下降趋势。提取得到的枸杞多糖量最高是pH值为8的条件,提取量为0.47 g,提取率为9.32%,其次是在pH7的条件下,多糖量为0.38 g。而提取效果最差的是最大pH条件(pH11),为0.26 g枸杞多糖,只有pH7条件下的54.74%。从实验结果可以得出,提取得到的枸杞多糖中,中性糖比例较大,其次是微偏酸性的多糖,这与Chao等[23]的研究结果相似。

图4 浸提pH值对枸杞多糖提取效果的影响
2.4 提取温度对枸杞多糖提取效果的影响
提取温度对枸杞多糖提取效果的影响见图5。

图5 提取温度对枸杞多糖提取效果的影响
由图5可知,在一定范围内,随着提取温度的逐渐升高,提取得到的枸杞多糖的量也在不断增加,但随着提取温度的进一步升高,枸杞多糖的提取量反而呈现出一定程度的下降。在设定的5个提取温度条件下,提取温度为60℃时,枸杞多糖的提取量最大,达到了0.37 g,其次是70℃(0.35 g)和50℃(0.34 g)。而提取效果最差的是80℃,提取量只有0.26 g,为60℃提取条件下的69.98%。
2.5 正交实验结果
根据单因素实验结果,以料液比、提取温度、提取时间、提取液pH值为探究因素,以枸杞多糖量为考察指标,选取L9(34)正交表进行枸杞多糖热水浴提取的正交实验,并进行极差和方差分析,以确定枸杞多糖的最佳提取工艺参数条件,结果见表2。
由表2可知,经过4因素3水平的正交实验,枸杞多糖的提取量在(0.2081±0.015)~(0.4842±0.011)g之间。极差R值最大的是B因素(温度),为0.1135,其次为D因素(pH条件)0.1114,最小的是C因素(提取时间),为0.0341。因此,根据极差R值,判定4个因素对枸杞多糖提取量的影响大小顺序为B>D>A>C,即各因素对枸杞多糖提取效果影响的显著性顺序为:提取温度>pH值>料液比>提取时间。另外,对各个因素的k值进行分析发现:因素A(料液比)中k3值最大,为0.3458,最小为k2,其值为0.2690,所以k3>k1>k2,故因素A的最优水平是A3(1∶20的料液比);同理分析得到其他各因素的最佳水平为:B2(k2=0.3774),C2(k2=0.3162),D3(k3=0.3595)。故热水浴法提取枸杞多糖的最佳工艺组合为A3B2C2D3,即料液比为1∶20,提取温度为60℃,提取时间为2 h,pH值为8。

表2 热水浴法提取枸杞多糖正交实验
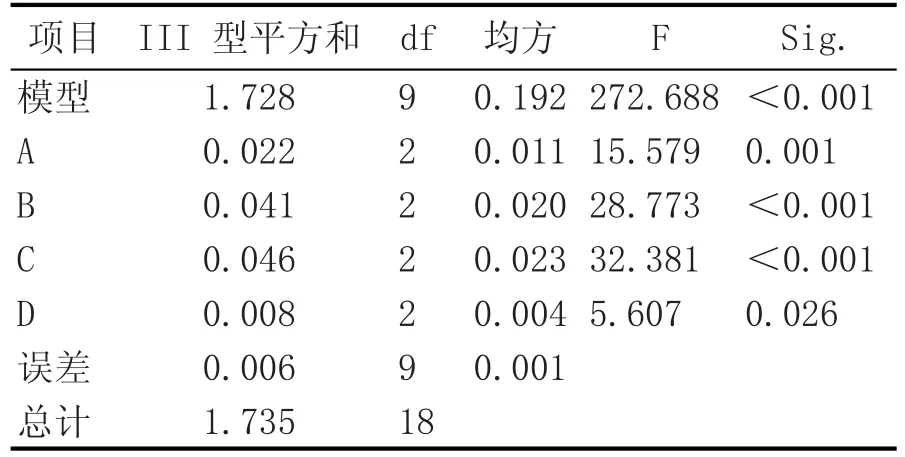
表3 正交实验方差分析
由表3可知,用于实验的各个单因素,对枸杞多糖的提取量影响达到了显著水平(p<0.05),其中B和C二因素还达到了极显著水平(p<0.01)。按最佳组合进行验证实验,得到枸杞多糖为0.4978 g± 0.036 g,提取率为9.96%,与正交实验结果相差不大,证实了模型的有效性和正确性。
3 结论
实验分别运用单因素实验对枸杞多糖提取的料液比、提取温度、提取时间、提取液pH值4个因素进行考察后,得出当料液比为1∶10(w/v)、1∶15(w/v)、1∶20(w/v)时,提取的多糖的量较高,提取温度在50℃、60℃、70℃时,提取量高于其他温度,而提取时间为1.5、2.0、2.5 h,浸提液pH值为7、8、9时的提取效果好于其他时间和pH值条件。根据单因素实验结果,进行正交实验以优化热水浴法提取枸杞多糖最佳工艺条件。得出各因素对枸杞多糖提取效果影响的主次因素顺序为:提取温度>pH值>料液比>提取时间,且枸杞多糖的最佳工艺为料液比1:20时、提取温度控制在60℃条件下、水浴浸提时间保持在2.0 h、pH值为8时,多糖提取量最大,达到0.4842 g±0.011 g。正交实验方差分析显示,4个因素对枸杞多糖提取量影响显著,验证实验所得的0.4978 g±0.036 g提取量与最优组合条件下的结果相符,验证了优化的有效性和正确性。
[1]李国梁,索有瑞,史俊友,等.柴达木枸杞多糖单糖组成的柱前衍生方法及其抗氧化活性[J].食品与发酵工业,2009,35(12):39-42.
[2]宋光锐.说药引诗,以诗释药——《解读本草纲目》中的诗·枸杞[J].家庭中医药,2014,222(11):10-11.
[3]郭巧生.药用植物栽培学[M].北京:高等教育出版社, 2004.
[4]宋毅,王玉娥.枸杞多糖免疫调节作用的实验研究[J].湖北预防医学杂志,2000,11(3):16-16.
[5]ZHANG X,ZHOUW,ZHANGY.Immunoregulation and Lycium barbarum[M]//Lycium barbarum and Human Health.Springer,2015:27-44.
[6]SU C X,DUAN X G,LIANG L J,etal.Lycium barbarum polysaccharidesasan adjuvant for recombinantvaccine through enhancementof humoral immunity by activating Tfh cells[J].Veterinary immunology and immunopathology,2014,158(1):98-104.
[7]肖琳,白秀珍,杨学东.枸杞多糖对人肺癌A549细胞影响的研究[J].数理医药学杂志,2006,19(2):130-132.
[8]M IAO Y,XIAO B,JIANG Z,etal.Grow th inhibition and cell-cycle arrestof human gastric cancer cells by Lycium barbarum polysaccharide[J].Medicaloncology, 2010,27(3):785-790.
[9]LUO Q,CAIY,YAN J,etal.Hypoglycem ic and hypolipidem ic effects and antioxidantactivity of fruit extracts from Lycium barbarum[J].Life sciences,2004, 76(2):137-149.
[10]QIU S,CHEN J,CHEN X,etal.Optim ization of selenylation conditions for Lycium barbarum polysaccharide based on antioxidantactivity[J]. Carbohydratev polymers,2014,103(3):148-153.
[11]LIX,MA Y,LIU X.Effectof the Lycium barbarum polysaccharideson age-related oxidative stress in aged m ice[J].Journalof ethnopharmacology,2007,111(3):504-511.
[12]CHANG RCC,SO K F.Useof anti-aging herbal medicine,Lycium barbarum,againstaging-associated diseases.Whatdo we know so far?[J].Cellular and molecularneurobiology,2008,28(5):643-652.
[13]孙桂菊,张勇,黄杰,等.枸杞多糖对Ⅱ型糖尿病大鼠肾脏保护作用及其机制研究[J].营养学报,2006,28(1):47-50.
[14]李进,瞿伟菁,刘丛,等.黑果枸杞色素对高脂血症小鼠血脂及脂质过氧化的影响[J].食品科学,2007,28(9):514-518.
[15]黄晓兰,杨明亮,吴晓旻,等.枸杞多糖对雄性大鼠睾丸组织损伤的保护作用[J].中国公共卫生,2003,19(9):1052-1054.
[16]CHENG D,KONG H.Theeffectof Lycium barbarum polysaccharideon alcohol-induced oxidative stress in rats[J].Molecules,2011,16(3):2542-2550.
[17]邓自辉,牛阳,王荣,等.枸杞多糖药理作用的研究现状[J].临床合理用药杂志,2011,4(24):164-165.
[18]王航宇,刘金荣,但建明,等.新疆枸杞多糖的超声提取及含量测定[J].中药材,2002,25(1):42-43.
[19]黄文书,冯作山,李焕荣,等.微波法提取枸杞多糖工艺研究[J].中国食物与营养,2007,13(8):44-46.
[20]孙敏,张晨君,孙普兵.超声提取法测定宁夏枸杞中粗多糖的含量[J].现代仪器,2012,18(1):70-73.
[21]胡仲秋,刘建党,王保玲.枸杞多糖的碱液提取工艺研究[J].西北农林科技大学学报(自然科学版),2008,36 (1):173-178.
[22]梁敏,邹东恢,郭建华.酶法提取枸杞多糖工艺研究[J].粮油加工,2010,381(3):104-106.
[23]CHAO J,CHIANG S,WANG C,etal.Hotwaterextracted Lycium barbarum and Rehmannia glutinosa inhibitproliferation and induce apoptosisof hepatocellular carcinoma cells[J].World journalof gastroenterology,2006,12(28):4478-4484.
Extraction of Lycium barbarum Polysaccharideby Hot-Water Bath
WANGYuxia1,2,YIN Xum in3and ZHANG Chao1,2
(1.Sichuan Key Lab of Solid-state Fermentation Resources Utilization,Yibin,Sichuan 644000;2.College of Life Science and Food Engineering,Yibin University,Yibin,Sichuan 644000;3.Chongqing Academy of Agricultural Sciences, Jiulongpo,Chongqing 401329,China)
The safe and effective extraction of Lycium barbarum polysaccharide was explored.The factors influencing the extraction such as the ratio of raw material to solution,extraction temperature,extraction time,and pH value of extract fluid were investigated by single factor test and orthogonal experiments respectively.Based on the results of single factor test,the follow ing influencing factors of different levels were selected:the ratio of raw material to solution(1∶15,1∶20,and 1∶25(w/v)),extraction temperature (50℃,60℃,and 70℃),extraction time(1.5 h,2.0 h,and 2.5 h)and pH value of extract fluid(6,7,and 8).The results of L934 orthogonal experiment demonstrated that the influence of the four factors on polysaccharide yield ranked in decreasing sequence as extraction temperature>pH value>the ratio>extraction time.The analysis of the variance for orthogonal experiments exhibited that all factors had significanteffects on the extraction of polysaccharide(p>0.05).As the ratio of raw material to solution was 1:25,extraction temperaturewas at60℃,extraction time was 2 h,and pH value of extract liquid was 8,the yield of polysaccharide reached up to 0.4978±0.036 g and the extraction ratio was 9.96%.
Lycium barbarum;polysaccharide;hot-water extraction;technical study
TS255.36;TS261.23
A
1001-9286(2017)04-0036-06
10.13746/j.njkj.2017016
四川省教育厅重点项目《发酵型青梅保健新酒种研发》(13ZA0197),《特色桑叶颗粒茶工艺关键技术研究》(14ZA0273);四川省科技厅应用基础研究项目《白酒大曲宏蛋白组研究》(2015JY0185),《再造粒桑叶颗粒茶加工技术研究》(2016JY0159);固态发酵资源利用四川省重点实验室应用基础项目《基于宏蛋白组学的大曲主要功能酶系研究》(2015GTY001);宜宾市重点科技项目《柑橘全果深加工技术体系研究》(2014SF030),《特色桑叶颗粒茶加工技术开发研究》(2013NY004);宜宾学院重点科研项目《猕猴桃果酒贮存过程中Vc变化规律研究》(2013QD15);四川省大学生创新创业项目《青梅加香果酒酿造技术研究》(201510641042)。
2017-01-24
王玉霞(1974-),女,副教授,博士,研究方向为生物工程,E-mail:wangyx0411@163.com。
张超(1972-),男,副教授,硕士,研究方向为农产品贮藏加工,E-mail:zhangch8619@163.com。
优先数字出版时间:2017-03-22;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170322.1127.001.htm。

