凋亡抑制蛋白和紧密连接蛋白4在前列腺癌中的表达及与前列腺癌临床病理特征的关系
张春霆,朱再生
凋亡抑制蛋白和紧密连接蛋白4在前列腺癌中的表达及与前列腺癌临床病理特征的关系
张春霆,朱再生
目的:探讨凋亡抑制蛋白(Livin)和紧密连接蛋白-4(Claudin-4)在前列腺癌中的表达及其与前列腺癌中病理特征的相关性。方法:采用组织芯片技术,构建64点阵组织芯片,对71例前列腺癌和37例前列腺增生组织进行检测,免疫组化SP法检测Livin和Claudin-4蛋白的表达,并与前列腺癌的临床病理关系进行分析;Spearman等级相关法分析Livin和Claudin-4表达的相关性。结果:Livin蛋白和Claudin-4蛋白在前列腺增生组织中的阳性表达率明显低于前列腺癌组织(P<0.01)。Livin在39例前列腺癌<7分和≥7分的阳性表达率分别为56.41%(22/39)和81.25%(26/32),两者之间比较有差异;在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期阳性表达率分别为56.10%(23/41)和83.33%(25/30),两者相比有明显差异。Claudin-4在<7分和≥7分的阳性表达率为43.59%(17/39)和75.00%(24/32),两者之间比较有差异;在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期阳性表达率分别为60.98%(25/ 41)和80.00%(24/30),两者比较有明显差异。Livin和Claudin-4蛋白表达状况Spearman相关分析显示呈正相关,相关系数r= 0.87。结论:Livin和Claudin-4蛋白异常表达可能与了前列腺癌的发生、进展,联合检测可能提高前列腺癌患者的预后评估。
前列腺癌;凋亡抑制蛋白;紧密连接蛋白-4;组织芯片;免疫组织化学
前列腺癌已成为危害我国男性健康的疾病之一[1],前列腺癌的发生进展涉及多个基因的异常表达,其中凋亡抑制调节紊乱及相关基因表达异常可能参与其中。研究发现Livin和Claudin-4的异常表达与多种肿瘤的发生进展有关[2-3]。本研究采用组织芯片技术检测浙江大学金华医院泌尿外科2001年6月—2011年6月病理组织库标本71例前列腺癌和37例前列腺增生组织Livin和Claudin-4蛋白的表达,分析Livin和Claudin-4在前列腺癌中的表达状况及相关性,现报道如下。
1 资料与方法
1.1 标本来源 本组共71例,患者年龄55~82岁,平均(67.5±8.5)岁。前列腺癌根据Gleason评分系统,Gleason评分<7分的39例,Gleason评分≥7分的32例,临床分期按照2002年AJCC的TNM分期标准:Ⅰ~Ⅱ期41例,Ⅲ~Ⅳ期30例。取标本前均未接受放疗、化疗和内分泌治疗。37例前列腺增生组织,取自同期非肿瘤,年龄56~79岁,平均年龄(66± 9)岁,前列腺增生患者无其他部位肿瘤发现。
1.2 方法 构建8×8点阵的组织芯片4个,2个用于免疫组化染色,2个用于阴性对照。标本经10%甲醛溶液固定后,石蜡包埋,连续3 μm切片,制成芯片的所有组织(DAB显色剂和SP试剂盒均购自北京中杉生物技术公司)每例前列腺癌和增生组织标本各取1个点,点阵后标记,点阵仪对标记完成组织打点取样,固定于多聚赖氨酸载玻片上,烤片6 h,制作完成。按说明书行免疫组化,所有癌和前列腺组织常规切片后二甲苯进行脱蜡,梯度乙醇依次水化。加入兔抗人Livin单抗(浓度1∶100)和Claudin-4单克隆抗体(1∶50),4℃孵育过夜,PBS×3次,每次5 min;滴加二抗(生物素标记)室温孵育30 min;PBS×3次,每次5 min;后经DAB显色,苏木素复染,封片、光镜观察,用PBS缓冲液代替Livin和Claudin-4一抗作为阴性对照。
1.3 结果判定 Livin蛋白主要定位于细胞浆,阳性细胞为免疫组化染色胞浆呈现蓝褐色颗粒,细胞膜和细胞核极少。Claudin-4阳性染色为细胞膜出现棕黄色颗粒;结果判定参照Sulzers表达分级法;由两位有经验的病理科医师对染色结果进行判断,根据阳性表达细胞数:(-)为阴性,阳性细胞表达细胞数<10%为(+),阳性表达细胞数10%~50%为(++),阳性表达细胞数>50%为(+++)。
1.4 统计学处理 采用SPSS18.0软件统计学分析,成组设计率的比较行χ2检验(或四格表Fisher概率法),Spearman行相关性分析,以P<0.05作为差异具有统计学意义的标准。
2 结果
2.1 Livin和Claudin-4在前列腺癌组织中的表达位置 Livin主要表达在细胞浆中,而在胞膜及胞核中表达不明显,Claudin-4主要主要表达在细胞膜(见图1)。
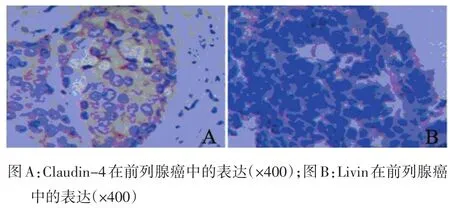
图1 Claudin-4和Livin在前列腺癌中的表达(sp法×400)
2.2 Livin和Claudin-4表达与Gleason分级和临床分期的关系 Livin在39例前列腺癌<7分的阳性表达率为56.41%(22/39),Livin在32例前列腺癌≥7分的表达率为81.25%(26/32),两者之间比较有差异;在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期阳性表达率分别为56.10%(23/41)和83.33%(25/30),两者相比有明显差异有统计学意义。Claudin-4在<7分的阳性表达率为43.59%(17/39),在≥7分的表达率为75.00%(24/ 32),两者之间比较有差异;在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期阳性表达率为表达率分别为60.98%(25/41)和80.00%(24/30),两者比较有明显差异(见表1)。

表1 Livin和Claudin-4在前列腺癌中的表达与前列腺患者临床病理关系
2.3 前列腺癌中两者表达之间的关系 对相同患者的同一病理切片同时行Livin和Claudin-4染色后进行Spearmen相关性分析,在48例Livin阳性病例中,Claudin-4阳性表达39例;两者都为阴性3例,相关性分析显示两者呈正相关,r=0.87,P<0.01,见图2。
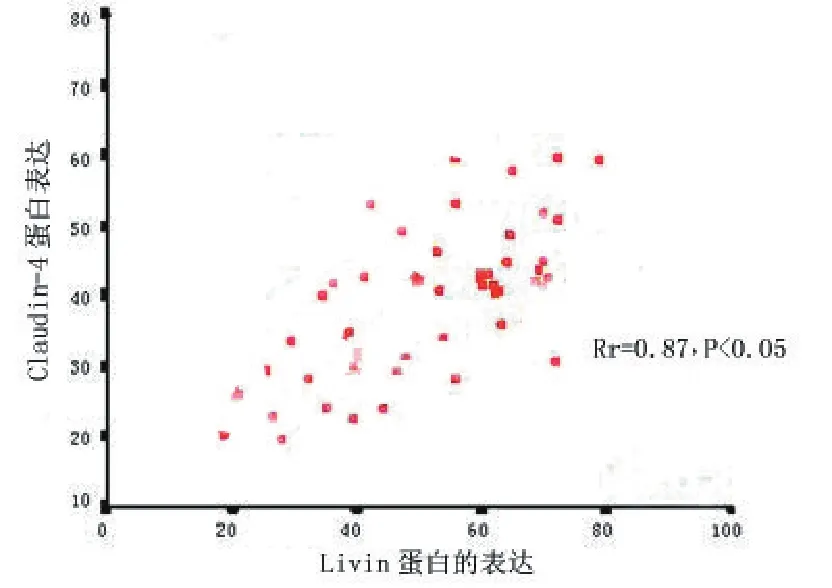
图2 Livin和Claudin-4在前列腺癌中Spearmen相关性分析结果
3 讨论
前列腺癌发生进展与基因调节的细胞异常增殖和凋亡功能散失有关。内源性抗凋亡蛋白Livin基因通过抑制半胱天冬酶激活因子(Smac)导致Caspase-3和Caspase-7酶的水解从而抑制了细胞的凋亡[4-5];而Claudins是构成紧密连接的主要成分,参与维持细胞极化的细胞信号的传导。研究显示,细胞间的连接结构和功能的改变后肿瘤细胞更易于脱离原发灶,穿过细胞间隙进入血管或淋巴管,引起肿瘤细胞的扩散和转移[6-7]。
本实验使用组织芯片和免疫组化SP法对Livin和Claudin-4在前列腺癌和增生前列腺组织中的表达状况进行了研究,结果显示,Livin和Claudin-4在前列腺增生组织内极少表达.而在前列腺癌内呈现高表达,在前列腺增生组织中表达率明显下降,在前列腺癌中39例Gleason评分<7分的阳性表达率为56.41%(22/39),在32例前列腺癌Gleason评分≥7分的表达率为82.05%(26/32),两者之间比较有差异。在前列腺癌Ⅰ~Ⅱ期表达率56.10%(23/41)和Ⅲ~Ⅳ期阳性表达率为83.33%(25/30),两者相比有明显差异(P<0.05),Claudin-4在39例前列腺癌<7分的阳性表达率为43.59%(17/39),Claudin-4在32例前列腺癌≥7分的表达率为75.00%(24/32),两者之间比较有差异。在Ⅰ~Ⅱ期表达率60.98%(25/41)和Ⅲ~Ⅳ期阳性表达率为80.00%(24/30),两者相比有明显差异(见表1)。结果显示在前列腺癌中Livin的异常表达可能在前列腺癌的发生进展中有重要作用。
Maeda等[8]体外实验对人类前列腺癌的细胞株(22Rv1,DU145和PC3)和正常的人类前列腺上皮细胞(PrECs)中Claudin-3和Claudin-4的表达水平及细胞定位进行研究,同时应用产气荚膜梭菌肠毒素(CPE)引发上皮细胞裂解实验观察靶向干扰Claudin-3和/或Claudin-4的CPE介导的细胞对PC3裸鼠移植瘤的治疗效果,结果显示Claudin-4和Claudin-3在人类前列腺癌细胞系22Rv1,DU145和PC3异常增高表达。靶向干扰Claudin-4后PC3和22Rv1细胞株中细胞毒性显著下降,移植瘤的生长受到明显抑制。证实了Claudin-4在前列腺癌细胞中存在异常表达。我们前期也利用组织芯片技术发现前列腺癌中存在Claudin-4基因和蛋白的异常表达,进而对其与前列腺癌分化和临床分期进行研究。
Livin与前列腺癌分期和分化程度相关[9-10],国内也有对前列腺癌组织中Livin蛋白阳性表达与前列腺癌临床分期和分化程度的报告[11-12],Livin以何种方式进行作用,研究显示:Livin通过抑制凋亡激活信号通路[13-14];Claudin-4异常表达影响细胞膜的通透性和细胞极性,致使肿瘤信号系统异常,刺激肿瘤增殖[15],我们还对前列腺癌中Livin蛋白和Claudin-4的表达进行了相关性分析,结果显示,前列腺癌中Livin蛋白和和Claudin-4有正相关性,据此推测,Livin在前列腺癌异常表达可能促进了Claudin-4异常增高表达,它们共同参与了前列腺癌发生进展,它们在前列腺中异常表达呈现出分期越晚,表达率越高,表示它们在前列腺癌演进中起重要作用。
总之,凋亡抑制基因Livin和Claudin-4在前列腺癌中异常表达,它们可能共同参与了前列腺癌的发生进展,但Livin和Claudin-4在前列腺癌中表达上调通过何种机制对前列腺癌进展起作用,靶向干扰Livin和Claudin-4是否可以影响前列腺癌细胞的生物学行为,尚需进一步研究。
[1]叶定伟.前列腺癌的流行病学及中国的发病趋势[J].中华外科杂志,2006,44(6):362-364.
[2]Guo H,Gao YT,Zhang Q,et al.Expression and clinical significance of livin protein in hepatocellular carcinoma[J].Dis Markers, 2013,35(5):489-496.
[3]Ding ZY,Liu GH,Birgit O,et al.Upregulation of the antiapoptotic factor Livin contributes to cisplatin resistance in colon cancer cells [J].Tumor Biol,2013,34(2):683-693.
[4]Yoon TM,Kim SA,Lee DH,et al.Expression of Livin and the inhibition of tumor progression by Livin silencing in laryngohypopharyngeal cancer[J].In Vivo,2014,28(5):751-759.
[5]Kenneth NS,Duckett CS.IAP proteins:regulators of cell migration and development[J].Curr Opin Cell Biol,2012,11(24):871-875.
[6]K Ye L,Song X,Li S,et al.Livin-alpha promotes cell proliferation by regulating G1-S cell cycle transition in prostate cancer[J]. Prostate,2011,71(1):42-51.
[7]Heiskala M,Peterson PA,Yang Y.The Roles of Claudin Superfamily Proteins in Paracellular Transport[J].Traffic,2001,2(2):92-98.
[8]Maeda T,Murata M,Chiba H,et al.Claudin-4-targeted therapy using Clostridium perfringens enterotoxin for prostate cancer[J].Prostate,2012,72(4):351-360.
[9]Gu J,Ren L,Wang X,et al.Expression of livin,survivin and caspase-3 in prostatic cancer and their clinical significance[J].Int J Clin Exp Pathol,2015,8(11):14034-14039.
[10]Chen F,Yang D,Wang S,et al.Livin regulates prostate cancer cell invasion by impacting the NF-κB signaling pathway and the expression of FN and CXCR4[J].Iubmb Life,2012,64(3):274-283.
[11]朱永锋,张春霆.组织芯片检测凋亡抑制蛋白Livin在前列腺癌中的表达及意义[J].中国中西医结合外科杂志,2015,14(3):221-223.
[12]宋涛,洪宝发,高江平,等.前列腺癌组织中凋亡抑制基因Livin的表达研究[J].中国男科学,2008,14(1):30-33.
[13]Ye L,Song X,Li S,et al.Livin-α promotes cell proliferation by regulating G1-S cell cycle transition in prostate cancer[J].Prostate,2011,71(1):42-51.
[14]Zhang Y,Huang H,Zhou H,et al.Activation of nuclear factor κB pathway and downstream targets survivin and livin by SHARPIN contributes to the progression and metastasis ofprostate cancer[J]. Cancer,2014,120(20):3208-3218.
[15]Landers KA,Samaratunga H,Teng L,et al.Identification of claudin-4 as a marker highly overexpressed in both primary and metastatic prostate cancer[J].Br J cancer,2008,99(3):491-501.
(收稿:2016-09-02 修回:2016-11-20)(责任编辑 张亚强)
Expression and Significance of Livin and Claudin-4 Protein in Prostate Cancers with Tissue Microar-ray
ZHANG Chun-ting,ZHU Zai-sheng.
Department of Urology,Zhejiang University Jinhua Hospital,Jin-hua(321000),China
Objective To explore the relationship of clinical pathological characteristics and expression of Livin and Claudin-4 protein in prostate cancers. Methods Tissue microarray technology was used for detect tissues for 71 cases with prostate cancer and 37 patients with benign prostatic hyperplasia.Total 64 paraffin microarray were arranged.ImmunohistochemicalSP method was used to detect expression of Livin and Claudin-4 protein in the chip.Relationship between expression of Livin and Claudin-4 and clinicopathologic features.Spearman rank correlation was used toassess the relationship between expression of Livin and Claudin-4. Results The positive expression rates of Livin and Claudin-4 in benign prostatic hyperplasia tissues were significantly lower than those in prostate cancer tissues(P<0.01).The positive expression rates of Livin in prostate cancer tissues were 56.41%(22/39) (Gleason score<7)and 81.25%(26/32)(Gleason score≥7).The positive expression rates of Livin were 56.10% (23/41)in stage I~II and 83.33%(25/30)in stageⅢ~Ⅳ,respectively.The positive expression rates of Claudin-4 were in prostate cancer tissues were 43.59(17/39)for Gleason score<7 and 75.00(24/32)for Gleason Score≥7. For stage I~II andⅢ~Ⅳ,the expression of Claudin-4 were 60.98%(25/41)and 80.00%(24/30),respectively. The expression of Livin and Claudin-4 was positively correlated by Spearman's rank correlation(r=0.87). Conclusion Abnormal expression of Livin and Claudin-4 protein may be involved in generation and development of prostate cancer.Combined detection can assess the prognosis of prostate cancer.
Prostate cancer;livin;claudin-4;tissue microarray;immunohistochemistry
R737.25
A
1007-6948(2017)02-0118-04
10.3969/j.issn.1007-6948.2017.02.004
浙江省金华市科学技术研究计划项目资助(2013-3-043)
浙江大学金华医院泌尿外科(金华 30021l)
朱再生,E-mail:zaishengzhu@126.com

