添加尿素和秸秆对三熟制水旱轮作土壤各形态氮素的影响①
张 丽,张 磊,鲁剑巍,李小坤,任 涛,丛日环
(华中农业大学资源与环境学院/农业部长江中下游耕地保育重点实验室,武汉 430070)
添加尿素和秸秆对三熟制水旱轮作土壤各形态氮素的影响①
张 丽,张 磊,鲁剑巍,李小坤,任 涛,丛日环*
(华中农业大学资源与环境学院/农业部长江中下游耕地保育重点实验室,武汉 430070)
添加不同外源氮对土壤中不同形态氮素的转化具有十分重要的影响。选取长期耕作土壤,设置对照、添加尿素N 150 kg/hm2(U150)、添加秸秆(相当于添加N 38 kg/hm2,Straw)、添加尿素N 150 kg/hm2+秸秆(相当于添加N 188 kg/hm2,U150+Straw)和添加尿素N 188 kg/hm2(U188)5个处理进行室内培养试验,研究了添加不同外源氮对土壤铵态氮、硝态氮、可溶性有机氮、微生物生物量氮含量的影响。结果表明,土壤铵态氮随着培养时间的延长表现为先增后减的趋势,添加尿素的两个处理其土壤铵态氮较 Straw、U150+Straw处理能够更快地达到峰值;而土壤硝态氮则表现为逐步增加的趋势。添加尿素处理能够显著提高土壤矿质氮的含量,在添加等量氮素的条件下,U188处理矿质氮含量在培养期间始终高于U150+Straw处理;此外,U150+Straw处理矿质氮含量在培养前期均低于U150处理,至培养30天后其含量略高于U150处理。与对照相比,培养结束时添加不同外源氮素处理的土壤矿质氮含量能够提高169.61% ~ 496.75%。对于微生物生物量氮和可溶性有机氮而言,添加不同外源氮素分别在培养10天和30天达到峰值,此后逐渐降低。不同处理而言,添加秸秆+尿素、添加秸秆处理的微生物生物量氮和可溶性有机氮含量在培养前期明显高于仅添加尿素的两个处理,说明添加有机物料氮源主要有益于提高土壤有机态的氮素含量。
秸秆;尿素;铵态氮;矿质氮;可溶性有机氮;微生物生物量氮
不同形态的氮在土壤中的转化是极其复杂的过程。土壤矿质氮、可溶性有机氮和微生物生物量氮是植物生长可利用氮素的直接或间接来源,也是氮储存库中较活跃的组分[1–3]。矿质氮在土壤中的固定方式短期内主要是生物同化作用,微生物通过同化作用将矿质氮转化为微生物生物量氮,经过短期储存后再以矿质氮形式释放出来,这种过程对土壤氮素变化影响较大[4]。微生物生物量氮也是可溶性有机氮的潜在来源,微生物死亡后,其微生物生物量氮部分转变为可溶性有机氮[5–6]。与施用化肥相比,秸秆还田是培肥土壤的有效措施之一[7]。有研究表明,碳(如秸秆等)、氮的种类和数量能影响微生物对施入氮素的固持与释放[8]。土壤氮素的固持是生物与非生物因素综合作用的结果。Accoe 等[9]和廖继佩等[10]研究表明,微生物对加入土壤的硝酸铵的固持迅速,施入土壤的铵态氮的晶格固定是其主要的非生物固持作用,施入土壤的硝态氮则通过异化性硝酸盐还原作用转化为铵态氮被土壤固持[11–12]。秸秆配施尿素处理能显著提高土壤的矿质态氮和微生物生物量氮[13],土壤矿质态氮含量较高时,作物首先利用矿质态氮,而在土壤矿质态氮含量处于较低水平时,微生物固持的氮素可能会释放出来供作物吸收利用[14]。梁斌等[15]研究表明,秸秆覆盖能提高土壤微生物生物量氮含量,显著降低小麦拔节期和灌浆期土壤可溶性有机氮含量,小麦生长后期适量施化学氮肥(120 kg/hm2)能提高微生物生物量氮含量,而过量施用(240 kg/hm2)则降低其含量。有研究指出,农作物根茬在改善土壤理化性质上有明显作用[16],由于大量根茬的残留,实行稻–稻–油轮作模式的长期定位试验土壤其基础理化性质将发生改变,本研究采用室内培养试验的方法(不种植作物),排除作物影响因素,选取稻–稻–油轮作模式下长期单施化肥的定位试验点土壤,采用室内模拟的方法研究添加不同外源氮对于土壤不同形态氮素的影响,旨在比较不同外源氮对长期定位试验土壤氮素供应特征的影响,为合理调控氮素提供科学依据。
1 材料与方法
1.1 供试土壤
供试土壤取自湖北省武穴市大金镇(29°59¢10.26²N,115°37¢9.72²E),该区域属亚热带季风性湿润气候区。年平均气温16.9℃,以7月份气温最高,平均29.1℃,1月份气温最低,平均为 4.1℃。年平均降雨量1 489 mm(1985—2014年30年平均值),年蒸发量1 361 mm。境内无霜期约为262 d,日照辐射平均为12.2 MJ/(m2· d),年均日照时数为1 913 h。地带性土壤为黏性水稻土。
供试土壤选取的是长期施用化肥土壤。该试验区每季早稻施肥量为N 150 kg/hm2、P2O560 kg/hm2、K2O 135 kg/hm2;晚稻施肥量为N 150 kg/hm2、P2O545 kg/hm2、K2O 150 kg/hm2;油菜施肥量为 N 210 kg/hm2、P2O575 kg/hm2、K2O 150 kg/hm2、硼砂15 kg/hm2,所用肥料为尿素(N 46%)、过磷酸钙(P2O512%)、氯化钾(K2O 60%)和硼砂(B 12%)。2014年油菜收获后采集耕层土壤样品(0 ~ 20 cm),一部分新鲜土壤样品置于冰箱冷藏(4℃)用于测定土壤初始理化性质,其中有机质和pH采用干土测定;另一部分土壤风干、过筛后(2 mm)作为培养试验使用。供试土壤各形态氮含量及有机质、微生物生物量碳、pH见表1。

表1 供试土壤不同形态氮含量及基础理化性质(0 ~ 20 cm)Table 1 Different form N contents and basic physical and chemical properties of tested soil
1.2 试验设计
室内培养试验设置5个处理:①对照(CK)、②添加尿素N 150 kg/hm2(U150)、③添加水稻秸秆(相当于添加N 38 kg/hm2,Straw)、④添加尿素N 150 kg/hm2+水稻秸秆(相当于添加N 188 kg/hm2,U150+Straw)、⑤添加尿素N 188 kg/hm2(U188),各处理设4次重复。添加秸秆处理相当于田间秸秆还田量为7 500 kg/hm2(按照耕层土壤重量2 500 t/hm2换算)。秸秆风干后剪成0.5 cm左右,秸秆中碳、氮含量分别为40.32%、0.51%,碳氮比为79.5。
称取100.0 g风干土样(过2 mm筛),与外源氮(秸秆或化学氮肥)混匀后装瓶,调整土壤含水量为30%,无菌封口膜封口,膜上留10个小孔。25 ℃ 恒温培养,每两天称重补加水分,保证培养期间土壤含水量恒定。
1.3 测定项目与方法
矿质氮取样时间:添加尿素处理(即U150、U150+ Straw、U188处理)为培养后第1,2,3,4,5,6,8,10,15,20,30,50,70天采样;未添加尿素处理(即CK、Straw处理)为培养后第5,10,20,30,50,70天采样。全氮、可溶性有机氮及微生物生物量氮取样时间为培养后第5、10、20、30、50天。各重复每次取一瓶土壤进行取样分析。
全氮测定采用凯氏定氮法[17];矿质氮使用流动分析仪测定[18];土壤可溶性有机氮用0.5 mol/L K2SO4浸提土样(水土比4︰1),浸提液经0.45 μm滤膜过滤后,滤液中可溶性总氮(TSN)用过硫酸钾氧化比色法测定[19],滤液中的可溶性有机氮(SON)为可溶性总氮与矿质态氮之差[20]。土壤微生物生物量碳、氮采用氯仿熏蒸法浸提,以熏蒸和未熏蒸的有机碳、全氮[21–22]含量之差分别除以转换系数kEC和kEN得到,其中kEC= 0.45[23],kEN= 0.54[24]。
1.4 数据处理
采用Origin 9.0和SPSS软件进行制图和统计分析,最小显著法(LSD)检验试验数据的差异显著性水平(P<0.05)。
2 结果与分析
2.1 添加不同外源氮对土壤铵态氮含量的影响
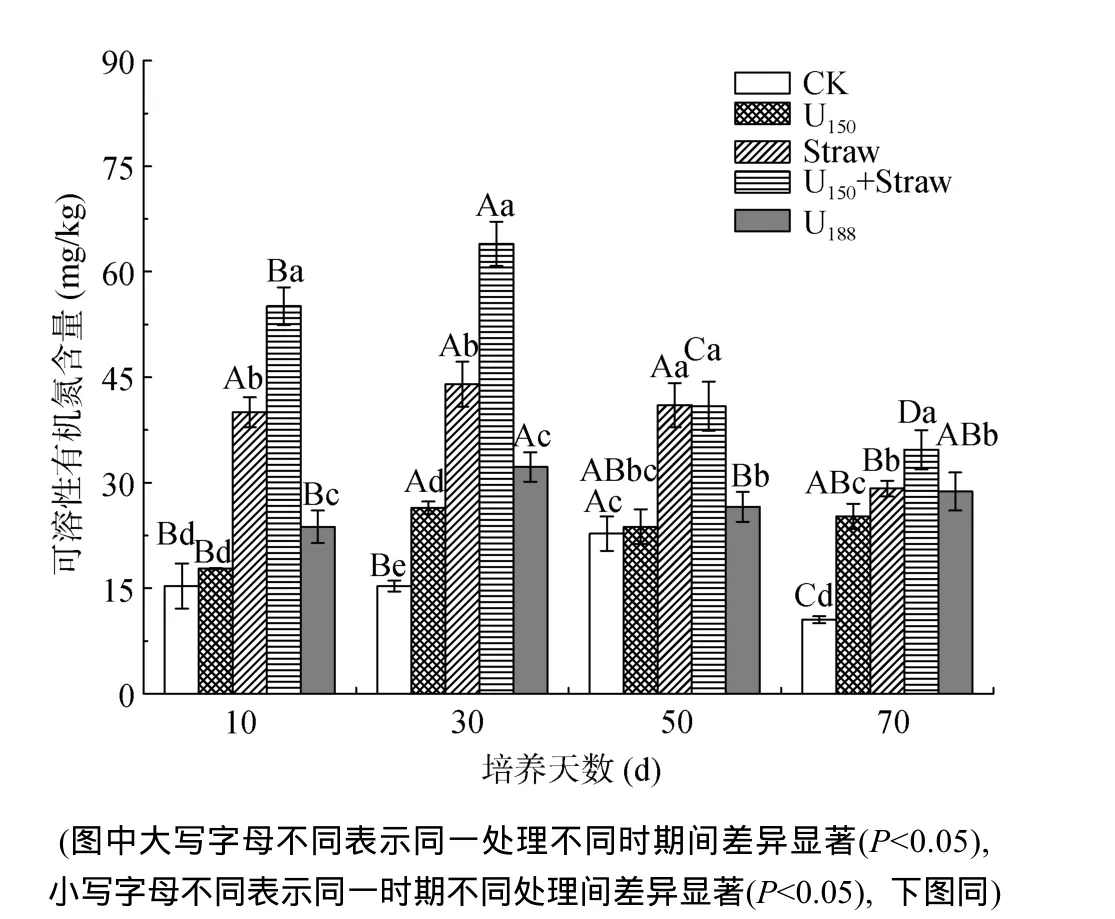
由图1可知,试验中不同外源氮处理均能提高土壤铵态氮含量,整体表现为:CK处理 2.2 添加不同外源氮对土壤硝态氮含量的影响 图1 添加不同外源氮对土壤铵态氮的影响Fig. 1 Effects of different exogenous N sources on soil ammonium N 图2 添加不同外源氮对土壤硝态氮的影响Fig. 2 Effects of different exogenous N sources on soil nitrate N 由图2可知,在培养10天内,各处理的硝态氮含量均较低且无显著差异,10天后迅速提升,至30天基本达到平衡,且添加不同外源氮均能显著提高土壤硝态氮含量,以U188处理效果最好,Straw处理最低。至培养结束,Straw处理硝态氮含量较CK提高264.46%;U150处理较Straw处理提高14.30%;U150+ Straw处理硝态氮含量与U150和Straw处理相比分别增加 38.49% 和 58.30%;而在添加等氮量条件下,U188处理硝态氮含量则显著高于U150+Straw处理,提高幅度为42.32%。 2.3 添加不同外源氮对土壤矿质氮含量的影响 如图3所示,各施氮处理土壤矿质氮含量在培养期间均呈现出先增加后降低的趋势。添加不同外源氮对土壤矿质氮的影响差异明显。至培养结束,土壤矿质氮表现为U188处理 > U150+Straw处理 > U150处理> Straw处理 > CK。其中,Straw处理在培养5天前矿质氮含量与 CK处理持平,随后逐渐高于后者。U150+Straw处理在培养30天内矿质氮含量低于U150处理,30天后前者逐渐表现出优势。以上结果表明与添加尿素相比,秸秆配施尿素对矿质氮的提高效应表现在30天之后。在等氮投入的情况下,U188处理矿质氮含量显著高于U150+Straw处理,U188处理最大值较后者提高38.95%,较U150处理提高91.31%。 图3 添加不同外源氮对土壤矿质氮的影响Fig. 3 Effects of different exogenous N sources on soil mineral N 2.4 添加不同外源氮对土壤可溶性有机氮含量的影响 如图4所示,添加不同外源氮均能提高土壤可溶性有机氮含量,在培养前期各处理间差异较大,随着培养时间的延长处理间可溶性有机氮差异逐渐减小。总体来看,土壤可溶性有机氮含量表现为U150+Straw处理>Straw处理>U188处理>U150处理>CK。Straw处理和U150+Straw处理均在培养第30天达到峰值且显著高于其他处理。培养第30天时,U150+ Straw处理较U150处理可溶性有机氮含量提高141.93%,较Straw处理提高 45.16%,较等氮量投入的 U188处理提高98.35%,说明与添加尿素或秸秆相比,秸秆配施尿素能显著提高土壤可溶性有机氮含量,而添加秸秆处理对可溶性有机氮的提升作用优于尿素。培养至第 70天时,不同外源氮处理间差异程度显著降低,土壤可溶性有机氮含量介于25.19 ~ 34.70 mg/kg。 图4 添加不同外源氮对土壤可溶性有机氮的影响Fig. 4 Effects of different exogenous N sources on soil dissolved organic N 2.5 添加不同外源氮对土壤微生物生物量氮含量的影响 添加秸秆能够显著提高土壤微生物生物量氮含量(图5),其中Straw处理和U150+Straw处理在第10天时微生物生物量氮含量达到最大值,10天后迅速下降并小幅波动,而U150和U188处理则在第30天时达到峰值。这可能是由于微生物受到秸秆中碳源刺激后迅速建立种群,而尿素对微生物种群的影响远小于秸秆所致。U150处理在培养前期(10天和30天)对微生物生物量氮含量有提升作用,到50天后与CK差异不显著,Straw处理、U150+Straw处理和U188处理在整个培养期间均能显著提高土壤微生物生物量氮含量。培养第10天时,U150+Straw处理微生物生物量氮含量显著高于其他处理,较U150处理微生物生物量氮含量提高139.32%,较等氮量投入的U188处理提高104.06%;Straw处理较U150处理和U188处理则分别提高128.21% 和94.60%。至培养第70天时,Straw处理和 U150+Straw处理较 U150处理提高 154.79% 和87.65%,较U188处理提高 104.72% 和 50.78%。 图5 添加不同外源氮对土壤微生物生物量氮的影响Fig. 5 Effects of different exogenous N sources on soil microbial N 前人研究表明,施入有机物料的碳、氮比越高,土壤微生物对肥料氮的固持量越大,释放率降低[25],添加外源有机物料对土壤微生物生物量碳、氮和可溶性有机碳、氮的影响远大于化肥的施用,特别是有机无机肥配合施用影响效果更明显[26–27]。本试验结果表明,U180处理对土壤矿质氮的提升效果最好,U150+Straw处理和U150处理次之,Straw处理和CK效果最差。Straw处理的矿质氮含量在培养前5天低于CK,第5天开始逐渐高于后者,而第10天时Straw处理的微生物生物量氮含量显著高于CK,10天后迅速下降。这可能是由于秸秆还田初期,土壤 C/N发生急剧变化,秸秆前10天的腐解速率最快[28],微生物利用矿质氮大量繁殖,导致添加秸秆的土壤矿质氮含量低于对照[29–32];腐解10天后,秸秆中可溶性有机物逐渐减少,微生物活性迅速降低[33],Straw处理的微生物生物量氮含量随之降低,且微生物生物量氮部分转化为矿质氮。而 U150+Straw处理矿质氮含量显著高于CK,是由于尿素中的氮不仅能作为微生物的营养物质,使本试验中 U150+Straw处理微生物生物量氮含量显著高于不添加秸秆处理,且能部分转化为土壤中的矿质氮[34]。在培养 30天前,U150+Straw处理矿质氮含量低于U150处理,培养30天开始呈现为U150处理 本试验中各外源氮处理均能提高土壤可溶性有机氮含量,在30天左右达到最大值,30天后逐渐下降,这一研究结果与李亚娟等[36]的研究结果相似,其中以Straw处理和U150+Straw处理效果最好,U180处理和U150处理次之,CK效果最差。这可能是由于加入水和秸秆后,土壤微生物活化且数量高于其他处理,一方面微生物代谢产物的增加促进了可溶性有机物的积累[37];另一方面微生物将土壤有机氮矿化,而可溶性有机氮作为矿化的中间物质大量积累并显著高于不施秸秆处理,随着矿化加深,各处理可溶性有机氮含量均逐渐降低[36]。从试验结果可知,Straw处理和U150+Straw处理微生物生物量氮在第10天达到最大值,可溶性有机氮在第30天达到最大值,微生物代谢产物作为可溶性有机氮重要来源[5–6]。由此推测,可能是微生物种群大量增加后代谢产物随之迅速积累,导致在之后的20天中可溶性有机氮含量大幅增加,在第30天达到最大值,30天后随微生物种群的减少而降低。 通过室内培养试验发现,添加不同氮源(尿素和秸秆)对土壤各形态氮含量影响不同。其中,添加尿素的两个处理其土壤铵态氮较Straw、U150+ Straw处理能够更快地达到峰值;而各处理土壤硝态氮则表现为逐步增加的趋势。在添加等量化学氮素的条件下,U150+Straw 处理矿质氮含量在培养前期均低于 U150处理,至培养30天后其含量略高于U150处理。此外,添加有机物料氮源更有利于提高土壤微生物生物量氮和可溶性有机氮的含量。 [1] Taylor J P, Wilson B, Mills M S, et al. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques[J]. Soil Biology and Biochemistry, 2002, 34(3): 387–401 [2] 肖新, 朱伟, 肖靓, 等. 适宜的水氮处理提高稻基农田土壤酶活性和土壤微生物量碳氮[J]. 农业工程学报, 2013, 29(21): 91–98 [3] 汤宏, 沈健林, 张杨珠, 等. 秸秆还田与水分管理对稻田土壤微生物量碳、氮及溶解性有机碳、氮的影响[J]. 水土保持学报, 2013, 27(1): 240–246 [4] 程谊, 张金波, 蔡祖聪. 土壤中无机氮的微生物同化和非生物固定作用研究进展[J]. 土壤学报, 2012, 49(5): 1030–1036 [5] Bowles T M, Acosta-Martínez V, Calderón F, et al. Soil enzyme activities, microbial communities, and carbon and nitrogen availability in organic agroecosystems across an intensively-managed agricultural landscape[J]. Soil Biology and Biochemistry, 2014, 68(1): 252–262 [6] Bonkowski M, Griffiths B, Scrimgeour C. Substrate heterogeneity and microfauna in soil organic ‘hotspots’ as determinants of nitrogen capture and growth of ryegrass[J]. Applied Soil Ecology, 2000, 14(1): 37–53 [7] 劳秀荣, 孙伟红, 王真, 等. 秸秆还田与化肥配合施用对土壤肥力的影响[J]. 土壤学报, 2003, 40(4): 618–623 [8] Saetre P, Stark J M. Microbial dynamics and carbon and nitrogen cycling following re-wetting of soils beneath two semi-arid plant species[J]. Oecologia, 2005, 142(2): 247–260 [9] Accoe F, Boeckx P, Videla X, et al. Estimation of gross nitrogen transformations and nitrogen retention in grassland soils using FLUAZ[J]. Soil Science Society of America Journal, 2005, 69(6): 1967–1976 [10] 廖继佩, 李法云, 张杨珠, 等. 湖南稻田土壤固定态铵含量的季节变化及生物有效性[J]. 应用生态学报, 2003, 14(10): 1665–1668 [11] Zogg G P, Zak D R, Pregitzer K S, et al. Microbial immobilization and the retention of anthropogenic nitrate in a northern hardwood forest[J]. Ecology, 2000, 81(7): 1858–1866 [12] Burger M, Jackson L E. Plant and microbial nitrogen use and turnover: Rapid conversion of nitrate to ammonium in soil with roots[J]. Plant and Soil, 2005, 266(1–2): 289–301 [13] 王晓波, 车威, 纪荣婷, 等. 秸秆还田和保护性耕作对砂姜黑土有机质和氮素养分的影响[J]. 土壤, 2015, 47(3): 483–489 [14] 梁斌, 周建斌, 杨学云. 长期施肥对土壤微生物生物量碳、氮及矿质态氮含量动态变化的影响[J]. 植物营养与肥料学报, 2010, 16(2): 321–326 [15] 梁斌, 周建斌, 杨学云, 等. 栽培和施肥模式对黄土区旱地土壤微生物量及可溶性有机碳、氮的影响[J]. 水土保持学报, 2009, 23(2): 132–137 [16] 张镜清, 王文山. 农作物根茬培肥土壤的作用[J]. 土壤通报, 1984, 15(2): 63–64 [17] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999 [18] 化党领, 张诗卉, 王瑞, 等. 施氮量对植烟土壤不同土层无机氮质量含量的调控[J]. 中国水土保持科学, 2012, 10(6): 86–91 [19] 党琦, 于涌杰, 程谊, 等. 过硫酸钾氧化法测定溶解性有机氮含量和15N 丰度方法研究[J]. 土壤, 2013, 45(6): 999–1002 [20] 靳红梅, 常志州, 郭德杰, 等. 追施猪粪沼液对菜地氨挥发的影响[J]. 土壤学报, 2012, 49(1): 86–95 [21] Joergensen R G. The fumigation-extraction method to estimate soil microbial biomass: Calibration of the kECvalue[J]. Soil Biology and Biochemistry, 1996, 28(1): 25–31 [22] Joergensen R G, Mueller T. The fumigation-extraction method to estimate soil microbial biomass: Calibration of the kENvalue[J]. Soil Biology and Biochemistry, 1996, 28(1): 33–37 [23] Wu J, Joergensen R G, Pommerening B, et al. Measurement of soil microbial biomass C by fumigation-extraction—an automated procedure[J]. Soil Biology and Biochemistry, 1990, 22(8): 1167–1169 [24] 何振立. 土壤微生物量的测定方法: 现状和展望[J]. 土壤学进展, 1994, 22(4): 36–44 [25] 唐玉霞, 孟春香, 贾树龙, 等. 不同碳氮比肥料组合对肥料氮生物固定、释放及小麦生长的影响[J]. 中国生态农业学报, 2007, 15(2): 37–40 [26] 宋震震, 李絮花, 李娟, 等. 有机肥和化肥长期施用对土壤活性有机氮组分及酶活性的影响[J]. 植物营养与肥料学报, 2014, 20(3): 525–533 [27] 韩晓日, 郑国砥, 刘晓燕, 等. 有机肥与化肥配合施用土壤微生物量氮动态、来源和供氮特征[J]. 中国农业科学, 2007, 40(4): 765–772 [28] 罗文丽, 周柳强, 谭宏伟, 等. 水稻秸秆腐解规律及养分释放特征[J]. 南方农业学报, 2014, 45(5): 808–812 [29] 江永红, 宇振荣, 马永良. 秸秆还田对农田生态系统及作物生长的影响[J]. 土壤通报, 2001, 32(5): 209–213 [30] Lovell R D, Jarvis S C, Bardgett R D. Soil microbial and activity in long-term grassland: Effects of management change[J]. Soil Biology and Biochemistry, 1995, 27(7): 969–975 [31] Ocio J A, Brookes P C, Jenkinson D S. Field incorporation of straw and its effects on soil microbial biomass and soil inorganic N[J]. Soil Biology and Biochemistry, 1991, 23(2): 171–176 [32] 张亚丽, 张娟, 沈其荣, 等. 秸秆生物有机肥的施用对土壤供氮能力的影响[J]. 应用生态学报, 2002, 13(12): 1575–1578 [33] 何念祖, 林咸永, 林荣新. 面施和深施对秸秆中氮磷钾释放的影响[J]. 土壤通报, 1995, 26(7): 40–42 [34] 梁斌, 赵伟, 杨学云, 等. 氮肥及其与秸秆配施在不同肥力土壤的固持及供应[J]. 中国农业科学, 2012, 45(9): 1750–1757 [35] 戴志刚. 秸秆养分释放规律及秸秆还田对作物产量和土壤肥力的影响[D]. 武汉: 华中农业大学, 2009 [36] 李亚娟, 杨俞娟, 张友润, 等. 水分状况与供氮水平对土壤可溶性氮素形态变化的影响[J]. 植物营养与肥料学报, 2010, 16(5): 1153–1160 [37] 刘艳, 周国逸, 刘菊秀. 陆地生态系统可溶性有机氮研究进展[J]. 生态学杂志, 2005, 24(5): 573–577 Effects of Urea and Straw on Soil Different Nitrogen Forms Under Paddy-Upland Rotation of Triple Cropping System ZHANG Li, ZHANG Lei, LU Jianwei, LI Xiaokun, REN Tao, CONG Rihuan* Adding different exogenous nitrogen (N) sources is essential for soil N transformation. In this study, soil under long-term cultivation was selected to conduct the indoor incubation experiment, in which five treatments were designed in order to analyze the effects of adding different exogenous N sources on soil ammonium N (NH4+), nitrate N (NO3–), dissolved organic N (DON), and microbial biomass N (MBN), the designed treatments were as follows: 1) control(CK), 2) adding Urea at N 150 kg/hm2(U150), 3) adding rice straw (equal to adding N 38 kg/hm2, Straw), 4) adding urea and straw (equal to adding N 188 kg/hm2, U150+Straw), and 5) adding urea at N 188 kg/hm2(U188). The results showed that soil NH4+increased first and then decreased during the incubation period, soil NH4+of treatments adding with urea reached the peak value more rapidly than those adding with straw. Soil NO3–content increased with time. Total mineral N of U188treatment was higher than that of U150+Straw treatment during the period of incubation. Compared with U150treatment, soil mineral N content was lower in U150+Straw treatment but became a little higher after 30 days of incubation. Compared with CK, adding different exogenous N source increased soil mineral N by 169.61% – 496.75% at the end of incubation. MBN and DON of treatments with adding different exogenous N sources reached maximum values at 10 days or 30 days after incubation and then decreased with time. MBN and DON of treatments with adding straw and/or straw+urea were higher than those with adding urea only during the prior stage of incubation. The results demonstrated that adding exogenous N sources of organic material mainly increased soil organic N. Straw; Urea; Soil ammonium N; Soil mineral N; Dissolved organic N; Microbial biomass N S565.4 A 10.13758/j.cnki.tr.2017.01.003 国家自然科学基金项目(41301319)、湖北省自然科学基金项目(2013CFB203)和湖北省耕地保护与质量提升补贴项目(鄂土肥2015-8)资助。 * 通讯作者(congrh@mail.hzau.edu.cn) 张丽(1989—),女,湖南长沙人,硕士研究生,主要从事土壤肥力培育与养分平衡管理方面研究。E-mail: zhangli1@webmail.hzau.edu.cn



3 讨论
4 结论
(College of Resources and Environment, Huazhong Agricultural University / Key Laboratory of Arable Land Conservation (Middle and Lower Reaches of Yangtze River), Ministry of Agriculture, Wuhan 430070, China)

