脱色工艺对甜菜果胶色值及结构特性的影响*
于淑娟 李太鸿 郭晓明 王智明 艾超 郭筱兵
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640; 2.华南理工大学 广东省天然产物绿色加工与产品安全实验室, 广东 广州 510640)
果胶是位于高等植物细胞壁中的一类异质性多糖,结构非常复杂[1].典型的果胶分子结构至少包括聚半乳糖醛酸聚糖(HG)、I型鼠李糖半乳糖醛酸聚糖(RG-I)等特异性结构区域,HG是由α-D-半乳糖醛酸单元经α-1,4-糖苷键连接而成的聚糖,RG-I则是由半乳糖醛酸和鼠李糖交替重复的线性长链、鼠李糖残基上的C- 4位分别以β-(1→4)糖苷键和α-(1→5)糖苷键与阿拉伯半乳聚糖和阿拉伯吡喃糖残基相连组成,其主要存在于果胶主链的毛发区.侧链由中性糖(阿拉伯糖、鼠李糖和半乳糖等)组成[2].甜菜果胶是一种新型的乳化型果胶,围绕甜菜果胶分子结构与功能、活性的研究受到广泛关注[2- 3].研究证实,甜菜果胶分子结构尤其复杂,除了典型的果胶组成单元外,侧链还含有酚酸、蛋白等单元[4].甜菜果胶中的酚酸、蛋白等物质中存在碳碳双键、羰基、苯基等官能团[5].这些基团能吸收特定波长的紫外可见光,是甜菜果胶潜在的生色基团.
果胶作为天然的食品添加剂,在食品行业中对果胶的需求也急剧增加.而色泽体现食品自身的美学价值,是消费者认知食物品质的直观印象.理想的商品化果胶应该是白色或淡黄色的粉末.然而,甜菜果胶存在色泽较深的问题[6],从而影响了甜菜果胶的感官品质.因此,如何降低甜菜果胶的色泽已成为提高甜菜果胶品质的关键问题[7- 8].目前果胶脱色的方法主要有4种:醇氨溶液脱色、活性炭吸附脱色、化学法脱色(双氧水氧化)以及树脂吸附法脱色[6].虽然这些方法能改善果胶的色泽,但难以从分子结构上解释果胶呈色物质的结构特征.文中评价物理方法(醇洗、透析)和化学方法(双氧水氧化)对甜菜果胶的脱色效果,并利用色差仪、高效阴离子色谱(HPACE)、高效液相体积排阻色谱(HPSEC)等技术探讨色泽与甜菜果胶结构单元的相关性.此外,文中还比较了不同脱色工艺对果胶色值、结构与乳化性能的影响,以期为甜菜果胶的脱色提供理论依据.
1 实验
1.1 材料与试剂
甜菜果胶,自制;鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、半乳糖醛酸,分析纯,美国Sigma公司出品;果胶酶(Rapidase® C80 MAX),酶活为750 U/mL,荷兰DSM公司出品;三氟乙酸,分析纯,上海Aladdin生化科技股份有限公司出品;氢氧化钠,色谱纯,德国Merck公司出品;其他试剂均为分析纯.
1.2 实验方法
1.2.1 甜菜果胶液的制备
称取一定量的甜菜果胶干粉溶于蒸馏水中,配制成10 g/L的果胶溶液,在室温下磁力搅拌4 h(500 r/min),转速6 000 r/min,离心沉降10 min,收集上清液放入4 ℃冰箱储存,备用.
1.2.2 脱色工艺
醇洗:分别取100 mL果胶储备液于4个500 mL烧杯中,加入3倍体积的乙醇(95%,体积分数,余同),静置2 h后离心沉降,取果胶沉淀,再分别用60%、70%、80%的乙醇200 mL重复洗涤3次,静置2 h,离心沉降.取果胶沉淀复溶于水后,将样品冻干.
透析:分别将100 mL果胶储备液装于截留分子质量为3 000、8 000、14 000 u的透析袋中,置于去离子水中,每隔6 h换一次水并用磁力搅拌搅动,透析48 h后,收集样品冻干.
H2O2漂白:各取果胶溶液50 mL于烧杯中,调节pH为11,设置果胶溶液-双氧水体积比为100∶1、100∶2、100∶3、100∶4,在磁力搅拌下(150 r/min),将双氧水与果胶溶液混合均匀,室温静置不同时间.除非另行注明,果胶溶液的脱色时间固定为1 h.脱色结束后,采用1 mol/L的HCl溶液,迅速将pH调回到3.5以终止反应,并将样品冻干.
1.2.3 不同脱色工艺脱色效果表观
色泽观察:每组分别取冻干后的样品溶解为相同质量浓度(5 g/L)的溶液,取10 mL于具塞比色管中进行比色,数码相机拍照后,对比不同溶液的色泽差异.
色差值的测定:将相同浓度、相同体积的果胶溶液分别倒入培养皿中,采用便携式色差仪(CR- 400,日本Konica公司生产)分别测量各组的色差值,各选取不同部位重复测定3次,记录ΔL、Δa、Δb值.
色值A420的测定[9]:色值A420表征甜菜果胶液的褐色差异.将冻干后的样品溶解为相同质量浓度(5 g/L)的溶液,蒸馏水作为空白调零,用紫外分光光度计分别测定各组样品的色值A420,每组测量3次.
1.2.4 甜菜果胶结构特性分析
半乳糖醛酸(GalA)含量测定[10]:配置半乳糖醛酸标准品溶液(50 mg/L),分别取40、120、240、360和400 μL标准溶液置入10 mL具塞试管中,再相应加入去离子水补充到相同体积,在冰浴条件下加入2.5 mL硼砂硫酸溶液,涡旋振荡使其充分混均后,100 ℃水浴中反应5 min,随后加入40 μL显色剂,空白样则加入40 μL 0.5% NaOH溶液,涡旋振荡使其完全混合,以空白样品校零,样品管于520 nm波长下测定其吸光值.根据吸光度与样品浓度关系,绘制半乳糖醛酸标准曲线(y=31.519x+1.418 6,r2=0.999 1);果胶样品测定时称取样品5 mg,充分溶解后定容到100 mL,取0.4 mL的样品到10 mL的具塞试管中,其余步骤同上,样品平行测定3次.
中性糖(NS)含量测定:参考Garna等[11]的方法并略作改动.称取5 mg果胶样品于消化管中,加入1 mL果胶酶溶液,45 ℃酶解24 h.再往酶解液中加入1 mL 2 mol/L的三氟乙酸(TFA),油浴加热至110 ℃,保温4 h后,用氨水调节pH至中性,终止酸解反应.水解液用蒸馏水定容到100 mL,过0.45 μm滤膜后,采用 ICS-5 000 型高效离子色谱仪定量分析中性糖组分.色谱柱采用高效阴离子交换柱CarboPac PA1(4×250 mm,戴安公司) 和 CarboPac PA1保护柱(4×50 mm,戴安公司),检测器采用脉冲安培检测器,淋洗程序为0~25 min,10 mmol/L NaOH;25~35 min,500 mmol/L NaOH.流速为1 mL/min,柱温为30 ℃,进样量为25 μL.绘制鼠李糖(Rha)、阿拉伯糖(Ara)、半乳糖(Gal)、葡萄糖(Glc)和木糖(Xyl)的标准曲线,采用外标法测定各单糖的含量.
阿魏酸(FA)含量测定[12]:将适量果胶样品溶解于碳酸钠-碳酸氢钠缓冲液(pH=10,100 mmol/L)中,以缓冲液作为空白调零,在375 nm下测定溶液的吸光值,样品平行测定3次.
分子质量分布曲线的测定[13]:利用高效液相-体积排阻色谱法(HPSEC)测定果胶的分子质量分布曲线.样品质量浓度为1 g/L.色谱条件:Ultrahydrogel 2 000和Ultrahydrogel 1 000(300 mm×7.5 mm,美国Waters公司)进行串联排阻;流动相为100 mmol/L NaNO3,内含0.4 g/L NaN3;流速为0.6 mL/min;采用2 414示差折光射检测器(美国Waters公司)检测;柱温为35 ℃.
1.2.5 甜菜果胶乳化性分析
乳化活性(AE)及乳化稳定性(SE)的测定:在Dalev等[14]方法基础上略作改动.准确称取一定量的果胶样品,置于100 mL烧杯中,用浓度为0.05 mol/L的柠檬酸缓冲液(pH=3.5)将其配制成5 g/L的果胶溶液.待果胶完全溶解后与中链脂肪酸按1∶1(体积比)混合,10 000 r/min均质2 min,得均匀水包油乳液.再分别移取4 mL乳液于15 mL具有刻度的离心管中,每组3平行,放入水浴锅中于50 ℃水浴加热2 h,以加速乳液分层.分别测量乳液总体积(VW)和乳化层体积(VEL).将上述样品放在室温下保存7 d,再次测量乳化层体积(VEL7).乳化活性AE、乳化稳定性SE的评价方法为
AE=VEL/VW×100%
(1)
SE=VEL7/VEL×100%
(2)
乳化液显微观察:将新鲜乳液用去离子水稀释5倍后,在光学显微镜下观察乳液的粒度,放大倍数为200倍,在清晰的视野下,采用数码相机拍摄油滴照片,随后分析油滴的粒径.
2 结果与讨论
2.1 不同处理方法对果胶色泽的影响
如图1所示,甜菜果胶溶液在H2O2氧化作用下,颜色迅速褪去,而经醇洗和透析处理后,颜色未见明显改善.Δb值指示甜菜果胶溶液的黄蓝色差,数值越大,色泽越偏黄,反之则色泽越偏蓝[15].与对照样相比,经醇洗和透析处理后的溶液Δb值无显著变化(P>0.05);而H2O2氧化脱色后色差值从1.71降至-0.11,溶液的色泽也相应由黄褐色变为澄清透明.上述结果表明,呈色物质可能源于甜菜果胶内源性物质的结构单元,而非以包裹或物理吸附等方式存在于甜菜果胶中.
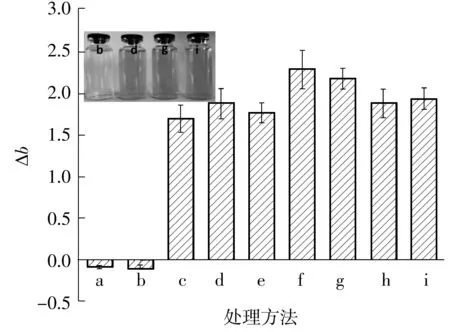
a—蒸馏水;b—3%H2O2氧化0.5 h;c—原样;d—透析(3 000 u);e—透析(8 000 u);f—透析(14 000 u);g—醇洗(60%);h—醇洗(70%);i—醇洗(80%)
Fig.1 Effect of different treatments on color value of sugar beet pectin solution
2.2 H2O2漂白处理对果胶色值的影响
如图2所示,H2O2的脱色效果与H2O2体积分数、脱色时间有关.在受试H2O2体积分数范围内(1%~4%),果胶溶液色值在15 min内从0.139急剧下降为0.058~0.081.反应1 h后,果胶溶液的色值基本趋于平缓.H2O2浓度为1%~3%时,脱色效果随着H2O2浓度的增加而增强;当H2O2体积分数达到3%时,脱色效果最好.但当H2O2体积分数为4%时,果胶颜色反而加深,这可能是H2O2氧化作用过于剧烈导致甜菜果胶碳化[16].

图2 不同浓度H2O2漂白处理后的A420
Fig.2 Absorbance(A420) after H2O2bleaching under different concentrations
2.3 H2O2漂白处理对甜菜果胶化学特性的影响
如表1所示,在H2O2的脱色作用下,果胶的化学成分发生了显著的变化.脱色后,半乳糖醛酸含量由75.5%下降为49.9%~50.6%,可能是H2O2的强氧化作用破坏了果胶聚半乳糖醛酸基本结构单元,导致半乳糖醛酸含量的降低.

表1 H2O2漂白处理对果胶化学组分的影响Table 1 Effect of H2O2 bleaching process on pectin chemical composition
原甜菜果胶的阿魏酸含量为0.38%,而脱色果胶中的阿魏酸几乎为0.究其原因,一方面可能由于H2O2的氧化作用破坏了阿魏酸分子结构中的共轭双键;另一方面,脱色过程的碱处理水解阿魏酸与多糖间的糖苷键[17],从而导致阿魏酸含量减少.阿魏酸含有乙烯基、苯基,能吸收特定波长可见光,将阿魏酸从甜菜果胶分子上剥离后也可能导致果胶的色泽降低.
采用HPAEC-PAD分析甜菜果胶的单糖种类与含量.研究结果表明,H2O2脱色工艺对甜菜果胶中性糖含量具有显著的影响(P<0.05).甜菜果胶中的鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖等的含量均有所下降,下降的幅度与单糖的种类、脱色时间有关.脱色处理前期(0.0~0.5 h),鼠李糖、阿拉伯糖、半乳糖、葡萄糖的含量迅速下降至原来的55%以下.随着脱色时间的进一步延长,这4种单糖的含量没有显著的下降(P>0.05),而木糖总体下降幅度较小.对照样中总中性糖含量较脱色果胶高,且游离的中性糖主要由阿拉伯糖和半乳糖组成.其原因是由于果胶侧链其中一种结构 RG-I的骨架结构是由交替的α-L-鼠李糖和α-D-半乳糖醛酸组成,RG-I侧链则是通过鼠李糖C- 4连接一定量的α-L-阿拉伯糖聚糖和β-D-半乳糖聚糖等[18].总体上脱色会稍微降低果胶中性糖的含量,可能是由于在强氧化脱色条件下,部分单糖结构被破坏,导致中性糖含量降低.
2.4 H2O2漂白处理对分子质量分布的影响
为明晰脱色工艺对样品大分子结构的影响,采用HPSEC法分析了甜菜果胶的分子质量分布曲线,如图3(a)所示.结果表明,原样的分子质量分布曲线见峰1,相对出峰时间为30~37 min,从而表现出典型的宽分散性.经脱色处理后,果胶的多分散程度增加,在原有基础上新生成部分小分子物质(如峰2),其出峰时间为37~39 min.小分子物质的含量随着脱色时间的增加而逐渐变高.可见H2O2漂白处理果胶时形成了分子质量较小的果胶分子片段.这与Diaz等[19]研究发现在碱性条件下果胶易发生β-消除反应,使果胶发生降解的结论相符合.
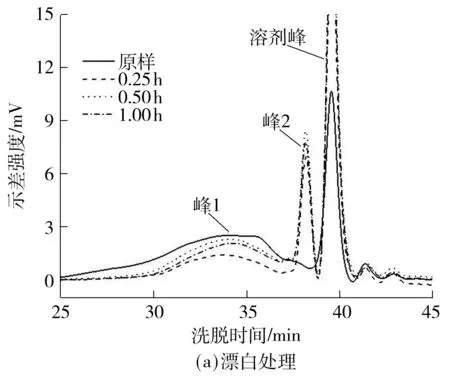
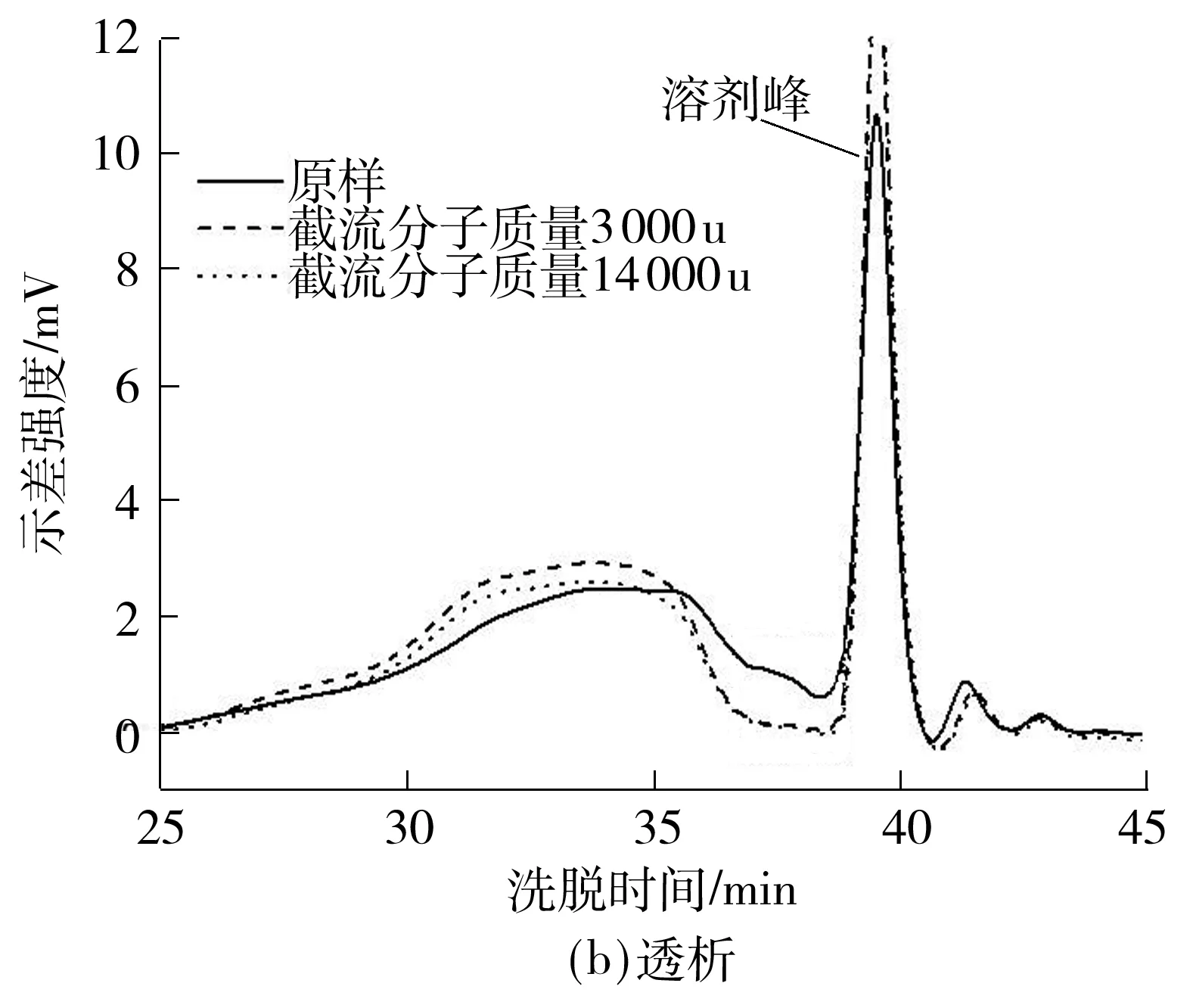
图3 H2O2漂白处理和透析对果胶分子质量的影响
Fig.3 Effect of H2O2bleaching treatment and dialysis on the molecular weight of pectin
对比透析前后样品的分子质量分布曲线,结果如图3(b)所示.原样和透析样品间的组分存在差异性.透析处理降低分子质量分布曲线在36~38 min处的吸收强度,说明一些小分子质量的物质(<14 000 u)被除去.结合图1结果可知,果胶色泽较暗的问题并非游离的小分子物质呈色所致,而可能是果胶内源性呈色物质所致.
2.5 H2O2漂白处理对果胶乳化性能的影响
如表2所示,与对照样相比(乳化活性83.3%),脱色果胶的乳化活性显著降低(P<0.05)(66.7%~75.0%).随着H2O2脱色时间的延长,果胶的乳化活性逐渐降低.研究证实,糖链结合蛋白质、阿魏酸基团是赋予甜菜果胶乳化性的关键因子[20].在本研究中,碱性条件下的H2O2氧化作用可能破坏甜菜果胶中的蛋白质和阿魏酸基团,最终降低果胶的乳化活性.

表2 H2O2漂白处理对乳化性的影响Table 2 Effect of H2O2 bleaching process on emulsification
甜菜果胶制备的乳液在室温储存7 d后,评价其乳化稳定性.如表2所示,脱色果胶所在乳液的稳定性显著低于对照组(P<0.05).另外,脱色时间对乳化稳定性并没有显著的影响.阿魏酸是决定甜菜果胶表面活性的重要结构单元.JUNG等[20]的研究发现,漆酶催化甜菜果胶阿魏酸发生交联后,甜菜果胶的乳化性随之增强.然而,阿魏酸基团在碱性条件下不稳定[17],本研究采用的碱性H2O2脱色法反而导致阿魏酸基团水解,这可能是脱色甜菜果胶乳化稳定性降低的重要原因.
2.6 果胶乳液的微观表征
为了观察不同条件下甜菜果胶乳化液在形态特征上的变化,分别选取不同条件下的乳化液进行显微分析.从图4可以看出,甜菜果胶乳化颗粒均呈较为规则的圆形.H2O2漂白处理后的果胶乳液的乳化颗粒数量减少,并且乳化颗粒体积增大,说明H2O2漂白处理后的果胶乳化活性降低,这与表2结果一致.JUNG等[21]还发现甜菜果胶大分子结构对其乳化性起重要作用,随着平均分子质量和分子链螺旋直径的降低,乳液粒径及吸附果胶量明显降低,在文中,H2O2在漂白甜菜果胶的同时也导致甜菜果胶的大分子组分水解成小分子片段,如图3(a)所示,从而导致甜菜果胶的乳化性能下降.

图4 不同条件下果胶乳化液的显微图片
Fig.4 Light microscopy images of pectin emulsion under diffe-rent conditions
3 结语
文中通过对甜菜果胶分别采用醇洗、透析和H2O2漂白3种方法进行脱色,发现H2O2漂白处理效果明显.当H2O2体积分数为3%、脱色时间为1 h时,脱色效果最好.文中还对H2O2漂白处理后果胶的结构和乳化性能进行了分析,发现H2O2漂白处理后果胶中的半乳糖醛酸含量明显低于未处理果胶中的半乳糖醛酸含量,分别为50.1%和75.5%;中性糖含量稍微降低,分别为11.6%和23.3%,分子质量和乳化活性也有所降低,这说明H2O2漂白工艺显著修饰了果胶的分子结构.由此也说明随着果胶分子质量变小、支链减少,果胶分子不易被吸附在乳化颗粒表面,进而导致乳化活性的降低.因此H2O2漂白虽然脱色效果显著,但对果胶的组分和结构完整性破坏较大,故寻找一种温和而有效的脱色方法将是下一步研究的重点.
参考文献:
[1] GUO Xiao-ming,MENG He-cheng,TANG Qiang,et al.Effects of the precipitation pH on the ethanolic precipitation of sugar beet pectins [J].Food Hydrocolloids,2016,52(1):431- 437.
[2] LÜ C,WANG Y,WANG L J,et al.Optimization of production yield and functional properties of pectin extracted from sugar beet pulp [J].Carbohydrate Polymers,2013,95(1):233- 240.
[3] REMOROZA C,CORDLANDWEHR S,LEIJDEKKERS A G,et al.Combined HILIC-ELSD/ESI-MS(n) enables the separation,identification and quantification of sugar beet pectin derived oligomers [J].Carbohydrate Polymers,2012,90(1):41- 48.
[4] SIEW C K,WILLIAMS P A.Role of protein and ferulic acid in the emulsification properties of sugar beet pectin [J].Journal of Agricultural and Food Chemistry,2008,56(11):4164- 4171.
[5] KARNIK D,JUNG J,HAWKING S,et al.Sugar beet pectin fractionated using isopropanol differs in galacturonic acid,protein,ferulic acid and surface hydrophobicity [J].Food Hydrocolloids,2016,31(60):179- 185.
[6] 吴国利.甜菜粕果胶树脂脱色工艺及不同分子质量脱色果胶的特性研究 [D].广州:华南理工大学,2013.
[7] SCHIEBER A,HILT P,STREKER P,et al.A new process for the combined recovery of pectin and phenolic compounds from apple pomace [J].Innovative Food Science and Emerging Technologies,2003,4(1):99- 105.
[8] STOLL T,SCHWEIGGERT U,SCHIEBER A,et al.Process for the recovery of a carotene-rich functional food ingre-dient from carrot pomace by enzymatic lique faction [J].Innovative Food Science and Emerging Technologies,2003,4(4):415- 423.
[9] 杨桂馥.软饮料工业手册 [M].北京:中国轻工业出版社,2001:904- 906.
[10] BLUMENKRANTZ N,ASBOEHANSEN G.New method for quantitative determination of uronic acids [J].Analytical Biochemistry,1973,54(2):484- 490.
[11] GARNA H,MABON N,WATHELET B,et al.New method for a two-step hydrolysis and chromatographic analysis of pectin neutral sugar chains [J].Journal of Agricultural and Food Chemistry,2004,52(15):4652- 4659.
[12] BUCHHOLT H C,CHRISTENSEN T,FALLESEN B,et al.Preparation and properties of enzymatically and chemically modified sugar beet pectins [J].Carbohydrate Polymers,2004,58(2):149- 161.
[13] YAPO B M,ROBERT C,ETIENNE I,et al.Effect of extraction conditions on the yield,purity and surface properties of sugar beet pulp pectin extracts [J].Food Chemistry,2007,100(4):1356- 1364.
[14] DALEV P G,SIMEONOVA L S.Emulsifying properties of protein-pectin complexes and their use in oil containing food stuffs [J].Journal of Science and Food Agriculture,1995,68(2):203- 206.
[15] 阮卫红,邓放明,毕金峰,等.桃汁热处理过程中非酶褐变动力学研究 [J].食品科学,2014,35(1):50- 55.
RUAN Wei-hong,DENG Fang-ming,BI Jin-feng,et al.Kinetic study of non-enzymatic browning of peach juice during thermal treatments [J].Food Sciences,2014,35(1):50- 55.
[16] 傅伟昌,杨远,陈莉华.湘西椪柑皮中果胶的提取及脱色 [J].湖南农业科学,2010,5(1):93- 95.
FU Wei-chang,YANG Yuan,CHEN Li-hua.Extraction and decolorization of pectin from Xiangxi Ponkan peel [J].Hunan Agricultural Sciences,2010,5(1):93- 95.
[17] TORRE P,ALIAKBARIAN B,RIVAS B,et al.Release of ferulic acid from corn cobs by alkaline hydrolysis [J].Biochemical Engineering Journal,2008,40(3):500- 506.
[18] YU L,ZHANG X,LI S,et al.Rhamnogalacturonan I domains from ginseng pectin [J].Carbohydrate Polymers,2010,79(4):811- 817.
[19] DIAZ J V,ANTHON G E,BARRETT D M.Nonenzymatic degradation of citrus pectin and pectate during prolonged heating:effects of pH,temperature,and degree of methyl esterification [J].Journal of Agricultural and Food Chemistry,2007,55(13):5131- 5136.
[20] JUNG J,WICKER L.Laccase mediated conjugation of sugar beet pectin and the effect on emulsion stability [J].Food Hydrocolloids,2012,28(1):168- 173.
[21] JUNG J,WICKER L.Laccase mediated conjugation of heat treatedβ-lactoglobulin and sugar beet pectin [J].Carbohydrate Polymers,2012,89(4):1244- 1249.

