盐酸苯胺诱导小鼠皮肤快速衰老模型的建立
刘军,邱美玉,于楠楠,崔玉东,韩英浩
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
盐酸苯胺诱导小鼠皮肤快速衰老模型的建立
刘军,邱美玉,于楠楠,崔玉东,韩英浩
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
为研究皮肤衰老机制和抗皮肤衰老药物的筛选奠定基础。采用腹腔注射盐酸苯胺160 mg·kg-1,每3天一次,注射5次的方法建立皮肤衰老小鼠模型。结果显示:注射盐酸苯胺后,Prdx2基因敲除小鼠与野生型小鼠外周血含海因茨小体红细胞数量均上升(P<0.001);小鼠血液活性氧水平升高(P<0.01);皮肤组织中Cyclin D1,Cyclin E,p21,p16的表达量和p38,ERK的磷酸化程度均升高(P<0.01);小鼠真皮层厚度减少。表明酸苯胺可诱导小鼠皮肤提前衰老,且Prdx2可延缓这一作用。
皮肤衰老;盐酸苯胺;Prdx2;动物模型;小鼠
2010年进行的第六次人口普查数据显示,中国人口老龄化加速,65岁及以上人口的比例上升1.91个百分点,国家将面临未富先老的困境。因此,有关老龄化和衰老的研究已经是刻不容缓。随着社会发展和生活模式与健康模式的转变,世界范围的衰老研究也是在如火如荼的展开。皮肤作为人体的重要器官,结构复杂,功能多样,不仅是体内脆弱组织与外界环境之间的坚实壁垒,同时还发挥着维持体温、保存水分、感觉和免疫监视等作用[1]。衰老的皮肤将经历结构和功能上的退化,这不仅会使皮肤的美观程度大打折扣,而且会使皮肤容易处于一些难以治愈甚至是致命的疾病当中,例如湿疹、基底细胞癌,甚至恶性黑色素瘤等。皮肤提前衰老会严重地影响人们的生活质量,因此切实有效地研究其致病机理受到了高度关注。经过长时间的观察研究发现Prdx2基因敲除小鼠出现了明显的皮肤衰老症状,表现为全层皮肤厚度减少、表皮角质层增厚、真皮层明显变薄,这些现象显示出了Prdx2在皮肤衰老过程中具有重要的作用[2-5]。虽然Prdx2基因敲除小鼠是很好的皮肤衰老小鼠模型,但其表现型建立最少需要约7个月时间。盐酸苯胺可以将血红素铁从亚铁状态氧化为三价铁状态,从而使红细胞产生大量高铁血红蛋白。盐酸苯胺对红细胞的作用是可逆的,并且盐酸苯胺本身并不会增加红细胞崩解的比例,但是它可以造成红细胞的氧化损伤并且还伴随着海因茨小体的产生,从而造成体内活性氧水平的升高,这一现象与Prdx2敲除鼠的表现是一致的[4,6-7]。利用盐酸苯胺制作皮肤衰老模型不仅使小鼠体内产生活性氧的方式与Prdx2敲除小鼠相同,而且可以大大缩短皮肤衰老模型出现的时间。因此利用野生型小鼠快速诱导皮肤衰老或建立方法加强Prdx2敲除小鼠表型可为研究皮肤衰老机制和筛选延缓皮肤衰老药物奠定实验基础。
1 材料和方法
1.1 材料及试剂
注射用盐酸苯胺(Sigma公司);煌焦油蓝染液(Solarbio公司);抗 p-JNK、JNK、p-ERK、ERK、pp38、p38、p21、p16、Cyclin D1、Cyclin E、α-tubulin抗体(Santa Cruz公司);抗Prdx2抗体(Abfrontier公司);NC膜(PALL公司);ECL(Thermo公司);培养皿(NEST公司);蛋白免疫印迹系统(Amersham Bioscience公司);伊红Y、苏木精(阿拉丁公司);载玻片、盖玻片(世泰公司)。
1.2 动物饲养
清洁级129/SVJ雄性小鼠,野生型与敲除型各24只,体重18~20 g,其中各12只为对照组,余各12只为注射组。小鼠引进自韩国生命工学研究院(KRIBB),饲养在恒温(23±2)℃,湿度50%~60%,自然光照的独立饲养室内,标准饲料和过滤饮用水自行取用。
1.3 模型的建立
盐酸苯胺以4 mg·mL-1浓度溶于DDW后用0.22 μm滤膜过滤,以160 mg·kg-1剂量腹腔注射,每3天一次,连续注射5次。
1.4 血液涂片海因茨小体观察
取20 μL小鼠外周血加180 μL煌焦油蓝染液,染色2 min后涂片,光学显微镜1 000 x下观察计数。
1.5 红细胞活性氧水平检测
取20 μL小鼠外周血红细胞稀释于500 μL PBS缓冲液,加入10 μM DCF-DA 37℃孵育15 min,离心弃上清,用PBS洗涤3遍,通过流式细胞仪进行检测。
1.6 Western blot检测老化相关蛋白
将1 cm2小鼠背部皮肤脱毛剪碎加入蛋白质裂解液裂解,充分混匀,4℃裂解4 h,在12 000 rpm·min-1、4℃条件下离心20 min,回收上清(即蛋白质)。10 μg总蛋白在12%十二烷基硫酸钠-聚丙烯酰胺(SDSPAGE)凝胶上进行凝胶电泳,并转移到硝酸纤维素膜(美国Millipore公司),封闭,用抗p-JNK、JNK、p-ERK、ERK、p-p38、p38、p21、P16、Cyclin D1、Cyclin、Prdx2、α-tubulin一抗(1∶2 000),在4℃下孵育过夜。弃去一抗,用TBST(含15 mmol·L-1NaCl、0.2% Tween-20和10 mmol·L-1Tris-HCl)洗涤5次,每次5 min,与HRP标记的鼠或兔二抗(1∶5 000)孵育2 h,洗膜、ECL显色、成像及结果分析。用Tina2.0进行定量分析。
1.7 皮肤H/E染色
将1 cm2小鼠背部皮肤脱毛固定于NC膜上,10%福尔马林溶液固定24 h,水洗1.5 h,70%酒精40 min,80%酒精50 min,90%酒精1 h,95%酒精1 h,100%酒精 1 h,100%酒精 1 h,100%二甲苯30 min,100%二甲苯30 min,100%二甲苯1 h,高熔点石蜡30 min,高熔点石蜡30 min,高熔点石蜡30 min,0.5 μm切片,室温晾片12 h后进行染色;染色为二甲苯 10 min,二甲苯 10 min,100% 酒精1.5 min,90%酒精1 min,80%酒精1 min,50%酒精1 min,DDW 2 min,hematoxylene 5 min,DDW 1 min,DDW 2 min,1%acid alcohol 2 s,DDW 1 min,DDW 2 min,0.8%Ammonia,DDW 3 min,DDW 2 min,Eosin 1 min,95%酒精 1 min,95%酒精1 min,100% Alcohol 1 min,封片,晾干后观察。
1.8 统计学处理
采用SigmaPlot绘图,多组均数比较采用t检验进行分析,P<0.01为差异显著,P<0.001为差异极显著。
2 结果与分析
2.1 注射盐酸苯胺后小鼠外周红血细胞含海因茨小体比例
Prdx2可以作为分子伴侣保护红细胞中的血红蛋白使其在高活性氧的状态下保持稳定[4,6-7],而Prdx2缺失的血红蛋白易变性导致海因茨小体产生,从而造成血液活性氧水平升高,这也是造成Prdx2小鼠皮肤提前衰老的原因之一[2-3]。因此,观察了野生型与Prdx2缺失小鼠分别在对照组与注射组的外周血含海因茨小体的红细胞数量。结果显示,野生型对照组(WT)小鼠红细胞状态正常几乎没有海因茨小体产生;野生型注射组(WT+AH)有海因茨小体产生且产生海因茨小体红细胞的比例为37%与Prdx2基因敲除型对照组(Homo)小鼠的比例相近;Prdx2敲除小鼠注射盐酸苯胺后含有海因茨小体的红细胞数量明显增多为60%,见图1。
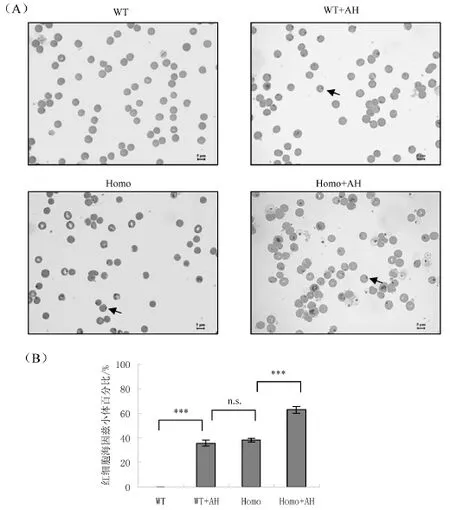
图1 野生型与Prdx2基因敲除型小鼠的对照组与注射盐酸苯胺组红细胞海因茨小体水平Fig.1 The increment of RBCs with the Heinz bodies in WT and Prdx2 knockout mouse with control group and injection group
2.2 DCF-DA染色血液活性氧检测
含海因茨小体红细胞数量升高通常造成血液活性氧水平升高,因此我们检测了两种基因型对照组与注射组小鼠的红细胞活性氧水平,。结果显示,注射盐酸苯胺后野生型注射组(WT+AH)小鼠血液活性氧水平升高且与敲除对照组(Homo)活性氧水平相近,敲除注射组(Homo+AH)与敲除型对照组(Homo)相比也有升高,且在四组小鼠中活性氧水平最高,见图2。

图2 血液活性氧水平Fig.2 ROS levels of blood
2.3 皮肤中衰老相关蛋白和活性氧相关蛋白表达检测
为进一步检测盐酸苯胺诱导皮肤衰老的作用及机制,对两种基因型的对照组及注射组小鼠的皮肤进行取样,并对CyclinD1,Cyclin E,p21,p16,p-p38,p38,p-JNK,JNK,p-ERK,ERK,Prdx2,α-tubulin进行Western blot检测。结果显示,注射盐酸苯胺后与细胞周期阻滞和细胞衰老密切相关的Cyclin D1,Cyclin E,p21,p16的表达量均上升,其中p16可作为皮肤衰老的生物标志物(Bio-marker)[8],且野生型注射组(WT+AH)与敲除型对照组(Homo)的Cyclin D1,Cyclin E,p21,p16表达量相近,在敲除型注射组(Homo+AH)的表达量最高;与活性氧密切相关的MAPKs信号也在注射盐酸苯胺后被激活,其中ERK的磷酸化水平在注射盐酸苯胺后显著升高,p38磷酸化程度也有所增加,JNK在野生型中增加不显著但在敲除型中有增加趋势,见图3。
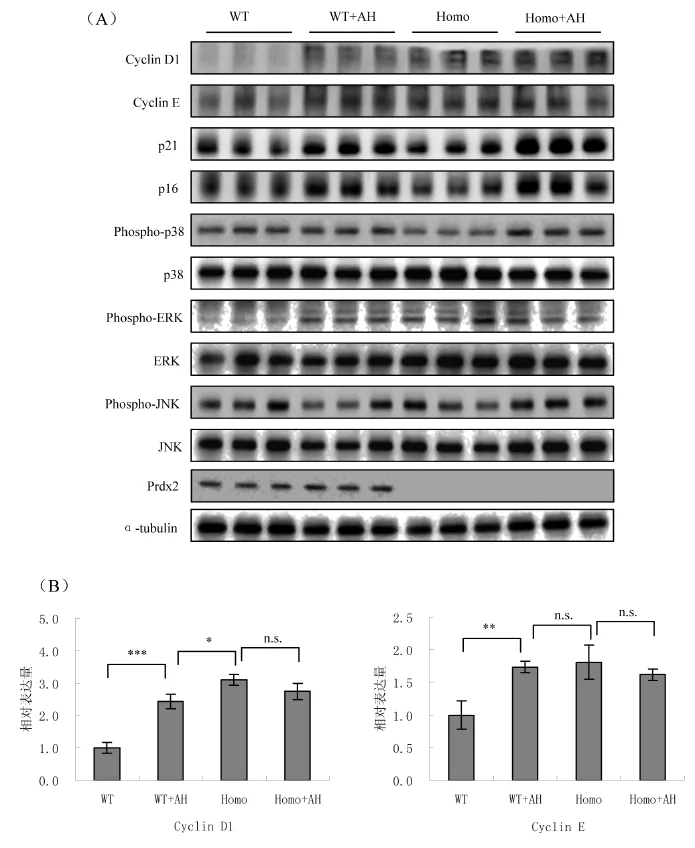

图3 皮肤中衰老相关蛋白和活性氧相关蛋白表达检测Fig.3 Determination of the proteins expressing relative with skin aging and ROS levels
2.4 皮肤组织H/E染色
衰老的皮肤会经历结构和功能上退化[9-11],例如Prdx2基因敲除小鼠出现了明显的皮肤衰老症状,表现为全层皮肤厚度减少、表皮角质层增厚、真皮层明显变薄。因此将两种基因型的对照组与注射组的小鼠皮肤样品进行HE染色,结果显示,注射盐酸苯胺后小鼠皮肤真皮层变薄,野生型注射组(WT+AH)与敲除型对照组(Homo)真皮厚度相近,敲除型注射组(Homo+AH)真皮层厚度减少最为明显,见图4。
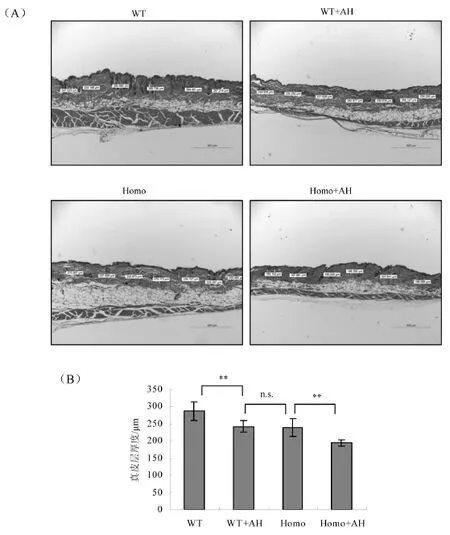
图4 皮肤组织H/E染色Fig.4 H/E staining of skin
3 讨论
引起皮肤衰老的因素可以分为内源性和外源性两大方面,究其原因主要源自活性氧造成的损伤。人体消耗的氧气中2%会变成活性氧(reactive oxygen species,ROS),活性氧是指由分子氧直接或间接转化而来、具有比分子氧更活泼的化学反应性的一类含氧物,是一组具有一个或多个未配对电子的原子或分子,包括超氧阴离子(superoxide anion,O2·-)、单线态氧(singlet oxygen)、过氧化氢(hydrogen peroxide,H2O2)、羟自由基(hydroxyl radical,HO·)等,它们的化学性质活跃,过高的活性氧水平会对细胞和基因结构造成损害[12-14]。机体中活性氧的增多会引起脂类过氧化作用,严重地损害了生物膜的功能,使脂质发生过氧化,损伤线粒体等细胞器膜的流动性、通透性和完整性,在细胞核中引起DNA断裂突变,影响其修复和复制过程,生成异常蛋白质,引起原有蛋白多肽和酶功能的丧失,最终导致衰老的发生[15],因此研究氧化应激与过氧化物酶的关系对了解皮肤衰老的机制和探索延缓皮肤衰老的方法具有重要作用。
近年来的研究发现了一种广泛存在于机体组织细胞中的过氧化物酶家族Peroxiredoxins(Prdxs)。哺乳动物的Prdxs家族包括6个成员,根据各成员间的同源性和cys残基的数目,Prdxs家族蛋白可分为3个亚类,即典型2-cys Prdx(Prdx1~4),非典型2-Cys Prdx(Prdx5)和1-cys Prdx(Prdx6)。Prdx2为2-cys Prdx含有两个高度保守的具有氧化还原活性的半胱氨酸残基,即具有过氧化活性的半胱氨酸残基(cys51)和还原活性的半胱氨酸残基(cys172),在发挥抗氧化作用时形成同型二聚体,利用硫氧还蛋白(thioredoxin)作为中间电子供体对过氧化物进行还原,具有及时清除体内较低浓度活性氧的作用。自Prdx2基因敲除鼠制作完成之后,Prdx2基因功能的研究得到了进一步的发展。Prdx2基因敲除鼠表现出外周血液网织红细胞增多、红细胞中出现海因茨小体以及脾肿大等溶血性贫血症状,表明Prdx2在血液系统中清除活性氧的重要生理意义[6]。
经过观察研究发现,Prdx2基因敲除小鼠的胚胎成纤维细胞(MEF)表现出严重的细胞衰老特征,而且Prdx2基因敲除小鼠出现了明显的皮肤衰老症状,表现为全层皮肤厚度减少、表皮角质层增厚、真皮层明显变薄,这些现象显示出了Prdx2在皮肤衰老过程中具有重要的作用。为了进一步研究Prdx2与皮肤衰老和活性氧之间的关系,利用野生型与Prdx2基因敲除型小鼠分别注射盐酸苯胺(aniline hydrochloride,AH)并与未注射小鼠进行对比,比较其皮肤衰老程度。盐酸苯胺可以将血红素铁从亚铁状态氧化为三价铁状态,从而使红细胞产生大量高铁血红蛋白。盐酸苯胺对红细胞的作用是可逆的,并且盐酸苯胺本身并不会增加红细胞崩解的比例,但是它可以造成红细胞的氧化损伤并且还伴随着海因茨小体的产生,从而造成体内活性氧水平的升高,这一现象与Prdx2敲除鼠的表型一致。利用盐酸苯胺制作皮肤衰老模型不仅使小鼠体内产生活性氧的方式与Prdx2敲除小鼠相类似,而且可以快速省时地制作这一模型。因此研究Prdx2抑制盐酸苯胺诱导的小鼠皮肤提前衰老的机制对Prdx2基因功能的研究和活性氧与皮肤衰老的研究都具有重要意义。
[1] Farage M A,Miller K W,Elsner P,et al.Characteristics of the Aging Skin[J].Adv Wound Care(New Rochelle),2013(1):5-10.
[2] Han Y H,Kim H S,Kim J M,et al.Inhibitory role of peroxiredoxin II(Prx II)on cellular senescence[J].FEBS Lett,2005,579(21):4897-4902.
[3] Han Y H,Kwon J H,Yu D Y,et al.Inhibitory effect of peroxiredoxin II(Prx II)on Ras-ERK-NFkappaB pathway in mouse embryonic fibroblast(MEF)senescence[J].Free Radic Res,2006,40(11):1182-1189.
[4] Matte A,Pantaleo A,Ferru E,et al.The novel role of peroxiredoxin-2 in red cell membrane protein homeostasis and senescence[J].Free Radic Biol Med,2014,76:80-88.
[5] Wang T,Diaz A J,Yen Y.The role of peroxiredoxin II in chemoresistance of breast cancer cells[J].Breast Cancer(Dove Med Press),2014(6):73-80.
[6] Han Y H,Kim S U,Kwon T H,et al.Peroxiredoxin II is essential for preventing hemolytic anemia from oxidative stress through maintaining hemoglobin stability[J]. Biochem Biophys Res Commun,2011,426(3):427-432.
[7] Lee T H,Kim S U,Yu S L,et al.Peroxiredoxin II is essential for sustaining life span of erythrocytes in mice[J]. Blood,2003,101(12):5033-5038.
[8] Waaijer M E,Parish W E,Strongitharm B H,et al.The number of p16INK4a positive cells in human skin reflects biological age[J].Aging Cell,11(4):722-725.
[9] Nikolakis G,Makrantonaki E,Zouboulis C C.Skin mirrors human aging[J].Horm Mol Biol Clin Investig,2001,16(1):13-28.
[10] Waller J M,Maibach H I.Age and skin structure and function,a quantitative approach (II):protein,glycosaminoglycan,water,and lipid content and structure[J]. Skin Res Technol,2006,12(3):145-154.
[11] Waller J M,Maibach H I.Age and skin structure and function,a quantitative approach(I):blood flow,pH,thickness,and ultrasound echogenicity[J].Skin Res Technol,2005,11(4):221-235.
[12] Lee S H,Gupta M K,Bang J B,et al.Current progress in Reactive Oxygen Species(ROS)-Responsive materials for biomedical applications[J].Adv Healthc Mater,2013(6):908-915.
[13] Zielonka J,Kalyanaraman B."ROS-generating mitochondrial DNA mutations can regulate tumor cell metastasis" a critical commentary[J].Free Radic Biol Med,2008,45(9):1217-1219.
[14] 王昊乾,孔令祖,申贵男,等.新型萘醌类衍生物对细胞衰老的抑制作用[J].黑龙江八一农垦大学学报,2015,27(4):72-76.
[15] Sesti F,Liu S,Cai S Q.Oxidation of potassium channels by ROS:a general mechanism of aging and neurodegeneration[J].Trends Cell Biol,2010,20(1):45-51.
Establishment of Rapid Skin Aging Mouse Model by Aniline Hydrochloride Injection
Liu Jun,Qiu Meiyu,Yu Nannan,Cui Yudong,Han Yinghao
(College of Life Sciences and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
In order to set up the experimental foundation for the study of skin aging mechanism and the screening drugs preventing skin aging.Intraperitoneal injections of aniline hydrochloride,160mg·kg-1every three days was used to set up skin premature aging model;Heinz body levels and Heinz body contents were increased after injection(P<0.001);the expression of Cyclin D1,Cyclin E,p21,p16 and the phosphorylation levels of p38,ERK were higher after injection aniline hydrochloride in the skin(P<0.01);the dermal thickness was decreased after injection.These results showed that Aniline Hydrochloride could induce premature skin aging and Prdx2 could play a protective role.
skin aging;aniline hydrochloride;Prdx2;animal models;mouse
Q78
A
1002-2090(2017)02-0079-07
10.3969/j.issn.1002-2090.2017.02.016
2016-03-20
2015研究生创新创业项目(YJSCX2015-Y58)。
刘军(1991-),男,黑龙江八一农垦大学生命科学技术学院2013级硕士研究生。
韩英浩,男,副教授,E-mail:yinghaohan@byau.edu.cn;崔玉东,男,教授,博士研究生导师,E-mail:cuiyudong@yahoo.com。

