川芎内生放线菌活性菌的筛选及鉴定
林婵春++何冬梅++李佳穗++柳敏++严铸云

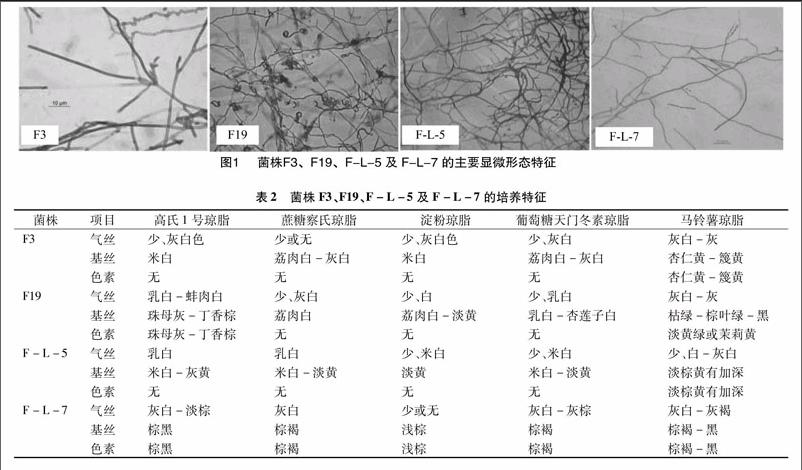
摘要:为了了解川芎内生放线菌抑制常见致病菌的能力,从中筛选活性较强的放线菌资源,采用纸片扩散法测定发酵提取液对5种指示菌的抑菌活性,结合经典分类法和分子生物学法鉴定活性菌种。结果表明,对金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、黑曲霉(Aspergillus niger)和白色念球菌(Canidia albicans)表现抑制活性的菌株占川芎内生放线菌的百分比分别为83.33%、76.67%、23.33%、3000%、13.33%;从中选出4株活性较强的放线菌,Blast比对结果表明,菌株F3、F19、F-L-5、F-L-7的16S rDNA序列与GenBank已知序列链霉菌属金色类群[Streptomyces sp.(KF126314.1)]、暗灰鏈霉菌[Streptomyces canus(AB7184118.1)]、肿痂链霉菌[Streptomyces turgidiscabies(FJ883749.1)]、暗色产色链霉菌[Streptomyces phaeochromogenes(KP718589.1)]高度相似,同源性分别为99%、100%、99%、99%。综合鉴定,F3为链霉菌属金色类群,F19为暗灰链霉菌,F-L-5为肿痂链霉菌,F-L-7为暗色产色链霉菌。表明川芎内生放线菌中具有应用潜力的高活性菌株,并鉴定出4株活性菌。
关键词:川芎;内生放线菌;抑菌活性;菌种鉴定;链霉菌
中图分类号: S182文献标志码: A
文章编号:1002-1302(2017)03-0076-04
收稿日期:2016-07-17[HJ1.4mm]
基金项目:国家自然科学基金(编号:81001610);高等学校博士学科点专项科研基金(编号:20135132110004);成都中医药大学科技发展基金(编号:ZRQN1546)。
作者简介:林婵春(1989—),女,硕士研究生,主要从事药用植物微生态研究。E-mail:1297107706@qq.com。
通信作者:严铸云,教授,博士生导师,主要从事道地药材品质形成与调控研究。Tel:(028)61800231;E-mail:cdutcmyan@126.com。[HJ]
放线菌是寻找和发现天然活性物质的生物资源之一,也是人们不懈研究的热点[1]。目前,发现新放线菌及新活性物质变得越来越困难,人们开始从特殊生境中寻找有用的放线菌[2]。植物内生放线菌生长环境独特,常产生多种类型的代谢产物[3]。笔者所在课题组前期筛选出了对川芎根腐病病原菌有拮抗活性的川芎内生放线菌[4]。本研究选取代表性细菌及真菌作为指示菌,筛选具有抑菌作用的放线菌资源,为开发利用植物内生放线菌提供技术支撑。
1材料与方法
1.1材料
1.1.1菌种川芎内生放线菌由课题组从健康川芎根茎中进一步分离并保存。
1.1.2指示菌[5-6]革兰氏阴性菌:大肠杆菌(Escherichia coli);革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus subtilis);酵母状真菌:白色念球菌(Canidia albicans);丝状真菌:黑曲霉(Aspergillus niger)。以上菌株均由成都中医药大学医学技术学院赠予。
1.1.3培养基发酵培养基采用高氏1号液体培养基。形态特征、培养特征及生理生化测定所用培养基的成分和制备方法均参考《链霉菌鉴定手册》[6]和《放线菌系统学》[7]。活化培养细菌、黑曲霉及白色念球菌的培养基分别采用肉汤培养基、马铃薯葡萄糖培养基、沙氏培养基,成分和制备方法参照文献[8-9]。
1.2方法
1.2.1[JP2]发酵粗提液的制备将供试菌株在高氏1号培养基上活化培养5 d,接种1枚直径5 mm的菌饼于250 mL发酵瓶中,每瓶发酵液50 mL。28 ℃、2 000 r/min摇瓶培养,6 d后取出发酵液4 000 r/min离心15 min,取上清液,等体积乙酸乙酯萃取2次,35 ℃旋转蒸发获得浆状物2~3 mL,35 ℃下挥发干,最后用无水乙醇定容至1 mL,过0.22 μm滤膜,保存备用[10]。[JP]
1.2.2抑菌活性测定采用纸片法[10]测定内生放线菌发酵液的抑菌活性,即将60 μL发酵粗提液分次加到9 mm无菌滤纸片上,待乙醇挥发干后接于含指示菌的平板上。细菌用5 mg/mL 的双抗溶液10 μL为对照(CK1),真菌用5 mg/mL氟康唑溶液20 μL为对照(CK2),设3组重复,24~48 h后测量抑菌圈的直径,以平均抑菌圈直径大小作为抑菌活性强弱的判断标准。
1.2.3形态及生理生化特征菌株的形态特征采用插片法在光学显微镜下观察。培养特征及生理生化特性采用常规放线菌鉴定方法,并参照文献[11]及《链霉菌鉴定手册》[6]中推荐的培养基。
1.2.4分子水平鉴定采用高氏1号液体富集培养方式,获取菌丝,用液氮充分研磨破壁后,结合试剂盒TIANamp Bacteria DNA Kit(TIANGEN)提取基因组DNA[12]。用1.5%琼脂糖凝胶电泳检验DNA提取效果。采用放线菌通用引物27F和1 492R对放线菌的16S rDNA 进行PCR扩增。反应体系为25 μL:DNA模板2 μL,10 pmol/μL上、下游引物各1 μL,2×Taq Master Mix[天根生化科技(北京)有限公司]12 μL,ddH2O[天根生化科技(北京)有限公司]10 μL,参照文献[12]中的程序扩增。PCR产物用1.2%琼脂糖凝胶电泳检测,再送成都擎科梓熙生物技术有限公司测序。将测定的序列进行Blast比对,并从GenBank数据库中下载同源性极高的序列,采用MEGA5.1软件构建系统进化树。
2结果与分析
2.1川芎内生放线菌的活性菌株
通过纸片法考察了30株川芎内生放线菌的抑菌活性(表1)。结果表明,不同内生放线菌对5种致病菌分别表现出不同的抑制活性。有83.33%的内生放线菌对金黄色葡萄球菌表现抑制活性,有76.67%的内生放线菌对枯草芽孢杆菌表现抑制活性,而对大肠杆菌、黑曲霉和白色念球菌表现抑制活性的内生放线菌比例较低,分别为23.33%、30.00%、1667%。其中有3株放线菌对5种指示菌有抑制作用,有1株放线菌对4种指示菌有抑制作用。
对照组(CK1)对3种细菌的平均抑菌直径均在13~14 mm 范围内,抑菌圈内清晰。F3、F19、F-L-5和F-L-7对金黄色葡萄球菌及枯草芽孢杆菌的抑制作用明显,前3株菌的平均抑菌直径大于13 mm,活性與CK1相仿。这4株菌均对大肠杆菌表现出抑制活性。对照组(CK2)对黑曲霉和白色念球菌的抑菌作用不明显,平均抑菌直径小于10.9 mm,且抑菌圈边缘模糊。F19和F-L-7对黑曲霉表现出抑制活性,平均抑菌直径为11.0~11.9 mm。F19和F-L-5对白色念球菌的平均抑菌直径在12 mm以上,抑菌圈较CK2清晰。F3和F-L-7对白色念球菌及F3和F-L-5对黑曲霉无抑菌作用。拟将此4株菌作为具有应用潜力的高活性菌株,并进行菌种鉴定。
2.2川芎内生放线菌活性菌株的形态特征
将4株具有抑菌活性的菌株进行插片培养后,镜检菌丝、孢子链、孢子形态(图1)。F3孢子丝直、断裂、孢子单个或成对;F19孢子丝多圈松螺旋形,孢子卵圆形或球形;F-L-5 孢子链呈直或柔曲状,孢子椭圆或球形;F-L-7孢子丝直或柔曲,孢子球形或长椭圆。在不同培养基上各菌株表现出不同的形态特征,详细结果见表2。
2.3川芎内生放线菌活性菌株的生理生化特征
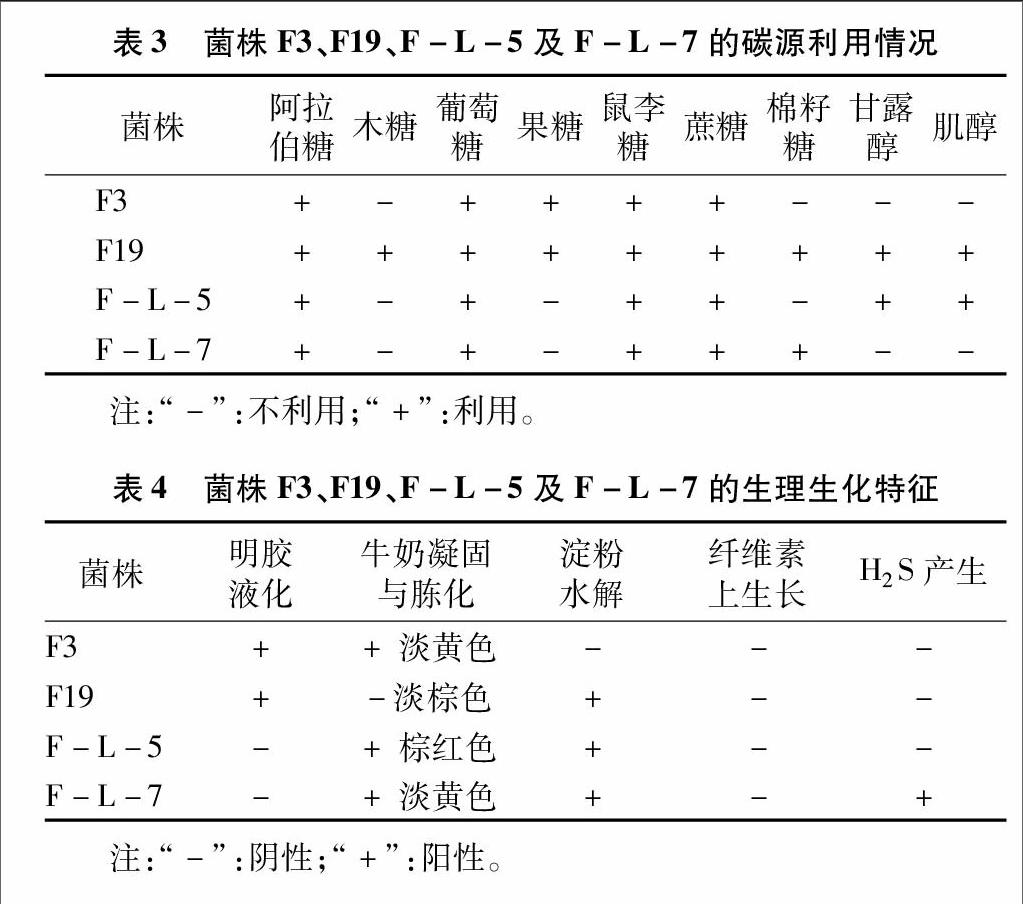
测试4株活性菌对9种碳源——阿拉伯糖(L-arabinose)、棉籽糖(raffinose)、甘露醇(D-mannit01)、木糖(D-xylose)、果糖(D-fructose)、鼠李糖(rhanmose)、葡萄糖(D-glucose)、[JP2]蔗糖(sucrose)、肌醇(meso-inositol)的利用情况,结果见表3。考察了4株活性菌的明胶液化、牛奶凝固与胨化、淀粉水解、纤维素上生长及H2S生成等一系列生理生化指标(表4)。可以看出F3能使牛奶胨化,呈淡黄色,能液化明胶,不能水解淀粉与纤维素,不产生H2S。
F19不能使牛奶凝固、胨化,能液化明胶,能水解淀粉,不能水解纤维素,不产生H2S。F-L-5 产酸使牛奶凝固、变红、后胨化,能水解淀粉,不能水解纤维素,不产H2S。F-L-7能使牛奶凝固,变淡黄色,能水解淀粉,不能在纤维素上生长,能产H2S,使培养基呈类黑色。
2.416S rDNA序列测定及系统进化树分析
采用试剂盒法提取活性放线菌 F3、F19、F-L-5及F-L-7 的基因组DNA,利用16S rDNA 通用引物27F和1492R进行PCR扩增,获得长度为1 300~1 500 bp的清晰[JP3]条带(图2)。经测序获得长度分别为1 373、1 364、1 308、1 379 bp[JP]的序列,GenBank登录号分别为KU975441、KU975442、KU975443、KU975444。将所测序列与GenBank中已知序列进行Blast比对,F3与链霉菌属金色类群[Streptomyces sp. (KP126314.1)]及[Streptomycesroseogriseus(2DQ02665.1)]相似度为99%,F19与暗灰链霉菌[Streptomyces canus(AB7184118.1)]相似度为100%,F-L-5与肿痂链霉菌[Streptomyces turgidiscabies(FJ883749.1)]相似度为99%,F-L-7与暗色产色链霉菌[Streptomyces phaeochromogenes(KP718589.1)]相似度为99%。用MEGA5.1软件中的邻接法(Neighbor-Joining,NJ)构建系统发育树(图3)。由图3可知,F3在系统进化树上与链霉菌属相近,这与形态特征相符,但与高相似度的种存在一定的差异,而且单独聚为1 支,故暂定为链霉菌属金色类群,其具体分类地位有待进一步确定。F19与暗灰链霉菌在自举值99%水平聚为1支;F-L-5与肿痂链霉菌在自举值98%水平聚为1支,F-L-7与暗色产色链霉菌在自举值98%水平聚为1支。结合菌株的形态及生理生化特征,确定F19为暗灰链霉菌,F-L-5为肿痂链霉菌,F-L-7 为暗色产色链霉菌。
3结论与讨论
[JP2]川芎内生放线菌的抑菌活性考察结果表明,主要抑制对象为革兰氏阳性菌,而抑制革兰氏阴性菌及真菌的作用较弱。从中选出了4株具有应用潜力的高活性菌株,菌种鉴定结果:链霉菌F3初步[JP]鉴定为链霉菌属的金色类群;确定F19为暗灰[JP]链霉菌,F-L-5为肿痂链霉菌,F-L-7为暗色产色链霉菌。
暗色产色链霉菌和暗灰链霉菌均能产生多种抗生素及酶[13-16],使暗色产色链霉菌和暗灰链霉菌具有重要的研发价值。肿痂链霉菌被报道为马铃薯疮痂病的致病菌之一[17],而滕青杉报道其能产生肉桂酰胺[18]。川芎内生菌肿痂链霉菌具有抑菌活性,其是否对川芎致病及能否产生肉桂酰胺类物质有待后续研究。
目前,尚未见有关川芎内生放线菌的研究,仅笔者所在课题组将分离自川芎的内生放线菌作为川芎根腐病生防菌的拟开发对象[4]。本试验首次开展川芎内生放线菌的抑菌活性研究,可以为开发新的抗生素提供放线菌资源。然而其最优发酵条件、抑菌机制及活性成分等均有待进一步研究,期望在抗菌化合物方面开发具有应用前景的产品。
[HS2]参考文献:
[1]刘志恒. 放线菌现代生物学与生物技术[M]. 北京:科学出版社,2004.
[2]何海钢. 两株特殊生境放线菌的次级代谢产物的研究[D]. 厦门:厦门大学,2011.
[3]冯天祥,王玲,陈海敏,等. 植物内生放线菌功能及生物活性物质研究进展[J]. 中国生物工程杂志,2015,35(4):98-106.
[4]何冬梅,林婵春,严铸云,等. 川芎内生放线菌的分离及根腐病抑菌活性菌株筛选[J]. 中草材药,2016,39(2):265-269.
[5]Gaskell E E,Sihanonth P,Rostron C,et al. Isolation and identification of mucinolytic actinomycetes[J]. Antonie Van Leeuwenhoek,2010,97(3):211-220.
[6]中国科学院微生物所放线菌分类组. 链霉菌鉴定手册[M]. 北京:科学出版社,1975:658-665.
[7]徐丽华. 放线菌系统学[M]. 北京:科學出版社,2007:41-45.
[8]杜连祥. 微生物学实验技术[M]. 北京:中国轻工业出版社,2005.
[9]钟志华. HIV感染患者口腔念珠菌的培养鉴定及耐药性研究[D]. 武汉:武汉大学,2004.
[10]郭泽经,冯治翔,吴华动,等. 1株罗汉杉内生放线菌的鉴定、活性分析及抗生素生物合成基因的筛查[J]. 微生物学杂志,2011,31(6):23-28.
[11]张丽. 印楝内生放线菌抑菌活性物质及作用机制初步研究[D]. 沈阳:沈阳农业大学,2014.[HJ1.8mm]
[12]孔亚男. 虎杖内生放线菌的抗菌活性研究及一株病原菌的分离鉴定[D]. 汉中:陕西理工学院,2013.
[13]杨煌建,张祝兰,黄小珍,等. 链霉菌FIM-0916产安福霉素的发酵条件优化[J]. 生物技术进展,2014,4(2):118-123.
[14]Bamzadeh Z,Baserisalehi M,Bahador N,et al. Characterization of a bioactive compounds produced by Streptomyces phaeochromogenes NRRL B-2123[J]. Nature Environment & Pollution Technology,2014,13(1):85-90.
[15]Mascotti M L,Palazzolo M A,Lewkowicz E,et al. Expanding the toolbox for enantioselective sulfide oxidations:Streptomyces strains as biocatalysts[J]. Biocatalysis & Agricultural Biotechnology,2013,2(4):399-402.
[16]Yang H J,Huang X Z,Zhang Z L,et al. Two novel amphomycin analogues from Streptomyces canus strain FIM-0916.[J]. Natural Product Research,2014,28(12):861-867.
[17]邢莹莹,吕典秋,魏琪,等. 黑龙江省部分地区马铃薯疮痂病菌种类及致病性鉴定[J]. 植物保护,2016,42(1):26-32.
[18]滕青杉. 放线菌次级代谢产物肉桂酰胺的生物合成及菌种鉴定[D]. 上海:华东理工大学,2011.

