高效液相色谱法测定酶法制备L-色氨酸
陈 军, 徐礼生, 张兴桃, 董 增
(宿州学院 生物与食品工程学院,安徽 宿州234000)
高效液相色谱法测定酶法制备L-色氨酸
陈 军, 徐礼生, 张兴桃, 董 增
(宿州学院 生物与食品工程学院,安徽 宿州234000)
研究了高效液相色谱法测定酶法制备L-色氨酸的最佳参数。结果表明,流动相分配比V(磷酸二氢钾溶液)∶V(甲醇)=30∶70,流量1 mL/min,C18柱分离,柱温38℃,检测波长265 nm时为高效液相色谱法检测L-色氨酸的最佳参数。回收率在92.00%~110.00%,外加丝氨酸没有干扰发酵液中L-色氨酸含量测定。此方法用于样品中的L-色氨酸的测定,分离效果良好。
高效液相色谱;L-色氨酸;酶法制备
L-色氨酸在人体是一种限制性氨基酸,也是一种必需氨基酸,在人体内无法合成,需要从食物中摄取。作为食品添加剂[1],早期L-色氨酸的生产多采用化学合成法、蛋白质水解法等,由于酶法制备色氨酸具有成本低、周期短、产率高、质量好等优点,因此该技术将会成为L-色氨酸的工业化生产的主要方法。目前,L-色氨酸测定方法有氨基酸分析仪 、分光光度法和荧光法等[2-9],鉴于高效液相色谱技术具有分辨率高、速度快、重复性高等优点,高效液相色谱法测定微生物发酵液中的L-色氨酸已有报道[10-11],但高效液相色谱法用于酶法制备L-色氨酸的测定尚未见报道。作者通过考察流动相及其分配比、波长、柱温等因素,确立了高效液相色谱法测定酶法制备L-色氨酸的最适色谱条件,并进行了方法评价。
1 材料与方法
1.1 材料与仪器
丝氨酸,甲醇,L-色氨酸,磷酸二氢钾,氢氧化钠,双蒸水:以上试剂均为分析纯。
岛津LC-20AT型高效液相色谱仪:日本岛津公司;KQ5200DB数控超声波清洗器;80-2型电动离心机:金城国盛实验仪器厂;PHS-3C型精密酸度计。
1.2 实验方法
1.2.1 色谱条件确定方法 利用岛津LC-20AT型高效液相色谱仪测定L-色氨酸的含量,采用0.025%磷酸溶液-甲醇体系作为流动相,分别研究流动相及分配比、流动相流速、检测波长及柱温对检测结果的影响。
1.2.2 标准曲线 称取L-色氨酸0.400 g定容1 L,配置成质量浓度为400 mg/L的L-色氨酸标准样品,将上述配置好的L-色氨酸标准样品用流动相稀释成一定的浓度梯度,将所有标准样品采用0.30 μm微孔滤膜过滤后采用UV-紫外分光光度法检测,绘制L-色氨酸标准样品。
1.2.3 发酵液样品的处理 取1.0 mL发酵液15 000 r/min离心5 min,然后用移液枪吸取其上清液,进行适当稀释,使其质量浓度介于0~400 mg/L的线性范围内,然后用0.30 μm微孔滤膜过滤,所得滤液采用UV-紫外分光光度法[12]测定其L-色氨酸含量。
2 结果与分析
2.1 流动相及分配比的确定
设置分配比为20∶80、25∶75、30∶70、35∶65、40∶60五个体系,由图1可知,随着增大流动相分配比,其波峰面积呈现先增大后降低趋势,分配比流动相为30∶70的条件下,波峰面积具有最大值,综上分析选用V(0.025%磷酸溶液)∶V(甲醇)=30∶70为该方法测定酶法制备L-色氨酸的最佳分配比流动相。
2.2 流动相流速的确定
分别选择流动相的总流速为0.8、0.9、1.0、1.1、1.2 mL/min,观察发酵液的波峰变化和高效液相色谱仪的压力变化。结果表明,流速越小其保留时间越大,波峰的分离效果较好;流速越大其保留时间越小,但发酵液中物质的分离效果变差。另外流速越大其泵压也增大,易损坏分离柱,该法测定酶法制备L-色氨酸研究的最适流速为1.0 mL/min。

图1 不同流动相分配比下L-色氨酸的检测波峰面积Fig.1 Peak area of L-tryptophan under different mobile phase
2.3 检测波长的确定
L-色氨酸含有一个苯环,紫外线区域内有吸收峰,测定中不需添加其它显色试剂。为了探讨最适检测波长,在工作站中设置5个检测器波长,分别为245、255、265、275、285 nm。由图2可知,随着波长提高,其波峰面积呈现先增大后降低趋势,波长设定为265 nm时,波峰具有最大值。确定检测波长在265 nm时为高效液相色谱法测定酶法制备L-色氨酸研究的最佳波长。
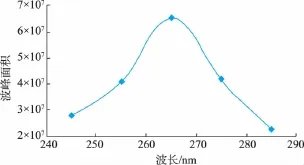
图2 不同紫外波长下L-色氨酸的检测波峰面积Fig.2 Peak area of L-tryptophan under different ultraviolet wavelengths
2.4 柱温的确定
柱温对高效液相色谱法测定酶法制备L-色氨酸有较大影响,选择一个合适的柱温对检测结果至关重要,柱温分别设置30、35、40、45、50℃。由图3知,随着柱温的提高,其波峰面积呈现先增大后减小的趋势,其中柱温在38℃时,L-色氨酸出现一个最大吸收峰面积,当柱温继续升高时,L-色氨酸的波峰面积逐渐降低。综上讨论,最终确定柱温38℃为高效液相色谱法测定酶法制备L-色氨酸研究的最优柱温。

图3 不同柱温条件下L-色氨酸的检测波峰面积Fig.3 Peak area of L-tryptophan at different column temperature
2.5 确定色谱条件及标准曲线的确定
以岛津 C18(5 μm,250 mm×4.6 mm)为分离柱,流动相分配比为V(0.025%磷酸溶液)∶V(甲醇)=30∶70,流速为1.0 mL/min,柱温为38℃,检测波长为265 nm,进样量为10 μL,图4所示为L-色氨酸标准品使用该法检测的色谱图,L-色氨酸的保留时间为3.520 min。
根据以上色谱条件,得L-色氨酸的标准曲线,见图5,可知线性范围在0~400 mg/L内,线性相关系数为R2=0.999 3,线性关系良好。
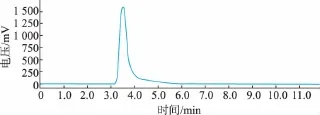
图4 L-色氨酸标准样品色谱图Fig.4 Chromatograms of L-tryptophan standard sample
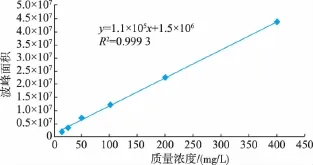
图5 L-色氨酸标准曲线Fig.5 Standard curves of L-tryptophan
2.6 加样回收率测定
为了进一步验证其准确性,进行了回收实验检测,取质量浓度为200 mg/L的L-色氨酸标准品100 mL,然后取100 mg的L-色氨酸样品加入到已知的200 mg/L L-色氨酸标准品中混合,将其混合液进行进样检测,在相同条件检测5次,结果见表1。结果表明,回收效果良好,回收率在92.00%~110.00%,平均值99%,由此可见,高效液相色谱法测定酶法制备L-色氨酸准确度较好。

表1 L-色氨酸加样回收率测定(n=5)Table 1 Recovery test of L-tryptophan(n=5)
2.7 干扰试验
本实验中的L-色氨酸发酵液是通过丝氨酸经过酶催化转换而成的,而检测结果证实了发酵液中含有剩余的丝氨酸,为了排除丝氨酸的影响,进行了标准品加入丝氨酸的干扰实验。取100 mg/L丝氨酸1 mL与100 mg/L L-色氨酸等体积混合,将其混合液用高效液相色谱法进行测定,结果见图6。色谱图中只有L-色氨酸波峰,且其保留时间为3.520 min,这与L-色氨酸标准品的保留时间基本相同,可见在265 nm检测波长下丝氨酸对L-色氨酸的检测没有影响,所以外加丝氨酸没有干扰发酵液L-色氨酸质量浓度的测定。

图6 混合液色氨酸与丝氨酸的色谱图Fig.6 Chromatograms of mixed liquor of L-tryptophan and serine
2.8 样品的测定
采用流动相分配比V(磷酸二氢钾溶液)∶V(甲醇)=30∶70,流量1 mL/min,柱温38℃,检测波长265 nm测定L-色氨酸合成酶发酵液,得出L-色氨酸色谱图。由图7可知,色谱柱柱效高,将波峰面积代入标准曲线中,得出发酵液中L-色氨酸质量浓度为80mg/L。

图7 样品中L-色氨酸检测色谱图Fig.7 Results of L-Tryptophan of the sample
3 结语
通过研究确立了高效液相色谱法测定酶法制备L-色氨酸的最适色谱条件,流动相分配比V(磷酸二氢钾溶液)∶V(甲醇)=30∶70,流量1 mL/min,C18柱分离,柱温38℃,检测波长265 nm。方法用于发酵液中的L-色氨酸的测定,保留时间为3.520 min,在0~400 mg/L范围内线性良好,回收率在92%~110%之间,外加丝氨酸没有干扰发酵液中L-色氨酸含量测定。该方法简便、准确、适用性强。
[1]LI Jianxin,ZHANG Xumei,XU Qishou.Physiological and biochemical effects of tryptophan and its application[J].Amino Acids&Biotic Resources,2005,27(3):58-62.(in Chinese)
[2]REN Jiaoyan,ZHAO Mouming,WANG Jinshui,et al.Novel method for spectrophotometric determination of tryptophan in phydrolysates[J].Food Science,2006,27(12):591-593.(in Chinese)
[3]WANG Jianqing,ZHANG Yu.Determination of the amino acid of fishmeal by amino acid analyzer[J].Animal Husbandry and Feed Science,2007(6):37-38.(in Chinese)
[4]HU Baoxiang,YANG Mu,LIU Wenhan,et al.Indirect determination of tryptophan by flame atomic absorption spectrometry[J]. Chinese Journal of Spectroscopy Laboratory,2006,23(6):1308-1310.(in Chinese)
[5]YANG Hongbing,LIANG Lanqiu,LU Liliang.Flow injection electrochemiluminescence method for determination of tryptophane[J].Journal of Shihezi University(Natural Science),2005,23(6):674-675.(in Chinese)
[6]LI Chunxiang,LIANG Yulin,DENG Keqin.Determination of L-tryptophan at electrochemicaly reduced grapheme oxide modifided electode[J].Journal of Analytical Science,2014,29(2):231-234.(in Chinese)
[7]ZHANG Shaohong,SHI Boan,XI Juan.Investigation on simultaneous determination of tryptophan and cysteine by chemiluminescence method[J].Chinese Journal of Analysis Laboratory,2007,7(26):5-8.(in Chinese)
[8]WANG Xiaoying,WEI Yongfeng,MA Dongmei,et al.Linear scanning voltammetry for the simultaneous determination of 5-hydroxytryptophan and tryptophan[J].Chemistry,2007(6):459-462.(in Chinese)
[9]CUI Zhumei,GU Xia,HUANG Youru,et al.The change of tryptophan content in pumpkin seeds during germination determined by fluorescence spectrophotometry[J].Seed,2009,11(28):62-64.(in Chinese)
[10]ZHANG Bo,LIU Yunjie,QUAN Xiangao.HPLC determination of tryptophan in fermental solution[J].Journal of Jining Medical College,2009,32(2):116.(in Chinese)
[11]CHENG Likun,XU Qingyang,XIE Xixian,et al.Quick determination of L-tryptophan in fermented broth by HPLC[J].Journal of Tianjin University of Science&Technology,2010,25(1):9-12.(in Chinese)
[12]XU Lan,AN Wei.Simultaneous determination of tryptophan and tyrosine by UV spectrophotometry[J].Chinese Journal of Spectroscopy Laboratory,2011,28(5):2321-2323.(in Chinese)
Study on High Performance Liquid Chromatography Method for Determination of Enzymatic Preparation of L-Tryptophan
CHEN Jun, XU Lisheng, ZHANG Xingtao, DONG Zeng
(College of Biology and Food Engineering,Suzhou University,Suzhou 234000,China)
High performance liquid chromatography method for determination of enzymatic Preparation of L-tryptophan(L-Trp)were studied.The results showed that the optimal parameter were 0.05 mmol/L potassium dihydrogan phosphate-methanol(30∶70)as the mobile phase,the detection wavelength by 265 nm,the flow rate of 1.3 mL/min,separated on a C18 column and 38℃column temperature.The recoveries ranged from 92.00%~110.00%,and the Serine added had no interference to determination of L-tryptophan.The L-Trp in fermentation liquid was separated effectively in these conditions.
high performance liquid,L-tryptophan,enzymatic preparation
S 816.17
A
1673—1689(2017)03—0327—04
2015-03-31
安徽省大学生创新创业训练计划项目(AH20141037906);宿州区域发展协同创新中心项目(2015SZXTZXKFZD01);宿州学院科研平台项目(2015ykf02);宿州学院教授(博士)科研启动基金项目(2014jb06)。
陈 军(1980—),男,安徽萧县人,农学硕士,讲师,主要从事微生物发酵方面的研究。E-mail:cj998001@163.com
陈军,徐礼生,张兴桃,等.高效液相色谱法测定酶法制备L-色氨酸的研究[J].食品与生物技术学报,2017,36(03):327-330.

