红细胞悬液制备洗涤红细胞的效果分析
鲍恩利
(沈阳中心血站,辽宁 沈阳 110000)
红细胞悬液制备洗涤红细胞的效果分析
鲍恩利
(沈阳中心血站,辽宁 沈阳 110000)
目的确保制备洗涤红细胞符合质量标准要求。方法采用泰尔茂无菌接口机连接洗涤袋的方式在无菌条件下将保存期内的红细胞悬液用大量生理盐水液洗涤,去除绝大部分非红细胞部分,并将红细胞悬浮在MAP液中所制备而成。结果经过洗涤的红细胞去除了80%以上的白细胞和98%的血浆蛋白,也去除了大量的红细胞碎屑、代谢产物、抗凝剂、乳酸盐、钾、氨和微聚物,同时也损失了大约20%以上的红细胞。结论使用无菌结合技术进行制备的洗涤红细胞,连接口完整且无渗漏,没有出现气泡等情况,且保存期的效果与采用密闭系统所制备的血液成分的保存期较为一致。
红细胞悬液;洗涤红细胞;无菌结合
洗涤红细胞为采用特殊的方法,对保存期内全血、悬浮红细胞进行清洗,将血浆成分及部分的非红细胞成分做清除,并将红细胞悬浮于氯化钠,制成红细胞成分血[1],其是将红细胞悬浮于氯化钠中。洗涤红细胞可以对需要输血且合并有过敏性疾病、自身免疫性溶血性贫血、肝肾功能障碍、高血钾等患者中,具有特定的用途[2]。目前临床进行洗涤红细胞制备的方法是在红细胞洗涤完成后,将氯化钠注射液进行添加使之悬浮,一般保存时间仅为24 h,且由于此方法的保存时间短,血站一般需要根据医院的预约情况才能进行制备,容易引起输血治疗时间被延误,因此受到了一定的限制。在无菌的闭合环境中制备洗涤红细胞,并以红细胞保存液混悬,其保存时间能够与常规红细胞悬浊液相同[3],这为红细胞保存液(MAP)混悬洗涤红细胞提供了积极有效的依据。本文针对MAP混悬洗涤红细胞进行了相关研究,报道如下。
1 材料与方法
表2 实验组洗涤红细胞与对照组红细胞pH、K+、游离血红蛋白的比较(n=32,
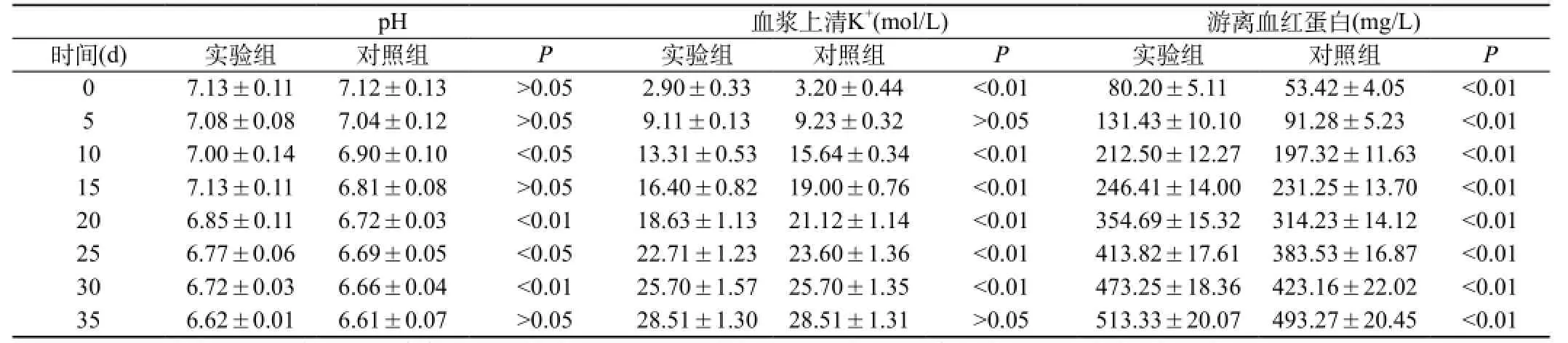
表2 实验组洗涤红细胞与对照组红细胞pH、K+、游离血红蛋白的比较(n=32,
pH 血浆上清K+(mol/L) 游离血红蛋白(mg/L)时间(d) 实验组 对照组 P 实验组 对照组 P 实验组 对照组 P0 7.13±0.11 7.12±0.13 >0.05 2.90±0.33 3.20±0.44 <0.01 80.20±5.11 53.42±4.05 <0.01 5 7.08±0.08 7.04±0.12 >0.05 9.11±0.13 9.23±0.32 >0.05 131.43±10.10 91.28±5.23 <0.01 10 7.00±0.14 6.90±0.10 <0.05 13.31±0.53 15.64±0.34 <0.01 212.50±12.27 197.32±11.63 <0.01 15 7.13±0.11 6.81±0.08 >0.05 16.40±0.82 19.00±0.76 <0.01 246.41±14.00 231.25±13.70 <0.01 20 6.85±0.11 6.72±0.03 <0.01 18.63±1.13 21.12±1.14 <0.01 354.69±15.32 314.23±14.12 <0.01 25 6.77±0.06 6.69±0.05 <0.05 22.71±1.23 23.60±1.36 <0.01 413.82±17.61 383.53±16.87 <0.01 30 6.72±0.03 6.66±0.04 <0.01 25.70±1.57 25.70±1.35 <0.01 473.25±18.36 423.16±22.02 <0.01 35 6.62±0.01 6.61±0.07 >0.05 28.51±1.30 28.51±1.31 >0.05 513.33±20.07 493.27±20.45 <0.01
1.1 日立CR-7大容量低温离心机、泰尔茂无菌结合机、SE-250热合机、分浆夹、山东威高生产的全密闭三联盐水洗涤袋、自动配平仪、电子采血秤等。
1.2 采用本站制备有效期内的红细胞悬液2 U。
1.3 采用无菌结合术,用无菌结合机连接红细胞悬液和全密闭三联盐水洗涤袋。
1.4 制备洗涤红细胞的离心条件见表1。见表1,离心4次,每次加盐水100 mL/U进行洗涤,最后加入适量MAP液,制备成洗涤红细胞。放入(4±2) ℃储血冰箱存放。 对照组的红细胞采用常规制备方法,温度为(4±2) ℃,并以红细胞悬液作为对比,注意确保其在保质期内。
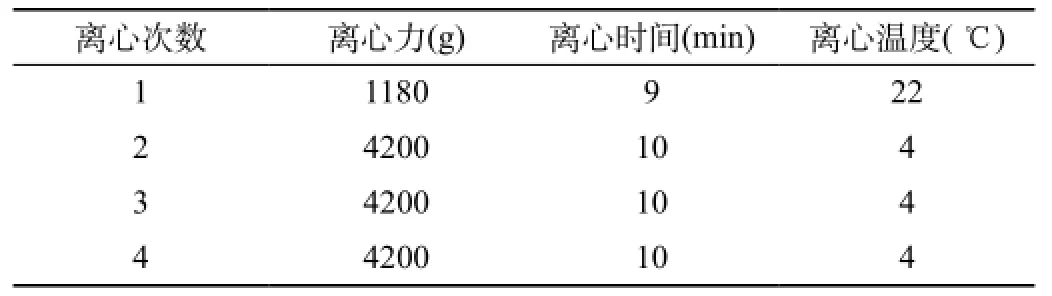
表1 制备洗涤红细胞的离心条件
1.5 pH值检验方法:使用Beckman Q40酸度计对pH值进行测定。
1.6 血浆上清K+检验方法:使用血液自动化分析仪进行测定。
1.7 红细胞ATP的检验方法:采用上海分析仪(VIS-723)提取上清液[4],其中含有ATP1u,根据ATP检验试剂盒方法对ATP标准液及发光素酶系统基于测定,随后再取0.2 mL的ATP标准液不同浓度加入到发光反应杯内,剂量为0.2 mL,置于分光光度仪的反应暗室内,注入荧光酶液,剂量为0.8 mL,并准确记录发光强度,随后将U样与标准品所得出的发光数值,计算出ATP的浓度。
1.8 测定游离血红蛋白方法[5]:采用CPD全血离心取样本的上层血清,剂量为0.02 mL,随后再取HB标准液应用液,剂量为0.02 mL,加入到2%邻-甲苯胺溶液1% H2O溶液,剂量为0.1 mL,放置10 min后加入乙酸溶液(浓度为2%,剂量为10 mL),混合于435 nm,鼻塞。计算游离血红蛋白的含量。进行洗涤红细胞制品、红细胞悬液的对照检测。
2 结 果
2.1 理化指标及血红蛋白游离率结果研究:观察实验组和对照组血液的pH值、血浆上清K+浓度及游离血红蛋白等指标。结果见表2。
3 讨 论
本血站实验采用泰尔茂无菌结合机连接红细胞悬液和盐水洗涤袋制备洗涤红细胞只是制备工艺的考虑,防止血袋管口交叉感染的机会和临床安全用血。使用无菌结合技术进行制备的洗涤红细胞,连接口完整且无渗漏,没有出现气泡等情况,且保存期的效果与采用密闭系统所制备的血液成分的保存期较为一致[6]。
[1] 叶汉泉,刘志泉,梁丽雯.红细胞保存液混悬洗涤红细胞质量控制动态观察[J].长江大学学报(自科版),2013,10(24):85-86.
[2] 中华人民共和国卫生部.血站技术操作规程[S].2012
[3] 戴庆昭.悬浮红细胞质量控制研究进展[J].实用医技杂志,2009, 16(1):34-35.
[4] 李小奎,孟宪均,宋旭华,等.用生物发光检测RBC-ATP含量的报告[J].中华输血杂志,1990,11(8):423.
[5] 叶应妩,王毓三,申子瑜.全国临床检验操作规程[S].南京:东南大学出版社,1997:61-62.
[6] Food and Drug Adminisation Memorandum:use of an FDA cleared or approved sterile (STCD) in blood bank practice July 29,1994 Rockville,MD:CBER office ofcommunicn-tion Training, and Manufacvrer S Assistance,1994.
R446
B
1671-8194(2017)08-0015-02

