4,4′,5,5′-四硝基-2,2′-联咪唑及其含能离子盐的合成及热性能
李亚南, 舒远杰, 张生勇, 王伯周, 翟连杰
(西安近代化学研究所, 陕西 西安 710065)
1 引 言
含能材料直接关系到武器装备的射程、威力、安全性等关键性能,为了适应不同战场环境对武器系统的特殊需求,现代武器系统对含能材料的爆轰性能和安全性提出了更高的要求,虽然军用单组份炸药的研究范围和种类不断扩大,但有实际应用价值的单组份仍很少。含能材料合成研究者一直在寻找能量密度高、感度低、热稳定性好的新型含能材料,多硝基氮杂环含能化合物成为含能材料研究领域的热点,这类化合物能形成类苯结构的大共轭体系,是一类静电、撞击和摩擦感度低、爆轰性能良好的单质炸药,具有良好的潜在应用前景[1-4]。4,4′,5,5′-四硝基-2,2′-联咪唑(TNBI)是多硝基氮杂环含能化合物的一个代表,其密度为1.80 g·cm-3,爆速为7840 m·s-1,爆压为27.6 GPa,生成热232 kJ·mol-1,撞击感度5.7 J,摩擦感度351 N,分解温度290 ℃[5]。1990年,Cromer等[6-7]首次报道了TNBI及其铵盐的晶体结构。随后,各国含能材料研究者相继开展了关于TNBI结构与性能的理论研究、TNBI金属盐(钠盐、钾盐、锂盐)及TNBI富氮含能离子盐(铵盐、肼盐、羟胺盐、胍盐、氨基胍盐、二氨基胍盐、三氨基胍盐及氮杂环盐等)的合成及性能研究,期望消除和解决TNBI分子结构中存在的酸性问题,并开展了部分应用探索研究[5,8-14]。
文献[11]报道的TNBI合成过程,需在亚硝酸钠/尿素/浓硫酸体系、85~90 ℃高温反应16 h,该操作工艺反应温度高、反应时间长、过程较为剧烈、危险性高。基于此,本研究对TNBI的合成工艺进行了改进,以80%硝酸/浓硫酸体系代替硝酸钠/尿素/浓硫酸体系、45 ℃反应4 h,反应过程温和平稳; 利用TNBI和不同有机胺的复分解、中和等反应制备了七种未见文献报道的TNBI含能离子盐; 培养了TNBI·H2O单晶,并进行了单晶结构解析; 用DSC、TG等方法研究了七种含能离子盐的热性能。
2 实验部分
2.1 试剂与仪器
乙酸铵、乙二醛(37%~40%)、甲醇、乙醇、氢氧化钠,分析纯,成都市科龙化工试剂厂; 浓硫酸(95%~98%)、浓硝酸(98%),工业级,西安福晨化学试剂有限公司; 二氨基呋咱、二肼基四嗪、4-氨基-1,2,4-三氮唑、80%硝酸, 均为实验室自制; 草酰肼、缩二胍盐酸盐、脒基脲硝酸盐、尿素,分析纯,济南伟都化工试剂有限公司。
NEXUS 870型傅里叶变换红外光谱仪,美国热电尼高力公司; AV 500型(500MHz)超导核磁共振仪,瑞士BRUKER公司; VARIO-EL-3型元素分析仪,德国EXEMENTAR公司; LC-2010A型高效液相色谱仪(归一化法),日本岛津公司; Q-200差示扫描量热仪,美国TA公司; TA 2950热重仪,美国Nicolet公司; Smart APEXⅡCCD衍射仪,瑞士BRUKER公司。
2.2 合成路线
以乙酸铵和乙二醛为原料,经环化、硝化反应合成了4,4′,5,5′-四硝基-2,2′-联咪唑(TNBI),TNBI与有机胺发生复分解、中和等反应制备了七种有机含能离子盐,合成路线如Scheme 1所示。
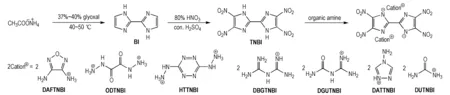
Scheme1Synthetic routes of TNBI and its energetic ion salts
2.3 实验过程
2.3.1 2,2′-联咪唑(BI)的合成
室温下,依次将79.7 g(1.03 mol)乙酸铵、50.0 mL蒸馏水加入反应瓶中,搅拌溶解,体系升温至45℃,保持温度在45 ℃滴加56.1 g(37.2 mmol) 质量分数为37%~40%乙二醛水溶液,滴加完毕后,在45 ℃保温反应3 h,过滤、水洗、乙醇洗、干燥得灰色固体8.5 g,收率49.2%,纯度99.0%(HPLC)。
1H NMR(DMSO-d6, 500 MHz)δ: 7.066(s, 4H, 4CH), 12.66(s, 2H, 2NH);13C NMR(DMSO-d6, 125 MHz)δ: 139.83; IR(KBr,ν/cm-1): 3143, 3074, 3001, 2896, 2805, 1678, 1545, 1436, 1404, 1333, 1217, 1144, 1104, 939, 915, 887, 828, 763, 747, 689。Anal.Calcd. for C6H6N4(%): C 53.72, H 4.51, N 41.77; Found C 53.63, H 4.56, N 41.84。
2.3.2 4,4′,5,5′-四硝基-2,2′-联咪唑(TNBI)的合成
搅拌下,在温度20~25 ℃,将1.0 g(7.46 mmol) 2,2′-联咪唑加入到10.0 mL质量分数为95%~98%的浓硫酸中,升温至45 ℃,滴加13.0 mL质量分数为80%的硝酸和13.0 mL 质量分数为95%~98%的浓硫酸混合溶液,加完后在45 ℃反应4 h,将反应液倒入40.0 g碎冰中,过滤、冷水洗、干燥得黄色固体1.35 g,收率为51.7%,纯度99.2%(HPLC)。
1H NMR(DMSO-d6, 500 MHz)δ: 7.308(s, 2H, 2NH);13C NMR(DMSO-d6, 125 MHz)δ: 138.67, 139.05; IR(KBr,ν/cm-1): 3608, 3538, 2474, 1844, 1589, 1537, 1485, 1412, 1368, 1320, 1287, 1229, 919, 853, 809, 745, 690。Anal.Calcd. for C6H2N8O8·2H2O(%): C 20.58, H 1.73, N 32.00; Found C 20.67, H 1.69, N 32.08。
2.3.3 4,4′,5,5′-四硝基-2,2′-联咪唑二氨基呋咱盐(DAFTNBI)的合成
室温下,向装有温度计、搅拌及冷凝器的25 mL三口瓶中,依次加入0.175 g(0.5 mmol)TNBI和10.0 mL甲醇,搅拌溶解后,加入0.1 g(1 mmol)二氨基呋咱,升温至50 ℃反应4 h,自然冷却至室温析出固体,过滤、甲醇洗、干燥得黄色固体0.19 g,收率71.4%,纯度98.9%。
1H NMR(DMSO-d6, 500 MHz)δ: 6.596(s, 10H, 2(AFH+));13C NMR(DMSO-d6, 125 MHz)δ: 138.68, 139.09, 150.17; IR(KBr,ν/cm-1): 3609, 3537, 3438, 3328, 1846, 1627, 1589, 1536, 1484, 1412, 1367, 1321, 1287, 1229, 919, 853, 809, 744, 689。Anal.Calcd. for C10H10N16O10·H2O(%): C 22.56, H 2.27, N 42.10; Found C 22.47, H 2.32, N 42.04。
2.3.4 4,4′,5,5′-四硝基-2,2′-联咪唑草酰肼盐(ODTNBI)的合成
室温下,向装有温度计、搅拌及冷凝器的25 mL三口瓶中,依次加入0.175 g(0.5 mmol)TNBI和10.0 mL甲醇,搅拌溶解后,加入0.059 g(0.5 mmol)草酰肼,升温至60 ℃反应3 h,自然冷却至室温析出固体,过滤、甲醇洗、干燥得黄色固体0.18 g,收率83.3%,纯度98.7%。
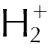
2.3.5 4,4′,5,5′-四硝基-2,2′-联咪唑二肼基四嗪盐(HTTNBI)的合成
室温下,向装有温度计、搅拌及冷凝器的25 mL三口瓶中,依次加入0.175 g(0.5 mmol)TNBI和10.0 mL甲醇,搅拌溶解后,加入0.071 g(0.5 mmol)二肼基四嗪,升温至70 ℃反应2 h,自然冷却至室温析出固体,过滤、甲醇洗、干燥得橘红色固体0.22 g,收率96.5%,纯度98.9%。
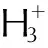
2.3.6 4,4′,5,5′-四硝基-2,2′-联咪唑缩二胍盐(DBGTNBI)的合成
室温下,向装有温度计、搅拌及冷凝器的25 mL三口瓶中,依次加入0.175 g(0.5 mmol)TNBI、8.0 mL甲醇、2.0 mL蒸馏水和0.04 g(1 mmol)氢氧化钠,搅拌溶解后,升温至50 ℃,加入0.138 g(1 mmol)缩二胍盐酸盐,在50℃保温反应4 h,冷却至室温析出固体,过滤、甲醇洗、干燥得橘红色固体0.24 g,收率93.0%,纯度99.2%。
1H NMR(DMSO-d6, 500 MHz)δ: 6.810(s, 16H, 2BGH+);13C NMR(DMSO-d6, 125 MHz)δ: 140.95, 144.78, 160.18; IR(KBr,ν/cm-1): 3457, 3381, 3353, 3130, 1676, 1638, 1579, 1553, 1510, 1486, 1458, 1388, 1370, 1307, 1196, 1100, 857, 810, 754, 699。Anal.Calcd. for C10H16N18O8(%): C 23.26, H 3.12, N 48.83; Found C 23.22, H 3.18, N 48.88。
2.3.7 4,4′,5,5′-四硝基-2,2′-联咪唑脒基脲盐(DGUTNBI)的合成
室温下,向装有温度计、搅拌及冷凝器的25 mL三口瓶中,依次加入0.175 g(0.5 mmol)TNBI、8.0 mL甲醇、2.0 mL蒸馏水和0.04 g(1 mmol)氢氧化钠,搅拌溶解后,升温至55 ℃,加入0.165 g(1 mmol)脒基脲硝酸盐,在55 ℃保温反应3 h,冷却至室温析出固体,过滤、甲醇洗、干燥得黄色固体0.24 g,收率92.7%,纯度99.3%。
1H NMR(DMSO-d6, 500 MHz)δ: 7.200(s, 4H, 2CN), 8.352(s, 8H, 4NH2), 9.685(s, 2H, 2NH);13C NMR(DMSO-d6, 125 MHz)δ: 140.79, 144.28, 154.98, 155.95; IR(KBr,ν/cm-1): 3466, 3375, 1736, 1703, 1667, 1604, 1530, 1471, 1397, 1382, 1349, 1311, 1264, 1198, 1113, 856, 812, 754, 642。Anal.Calcd. for C10H16N18O8(%): C 23.17, H 2.72, N 43.24; Found C 23.21, H 2.78, N 43.18。
2.3.8 4,4′,5,5′-四硝基-2,2′-联咪唑4-氨基-1,2,4-三唑盐(DATTNBI)的合成
室温下,向装有温度计、搅拌及冷凝器的25 mL三口瓶中,依次加入0.175 g(0.5 mmol)TNBI和10.0 mL甲醇,搅拌溶解后,加入0.084 g(1 mmol) 4-氨基-1,2,4-三唑,升温至60 ℃反应3 h,自然冷却至室温析出固体,过滤、甲醇洗、干燥得橘红色固体0.23 g,收率95.4%,纯度98.9%。
1H NMR(DMSO-d6, 500 MHz)δ: 9.226(s, 4H, 4CH);13C NMR(DMSO-d6, 125 MHz)δ: 139.32, 140.72, 144.54; IR(KBr,ν/cm-1): 3325, 3242, 3107, 1645, 1523, 1499, 1465, 1395, 1351, 1303, 1265, 1228, 1113, 1075, 1002, 958, 856, 815, 756, 699。Anal.Calcd. for C10H10N16O8(%): C 24.90, H 2.09, N 46.47; Found C 24.94, H 2.13, N 46.41。
2.3.9 4,4′,5,5′-四硝基-2,2′-联咪唑尿素盐(DUTNBI)的合成
室温下,向装有温度计、搅拌及冷凝器的25 mL三口瓶中,依次加入0.175 g(0.5 mmol)TNBI和5.0 mL甲醇,搅拌溶解后,加入0.06 g(1 mmol) 尿素,升温至40 ℃反应3 h,冰水浴冷却至0~5 ℃析出固体,过滤、干燥得黄色固体0.19 g,收率87.6%,纯度98.8%。
1H NMR(DMSO-d6, 500 MHz)δ: 7.809(s, 10H, 2UH+);13C NMR(DMSO-d6, 125 MHz)δ: 138.82, 139.44, 161.04; IR(KBr,ν/cm-1): 3478, 3388, 3050, 1679, 1546, 1496, 1404, 1382, 1349, 1315, 1280, 1118, 994, 853, 813, 751, 677。Anal.Calcd. for C8H10N12O10(%): C 22.13, H 2.32, N 38.71; Found C 22.16, H 2.28, N 38.66。
2.4 TNBI·H2O单晶培养
称取1.0 g纯度为99.7%的TNBI自制样品,将其分散于适量的蒸馏水中,加热至50 ℃,使TNBI完全溶解,得到黄色澄清溶液,冷却至室温,过滤出不溶物,滤液置于干净的锥形瓶中,室温(20~25 ℃)下放置1周后,得到淡黄色柱状晶体。
2.5 TNBI·H2O晶体结构测定
选取尺寸为0.35 mm×0.25 mm×0.13 mm的单晶,在 Smart APEXⅡCCD衍射仪上,用Mo Kα射线(λ=0.071073 nm)、石墨单色器。在296(2) K温度下,以ω扫描方式扫描,扫描范围: 2.69°≤θ≤25.09°,-6≤h≤6,-10≤k≤8,-18≤l≤16,共收集衍射点3142个,其中独立衍射点1146个,选取I>2σ(I)的11146个点用于结构测定和修正,全部数据均经Lp因子和半经验吸收校正,所有计算均用SHELXTL-97程序包完成。
3 结果与讨论
3.1 TNBI·H2O的晶体结构解析
TNBI·H2O晶体的分子结构和分子在晶胞中的堆积分别示于图1和图2。
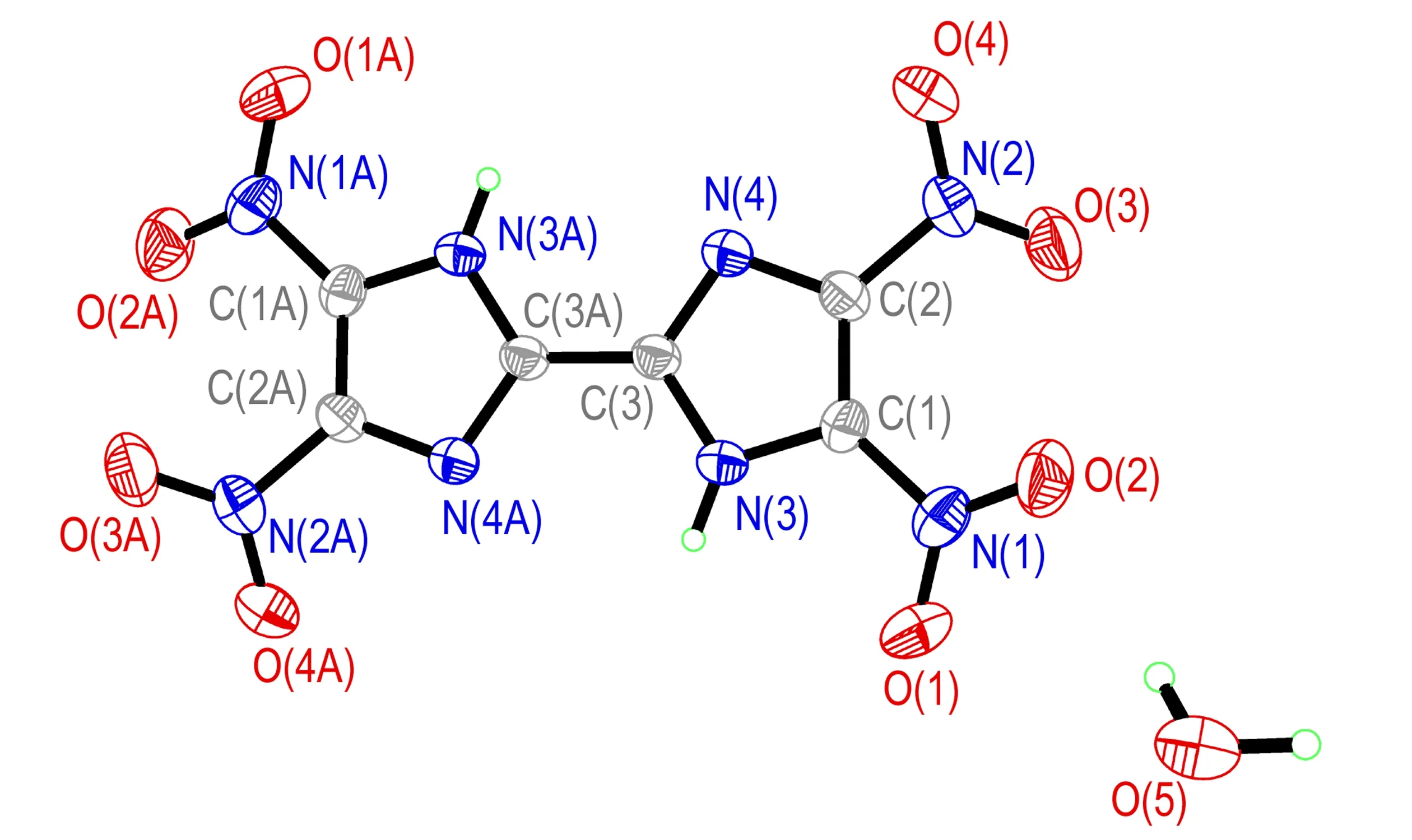
图1TNBI·H2O的分子结构
Fig.1Molecular structure of TNBI·H2O
晶体分析结果表明,该晶体为单斜晶系,空间群为P2(1)/n。晶体学参数为:a=0.5051(17) nm,b=0.8528(3) nm,c=1.5270(5) nm,β=96.948(6)°,V=0.6529(4) nm3,Z=4,Dc=1.781 g·cm-3,μ=0.170 mm-1,F(000)=356。该晶体结构由Patterrson直接法[15]解出,原子位置均由差值Fourier合成法得到。分子结构用117个参数,由块矩阵最小二乘法进行优化(对于氢原子采用各向同性热参数,对于非氢原子采用各向异性热参数)。对于I>2σ(I)数据的最终偏差因子R1=0.0441,wR2=0.0945; 对所有数据的偏差因子R1=0.0807,wR2=0.1110,最佳拟合度s=1.003,最终差值电子云密度的最高峰为174 e·nm-3,最低峰为-161 e·nm-3。
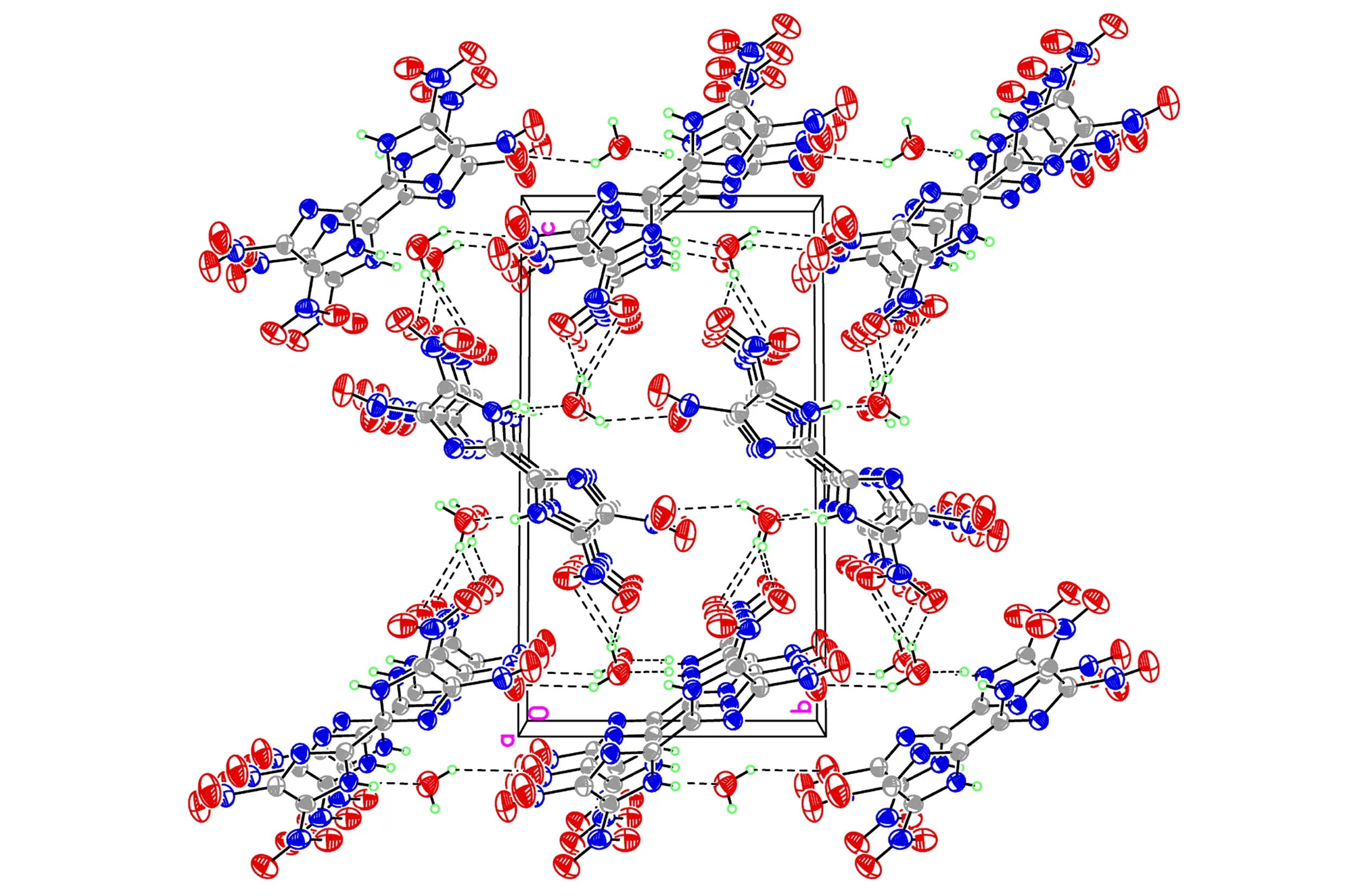
图2TNBI·H2O的晶胞堆积图
Fig.2Packing diagram of the unit cell of TNBI·H2O
分析以上结果可以看出,TNBI分子属于中心对称结构,由于C(1)—N(3)—C(3)—C(3)#1的二面角为179.5(3)°,C(2)—N(4)—C(3)—C(3)#1的二面角为-179.2(3)°,C(3)—N(3)—C(1)—N(1)二面角为177.4(2)°,C(3)—N(4)—C(2)—N(2)二面角为177.3(2)°,N(1)—C(1)—C(2)—N(2)二面角为5.7(5)°,故联咪唑环以及四个硝基N原子的所有原子几乎处在同一平面上。在TNBI分子结构中,联咪唑环和四个硝基之间形成了一个大的离域共轭体系,从而使该化合物表现出良好的热稳定性。同时,由于TNBI分子结构中的亚氨基含有活泼氢,在以水为溶剂培养TNBI单晶时,由于TNBI和水分子之间存在分子间氢键,一分子TNBI结合了一分子水(从晶胞堆积图可以看出),从而也使该物质的晶体密度小于其实测密度。
3.2 TNBI含能离子盐的热性能研究
在动态氮气气氛,压力0.1 MPa,温度25~500 ℃,升温速率10 ℃·min-1,试样量约0.5~1.0 mg,试样皿为铝盘的条件下分别研究了七种TNBI有机胺含能离子盐的热性能,其DSC和TG实验结果分别如图3、图4所示。
从图3可以看出,由于TNBI有机胺盐结构中存在体积较大的阴、阳离子部分,热分解过程可能涉及的官能团比较多,故部分化合物热分解过程比较复杂,存在多个放热分解峰。化合物DAFTNBI、DUTNBI分别都有一个明显的吸热峰和至少一个放热峰,其中依次在171.15,172.77 ℃处的吸热峰分别为各物质的熔化峰,即为各物质的熔点; 其中DAFTNBI在88.68 ℃处的吸热峰为该物质结晶水的吸热峰; 在199.23,260.19 ℃处的放热峰分别为各物质的第一阶段热分解放热峰,随着温度的升高,化合物进一步热分解,表明这些化合物的热分解过程是经历了液相分解过程。而化合物ODTNBI、HTTNBI、DBGTNBI、DGUTNBI、DATTNBI没有明显的吸热峰,只存在一个或两个明显的放热分解峰,表明这些物质不存在明确的熔点,故其后经历的热分解过程是不经过吸热熔化的相变过程,而是固相直接热分解过程,在204.52,230.13,266.96,240.63,187.98 ℃处的放热峰分别为各物质的第一阶段热分解放热峰,而311.82,216.64 ℃处的放热峰分别为DBGTNBI和DATTNBI第二阶段热分解放热峰。部分TNBI有机胺含能离子盐的热分解比较复杂,分解过程存在不止一个热分解峰,且所有化合物的第一阶段热分解峰温都高于187 ℃,表明此类化合物的具有较好的热稳定性。
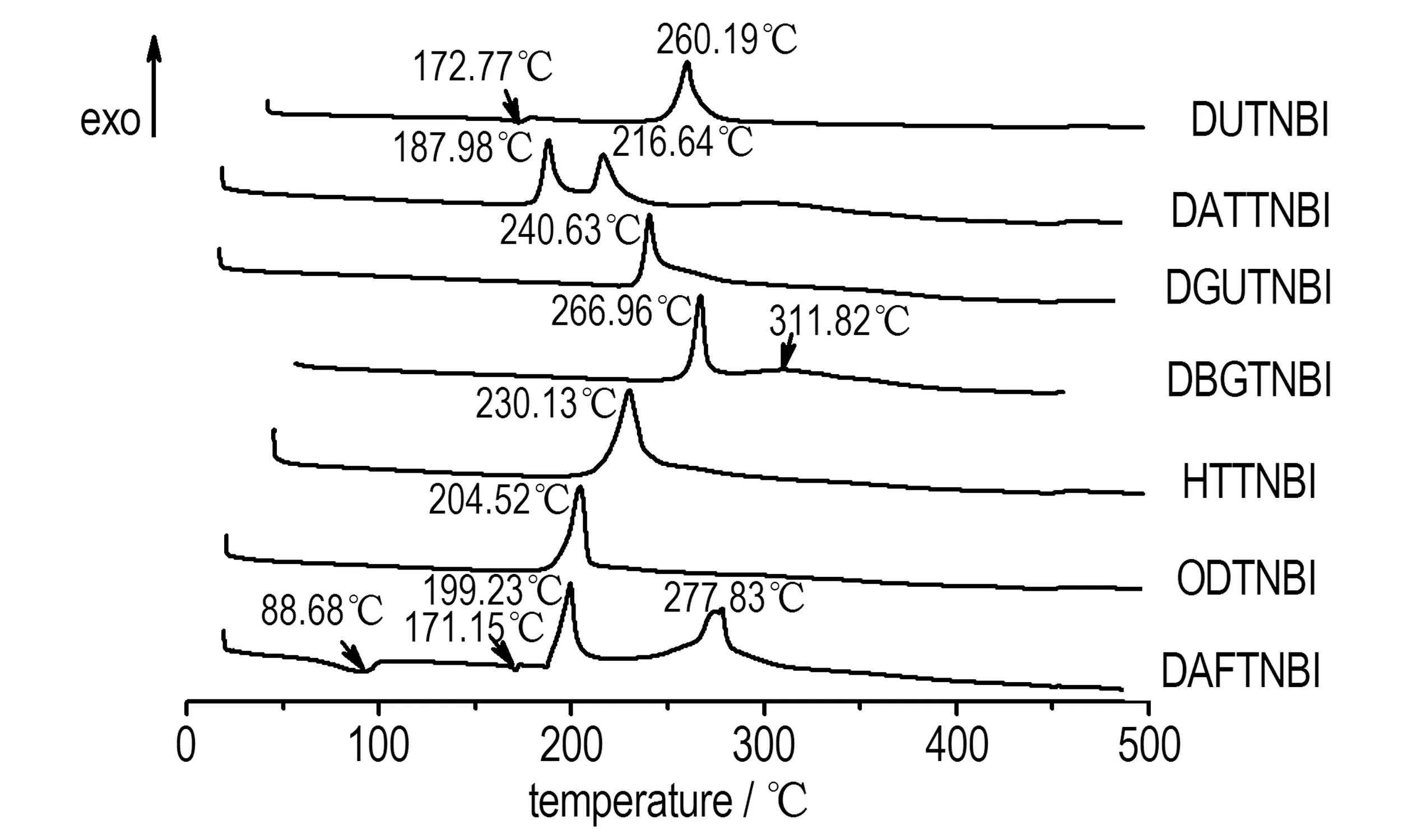
图3TNBI含能离子盐的DSC曲线
Fig.3The DSC curves of TNBI′s energetic ion salts
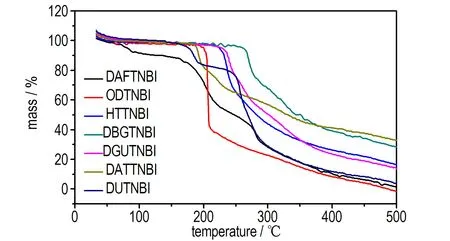
图4TNBI含能离子盐的TG曲线
Fig.4The TG curves of TNBI′s energetic ion salts
从图4可知,合成的TNBI有机含能离子盐化合物(DAFTNBI除外)在175 ℃之前,其热分解累积质量损失均小于5%,如: ODTNBI、HTTNBI、DBGTNBI、DGUTNBI、DATTNBI和DUTNBI在200.00,224.14,260.13,228.45,190.09,177.80 ℃处的累积质量损失分别为4.72%,4.57%,4.71%,4.87%,4.88%,4.72%,热分解质量损失较小,表明上述化合物在175 ℃之前的热稳定性较好,且化合物DAFTNBI、DBGTNBI、DATTNBI和DUTNBI都存在两个热失重过程,经历了至少两个热分解阶段; 从图4还可以看出,所有化合物的最大热分解失重峰温都在200 ℃以上,随着温度的继续升高,各个物质进一步分解,最后剩余一定量难以分解的“残渣”。
4 结 论
(1) 改进了4,4′,5,5′-四硝基-2,2′-联咪唑(TNBI)的合成工艺,以80%硝酸/浓硫酸体系代替文献的硝酸钠/尿素/浓硫酸体系,反应温度由85~90 ℃降低到45 ℃、反应时间从16 h缩短至4 h,反应过程平稳温和,为其进一步工艺放大奠定基础。
(2) 以自制的TNBI为原料,合成了TNBI的二氨基呋咱盐(DAFTNBI)、草酰肼盐(ODTNBI)、二肼基四嗪盐(HTTNBI)、缩二胍盐(DBGTNBI)、脒基脲盐(DGUTNBI)、4-氨基-1,2,4-三唑盐(DATTNBI)、尿素盐(DUTNBI) 等七种新型含能离子盐,收率分别为71.4%,83.3%,96.5%,93.0%,92.7%,95.4%和87.6%。
(3) 获得了TNBI·H2O单晶,晶体结构解析表明,TNBI·H2O为单斜晶系,空间群为P2(1)/n,TNBI分子结构中联咪唑环及四个硝基彼此间形成一个大的离域共轭体系。
(4) 采用差示扫描量热(DSC)、热重(TG)研究了TNBI七种含能离子盐的热性能,结果表明,此类化合物具有较好的热稳定性,所有化合物的第一阶段热分解峰温均高于187 ℃。
参考文献:
[1] Zhang Y, Parrish D A,Shreeve J M. 4-Nitramino-3,5-dinitropyrazole-based energetic salts[J].Chemistry-AEuropeanJournal, 2012, 18: 987-994.
[2] Huang Y, Zhang Y,Shreeve J M. Nitrogen-rich salts based on energetic nitroaminodiazido 1,3,5-triazine and guanazine[J].Chemistry-AEuropeanJournal, 2011, 17: 1538-1546.
[3] HUO Huan, WANG Bo-zhou, ZHAI Lian-jie, et al. An insensitive energetic compound 5,7-diamino-4,6-dinitrobenzotriazol-3-ium-1-oxide: synthesis, characterization and performances[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2016, 24(9): 857-861.
[4] 吴军鹏, 曹端林, 王建龙, 等. 3,4,5-三硝基吡唑及其衍生物的研究进展[J]. 含能材料, 2016, 24(11): 1121-1130.
WU Jun-peng, CAO Duan-lin, WANG Jian-long, et al. Progress on 3,4,5-trinitro-1H-pyrazole and its derivatives[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2016, 24(11): 1121-1130.
[5] Liu L, Zhang Y, Zhang S, Fei T. Heterocyclic energetic salts of 4,4′,5,5′-tetranitro-2,2′-biimidazole[J].JournalofEnergeticMaterials, 2015, 33: 202-214.
[6] Cromer D T, Storm C B. Structure of 4,4′,5,5′-Tetranitro-2,2′-biimidazole dihydrate[J].ActaCrystallogr,SectC:CrystStructCommun, 1990, 46: 1957-1958.
[7] Cromer D T, Storm C B. Structure of thediammonium salt of 4,4′,5,5′-tetranitro-2,2′-biimidazole, C6N8O8·2NH4[J].ActaCrystallogr,SectC:CrystStructCommun, 1990, 46: 1959-1960.
[8] Cho S G, Cho J R, Goh E M, et al. Synthesis and characterization of 4,4′,5,5′-tetranitro-2,2′-bi-1H-imidazole(TNBI)[J].Propellants,Explosives,Pyrotechnics, 2005, 30(6): 445-449.
[9] Cho S G, Goh E M, Cho J R, et al. Theoretical studies on molecular and explosive properties of 4,4′,5,5′-tetranitro-2,2′-bi-1H-imidazole(TNBI)[J].Propellants,Explosives,Pyrotechnics, 2006, 31(1): 33-37.
[10] Chavez D E, Parrish D, Preston D N,et al. Synthesis and energetic properties of 4,4′,5,5′-tetranitro-2,2′-biimidazolate (N4BIM) salts[J].Propellants,Explosives,Pyrotechnics, 2012, 37: 647-652.
[11] Klapötke T M, Preimesser A, Stierstorfer J. Energetic derivatives of 4,4′,5,5′-tetranitro-2,2′-bisimidazole(TNBI)[J].ZAnorgAllgChem, 2012, 638 (9): 1278-1286.
[12] Kim S H, Kim J S. High nitrogen energetic salts of 4,4′,5,5′-tetranitro-2,2′-biimidazole[J].BullKoreanChemSoc, 2013, 34(8): 2503-2506.
[13] Lewczuk R, Wasilewska M, Szala M. Synthesis and properties of some new salts of 4,4′,5,5′-tetranitro-2,2′-bi-1H-imidazole[C]∥New Trends in Research of Energetic Materials, Pardubice, Czech Republic, April, 2014: 825-810.
[14] Paraskos A J, Cooke E D,Caflin K C. Bishydrazinium and diammonium salts of 4,4′,5,5′-tetranitro-2,2′-biimidazolate(TNBI): synthesis and properties[J].Propellants,Explosives,Pyrotechnics, 2015, 40: 46-49.
[15] Sheldrick G M. SHELXS-97, Program for Crystal Structure Solution[CP], University of Göttingen, Germany, 1997.

