磁性四氧化三铁纳米粒子在医学诊疗领域的研究
严微,郭娇娇,向晨阳,莫康伟,徐祖顺(功能材料绿色制备与应用教育部重点实验室,有机化工新材料湖北省协同创新中心,湖北大学材料科学与工程学院, 湖北 武汉 430062)
磁性四氧化三铁纳米粒子在医学诊疗领域的研究
严微,郭娇娇,向晨阳,莫康伟,徐祖顺
(功能材料绿色制备与应用教育部重点实验室,有机化工新材料湖北省协同创新中心,湖北大学材料科学与工程学院, 湖北 武汉 430062)
在过去的几十年间,纳米粒子在生物医学领域取得了飞速发展.在众多类型的纳米粒子中,磁性四氧化三铁(Fe3O4)纳米粒子又以其大比表面积、低毒性和良好的生物相容性等物理化学性质而得到全世界生物医用领域的广泛关注.配合以表面修饰手段以及相应的体内作用机制,磁性四氧化三铁(Fe3O4)纳米粒子展现出巨大的应用价值,已成为在生物医学材料领域应用最为成功的磁性纳米粒子之一.文中概述了Fe3O4纳米粒子作为诊断试剂、药物载体以及诊疗一体化试剂的研究进展,并对该领域的未来发展进行展望.关键词:磁性Fe3O4纳米粒子;诊疗试剂;药物载体; 诊疗一体化试剂
0 引言
磁性四氧化三铁纳米粒子由于其独特的比表面效应、量子尺寸效应和磁学性质,因而在光、电、磁、医学等领域受到科研人员的广泛关注.作为一种具有特殊理化性质的材料,磁性四氧化三铁纳米粒子的合成和修饰是一个相对复杂的过程,在这一过程中面临的两个主要挑战:磁性核的单分散性和合成的可重复性.在长期的研究探索中,多种方法已被用来合成超顺磁性纳米粒子,包括标准的氯化铁沉淀法、有机金属前体的热分解法、水热法、微乳液法、声化学方法、溶胶凝胶法和多元醇法等.每一种合成方法都有其优点和缺点,如共沉淀法操作简单且易扩大反应,但产生的磁性四氧化三铁纳米粒子尺寸分布较大;而热分解方法能得到高结晶性、高磁化强度和单分散性的磁性氧化铁纳米粒子,然而有机溶剂的使用却不利于其表面进行功能化修饰而限制了其应用领域.在磁性四氧化三铁纳米粒子的众多应用中,以药物载体、生物标定、磁性分离、核磁造影为核心的生物医学领域备受研究人员的重视.众所周知,尽管当代科学技术在不断进步发展,癌症仍然是导致人类死亡的最主要原因之一.癌症死亡率偏高,主要归因于目前的医疗技术对于恶性肿瘤缺乏有效的早期诊断、预测及有效的临床方案.为改善这一现状,迫切需要发展精准的癌前诊断和治疗方法[1-2].在众多可用作诊疗试剂的纳米材料中,磁性四氧化三铁纳米粒子因其独特的物理化学性质和良好的生物相容性已发展为最具吸引力的诊断试剂之一[3-6].磁性四氧化三铁纳米粒子作为磁共振成像的造影增强剂,具有捕获质子磁矩信号的能力且易形成高分辨率的图像[7-8].在外加磁场下,纳米粒子可以被定向吸引到特定的组织区域,而当磁场撤去之后,纳米粒子通过血液循环被肝、脾、淋巴结等的网状内皮吞噬系统的细胞识别或者进入炎症肿瘤部位而被机体清除[5,9].此外,经表面修饰的磁性四氧化三铁纳米粒子不易被血浆蛋白包绕,从而避免被(RES)吞噬,降低了其被清除的速度,延长其在血液中的循环时间[10-11].本文中简要概述了磁性四氧化三铁纳米粒子在成像和治疗领域的研究进展,探索其作为诊断治疗一体化试剂的应用前景.
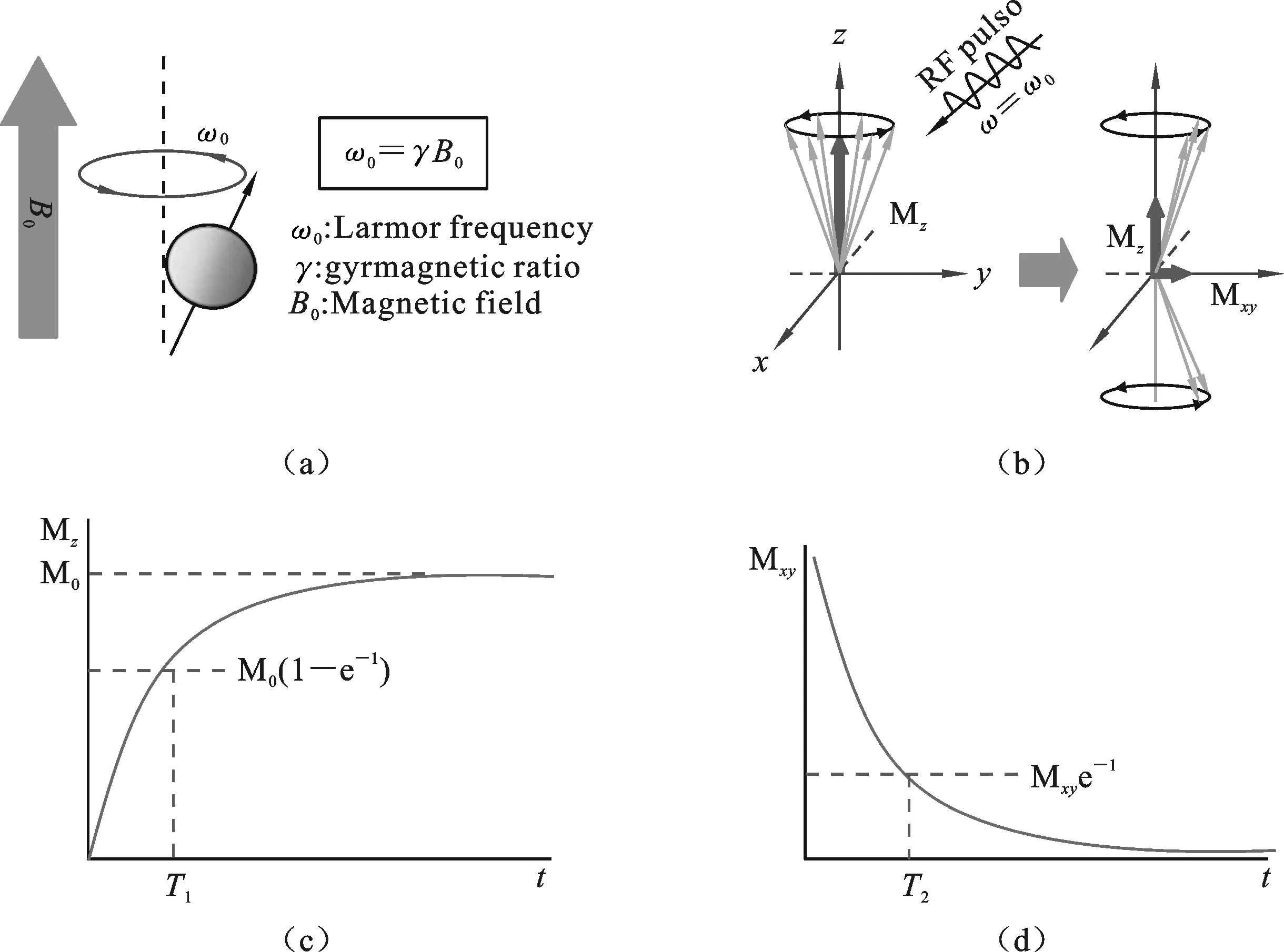
图1 磁共振成像原理图a) 在外磁场下对齐平行旋转或反平行旋转示意图以及转动的相应的拉莫尔频率;b) 感应射频脉冲后,自旋磁化强度的变化;激发的自旋弛豫过程分别是c) T1弛豫时间和d) T2弛豫时

图2 DDT-PMAA功能化修饰的磁性四氧化三铁纳米粒子(MIONs)及负载药物DOX的合成示意图
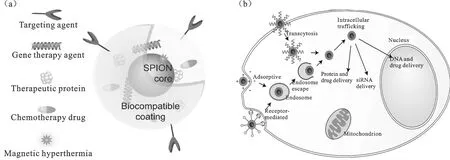
图3 纳米四氧化三铁与基因载体作用的机理示意图(a) 超顺磁性四氧化三铁纳米粒子(SPION)作为纳米诊疗试剂的架构示意图;(b) 越过细胞壁垒治疗的典型的示意图
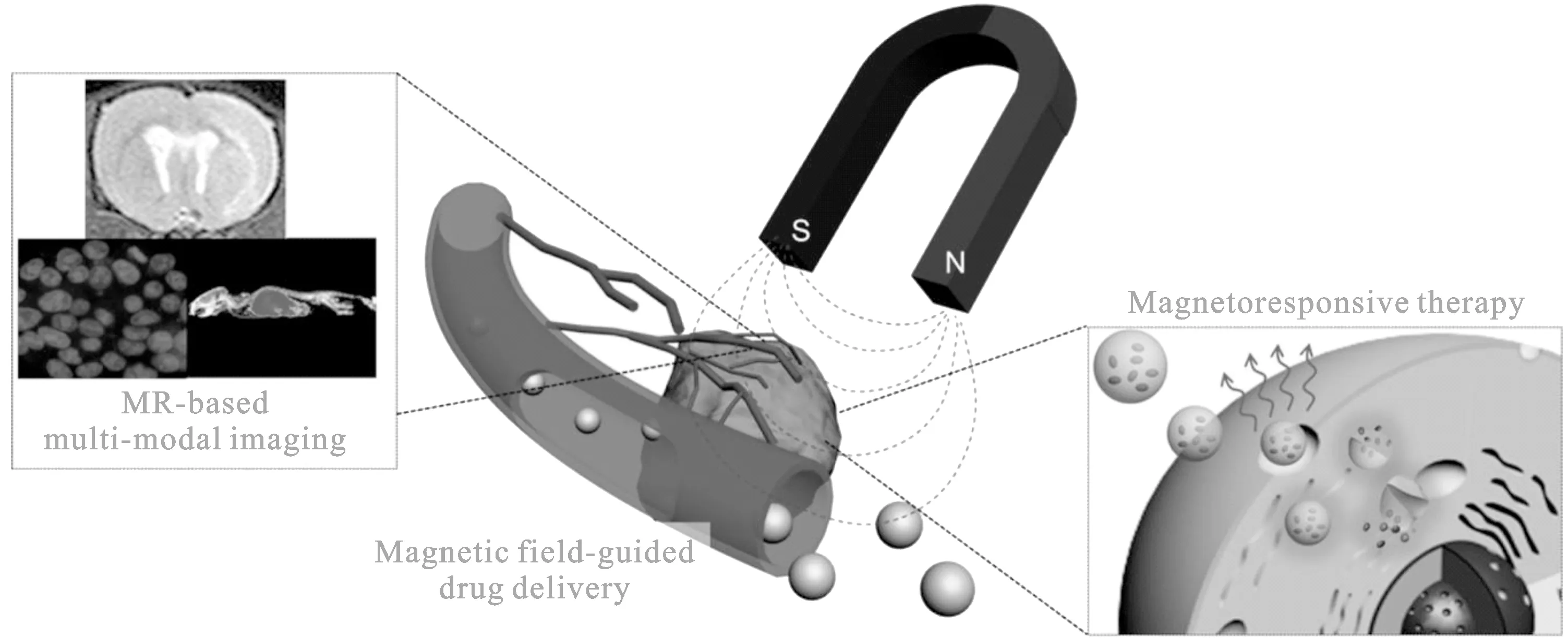
图4 磁性四氧化三铁纳米粒子在磁共振成像,药物运载和治疗中的应用图
1 磁性Fe3O4纳米粒子在诊疗领域的研究
1.1 作为诊断试剂应用的磁性Fe3O4纳米粒子 磁性Fe3O4纳米粒子是一种特殊的铁磁性物质且具有独特的晶体结构.在外部磁场作用下可缩短来自水分子质子附近的纵向和横向弛豫时间而形成清晰的图像[12],帮助从周围健康组织中分辨出病变组织.此类Fe3O4磁性纳米粒子因其低毒性和生物适应性通常被用作T2造影剂,与Gd类小分子造影剂相比,其有着更高的体内安全性和检测灵敏度,已成为构建新型MRI造影剂的首选材料.
2013年,朱海娥等[13]用苯乙烯(St)和N-异丙基丙烯酰胺(NIPAM)的共聚物修饰油酸钠稳定的Fe3O4纳米粒子,并以此为种子进行镧系稀土络合物的聚合,制备出磁性、荧光和热响应型的核-壳结构的胶体纳米粒子.较高的横向弛豫率(411.78 mmol-1s-1)以及对肝和脾部位较强的信号对比表明该纳米粒子可以用作单一模式MRI成像的造影剂,同时也有潜力应用于多模式光学/磁共振造影成像试剂.2015年,龚莹等[14]采用同样的合成步骤利用甲基丙烯酸甲酯(MMA)和NIPAM聚合物也成功修饰了带有另一种稀土金属Tb的磁性、荧光、热响应型的poly(MMA-NIPAM-Tb(AA)3Phen)/ Fe3O4多功能性的纳米粒子, 显示出更高的横向弛豫(562.56 mmol-1s-1).2015年,李环等[15]进一步研究,利用含有牛血清蛋白的叶酸对聚合物胶束进行表面功能化,成功负载了超顺磁性Fe3O4纳米粒子.由于叶酸的靶向性,该纳米粒子可以用作肿瘤靶向探针,对肿瘤部位进行有效的磁共振成像.
因单一成像模式固有的局限性,发展多模式的成像系统已成为非常热门的研究课题.多模式的成像系统不仅可以弥补单一模式成像的不足和缺陷,还能更为精确地反应微小肿瘤的形态与定位,为肿瘤的诊断和治疗提供更为有效的信息.MRI作为无创实时监测的有效检测手段,能提供丰富的空间和解剖信息,而Fe3O4纳米粒子作为安全无毒和生物适应性的造影剂无疑成为构建多模式成像系统平台的理想载体.闫凯等[16]通过自组装两亲性的且带有荧光性质的poly(-HFMA-co-VBK)-g-PEG聚合物胶封装油酸稳定的Fe3O4纳米粒子形,结果其在肝和脾部位显示出较好的MRI和荧光成像的特性,可作为MRI和光学双功能成像的载体.张力等[17]通过种子无皂乳液聚合的方法,用Fe3O4纳米晶体、Gd(AA)3Phen和Eu(AA)3Phen成功合成了一种集T1和T2双模式MRI成像和光学成像为一体的多模式探针.汪鑫等[18]将Fe3O4纳米粒子跟含碘的稀土金属复合物整合,形成一种尺寸分布较窄的粒径约为130 nm的三功能化的纳米粒子.这一多功能化的纳米粒子可以同时用作CT、MRI和光学成像的造影剂,显示出较大的应用潜力.
1.2 作为治疗载体应用的磁性Fe3O4纳米粒子
1.2.1 靶向药物治疗载体 传统的化疗药物输送对受伤或病变部位缺乏特异性,容易被网状内皮系统所吞噬,使得穿过生理障碍进入病变部位的药量很少,进而导致药物活性降低和引起不必要的副反应.经聚合物、脂质体或无机纳米粒子修饰的磁性四氧化三铁纳米粒子可以用作抗肿瘤试剂的药物载体,其独特的优势在于这些负载有治疗药物的磁性纳米粒子在外磁场作用下具有较强的靶向性和专一性,会定向移动到靶向部位,能够更好的控制药物在体内的药代动力学行为,增强药物活性,降低毒副作用,从而达到更好的治疗效果.这种磁性介导的纳米粒子作为药物载体在化学治疗中显示出靶向特异性和较高的抗肿瘤活性,成为药物运载系统中一种新型的导向载体.
2014年,Majeed等[19]报道了利用DDT-PMAA聚合物配体成功合成表面附有硫醚和羧酸官能团的磁性纳米粒子,并将其用作负载药物阿霉素的药物载体.2016年, 彭娜等[20]用海藻酸修饰合成了具有磁靶向功能的超顺磁性四氧化三铁纳米粒子(SPIONs-4).该SPIONs-4纳米粒子对抗癌药物具有高达48.98%的载药量,同时在酸性环境下能够有效的释放出药物,是一个很好的抗肿瘤化疗载体.2016年,吴娟等[21]利用聚丙烯酸成功合成了具有良好的稳定性、较高的超顺磁性以及pH响应性的磁性纳米粒子,其高达88.1%的负载效率表明该纳米粒子可以用作pH和磁靶向双功能的抗癌药物载体.

Pala等[22]用右旋糖苷修饰的Fe3O4纳米粒子跟特异性的反人类表皮生长因子受体(HER2)适体结合,在过表达HER2受体的人类腺癌SK-BR3细胞簇和不表达人HER2受体的类胶质母细胞瘤上皮细胞簇上进行磁流体热疗,结果表明即使在低浓度下该纳米粒子对过表达HER2受体的人类腺癌SK-BR3细胞簇有着更高的靶向杀死细胞的能力.Kruse等[23]设计了用自导引肿瘤的多肽与Fe3O4纳米粒子结合,从而进行肿瘤的定位,同时利用磁介导产生的热量对肿瘤部位进行治疗,显示较好的靶向定位和治疗的功能.
1.2.3 基因载体 磁性Fe3O4纳米粒子也可作为一个模板用于基因运载,这一过程又可称为磁转染.其主要是通过磁场将DNA、AODN和siRNA等核酸运载到靶向细胞或组织,同时因其MRI的成像能力可以同步监控运载过程及其到达的部位.导入的正常的外源性基因可以用来纠正或补偿因基因的缺陷和异常引起的疾病,从而有效地治疗疾病.
2009年,李文章等[24]利用2-吡咯烷酮和乙酰丙酮铁为原料制备Fe3O4磁性纳米颗粒,以此复合粒子作为传递载体,将CD基因转染U251胶质瘤细胞,并稳定表达.邓迎春等[25]采用碱沉淀法一步合成了外包葡聚糖的磁性纳米粒子,并用多聚赖氨酸对其表面进行修饰,使之通过静电作用吸附连接DNA,该复合纳米粒子能作为一种新型有效的基因载体在体外将载有肺癌耐药基因的质粒转入肺癌细胞系中并成功表达.2012年,李小龙等[26]成功合成一种带有磁性和表面带正电的复合Fe3O4/poly(St-BA-METAC)纳米粒子.据其研究表明该纳米粒子可以通过静电相互作用与DNA反应,进而能够用作靶向基因载体. 如图3所示为纳米四氧化三铁与基因载体作用的机理示意图.
1.3 作为诊疗一体化载体应用的磁性Fe3O4纳米粒子 随着纳米和生物科技的交叉发展,在单一纳米系统中构建集多种功能或性质于一体的多功能性的复合纳米载体,形成诊疗一体化系统或者多模式成像系统已成为当下全新的研究热点.据以上所知,磁性Fe3O4纳米粒子因其固有的磁性性质,不仅可以对外加的交变磁场作出响应同时也可以产生热量,因此是一个较好的诊疗一体化的载体试剂[4],如图4所示.磁性纳米粒子是成像和治疗领域非常有力的平台材料. 多模态靶向成像,介导运输,可控释放以及热治疗的治疗手段,使用磁性纳米粒子都可以得到实现.[4]
2012年,李小龙等[28]用含氟的两亲性聚合物胶束poly(HFMA-g-PEGMA)修饰油酸稳定的Fe3O4纳米粒子,并进一步探讨了该磁力胶束作为药物载体和MRI造影剂的可能性.其良好的稳定性、生物适应性和较高的T2弛豫证明其有用作药物载体和MRI造影剂的巨大潜力.2013年,王慧等[29]在多孔PEG封装Fe3O4的核-壳纳米粒子上设计合成了多功能型的Fe3O4@Ag-PEG复合纳米粒粒子.这一复合纳米粒子不仅具备了Fe3O4纳米粒子应对外磁场快速响应的能力,而且也拥有Ag纳米晶体的较高的抗菌效果和强荧光特性,能够克服细胞屏障进入细胞内区域进行细胞成像同时利用多孔的PEG壳跟药物的结合能力作为光热/化学治疗试剂的载体,显示出良好的协同效应,在生物医药领域有着较大的应用潜力.2016年,邓瑶瑶等[30]合成了复合的Pt@Fe2O3纳米棒,经3,4-二羟基苯基丙酸修饰之后形成水溶性的核-壳纳米棒.该复合的核-壳纳米棒有着良好的光热稳定性并对癌细胞展现出良好的光热治疗效应,而且在X线辐射下,该纳米棒产生对光热治疗和辐射治疗的协同效应以产生更好的治疗效果.Kostevsek等[31]通过一个简单新颖的方法合用天然的高生物适应的壳聚糖为基质的聚合物来修饰哑铃型的Au/ Fe3O4纳米粒子,经证明该多成分的纳米系统可以用作无创的光声成像(PAI)的造影剂和作为一个纳米热源用于光热分析疗法(PTT).
2 展望
磁性四氧化三铁纳米粒子作为一种诊断试剂不仅可以提供实时的图像和造影效果,还可以跟其他的药物分子、靶向分子等治疗试剂结合,构建集诊断、治疗功能于一体的多模式成像系统和多功能型探针,在获取更多精确信息的同时提高临床疗效、降低毒副作用并减少病患痛苦.在这一过程中,有很多关键屏障问题需要解决:如何通过合适的化学方法调控粒子的形貌、尺寸、单分散性及稳定性;如何深入了解磁性纳米粒子和细胞之间的作用机制;如何探寻磁性纳米粒子在体内的潜在毒性、分布及其在体内的吸收、代谢、排泄途径等. 我们期待通过化学、材料学、生物学、药理学等各领域研究人员的共同努力,克服以上屏障,推动磁性四氧化三铁纳米粒子作为诊疗试剂的研究进展.
[1] 乔瑞瑞, 曾剑锋, 贾巧娟, 等. 磁性氧化铁纳米颗粒——通向肿瘤磁共振分子影像的重要基石[J]. 物理化学学报, 2012, 28(5): 993-1011.
[2] Ren X, Chen H, Yang V, et al. Iron oxide nanoparticle-based theranostics for cancer imaging and therapy[J]. Frontiers of Chemical Science and Engineering, 2014, 8(3):253-264.
[3] Hola K, Markova Z, Zoppellaro G, et al. Tailored functionalization of iron oxide nanoparticles for MRI, drug delivery, magnetic separation and immobilization of biosubstances[J]. Biotechnology advances, 2015, 33(6):1162-1176.
[4] Lee N, Yoo D, Ling D, et al. Iron oxide based nanoparticles for multimodal imaging and magnetoresponsive therapy[J]. Chem Rev, 2015, 115(19):10637-10689.
[5] Sharifi S, Seyednejad H, Laurent S, et al. Superparamagnetic iron oxide nanoparticles for in vivo molecular and cellular imaging[J]. Contrast media & molecular imaging, 2015, 10(5):329-355.
[6] Mahmoudi M, Sahraian M A, Shokrgozar M A, et al. Superparamagnetic iron oxide nanoparticles: promises for diagnosis and treatment of multiple sclerosis[J]. Acs Chemical Neuroscience, 2011, 2(3):118-140.[7] Liu T H, Chang G, Cao R J, et al. Applications of superparamagnetic Fe3O4nanoparticles in magnetic resonance imaging[J]. Progress in Chemistry, 2015, 27(5):601-613.
[8] Su H Y, Wu C Q, Li D Y, et al. Self-assembled superparamagnetic nanoparticles as MRI contrast agents-a review[J]. Chinese Physics B, 2015, 24(12).[
9] Yue X-L, Ma F, Dai Z-F. Multifunctional magnetic nanoparticles for magnetic resonance image-guided photothermal therapy for cancer[J]. Chinese Physics B, 2014, 23(4):044301.
[10] Chu X, Yu J, Hou Y L. Surface modification of magnetic nanoparticles in biomedicine[J]. Chinese Physics B, 2015, 24(1):1-8.
[11] Muthiah M, Park I K, Cho C S. Surface modification of iron oxide nanoparticles by biocompatible polymers for tissue imaging and targeting[J]. Biotechnology advances, 2013, 31(8):1224-1236.
[12] Na H B, Song I C, Hyeon T. Inorganic nanoparticles for MRI contrast agents[J]. Advanced Materials, 2009, 21(21):2133-2148.
[13] Zhu H, Tao J, Wang W H, et al. Magnetic, fluorescent, and thermo-responsive Fe3O4/rare earth incorporated poly(St-NIPAM) core-shell colloidal nanoparticles in multimodal optical/magnetic resonance imaging probes[J]. Biomaterials, 2013, 34(9):2296-2306.
[14] Gong Y, Dai J W, Li H, et al. Magnetic, fluorescent, and thermo-responsive poly(MMA-NIPAM-Tb(AA)(3)Phen)/Fe3O4multifunctional nanospheres prepared by emulsifier-free emulsion polymerization[J]. Journal of Biomaterials Applications, 2015, 30(2):201-211.
[15] Li H, Yan K, Shang Y L, et al. Folate-bovine serum albumin functionalized polymeric micelles loaded with superparamagnetic iron oxide nanoparticles for tumor targeting and magnetic resonance imaging[J]. Acta biomaterialia, 2015, 15:117-126.
[16] Yan K, Li H, Li P H, et al. Self-assembled magnetic fluorescent polymeric micelles for magnetic resonance and optical imaging[J]. Biomaterials, 2014, 35(1):344-355.
[17] Zhang L, Liang S, Liu R Q, et al. Facile preparation of multifunctional uniform magnetic microspheres for T-1-T-2 dual modal magnetic resonance and optical imaging[J]. Colloids and Surfaces B-Biointerfaces, 2016, 144:344-354.
[18] Wang X, Tu M Q, Yan K, et al. Trifunctional polymeric nanocomposites incorporated with Fe3O4/iodine-containing rare earth complex for computed X-ray tomography, magnetic resonance, and optical imaging[J].ACS Appl Mater Interfaces, 2015, 7(44):24523-24532.
[19] Majeed M I, Lu Q, Yan W, et al. Highly water-soluble magnetic iron oxide(Fe3O4) nanoparticles for drug delivery: enhanced in vitro therapeutic efficacy of doxorubicin and MION conjugates[J]. Journal of Materials Chemistry B, 2013, 1(22):2874.
[20] Peng N, Wu B, Wang L, et al. High drug loading and pH-responsive targeted nanocarriers from alginate-modified SPIONs for anti-tumor chemotherapy[J]. Biomater Sci, 2016, 4(12):1802-1813.
[21] Wu J, Shen Y, Jiang W, et al. Magnetic targeted drug delivery carriers encapsulated with pH-sensitive polymer: synthesis, characterization and in vitro doxorubicin release studies[J]. Journal of Biomaterials Science-Polymer Edition, 2016, 27(13):1303-1316.
[22] Pala K, Serwotka A, Jelen F, et al. Tumor-specific hyperthermia with aptamer-tagged superparamagnetic nanoparticles[J]. International journal of nanomedicine, 2014, 9:67-76.
[23] Kruse A M, Meenach S A, Anderson K W, et al. Synthesis and characterization of CREKA-conjugated iron oxide nanoparticles for hyperthermia applications[J]. Acta biomaterialia, 2014, 10(6):2622-2629.
[24] 李文章,李洁,谭泽明. 用于体外基因转染的氨基硅烷Fe3O4复合纳米粒子的合成及表征[J].高等化学学报,2009,30(12):2331-2336.
[25] 邓迎春,张志培,程庆书,等.功能化Fe3O4的制备及在基因转染中的应用[J].生物医学工程与临床,2009,13(1):62-66.
[26] Li X L, Liu G Q, Yan W, et al. Preparation of Fe3O4/poly(styrene-butylacrylate- 2-(methacryloxy) ethyl trimethylammoniumchloride) byemulsifier-free emulsion polymerization and its interaction with DNA[J]. Journal of Magnetism and Magnetic Materials, 2012, 324(7):1410-1418.
[27] Kievit F M, Zhang M Q. Surface Engineering of Iron Oxide Nanoparticies for Targeted Cancer Therapy[J]. Accounts of chemical research, 2011, 44(10):853-862.
[28] Li X L, Li H, Liu G Q, et al. Magnetite-loaded fluorine-containing polymeric micelles for magnetic resonance imaging and drug delivery[J]. Biomaterials, 2012, 33(10):3013-3024.
[29] Wang H, Shen J, Cao G X, et al. Multifunctional PEG encapsulated Fe3O4@silver hybrid nanoparticles: antibacterial activity, cell imaging and combined photothermo/chemo-therapy[J]. Journal of Materials Chemistry B, 2013, 1(45):6225-6234.
[30] Deng Y, Li E, Cheng X, et al. Facile preparation of hybrid core-shell nanorods for photothermal and radiation combined therapy[J]. Nanoscale, 2016, 8(7):3895-3899.
[31] Kostevsek N, Locatelli E, Garrovo C, et al. The one-step synthesis and surface functionalization of dumbbell-like gold-iron oxide nanoparticles: a chitosan-based nanotheranostic system[J]. Chem Commun, 2016, 52(2):378-381.
(责任编辑 胡小洋)
Research on magnetic iron oxide nanoparticles for theranostics
YAN Wei, GUO Jiaojiao, XIANG Chenyang, MO Kangwei, XU Zushun
(Ministry of Education Key Laboratory for The Green Preparation and Application of Functional Material,Hubei Collaborative Innovation Center for Advanced Organic Chemical Materials, Faculty of Materials Science and Engineering, Hubei University, Wuhan 430062, China)
In the past few decades, there has been rapid progress in the research of nanoparticles in biomedicine field. Among the various of nanoparticles, magnetic iron oxide(Fe3O4) nanoparticles have attracted much attention in the world due to their large surface area, low toxicity and excellent biocompatibility. With the surface modification and the corresponding behavior in vivo, magnetite(Fe3O4) nanoparticles show great application values, which has become one of the most successful use of magnetic nanoparticles in biomedical applications.We briefly summarized the present progress of the research of Fe3O4nanoparticles used as the diagnostic reagents, drug carrier and theranostic reagents,and gave an outlook about the future of magnetic iron oxide.Key words: magnetic iron oxide; theranostic regent; diagnostic reagents; drug carrier; theranostic reagents
2017-02-26
湖北省教育厅科研项目(Q20141006)资助
严微(1976-),女,博士,副教授,研究方向:生物医用材料的研究
1000-2375(2017)03-0317-06
R318.08
A
10.3969/j.issn.1000-2375.2017.03.018

