新型L-色氨酸分离纯化连续色谱工艺的研究
沈春娟,沈 泉,赵黎明
(1.诺华赛分离技术(上海)有限公司,上海 201203; 2.复旦大学生命科学学院,上海 200433; 3.华东理工大学生物工程学院,上海 200237)
新型L-色氨酸分离纯化连续色谱工艺的研究
沈春娟1,2,3,沈 泉1,赵黎明3,*
(1.诺华赛分离技术(上海)有限公司,上海 201203; 2.复旦大学生命科学学院,上海 200433; 3.华东理工大学生物工程学院,上海 200237)
L-色氨酸发酵液的分离纯化是决定L-色氨酸生产成本和产品质量的重要因素,本研究旨在建立一种新型L-色氨酸连续色谱分离工艺,以降低L-色氨酸分离纯化成本,提高L-色氨酸的收率。通过单柱实验进行色谱填料筛选,并对L-色氨酸在不同树脂上吸附性能进行研究。结果表明,L-色氨酸在Applexion XA2014-22树脂上的动态载样量最高,达120 g/L树脂,确定以氨水为洗脱液,进行顺序式模拟移动床分离以后,L-色氨酸的纯度从30%提纯到80%左右,L-色氨酸收率达到99%,谷氨酸的去除率达到100%。本研究所得L-色氨酸发酵液分离提纯工艺和传统离子交换工艺相比,操作更为简单,产品纯度更高,能够有效降低工业化L-色氨酸生产成本,具有应用推广价值。
L-色氨酸,顺序式模拟移动床,吸附,收率
色氨酸又名2-氨基-3-吲哚基丙酸,是一种芳香族、杂环、非极性α-氨基酸,其结构式如图1所示。有D-、L-色氨酸两种异构体,天然存在的色氨酸均为L-型。L-色氨酸(L-tryptophan,Trp)是一种重要的营养必需氨基酸,人和动物自身不能合成,只能通过食物来摄取[1]。L-色氨酸又被称为第二必需氨基酸,目前广泛应用于医药、食品、饲料添加剂以及农业环境检测等行业。近年来,随着对L-色氨酸生理功能了解和科学研究的不断深入,L-色氨酸的应用越来越广泛,世界上对其需求量也越来越大。目前,L-色氨酸最大的应用市场为氨基酸饲料添加剂,是继蛋氨酸和赖氨酸之后的第三大饲料添加氨基酸[2]。
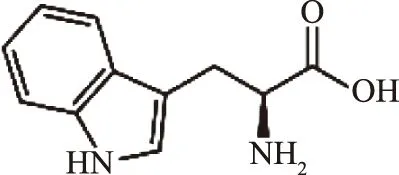
图1 L-色氨酸的化学结构式Fig.1 Structure of L-tryptophan
随着L-色氨酸发酵水平的不断提高,发酵成本大大降低,发酵液后续的分离纯化成为决定生产成本的重要因素,下游分离成本可以占到总成本的50%~80%以上[3]。目前,离子交换法是从发酵液中提纯L-色氨酸的主流方法。然而离子交换均为单柱间歇操作,树脂利用率低,对L-色氨酸的吸附量一般在64~90 g/kg树脂范围,且离子交换工艺一般包括进样、纯水洗杂、0.2~0.5 mol/L低浓度氨水洗杂(如L-谷氨酸杂质)、2 mol/L高浓度氨水解析L-色氨酸和水洗等步骤,工艺步骤繁琐,对L-色氨酸解吸缺乏精确控制,存在解吸拖尾现象,解吸收率徘徊在93%~95%,洗脱剂消耗大,增加了L-色氨酸的生产成本,而低浓度氨水洗杂去除谷氨酸步骤要严格控制洗脱时间以及出料pH,因此对于L-谷氨酸的去除率并不高,而且该步骤也会伴随L-色氨酸的损失。
模拟移动床(Simulated Moving Bed,SMB)色谱分离技术是20世纪60年代发展起来的一种现代化分离技术,将若干根色谱柱串联在一起,每根色谱柱均设有物料的进出口,并通过操作开关阀组沿着流动相的循环流动方向定时切换,从而周期性改变物料的进出口位置,以此来模拟固定相与流动相之间的逆流移动,实现组分之间的连续分离[7-8]。SMB具有分离能力高、能耗低、总柱效高、流动相耗量少等优点,广泛应用于石油、精细化工、制糖、食品等领域,近年来更是在手性药物、有机酸和氨基酸等生化产品的分离中得到广泛应用[9]。模拟移动床色谱技术广泛应用于赖氨酸、苯丙氨酸和缬氨酸等氨基酸产品的分离和精制[10]。万红贵等采用模拟移动床技术分离缬氨酸和丙氨酸,得到纯度为98.6%缬氨酸和82.9%丙氨酸[11]。吴昊等通过用模拟移动床色谱技术分离L-苯丙氨酸,其收率大于97.6%,对天冬氨酸也有很高的去除率,并将该技术应用到L-苯丙氨酸工业化生产[12]。
本研究旨在筛选不同的树脂和工艺条件,以水或其他水溶液作为洗提液,开发出L-色氨酸分离纯化色谱工艺,并采用顺序式模拟移动床技术进行L-色氨酸连续色谱分离,以减少传统工艺过程中的酸碱消耗和水耗,寻求更加绿色环保的工艺路线,降低工业化L-色氨酸生产成本,取代传统离子交换工艺,推动我国L-色氨酸生产技术的进步。
1 材料与方法
1.1 材料与仪器
L-色氨酸发酵液、离子交换法纯化后产品溶液 由伊品生物公司提供,发酵液中L-色氨酸浓度为15~20 g/L,主要杂质为L-谷氨酸、无机盐、糖、蛋白质、色素等,纯度为30%;Applexion XA2014-22和Applexion XA2043苯乙烯系强酸性阳离子交换树脂 Novasep Process公司;XAD1600大孔吸附树脂 陶氏化学有限公司;氨水 分析纯,中国医药集团上海化学试剂公司;HPLC级甲醇及乙腈 迪马科技有限公司。
小型模拟移动床系统 配置6~10根2.6 cm×100 cm层析柱,循环泵、原料泵、洗脱剂泵,流量计,温度控制系统,不锈钢储罐,软件控制系统以及相应的进口和出口阀门和管路,由诺华赛分离技术有限公司提供;ORION 013005MD电导率仪、LE438 PH计 梅特勒;2695系列高效液相色谱仪 美国Waters;ICS2100离子色谱仪 赛默飞世尔。
1.2 检测方法
L-色氨酸浓度分析采用高效液相色谱法,色谱分离柱:YMC-Pack Pro C18 S-5 μm,12 nm,4.6 mm×250 mm,流动相:50 mmol/L磷酸二氢钾,10%甲醇溶液,流速:1 mL/min,柱温:40 ℃,检测波长:278 nm[13]。
L-谷氨酸浓度分析采用Waters AccQ·Tag柱前衍生法氨基酸分析试剂盒进行样品处理,以及HPLC分析柱检测。色谱分离柱:Nova-Pak C18 4 μm×3.9 mm×150 mm;流动相A:AccQ·Tag试剂盒提供;流动相B:60%乙腈,梯度AccQ·Tag试剂盒提供;流速:1 mL/min;柱温:37 ℃;检测波长:254 nm。
1.3 单柱实验
1.3.1 分离条件筛选 L-色氨酸侧链带有苯环结构,易和离子交换树脂的骨架结合,用纯水无法将色氨酸从树脂上解析下来,因此本实验设计阴离子树脂采用酸作为洗提液,而阳离子树脂采用碱作为洗提液。
将460 mL阳离子交换树脂Applexion XA2041-NH4以及阴离子交换树脂Applexion XA3114-SO4分别装填于2.6 cm×100 cm玻璃柱内,分别用2 g/L氨水和2 g/L硫酸洗提液平衡阳离子及阴离子交换树脂,然后将60 mL L-色氨酸发酵液注入色谱柱内,最后用洗提液洗脱。20 mL/管收集流出液,并分别对所收集样品进行pH、电导率以及L-色氨酸浓度检测,并绘制各组分在两种不同树脂上的分离曲线。对比L-色氨酸和无机盐(以硫酸铵为主)在树脂上的分离度,选择最佳分离介质和洗提液。
式(1)
式中,R为分离度,TRT:L-Trp的保留时间,TRS:盐的保留时间,WT和WS分别代表L-Trp和盐份的峰宽。
1.3.2 树脂筛选 将型号为Applexion XA2043、Applexion XA2014-22和R&H XAD1600的3种树脂各取60 mL,分别装填于1.6 cm×40 cm玻璃柱内,并用2 g/L氨水平衡树脂,L-色氨酸发酵液以2 BV/h的流速吸附,当柱底流出液与上柱液浓度一样时停止上样,共上样7~15 BV。30 mL/管收集上样过程中的流出液,并分别对所收集样品进行pH、电导率和L-色氨酸浓度检测,绘制各组分在三种不同树脂上的吸附曲线,并计算L-色氨酸动态载样量,选择最佳的树脂。
式(2)

DBC=VBT×C0
式(3)
式中,DBC为L-Trp动态吸附载量(g/L),VBT:穿透体积(BV),C0:粗品中L-色氨酸的浓度(g/L)。
1.3.3 L-色氨酸和L-谷氨酸的分离 采用上述实验筛选得到的树脂和洗提液,上样体积17 BV后用10 BV洗提液洗脱,观察L-色氨酸和L-谷氨酸在树脂上的吸附解析行为。
1.4 顺序式模拟移动床分离纯化L-色氨酸
1.4.1 顺序式模拟移动床实验设计 顺序式模拟移动床技术(SSMB)是在传统模拟移动床色谱(SMB)的基础上进行了改进。SSMB是一种间歇顺序操作的模拟移动床,采用了间歇进料、间歇出料的不同顺序及连续分离等不同程序的运行模式,将传统SMB的每一步均分为3~4个子步骤进行,见图2所示。
分步1:物料循环——没有进料出料,物料在树脂内循环移动,各组分在该步骤进一步分离但没有洗提液消耗。
分步2:进料——物料由FZ3进入柱内,残液由FZ3出料,物料在该步骤吸附并收集已分离的纯弱吸附组分。
分步3:提取液收集——洗提液由FZ1进入,提取液由FZ1收集,收集纯强吸附组分。分步2和3同时进行以提高产能。该步骤进行时,FZ2和FZ4无任何操作。
分步4:残液收集——洗提液由FZ1进入,残液由FZ3排出并收集。该步骤下,FZ4无任何操作。
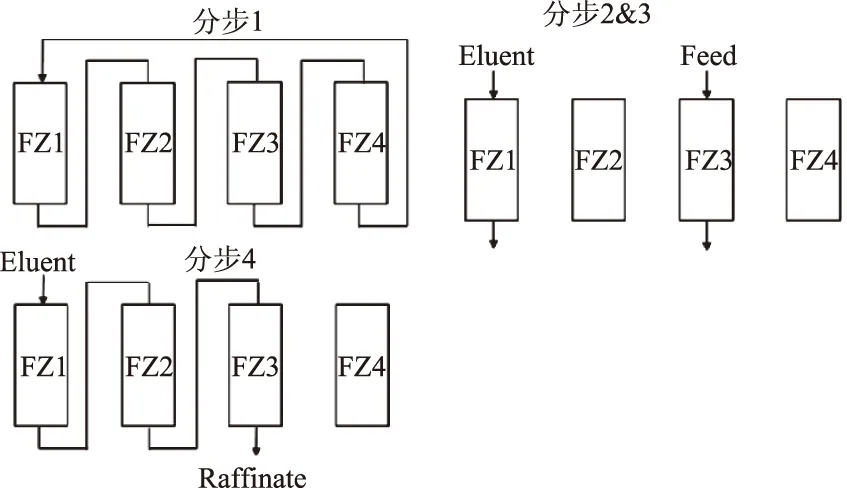
图2 SSMB每个周期的运行步骤Fig.2 SSMB steps for each period
1.4.2 SSMB分离L-色氨酸实验 顺序式模拟移动床系统恒温控制在60 ℃,包括色谱柱、原料罐和洗脱剂罐。原料泵连续把原料罐中的L-色氨酸发酵液和洗脱液泵将洗脱罐的洗脱剂氨水通过柱位阀的切换连续泵入到色谱柱的不同部位,提纯后的L-色氨酸溶液和剩余液分别从不同色谱柱的出口阀连续流出[14]。测定收集得到的提取液和剩余液中干物质、pH、电导率、L-谷氨酸及色氨酸浓度,并计算色氨酸收率和L-谷氨酸的去除率以及色谱纯化后L-色氨酸纯度(质量含量)。
式(4)
式中,RECT为L-Trp收率(%),CTEXT:提取液中L-色氨酸浓度(g/L),VEXT:提取液体积(L),CTRAF:剩余液中L-色氨酸浓度(g/L),VRAF:剩余液体积(L)。
式(5)
式中,REMG为L-Glu去除率(%),CGEXT:提取液中L-谷氨酸浓度(g/L),VEXT:提取液体积(L),CGRAF:剩余液中L-谷氨酸浓度(g/L),VRAF:剩余液体积(L)。
式(6)
式中,PT为L-Trp纯度即质量含量(%),CTEXT:提取液中L-色氨酸浓度(g/L),DSEXT:提取液干基含量(%),DEXT:提取液密度(g/mL)。
实验共采用9根直径为2.6 cm的层析柱,树脂装填高度为95 cm,温度恒定在60 ℃,树脂采用阳离子交换树脂Applexion XA2014-22,洗提液为2 g/L氨水。L-色氨酸发酵液中L-色氨酸浓度为15~20 g/L。
2 结果和分析
2.1 单柱实验
2.1.1 分离条件筛选 从图3和图4中可以看出,L-色氨酸在阳离子交换树脂(保留时间为1.6 BV)上吸附强于阴离子交换树脂(保留时间为0.7 BV),这主要因为L-色氨酸侧链基团苯环和苯乙烯系阳离子交换树脂骨架有很强的疏水作用力,而与聚丙烯酸阴离子交换树脂骨架吸附比较弱。无机盐在阴离子交换树脂和阳离子交换树脂上都以离子形式被排斥而很快从树脂上洗脱下来,其保留时间在两种树脂上均为0.5 BV。虽然L-色氨酸和盐分在以硫酸为洗提液的阴离子交换树脂Applexion XA3114-SO4上有一定的分离,但L-色氨酸与盐分分离度R(如表1所示)为0.401,远小于在阳离子交换树脂上的分离度1.503。因此将聚苯乙烯系强阳离子交换树脂选为L-色氨酸色谱分离树脂,氨水作为洗提液。

图3 L-色氨酸和盐份在阴离子交换树脂上的分离曲线图Fig.3 Separation profile for L-Trp and salt on anion resin

图4 L-色氨酸和盐份在阳离子交换树脂上的分离曲线图Fig.4 Separation profile for L-Trp and salt on cation resin

树脂型号洗提液分离度RApplexionXA2043-NH42g/LNH31503ApplexionXA3114-SO42g/LH2SO40401
2.1.2 树脂筛选 图5和表2分别显示了L-色氨酸在不同树脂上的吸附动力学曲线和L-色氨酸的动态吸附载量,可以看出,L-色氨酸在强酸性树脂Applexion XA2014-22上流穿体积最大动态载样量最高,达到120 g Trp/L树脂。而在吸附树脂XAD1600和阳离子交换树脂Applexion XA2043动态吸附载量仅为50~60 g Trp/L树脂。因此选择Applexion XA2014-22树脂为最佳后续实验工作树脂。
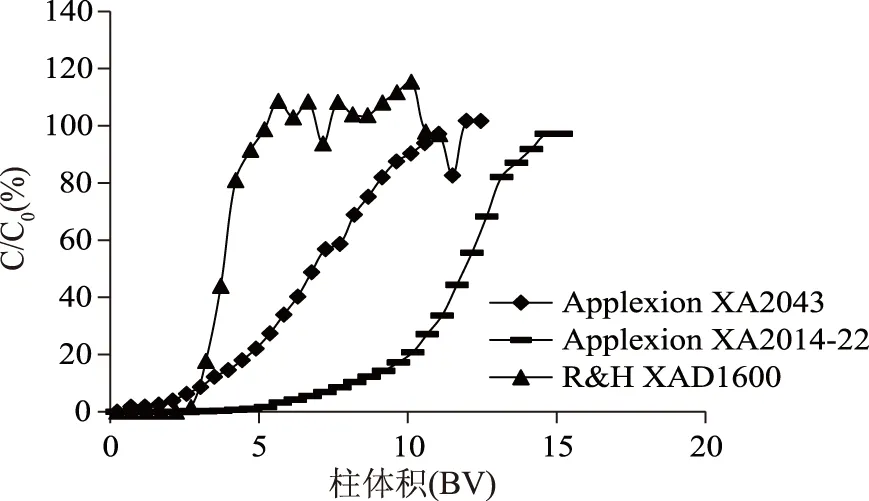
图5 L-色氨酸在不同树脂上的吸附动力学曲线Fig.5 Dynamic absorption profile for L-Trp on different resins

树脂名穿透体积(BV)L-色氨酸动态吸附量(g/L树脂)ApplexionXA2043~2550ApplexionXA2014-22~6120R&HXAD1600~360
2.1.3 L-色氨酸和L-谷氨酸分离 从图6所示的吸附曲线上可以看出,色氨酸在5 BV的时候开始流穿,而谷氨酸在1 BV的时候开始流穿、2 BV时已经接近样品中的初始值,这说明在本实验条件下谷氨酸在树脂上的吸附能力远低于色氨酸。从图6中可以看出,在解析部分,基本没有谷氨酸被洗脱下来,这说明谷氨酸没有吸附到树脂上。L-谷氨酸有一个α氨基、一个α羧基和一个侧链羧基,α羧基端pKa1为2.1,侧链羧基端pKa2为4.07,氨基端pKa3为9.47,谷氨酸的等电点为3.2。在上样的最初2 BV内,树脂内的pH基本大于谷氨酸的等电点,而且谷氨酸是酸性氨基酸,和树脂的疏水作用力非常弱,因此谷氨酸不能结合到树脂上。
L-色氨酸在强酸性阳离子交换树脂Applexion XA2014-22上动态吸附载量高,主要杂质盐份和L-谷氨酸在树脂上基本没有吸附,和L-色氨酸能达到很好的分离效果。因此选用Applexion XA2014-22阳离子交换树脂作为色谱分离实验的工作树脂。
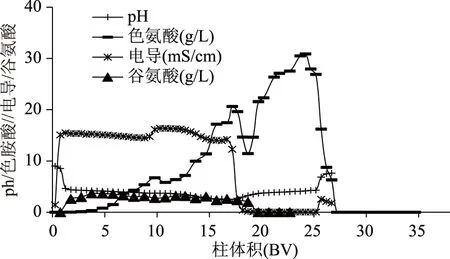
图6 各组分在Applexion XA2014-22树脂上的吸附解析曲线Fig.6 Absorption and desorption profile for each component on Applexion XA2014-22 resin
2.2 顺序式模拟移动床中试实验
在中试实验过程中,优化SSMB色谱运行参数,并在每根柱子的出口端取样分析以绘制各组分在树脂上的分离曲线图,优化后的色谱分离图谱见图7。从图7中可以看出,L-色氨酸与盐及L-谷氨酸有很好的分离效果,L-色氨酸主要分布在FZ1为强吸附组分,L-谷氨酸和盐分布在FZ3为弱吸附组分,而提取液在FZ1收集,剩余液在FZ3收集。因此通过SSMB色谱分离后,可以得到色氨酸富集的提取液以及盐和谷氨酸富集的剩余液,从而达到L-色氨酸提纯的目的。
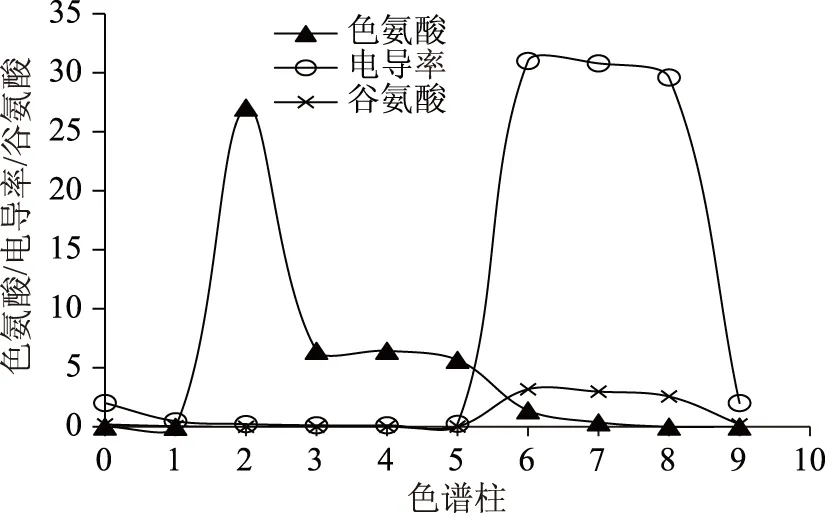
图7 各组分在各个柱子内的分离曲线图Fig.7 Separation profile for each component on columns
SSMB色谱分离实验收集得到的提取液与由离子交换法制备得到的样品进行比较,结果如表3所示。通过SSMB分离以后,L-色氨酸的纯度(质量含量)从30%提纯到80%左右,纯度略高于离子交换法制备得到的产品,pH和电导率均明显底于离子交换法制备得到的产品。尤其是pH和电导率远低于离交样品,其主要原因是离交样品中有过量的氨水,因此在工业生产中,离子交换后的样品都需要进行脱氨除去多余的氨再结晶,否则会影响结晶的收率。
此外采用SSMB连续色谱法L-色氨酸收率达到99%,高于93%~95%离交收率。L-谷氨酸去除率达到100%,高于离交法。总的来说SSMB色谱分离得到的L-色氨酸产品质量及收率明显优于离子交换法得到的产品质量,SSMB色谱法氨水消耗量也低于离子交换法。

表3 SSMB及离子交换法分离得到L-色氨酸产品分析结果Table 3 Analytical result for product purified by SSMB and IEX
3 结论
本文首次利用芳香族氨基酸——L-色氨酸α-氨基的离子交换性能以及侧链基团上苯环的疏水性能共同作用,以氨水作为洗提液,筛选得到了一种对L-色氨酸有很强的吸附作用力而对L-谷氨酸基本没有吸附能力的树脂,并且采用连续色谱分离模式——连续上样、连续洗脱提纯L-色氨酸,获得良好的分离效果。从实验结果来看,色谱工艺纯化得到的L-色氨酸产品质量明显优于离交产品,收率比离交工艺高5%~7%,而氨水消耗低于离交工艺,此外色谱工艺得到的L-色氨酸产品不需要额外的脱氨步骤。采用SSMB技术进行连续分离提纯,该工艺只采用一种洗提液进行L-色氨酸吸附解析,和传统离子交换繁琐的工艺步骤相比,工艺操作更为简单。因此色谱工艺无论从工艺操作和控制的复杂性以及产品质量和运行成本都优于传统离子交换工艺,作为L-色氨酸分离纯化的新型工艺可以取代传统离交工艺,降低L-色氨酸工业化生产成本。
[1]杨会琴.L-色氨酸生物技术研究进展[J].食品科学,2007,28(9):630-632.
[2]陈荣庆,刘伟,皮雄娥,等.L-色氨酸的研究进展[J].安徽农业科学,2014,42(14):4438-4440,4443.
[3]王健.直接发酵法生产L-色氨酸的研究[D].天津:天津科技大学,2004.
[4]徐琪寿.发酵液中L-色氨酸的提取[J].氨基酸杂志(现刊名:氨基酸和生物资源),1978(2):11-14.
[5]梅丛笑,王福荣.L-色氨酸提取工艺的研究[D].天津:天津轻工业学院,2000.
[6]武彩莲,郭长江,杨继军,等.发酵液中L-色氨酸分离纯化工艺研究[J].氨基酸和生物资源,2007,29(3):42-46.
[7]周日尤.模拟移动床分离技术的发展和应用[J].中国食品添加剂,2010(5):182-186.
[8]Imamoglu S. Simulated moving bed chromatography(SMB)for application in bioseparation[J].Adv Biochem Eng Biotechno,2002(76):211.
[9]Wu D J,Xie Y,Ma Z,et al. Design of simulated moving bed chromatography for amino acid separations[J].Industry,Engineering and Chemistry Research,1998,37(10):4023-4035.
[10]孙菲菲,崔波,张晓旭.模拟移动床色谱(SMB)技术在食品工业中的应用[J].中国食品添加剂,2011(3):201-205.
[11]万红贵,方煜宇,叶慧.模拟移动床技术分离缬氨酸和丙氨酸[J].食品与发酵工业,2005,31(12):50-53.
[12]吴昊,韦萍,万红贵,等.模拟移动床连续分离L-苯丙氨酸的研究[J].食品科学,2007,28(4):64-68.
[13]贺希娜. 发酵液中色氨酸的分离纯化研究[D]. 福建:福建师范大学,2013.
[14]诺瓦塞普工艺公司.用于提纯芳香族氨基酸的方法:中国,201410274032.0[P].2015-7-8.
Study on innovated continuous chromatographic process to separate L-tryptophan
SHEN Chun-juan1,2,3,SHEN Quan1,ZHAO Li-ming3,*
(1.Novasep Asia Co.,Ltd.,Shanghai 201203,China; 2.School of Life Science,Fudan University,Shanghai 200433,China; 3.School of Bioengineering,East China University of Science and Technology,Shanghai 200237,China)
The separation and purification of L-tryptophan fermentation broth is an important factor forthe production cost of L-tryptophan industry.This study is aiming to develop an innovative chromatographic process to isolate L-tryptophan from fermentation broth in order to reduce the purification cost and increase the recovery of L-tryptophan. Continuous chromatographic process for L-tryptophan separation was set up by use of resin screening and sequential simulated moving bed(SSMB)technology. Based on dynamic capacity of L-tryptophan on different resin,cation IEX resin of Applexion XA2014-22 was selected as the best one with dynamic capacity of 120 g L-Trp/L resin. After SSMB separation,80% purity of L-tryptophan was obtained starting from 30% purity of raw material with selected resin and eluent by elution test. The final yield of L-tryptophan reached 99%,and all of the glutamic acid of raw material was removed.Compared with the traditional ion exchange process,this study provided an effective and economical technology for the separation and purification of L-tryptophan in industrial production.
L-tryptophan;sequential simulated moving bed;absorption;recovery
2016-10-11
沈春娟(1977-),女,硕士,研究方向:分离纯化,E-mail:sanndy.SHEN@novasep.com。
*通讯作者:赵黎明(1977-),男,博士,教授,研究方向:分离纯化技术、食品加工技术,E-mail:zhaoliming@ecust.edu.cn。
TS201.1
B
1002-0306(2017)08-0290-05
10.13386/j.issn1002-0306.2017.08.048

