母猪妊娠末期背膘厚度对产仔性能和胎盘脂质氧化代谢的影响
徐 涛 周远飞 蔡安乐 吴英慧 彭 健,2*(.华中农业大学动物科技学院,武汉430070;2.生猪健康养殖协同创新中心,武汉430070)
母猪妊娠末期背膘厚度对产仔性能和胎盘脂质氧化代谢的影响
徐 涛1周远飞1蔡安乐1吴英慧1彭 健1,2*
(1.华中农业大学动物科技学院,武汉430070;2.生猪健康养殖协同创新中心,武汉430070)
本试验旨在探讨母猪妊娠末期背膘厚度对产仔性能和胎盘脂质氧化代谢的影响,以探索母猪妊娠期脂肪沉积与繁殖性能的关系。本试验度量了846头经产大白母猪妊娠第109天时的背膘厚度,并分为3组,背膘厚度≤18 mm的为第1组(母猪192头),背膘厚度为19~22 mm的为第2组(母猪265头),背膘厚度≥23 mm的为第3组(母猪389头)。记录母猪分娩后的产仔性能,测定胎盘组织中脂质、氧化产物水平及抗氧化酶活性。结果表明:1)尽管母猪妊娠末期背膘厚度对总产仔数、产活仔数及木乃伊数无显著影响(P>0.05),但显著影响了死胎数、初生窝重、初生头重和胎盘效率(P<0.05)。其中,第2组的初生头重、初生窝重及胎盘效率显著高于其他2组(P<0.05);第2组的死胎数显著低于第1组(P<0.05),与第3组差异不显著(P>0.05)。值得注意的是,母猪妊娠末期背膘厚度显著影响每窝初生重≤0.9 kg的仔猪数和每窝初生重≤1.0 kg的仔猪数(P<0.05),第3组的每窝初生重≤0.9 kg的仔猪数和每窝初生重≤1.0 kg的仔猪数均显著高于其他2组(P<0.05)。2)在第3组的胎盘组织中,不仅甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)及游离脂肪酸(FFA)的水平显著高于其他2组(P<0.05),而且丙二醛(MDA)和活性氧(ROS)水平也显著高于其他2组(P<0.05),同时超氧化物歧化酶(SOD)活性显著低于其他2组(P<0.05)。3)妊娠末期母猪胎盘组织中ROS水平与总产仔数、初生窝重及胎盘效率呈显著负相关(P<0.05),而MDA水平与总产仔数呈显著负相关(P<0.05)。由此可知,母猪妊娠末期背膘厚度与产仔性能密切相关。妊娠末期维持背膘厚度在19~22 mm,母猪可获得较高的产仔性能;背膘厚度≤18 mm时,会增加死胎数;而背膘厚度≥23 mm时,会引起胎盘组织中脂质过度沉积,从而加剧胎盘氧化应激的发生。
妊娠母猪;背膘厚度;产仔性能;胎盘;脂质水平;氧化应激
背膘厚度是反映母猪体况的重要指标。研究表明,母猪体况异常时,常常导致猪出现流产、死胎或宫内发育迟缓(IUGR)[1-2]。胎盘组织是胎儿与母体直接联系的场所,通过运输营养物质、参与母体免疫反应和分泌激素等来维持妊娠及胚胎发育与生长[3-4]。因此,胎盘环境对胎儿的发育状况产生直接影响。已有的研究发现,母体妊娠阶段会伴随氧化应激的发生,并且母体妊娠期肥胖会加剧母体及胎儿体内的氧化应激反应,影响胎儿发育[5-6]。近期研究发现,孕妇肥胖同样会加剧胎盘的氧化应激反应,刺激胎盘组织分泌一系列因子,如自由基、氧化脂质、细胞因子以及可溶性血管内皮生长因子受体等,这些因子在肥胖状态下显著升高,会影响胎盘功能,进而影响胎儿发育[7],并且在羊[8]和狒狒[9]为模型的研究中均发现类似结果。母猪妊娠期体脂状况是调控繁殖性能的关键指标,但目前仅见不同品种的母猪妊娠期体况影响胎盘效率的报道[10],其与胎盘环境的关系还尚未报道。本试验通过研究母猪妊娠末期背膘厚度对产仔性能和胎盘脂质氧化代谢的影响,以期探索母猪妊娠期脂肪沉积与繁殖性能的关系,为养猪实践中合理控制母猪背膘厚度、规范母猪饲养提供参考依据。
1 材料与方法
1.1 试验动物和分组
本试验于2015年8月至2015年11月在湖北省武汉金龙原种猪场进行。选取正常妊娠的经产大白母猪846头,根据妊娠第109天时的背膘厚度分为3个组,背膘厚度≤18 mm的为第1组(母猪192头),背膘厚度为19~22 mm的为第2组(母猪265头),背膘厚度≥23 mm的为第3组(母猪389头)。
1.2 饲养管理
试验母猪按照猪场免疫程序进行常规免疫,自由饮水,母猪在妊娠期每日06:00、14:00各饲喂1次,每日饲喂量为2.0~3.5 kg,在泌乳期每日06:00、11:00、17:00各饲喂1次,每日饲喂量为4.5~6.5 kg,根据剩余料量调整。分娩后仔猪由母猪哺乳。
1.3 样品采集及方法
根据配种记录,记录母猪耳号、品种、胎次及配种公猪品种、耳号。待产母猪提前7 d进入产房,24 h监测,准备接产。
1.3.1 背膘厚度的测定方法
采用美国Renco超声波背膘仪测定母猪妊娠第109天时的背膘厚度,具体方法如下:选定待测母猪,于待测母猪最后肋骨上距背中线6.5~7.0 cm处剪毛,然后涂上液体石蜡,调节好背膘仪,将探头放在剪毛处,待背膘仪稳定读数后记录数据,连续测定3次,取平均值[11]。
1.3.2 样品采集与测定
根据母猪胎次、品种,每组随机采集18~20头母猪胎盘样品。
胎盘样品的采集:母猪分娩时,将排出的胎盘收集称重,记录胎盘个数,并采取脐带周围胎盘样品,立即转入-20 ℃冰箱保存。
产仔性能的测定:记录总产仔数、产活仔数、木乃伊数、死胎数、初生头重及初生窝重,并统计每窝初生重≤0.9 kg的仔猪数和每窝初生重≤1.0 kg的仔猪数。
胎盘效率的计算:初生头重与胎盘重的比值[12]。
1.4 相关指标测定及方法
取0.1 g胎盘放入1 mL生理盐水中匀浆,然后用酶法测定总胆固醇(TC)、甘油三酯(TG)及低密度脂蛋白胆固醇(LDL-C)的水平,用黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)活性,用硫代巴比妥酸法测定丙二醛(MDA)水平,用铁离子法测定总抗氧化能力(T-AOC),用二硫代二硝基苯甲酸法测定谷胱甘肽过氧化物酶(GSH-Px)活性,用钼酸铵法测定过氧化氢酶(CAT)活性,用酶联免疫吸附测定法测定游离脂肪酸(FFA)和活性氧(ROS)的水平。FFA和ROS水平测定所用试剂盒购自湖北骋前生物公司,其他指标测定所用试剂盒购自南京建成生物工程研究所。
1.5 统计分析
利用Excel 2003对收集的数据进行整理,采用SAS 8.0软件的GLM程序进行单因素方差分析,同时采用Pearson法进行相关性分析,显著水平为P<0.05。
2 结果与分析
2.1 母猪妊娠末期背膘厚度对产仔性能的影响
由表1可知,总产仔数、产活仔数及木乃伊数3组之间虽无显著差异(P>0.05),但第1组的死胎数显著高于其他2组(P<0.05),第2组与第3组之间差异不显著(P>0.05)。另外,母猪妊娠末期背膘厚度对仔猪的初生窝重、初生头重、每窝初生重≤0.9 kg的仔猪数和每窝初生重≤1.0 kg的仔猪数均有显著影响(P<0.05)。其中,第2组的初生窝重显著高于第1组(P<0.05),初生头重显著高于其他2组(P<0.05);第3组的每窝初生重≤0.9 kg的仔猪数和每窝初生重≤1.0 kg的仔猪数均显著高于其他2组(P<0.05),其他2组之间差异不显著(P>0.05)。母猪妊娠末期背膘厚度对胎盘重和胎盘效率有显著影响(P<0.05)。其中,第1组与第2组的胎盘重显著低于第3组(P<0.05);胎盘效率3组之间差异显著(P<0.05),以第2组的胎盘效率最高,为4.93,第3组的胎盘效率最低,为4.57。
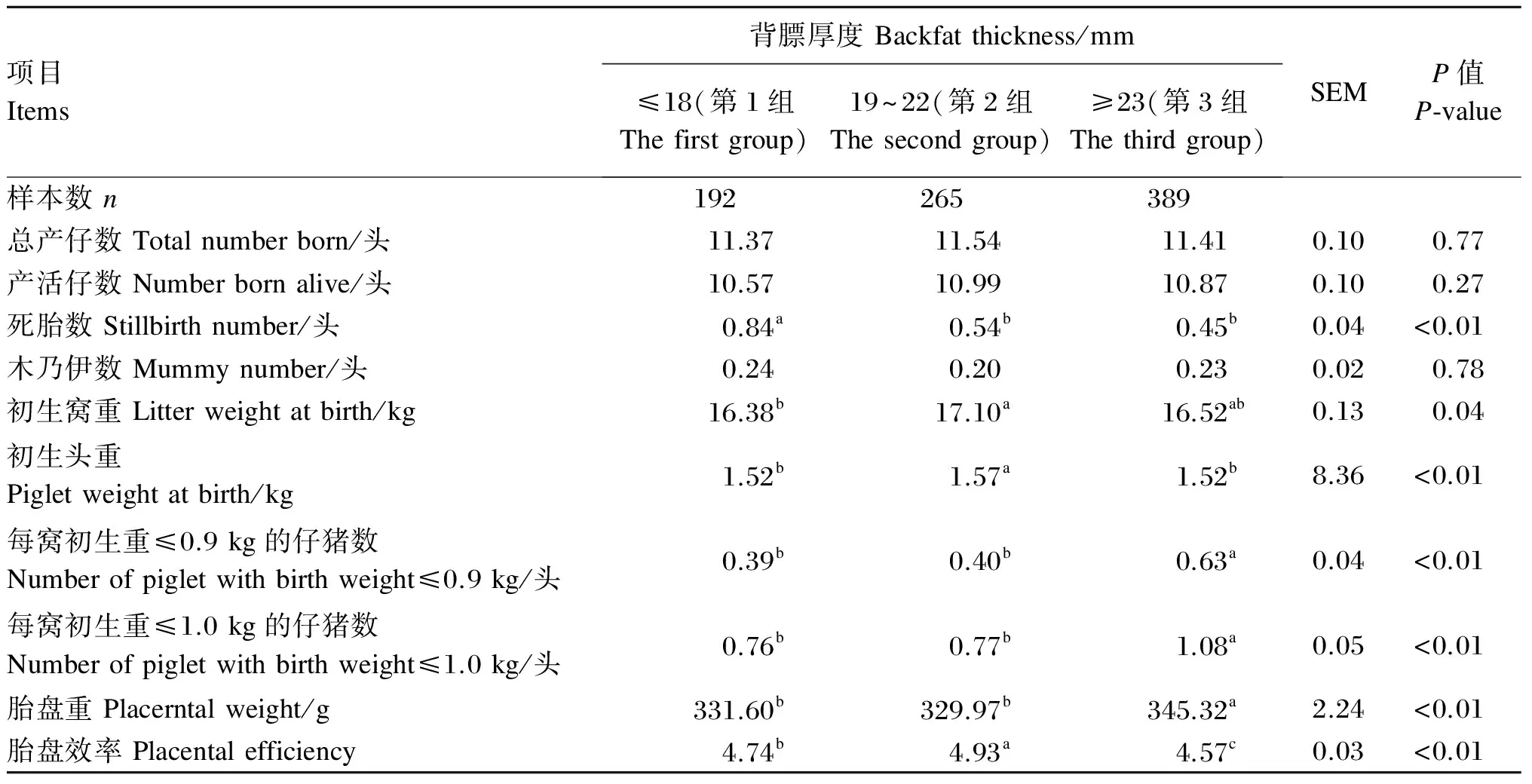
表1 母猪妊娠末期背膘厚度对产仔性能的影响
同行数据肩标无字母或相同字母差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。表2和表3同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as Table 2 and Table 3.
2.2 母猪妊娠末期背膘厚度对胎盘脂质水平的影响
由表2可知,胎盘组织中TC水平3组之间差异不显著(P>0.05),但第3组胎盘组织中TG、LDL-C及FFA水平显著高于其他2组(P<0.05),第1组与第2组之间差异不显著(P>0.05)。
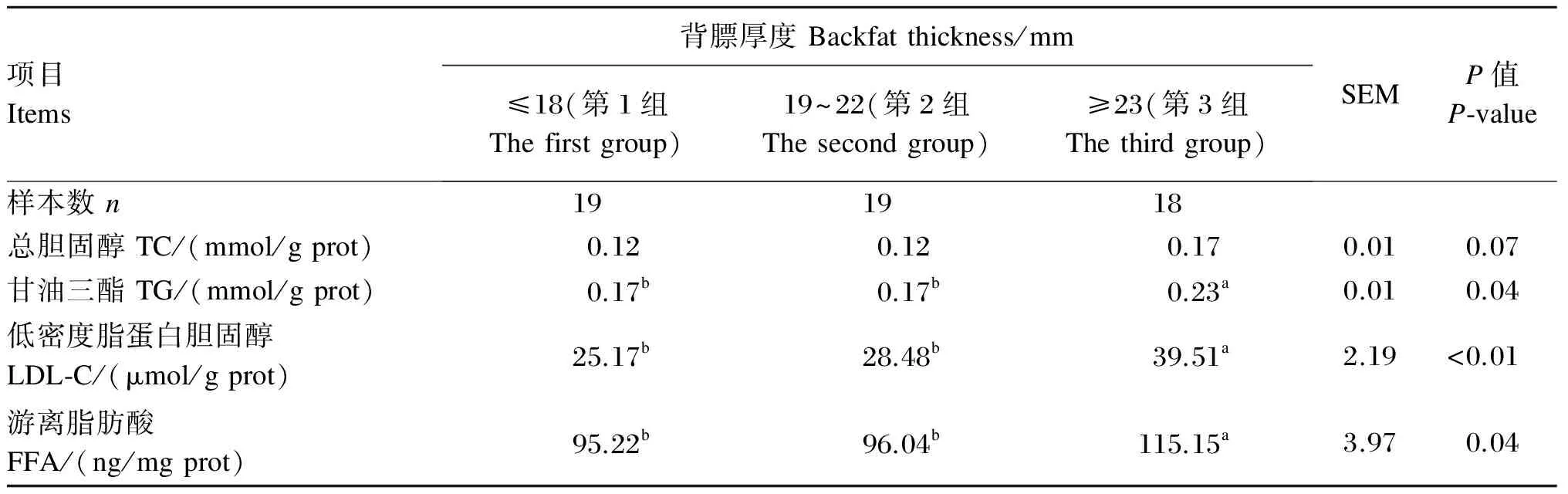
表2 母猪妊娠末期背膘厚度对胎盘脂质水平的影响
2.3 母猪妊娠末期背膘厚度对胎盘脂质氧化代谢的影响
由表3可知,母猪妊娠末期背膘厚度对胎盘组织中T-AOC及CAT和GSH-Px活性均无显著影响(P>0.05),但第3组胎盘组织中ROS及MDA水平显著高于其他2组(P<0.05),并且SOD活性显著低于其他2组(P<0.05),第1组与第2组之间差异不显著(P>0.05)。
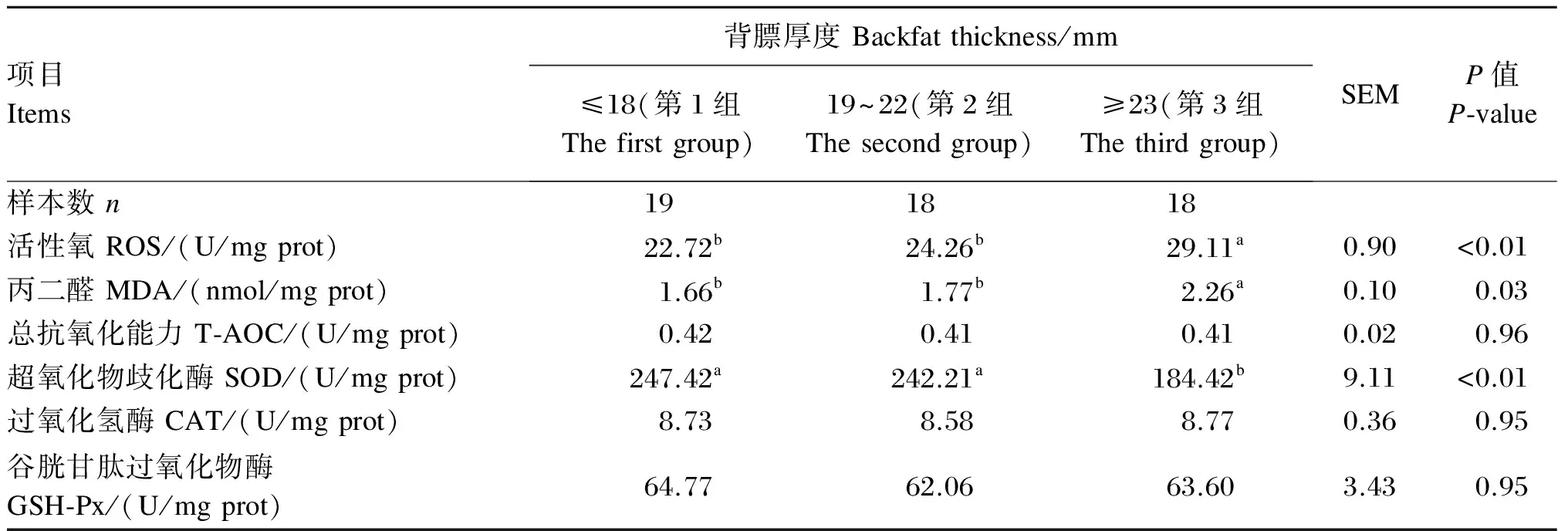
表3 母猪妊娠末期背膘厚度与胎盘组织中脂质氧化代谢的影响
2.4 胎盘组织中ROS、MDA水平和SOD活性与母猪产仔性状的相关性分析
由表4可知,母猪胎盘组织中ROS水平与总产仔数、初生窝重及胎盘效率呈显著负相关(P<0.05),相关系数分别为-0.311、-0.305、-0.295,与初生头重无显著相关性(P>0.05)。母猪胎盘组织中MDA水平与初生窝重、初生头重及胎盘效率均无显著相关性(P>0.05),但与总产仔数呈显著负相关(P<0.05),相关系数为-0.286。母猪胎盘组织中SOD活性与总产仔数、初生窝重、初生头重及胎盘效率均无显著相关性(P>0.05)。

表4 胎盘组织中ROS、MDA水平和SOD活性与母猪产仔性状的相关系数
*表示在0.05水平显著相关。
* mean significant correlation at 0.05 level.
3 讨 论
本研究表明,母猪妊娠末期体脂沉积情况影响了产仔性能。母猪妊娠末期的背膘厚度为19~22 mm时产仔性能最佳,初生窝重及初生头重均显著高于背膘厚度≤18 mm或≥23 mm时;同时,而背膘厚度≤18 mm或≥23 mm时,死胎及弱仔数较背膘厚度为19~22 mm时增多。其原因是母猪妊娠末期的体况影响了胎盘组织中脂质水平及氧化应激状态,特别是母猪妊娠末期背膘厚度超过23 mm时,胎盘中脂质过度沉积,胎盘氧化应激加剧,是降低母猪产仔性能的重要原因。
3.1 母猪妊娠末期背膘厚度对产仔性能的影响
妊娠期体况与产仔性能的关系始终受到研究者的关注。本研究结果证实,妊娠末期母猪维持中等背膘厚度(19~22 mm)时,母猪的产仔性能最佳,尤其是初生头重,显著高于背膘厚度≤18 mm或≥23 mm时,并且胎盘效率为3组最高,显著高于背膘厚度≤18 mm或≥23 mm时。研究证实,妊娠期母猪营养不良会影响胎盘的正常代谢,造成胎盘细胞数目减少,胎盘体积和重量降低,胎盘功能低下,进而引起流产、早产、死胎和低初生重儿数目增多[13]。因此,在母猪妊娠过程中,根据体况调节饲喂量,以保持合适的体脂沉积或背膘厚度,这对于取得良好的繁殖成绩具有十分重要的作用,而妊娠末期的体脂状况是整个妊娠期饲喂的结果。本研究发现,与背膘厚度为19~22 mm时相比,母猪妊娠末期背膘厚度≤18 mm时,死胎数显著增多,初生窝重及初生头重均显著降低,这与孙彩霞等[14]和刘柱等[15]研究报道一致。然而,体脂过度沉积的危害可能更加严重。本试验发现,在母猪妊娠末期背膘厚度≥23 mm的第3组中,每窝初生重≤0.9 kg的仔猪数和每窝初生重≤1.0 kg的仔猪数均显著高于其他2组,表明母猪妊娠末期背膘厚度过厚时,IUGR仔猪发生率升高。IUGR仔猪发生的原因主要包括母猪营养不良、母猪营养过剩、疾病、环境应激以及胎盘功能异常等[16-17]。胎盘效率这个概念是由Wilson等[12]提出的,用来衡量胎盘提供胎儿生长需要的能力。本研究发现,第1组和第3组的胎盘效率均显著低于第2组,尤其第3组,其胎盘效率还显著低于第1组,这与姚姣姣等[10]的研究结果一致,该结果表明妊娠末期母猪体脂状况对胎盘营养物质的转运能力具有显著影响,并且妊娠末期母猪体脂过度沉积对胎盘功能的影响更为显著,因此第3组中IUGR仔猪的发生可能与胎盘功能有关。综上所述,本试验结果表明,妊娠末期母猪营养状况不仅与胎盘功能密切相关,而且影响仔猪出生时的体重以及IUGR胎儿的数量和程度。由于妊娠期母猪背膘厚度是反映母猪营养状况的重要指标,对于妊娠母猪的生产和管理而言,在整个妊娠期管理好母猪的体况,合理控制母猪妊娠期背膘厚度,对于维持胎盘正常功能、提高母猪产仔性能具有的关键作用。
3.2 母猪妊娠末期背膘厚度对胎盘脂质氧化代谢的影响
胎盘作为母体与胎儿营养物质转运的媒介,妊娠末期母猪的体脂状况同样也会影响胎盘中脂质水平的变化。胎盘中脂质的获取主要通过母体脂质转运及胎盘自身脂质代谢生成2种途径。母体在妊娠后期脂肪分解增多,母体的胆固醇、LDL-C及FFA均可通过胎盘受体转运至胎盘,TG则以脂蛋白形式进入血液,水解成FFA转运至胎盘[18-20]。同时,研究发现肥胖孕妇的胎盘组织中脂蛋白脂酶的活性升高,促进脂肪水解,产生FFA,进而在脂肪合成酶作用下酯化为TG[21]。本研究中第3组胎盘组织中脂质水平增加的结果与Malti等[7]所得结果一致。Malti等[7]研究发现,孕妇肥胖时母体及胎盘组织中TG的水平均显著高于对照组。因此,胎盘中脂质过度沉积的原因主要是母猪体脂过多导致脂肪分解产生的大量FFA和其他脂质转运至胎盘,同时在脂肪合成酶的作用下胎盘中TG合成增多。与此同时,本研究还发现第3组的胎盘组织中氧化产物增加,ROS和MDA水平较其他2组显著升高,且其胎盘组织中SOD活性较其他2组显著降低。氧化产物增加不利于胎盘维持健康环境。研究报道,脂质过氧化产物MDA的水平升高会导致血管内皮损伤,造成胎盘血管发育异常,使得胎儿的营养物质和气体交换调节受损[22-23]。低密度脂蛋白(LDL)极易被氧化成氧化修饰低密度脂蛋白(ox-LDL),ox-LDL能够促进内皮细胞损伤及炎症反应的发生[24]。本研究虽然未测定胎盘组织中ox-LDL的水平,但第3组胎盘组织中LDL-C水平较其他2组显著升高。进一步将胎盘组织中ROS或MDA水平与母猪产仔性状进行相关性分析发现,胎盘组织中ROS或MDA水平升高均对母猪的产仔性能具有不利影响。综上所述,母猪妊娠期体脂沉积过多时产仔性能下降的主要原因是胎盘中脂质的过度沉积加剧了胎盘氧化应激的发生,导致胎盘环境不利于胎儿的生长。因此,合理控制母猪脂肪沉积是维持胎盘健康环境,提高繁殖性能的关键措施。
4 结 论
① 母猪妊娠末期背膘厚度与产仔性能密切相关。
② 母猪妊娠末期维持背膘厚度在19~22 mm,母猪可获得较高的产仔性能;背膘厚度≤18 mm时,会增加死胎数;而背膘厚度≥23 mm时,会引起胎盘组织中脂质过度沉积,从而加剧胎盘氧化应激的发生。
[1] ROONGSITTHICHAI A,TUMMARUK P.Importance of backfat thickness to reproductive performance in female pigs[J].The Thai Veterinary Medicine,2014,44(2):171-178.
[2] FILHA W S A,BERNARDI M L,WENTZ I,et al.Reproductive performance of gilts according to growth rate and backfat thickness at mating[J].Animal Reproduction Science,2010,121(1/2):139-144.
[3] ROSEBOOM T J,PAINTER R C,DE ROOIJ S R,et al.Effects of famine on placental size and efficiency[J].Placenta,2011,32(5):395-399.
[4] SADOVSKY Y,MOUILLET J F,OUYANG Y S,et al.The function of trophomirs and other micrornas in the human placenta[J].Cold Spring Harbor Perspectives in Medicine,2015,5(8):a023036.
[5] ADEMUYIWA O,ODUSOGA O L,ADEBAWOO O,et al.Endogenous antioxidant defences in plasma and erythrocytes of pregnant women during different trimesters of pregnancy[J].Acta Obstetricia et Gynecologica Scandinavica,2007,86(10):1175-1180.
[6] MALTI-BOUDILMI N,MERZOUK H,BABA F Z A,et al.Oxidative stress biomarkers in obese mothers and their appropriate for gestational age newborns[J].Journal of Clinical and Diagnostic Research,2010,4(2):2237-2245.
[7] MALTI N,MERZOUK H,MERZOUK S A,et al.Oxidative stress and maternal obesity:feto-placental unit interaction[J].Placenta,2014,35(6):411-416.
[8] ZHU M J,DU M,NATHANIELSZ P W,et al.Maternal obesity up-regulates inflammatory signaling pathways and enhances cytokine expression in the mid-gestation sheep placenta[J].Placenta,2010,31(5):387-391.
[9] FARLEY D,TEJERO M E,COMUZZIE A G,et al.Feto-placental adaptations to maternal obesity in the baboon[J].Placenta,2009,30(9):752-760.
[10] 姚姣姣,田亮,胡健,等.妊娠母猪膘情对其繁殖性能的影响[J].动物营养学报,2014,26(6):1638-1643.
[11] TUMMARUK P,TANTASUPARUK W,TECHAKUMPHU M,et al.The association between growth rate,body weight,backfat thickness and age at first observed oestrus in crossbred Landrace×Yorkshire gilts[J].Animal Reproduction Science,2009,110(1/2):108-122.
[12] WILSON M E,BIENSEN N J,FORD S P.Novel insight into the control of litter size in pigs,using placental efficiency as a selection tool[J].Journal of Animal Science,1999,77(7):1654-1658.
[13] 漆洪波.妊娠期营养对胎儿生长发育的影响[J].实用妇产科杂志,2006,22(5):257-258.
[14] 孙彩霞,赵传发,乔瑞敏,等.临产母猪背膘厚度对美系大白母猪繁殖性能的影响[J].猪业科学,2016,33(2):110-111.
[15] 刘柱,杨志远,李晓玉,等.分娩与断奶背膘厚度对猪繁殖性能的影响研究[J].中国畜牧兽医,2014,41(6):187-190.
[16] 董彦亮.胎儿宫内发育迟缓的病因[J].中国实用妇科与产科杂志,2002,18(1):6-8.
[17] BELKACEMI L,NELSON D M,DESAI M,et al.Maternal undernutrition influences placental-fetal development[J].Biology of Reproduction,2010,83(3):325-331.
[18] HERRERA E,ORTEGA-SENOVILLA H.Lipid metabolism during pregnancy and its implications for fetal growth[J].Current Pharmaceutical Biotechnology,2014,15(1):24-31.
[19] MAGNUSSON-OLSSON A L,LAGER S,JACOBSSON B,et al.Effect of maternal triglycerides and free fatty acids on placental LPL in cultured primary trophoblast cells and in a case of maternal LPL deficiency[J].American Journal of Physiology Endocrinology and Metabolism,2007,293(1):E24-E30.
[20] DUBÉ E,GRAVEL A,MARTIN C,et al.Modulation of fatty acid transport and metabolism by maternal obesity in the human full-term placenta[J].Biology of Reproduction,2012,87(1):14.
[21] COLOMIERE M,PERMEZEL M,RILEY C,et al.Defective insulin signaling in placenta from pregnancies complicated by gestational diabetes mellitus[J].European Journal of Endocrinology,2009,160(4):567-578.
[22] SABEN J,LINDSEY F,ZHONG Y,et al.Maternal obesity is associated with a lipotoxic placental environment[J].Placenta,2014,35(3):171-177.
[23] 陈轩,李华萍.高脂饮食对孕鼠代谢及胎盘炎症和氧化应激反应的影响[J].上海交通大学学报:医学版,2013,33(8):1079-1084.
[24] LUBRANO,GABRIELE V,PUNTONI M R,et al.Relationship among IL-6,LDL cholesterol and lipid peroxidation[J].Cellular and Molecular Biology Letters,2015,20(2):310-322.
*Corresponding author, professor, E-mail: pengjian@mail.hzau.edu.cn
(责任编辑 菅景颖)
Effects of Backfat Thickness of Sows at the End of Gestation on Litter Performance and Placental Lipid Oxidative Metabolism
XU Tao1ZHOU Yuanfei1CAI Anle1WU Yinghui1PENG Jian1,2*
(1.CollegeofAnimalScienceandTechnology,HuazhongAgriculturalUniversity,Wuhan430070,China; 2.TheCooperativeInnovationCentreforSustainablePigProduction,Wuhan430070,China)
The present study was conducted to investigate the effects of backfat thickness of sows at the end of gestation on litter performance and placental lipid oxidative metabolism, and thus to explore the relationship between fat deposition and reproductive performance in gestational sows. At day 109 of gestation, the backfat thickness of 846 multiparous Large White sows was measured and the sows were divided into three groups on the basis of the backfat thickness: backfat thickness≤18 mm for the first group (192 sows), backfat thickness was 19 to 22 mm for the second group (265 sows), and backfat thickness≥23 mm for the third group (389 sows). The litter performance of sows was recorded, and the levels of lipids, oxidation products and antioxidant enzyme activities in placenta were determined. The results showed as follows: 1) although the total number of born, number born alive and mummy number were not significantly affected by the backfat thickness of sows at the end of gestation (P>0.05), but the stillbirth number, litter weight at birth, piglet weight at birth and placental efficiency were significantly affected (P<0.05). Sows of the second group had significantly higher litter weight at birth, piglet weight at birth and placental efficiency than those of the other two groups (P<0.05), and had significantly lower stillbirth number than that of the first group (P<0.05), but with no significant difference compared with the third group (P>0.05). It is noteworthy that the number of piglet with birth weight≤0.9 kg and the number of piglet with birth weight≤1.0 kg were also significantly affected by the backfat thickness of sows at the end of gestation (P<0.05). The number of piglet with birth weight≤0.9 kg and the number of piglet with birth weight≤1.0 kg of the third group were significantly higher than those of the other two groups (P<0.05). 2) Compared with the first and second groups, there were significant increases in the levels of triglyceride (TG), low density lipoprotein cholesterol (LDL-C), free fatty acid (FFA), malondialdehyde (MDA) and reactive oxygen species (ROS) in the placenta of the third group (P<0.05). Moreover, superoxide dismutase (SOD) activity in the placenta of the third group was significantly lower than that of the other two groups (P<0.05). 3) The level of ROS in the placenta had a significant negative correlation with the total number born, litter weight at birth and placental efficiency (P<0.05). Furthermore, a significant negative correlation was detected between the level of MDA in the placenta and total number born (P<0.05). Taken together, backfat thickness of sows at the end of gestation has a significant impact on litter performance. The backfat thickness of sows at the end of gestation is 19 to 22 mm to attain a high litter traits. When the backfat thickness≤18 mm, the stillbirth number is increased. Nevertheless, the backfat thickness≥22 mm promotes excessive placental lipid deposition, exacerbates the oxidative stress in the placenta.[ChineseJournalofAnimalNutrition, 2017, 29(5):1723-1729]
gestational sow; backfat thickness; litter performance; placenta; lipid level; oxidative stress
10.3969/j.issn.1006-267x.2017.05.032
2016-11-15
国家自然科学基金(31402085);湖北省科技计划重大项目(2016ABA113);湖北省科技支撑计划(2014ABB014,2014ABC012)
徐 涛(1991—),女,山东青岛人,硕士研究生,从事猪的营养研究。E-mail: xutao0913yeah@163.com
*通信作者:彭 健,教授,博士生导师,E-mail: pengjian@mail.hzau.edu.cn
S816
A
1006-267X(2017)05-1723-07

