酵母培养物对生长期锦江黄牛生产性能、抗氧化能力及免疫性能的影响
陈作栋 周 珊 赵向辉 杨食堂 瞿明仁 文露华 许兰娇*(.江西农业大学江西省动物营养重点实验室/营养饲料开发研究中心,南昌330045;.高安裕丰农牧有限公司,高安330800)
酵母培养物对生长期锦江黄牛生产性能、抗氧化能力及免疫性能的影响
陈作栋1周 珊1赵向辉1杨食堂2瞿明仁1文露华1许兰娇1*
(1.江西农业大学江西省动物营养重点实验室/营养饲料开发研究中心,南昌330045;2.高安裕丰农牧有限公司,高安330800)
本研究旨在探讨饲粮中添加酵母培养物对生长期锦江黄牛生产性能、抗氧化能力及免疫性能的影响,为生长期肉牛培育及锦江黄牛饲粮配制提供依据。试验选择16头6月龄、体重140 kg左右的锦江黄牛公犊,随机分成对照组和试验组,每组8头。对照组饲喂基础饲粮,试验组在对照组饲粮基础上添加30 g/(d·头)酵母培养物,试验期为60 d。结果表明:1)试验组平均日增重显著高于对照组(P<0.05);2)试验组饲粮干物质和粗蛋白质的表观消化率显著高于对照组(P<0.05),但饲粮有机物、中性洗涤纤维和酸性洗涤纤维的表观消化率相比于对照组则差异不显著(P>0.05);3)试验第30天和第60天,试验组血清总超氧化物歧化酶(T-SOD)活性显著高于对照组(P<0.05),而血清丙二醛(MDA)含量较对照组有所降低,但差异不显著(P>0.05),同时血清谷胱甘肽过氧化物酶(GSH-Px)活性也与对照组无显著差异(P>0.05);4)试验组血清免疫球蛋白A(IgA)含量在试验第30天显著高于对照组(P<0.05),血清免疫球蛋白G(IgG)含量在试验第30天和第60天相比对照组均有一定程度的提高,但差异不显著(P>0.05),血清免疫球蛋白M(IgM)含量在试验第30天和第60天与对照组相比无显著差异(P>0.05)。由上述结果可知,饲粮中添加30 g/(d·头)酵母培养物可促进饲粮中养分的消化,增加生长期锦江黄牛的抗氧化能力和免疫性能,进而改善其生产性能。
锦江黄牛;酵母培养物;生产性能;抗氧化能力;免疫性能
生长期是肉牛养殖的关键时期,这一阶段生长发育的好坏会严重影响到整个养殖阶段的生产性能和经济效益的提高。因此,不仅要确保生长期肉牛能够获取必需的各种营养物质,还要提高其免疫力及抗氧化功能,保证肉牛的健康成长,从而在保证养殖户的经济收益同时,也为广大消费者提供安全的牛肉产品。
酵母培养物(yeast culture)是指在严格控制条件下,由酵母菌在特定的培养基上经过充分的厌氧发酵后形成的微生态制品[1]。酵母培养物含有各种消化酶和酵母发酵所产生的其他营养代谢产物,具有储存期长、在热和湿环境条件下的稳定性好、能够提高饲粮的适口性和改善消化率等特点[2]。此外,大量研究表明,酵母培养物能够促进动物肠道益生菌的生长繁殖,抑制有害菌的生长繁殖,并能提供动物生长必需的营养因子,在促进动物生长、提高饲料利用率、预防疾病、提高机体免疫力和改善环境等方面具有重要的作用[3]。酵母培养物已广泛应用于畜禽及水产养殖上[4],但其对生长期肉牛培育及相关影响尚未见报道。本试验以江西著名的地方牛种——锦江黄牛为研究对象,探索酵母培养物对生长期肉牛生产性能、抗氧化能力及免疫性能的影响,为生长期肉牛培育及锦江黄牛饲粮配制提供参考。
1 材料与方法
1.1 试验时间与地点
本试验在江西省高安市裕丰农牧有限公司养殖基地进行,时间为2015年5月5日至2015年7月3日,共60 d。
1.2 试验材料
试验用酵母培养物由美国达农威生物发酵工程技术(深圳)有限公司生产,其粗蛋白质≥15.0%,粗脂肪≥0.5%,粗纤维≤32.0%,水分≤10.0%,粗灰分≤12.0%,用于肉牛的产品推荐量为30~45 g/(d·头)。
1.3 试验牛的选择与分组设计
本试验共选择6月龄、健康、体重(140±10) kg的锦江黄牛公犊16头,随机分为试验组和对照组,每组8头。生长期锦江黄牛饲粮营养水平按照我国《肉牛饲养标准》(NY/T 815—2004)进行配制。对照组饲喂基础饲粮,试验组在对照组饲粮基础上添加30 g/(d·头)酵母培养物。基础饲粮精粗比为4∶6,其组成及营养水平见表1。各组锦江黄牛限饲喂养,干物质采食量(DMI)均为6.37 kg/(d·头)。
1.4 饲养管理与称重
试验牛采取圈养方式,日饲喂2次(07:00和16:00),自由采食,自由饮水,按时打扫卫生,常规消毒与免疫。饲养试验开始和结束早饲前空腹称重,详细记录,并计算平均日增重。
1.5 粪样采集、常规养分含量的测定和养分表观消化率的计算
在饲养试验结束前最后3 d进行消化试验。从试验组和对照组中各选取3头体重接近的锦江黄牛,单栏饲喂。准确记录每天的投料量和剩料量,采用全收粪法收集粪便。取200 g混匀粪样,加入50 mL稀硫酸,用于测定粗蛋白质含量。另取300 g混匀粪样,用于测定其他常规养分含量。粗蛋白质、干物质和有机物含量采用常规分析方法测定,中性洗涤纤维和酸性洗涤纤维含量采用范氏(Van Soest)洗涤纤维分析法[5]测定。饲粮样和粪样中的酸不溶灰分(AIA)含量按4 mol/L HCl不溶灰分法测定。根据饲粮样与粪样中养分含量测定结果,计算各养分的表观消化率。
养分表观消化率(%)=1-bc/ad。
式中:a为饲粮中某养分的含量(%);b为粪样中该养分的含量(%);c为饲粮中指示剂酸不溶灰分的含量(%);d为粪样中指示剂酸不溶灰分的含量(%)。
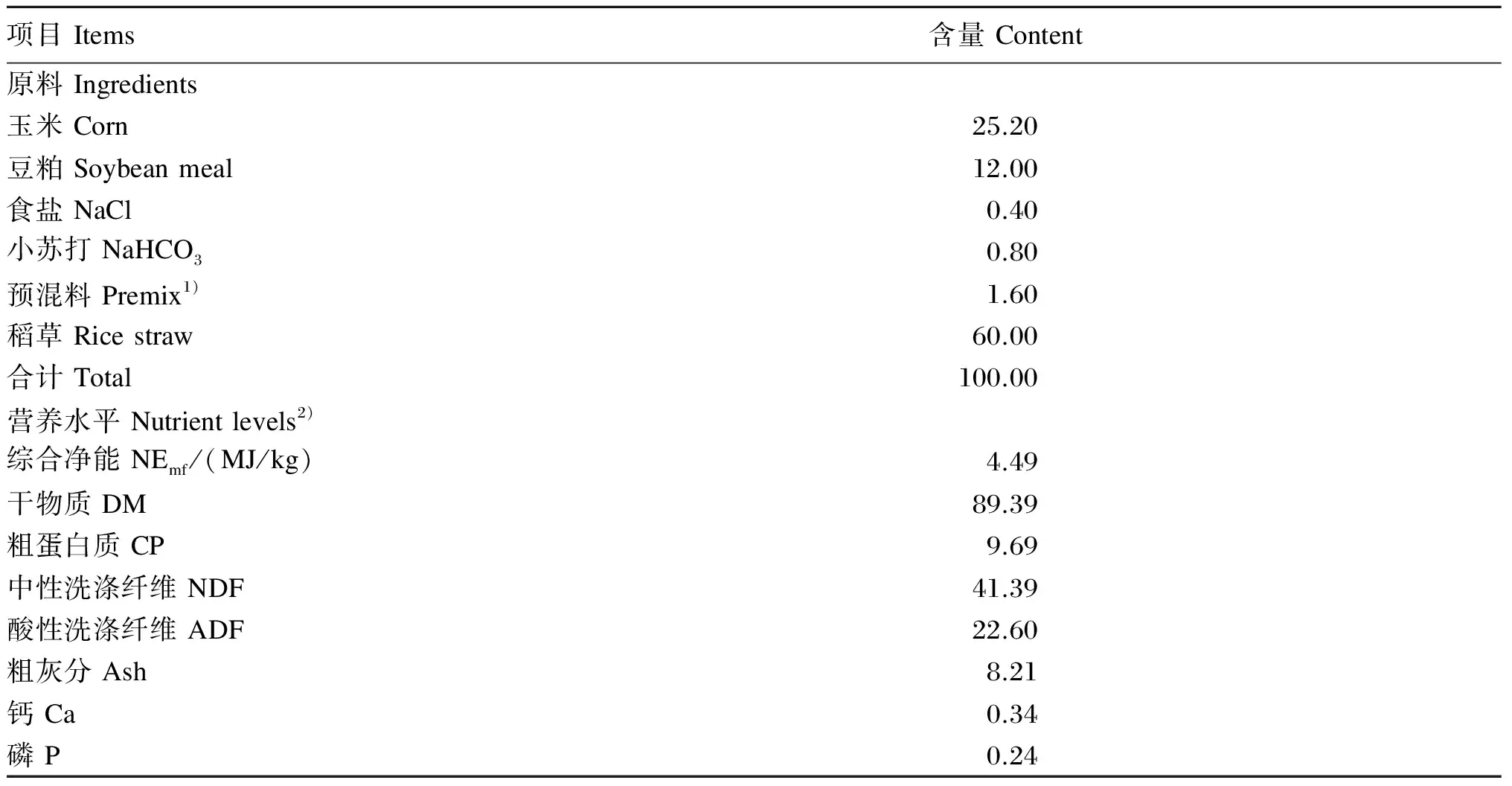
表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供Premix provided the following per kilogram of the diet:VA 2 400 IU,VD 320 IU,VE 48 mg,Fe 51.2 mg,Cu 10.4 mg,Zn 32 mg,Mn 24 mg,Co 0.16 mg,I 0.56 mg,Se 0.16 mg。
2)综合净能、钙和磷为计算值,其余为实测值。NEmf, Ca and P were calculated values, while the others were measured values.
1.6 血样采集、测定指标及方法
在饲养试验的第30天和第60天,早饲前2 h颈静脉采血15 mL,其中5 mL用肝素抗凝备用,另外10 mL于恒温箱中孵育30 min,之后以2 200×g离心15 min取血清,将血清保存于-20 ℃冰箱待测。血清丙二醛(MDA)含量采用硫代巴比妥酸(thibabituric ccid,TBA)法[6]测定,谷胱甘肽过氧化物酶(GSH-Px)活性采用二硫代二硝基苯甲酸(DTNB)直接显色法[7]测定,总超氧化物歧化酶(T-SOD)活性采用黄嘌呤氧化酶-亚硝酸盐形成法[8]测定。血清免疫球蛋白A(IgA)、免疫球蛋白M(IgM)和免疫球蛋白G(IgG)含量采用免疫比浊法测定,试剂盒购于南京建成生物工程研究所。
1.7 数据统计与分析
本试验采用Excel 2003对数据进行初步整理,并采用SPSS 17.0进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 饲粮中添加酵母培养物对生长期锦江黄牛平均日增重的影响
由表2可知,试验组的平均日增重显著高于对照组(P<0.05),与对照组相比,试验组的平均日增重提高了31.82%。

表2 饲粮中添加酵母培养物对生长期锦江黄牛平均日增重的影响
2.2 饲粮中添加酵母培养物对生长期锦江黄牛养分表观消化率的影响
由表3可知,试验组饲粮粗蛋白质、干物质的表观消化率显著高于对照组(P<0.05),其中粗蛋白质的表观消化率较对照组提高7.74%,干物质的表观消化率较对照组提高3.58%。试验组饲粮有机物、中性洗涤纤维和酸性洗涤纤维的表观消化率与对照组差异不显著(P>0.05),但有机物、中性洗涤纤维的表观消化率均较对照组有所提高,其中有机物的表观消化率较对照组提高2.88%,中性洗涤纤维的表观消化率较对照组提高0.73%。
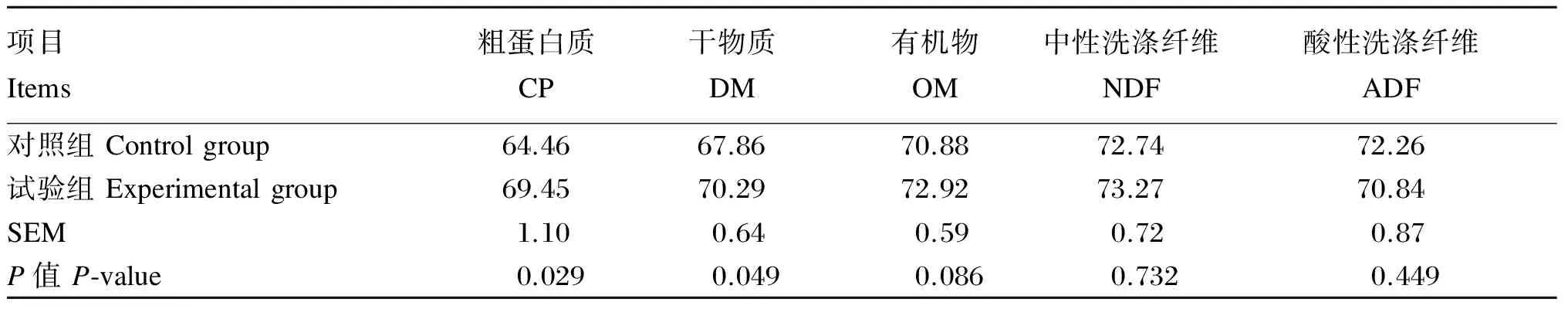
表3 饲粮中添加酵母培养物对生长期锦江黄牛养分表观消化率的影响
2.3 饲粮中添加酵母培养物对生长期锦江黄牛血清抗氧化指标的影响
由表4可知,在试验第30天和第60天,试验组血清MDA含量较对照组分别降低25.39%和4.87%,但差异均不显著(P>0.05)。试验组血清GSH-Px活性在试验第30天和第60天与对照组均无显著差异(P>0.05)。在试验第30天和第60天,试验组血清T-SOD活性均显著高于对照组(P<0.05),其中第30天较对照组提高33.85%,第60天较对照组提高17.86%。
2.4 饲粮中添加酵母培养物对生长期锦江黄牛血清免疫指标的影响
由表5可知,试验组血清IgG含量在试验第30天和第60天相比对照组均有一定程度的提高,但差异均不显著(P>0.05)。在试验第30天和第60天,试验组血清IgM含量与对照组相比无显著差异(P>0.05)。在试验第30天,试验组血清IgA含量较对照组显著升高(P<0.05);在试验第60天,试验组血清IgA含量较对照组有所升高,但差异不显著(P>0.05)。

表4 饲粮中添加酵母培养物对生长期锦江黄牛血清抗氧化指标的影响
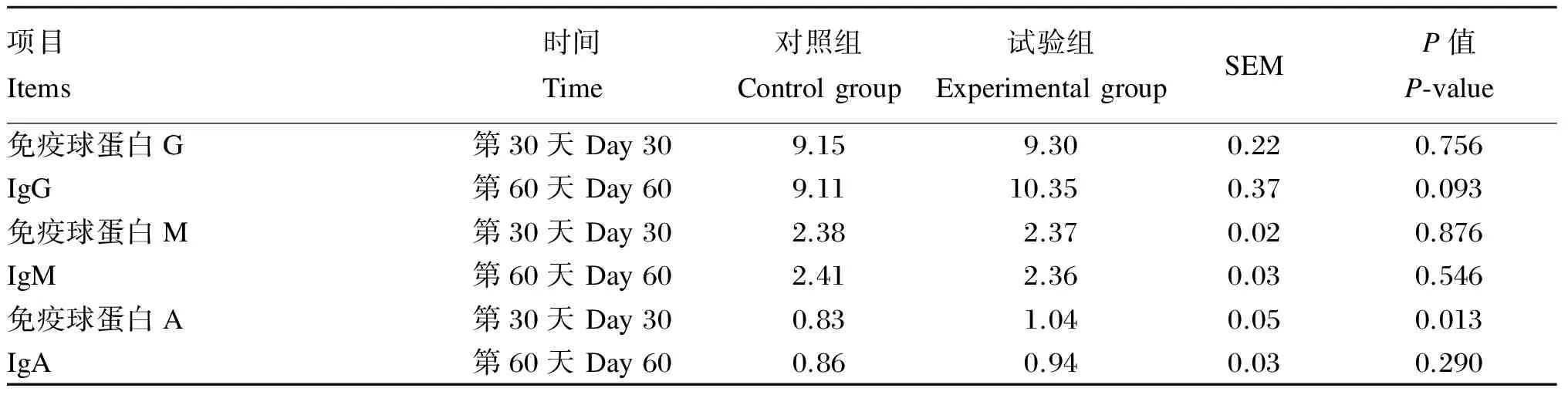
表5 饲粮中添加酵母培养物对生长期锦江黄牛血清免疫指标的影响
3 讨 论
3.1 饲粮中添加酵母培养物对生长期锦江黄牛生产性能的影响
酵母培养物含有蛋白质、B族维生素、核苷酸、寡糖等多种物质[9],可为动物机体提供营养物质。早在1994年Olson等[10]就报道,酵母培养物能明显改善肉牛的生产性能,饲粮中添加酵母培养物可使肉牛增重5%,犊牛增重12%。另有研究显示,酵母培养物能提高反刍动物的干物质采食量及体增重[11-12]。汤飞飞[13]在母猪妊娠后期和仔猪饲粮中添加酵母培养物,结果表明添加酵母培养物能显著提高母猪的饲料转化率和产仔性能,对仔猪的肠道发育起促进作用。张连忠[14]在雏鸡饲粮中添加酵母培养物提高了蛋雏鸡的平均日增重,降低料重比并提高成活率。本试验研究结果与前人研究结果基本一致,在饲粮中添加酵母培养物的试验组锦江黄牛的平均日增重比对照组高出34%。关于酵母培养物对反刍动物的作用机理,张鹏飞等[2]做了大量研究,研究发现酵母培养物中含有有机酸、维生素、钙、磷等营养成分,在瘤胃中可以对微生物起到营养作用,增加瘤胃细菌数,从而加大发酵强度,促进纤维素降解,增加瘤胃挥发性脂肪酸(VFA)浓度。酵母培养物中的活性酵母菌通过对瘤胃内氧气的消耗,促进瘤胃内厌氧微生物的生长,与瘤胃微生物竞争发酵底物,改善瘤胃内环境及微生物菌群,促进瘤胃发育,提高饲粮消化吸收效率,最终改善肉牛生产性能。
3.2 饲粮中添加酵母培养物对生长期锦江黄牛养分表观消化率的影响
研究报道酵母培养物可影响瘤胃内消化途径,提高对粗蛋白质、中性洗涤纤维、酸性洗涤纤维的瘤胃消化率及全消化道消化率[15]。研究发现,饲粮中添加酵母培养物,反刍动物采食后,瘤胃内厌氧菌和纤维素分解菌的数量增加[16]。酵母培养物还可以促进瘤胃内有益菌的比例和活性[16],提高营养物质的降解率。寇慧娟等[17]在绒山羊羔羊饲粮中添加20 g/kg酵母培养物,研究其对羔羊养分表观消化率的影响,结果发现试验组的粗蛋白质、中性洗涤纤维的表观消化率显著高于对照组。Mcgilliard等[18]研究表明,酵母培养物能改变非氨态氮的代谢速度,使干物质和中性洗涤纤维的降解加快,增加非菌氮、非氨态氮流入十二指肠的速度,从而使瘤胃中的氨态氮浓度下降。张昌吉[19]在瘘管羯绵羊饲粮中添加酵母培养物后发现,干物质、有机物、中性洗涤纤维和酸性洗涤纤维的降解率均高于对照组。本试验得出基本一致结果,即在饲粮中添加酵母培养物显著提高了生长期锦江黄牛粗蛋白质和干物质的表观消化率。这与酵母培养物影响蛋白质分解菌的生长和活性有关,研究发现,活酵母细胞的小肽可对细菌的蛋白酶产生抑制效应[20]。饲粮中的可溶性氮与碳水化合物之间有一个合适的平衡比例,酵母培养物可加强微生物的生长并减少氮损失,增加机体可利用的氮量。本试验中,试验组中性洗涤纤维与酸性洗涤纤维的表观消化率与对照组相比差异不显著,可能与选用的酵母培养物中的菌种有关,不是所有的酵母培养物中的菌种对瘤胃纤维分解菌的生长都具有刺激作用。饲喂可溶性氮与碳水化合物平衡性较好的饲粮时,促进肠道菌群的稳定,酵母培养物获得的影响效果较小,对真菌和纤维菌在纤维基质上的定植刺激程度较小,导致中性洗涤纤维和酸性洗涤纤维的表观消化率差异不显著。
3.3 饲粮中添加酵母培养物对生长期锦江黄牛抗氧化能力的影响

3.4 饲粮中添加酵母培养物对生长期锦江黄牛免疫性能的影响
酵母培养物为体内的微生物菌群提供营养底物,可改善胃肠道环境和菌群结构,促进肠道双歧杆菌、乳酸菌等有益菌的繁殖,从而提高抗病能力[29]。酵母培养物中的酵母菌代谢产生有机酸可降低胃肠道pH,有效抑制病原菌的入侵[30]。构成酵母细胞壁的主要物质有β-葡聚糖和磷酸化甘寡糖。β-葡聚糖可以刺激网状内皮细胞发育,使巨噬细胞增生,吞噬入侵的病原体。磷酸化甘寡糖能吸附病菌,与病原菌进行生存竞争,诱导机体产生细胞免疫和体液免疫,进而提高机体的免疫性能[31]。目前关于酵母培养物对肉牛免疫性能影响的报道很少。Zhang等[32]研究发现,在开士米羊饲粮中添加酵母培养物可显著提高血清中IgA含量,血清中IgG含量有增加趋势。本试验结果显示,饲粮中添加酵母培养物,在试验第30天时血清IgA含量显著提高,其他免疫球蛋白含量都无显著变化,可能与试验动物的种类、气候环境和机体生理状态有关。由此可知,饲粮中添加酵母培养物对生长期锦江黄牛的免疫性能有一定提高作用。
4 结 论
饲粮中添加30 g/(d·头)酵母培养物可促进饲粮中养分的消化,增加生长期锦江黄牛的抗氧化能力和免疫性能,进而改善其生产性能。
[1] 郭勇庆,张英杰.酵母培养物在反刍动物上的应用[J].北方牧业,2008(16):9.
[2] 张鹏飞,于安乐,高巍.酵母培养物对反刍动物作用的研究进展[J].吉林畜牧兽医,2007,28(6):17-20.
[3] 易力,汪洋.饲用微生态制剂——酵母培养物及其在水产养殖中的应用[J].饲料博览,2009(9):25-27.
[4] 周淑芹,孙文志.酵母培养物[J].中国饲料,2003(5):31-32.
[5] 杨胜.饲料分析及饲料质量检测技术[M].北京:北京农业大学出版社,1993.
[6] TAKEMURA G,ONODERA T,ASHRAF M.Characterization of exogenous hydroxyl radical effects on myocardial function,metabolism and ultrastructure[J].Journal of Molecular and Cellular Cardiology,1994,26(4):441-454.
[7] SEDLAK J,LINDSAY R H.Estimation of total,protein-bound,and nonprotein sulfhydryl groups in tissue with Ellman’s reagent[J].Analytical Biochemistry,1968,25:192-205.
[8] KOO D D H,WELSH K I,WEST N E J,et al.Endothelial cell protection against ischemia/reperfusion injury by lecithinized superoxide dismutase[J].Kidney International,2001,60(2):786-796.
[9] 王东明.酵母培养物对肉鸡消化与免疫调节影响的研究[D].硕士学位论文.长春:吉林农业大学,2007.
[10] OLSON K C,CATON J S,KIRBY D R,et al.Influence of yeast culture supplementation and advancing season on steers grazing mixed-grass prairie in the northern Great Plains:Ⅱ.Ruminal fermentation,site of digestion,and microbial efficiency[J].Journal of animal science,1994,72(8):2158-2170.
[11] ERASMUS L J,BOTHA P M,KISTNER A.Effect of yeast culture supplement on production,rumen fermentation,and duodenal nitrogen flow in dairy cows[J].Journal of Dairy Science,1992,75(11):3056-3065.
[12] EL HASSAN S M,NEWBOLD C J,EDWARDS I E,et al.Effect of yeast culture on rumen fermentation,microbial protein flow from the rumen and live-weight gain in bulls given high cereal diets[J].Animal Science,1996,62(1):43-48.
[13] 汤飞飞.母猪妊娠后期和仔猪日粮添加酵母培养物对母猪生产性能、仔猪肠道健康及免疫机能的影响[D].硕士学位论文.南京:南京农业大学,2012.
[14] 张连忠.酵母培养物对雏鸡生长性能、免疫器官发育和血清相关激素的影响[J].中国畜牧兽医,2011,38(4):33-37.
[15] ROBINSON P H.Effect of yeast culture (Saccharomycescerevisiae) on adaptation of cows to diets postpartum[J].Journal of Dairy Science,1997,80(6):1119-1125.
[16] DENEV S A,PEEVA T,RADULOVA P,et al.Yeast cultures in ruminant nutrition[J].Bulgarian Journal of Agricultural Science,2007,13:357-374.
[17] 寇慧娟,陈玉林,刘敬敏,等.酵母培养物对羔羊生产性能、营养物质表现消化率及瘤胃发育的影响[J].西北农林科技大学学报:自然科学版,2011,39(8):45-50.
[18] MCGILLIARD M L,STALLINGS C C.Increase in milk yield of commercial dairy herds fed a microbial and enzyme supplement[J].Journal of Dairy Science,1998,81(5):1353-1357.
[19] 张昌吉.饲粮中添加酵母培养物对绵羊瘤胃发酵及养分消化代谢的影响[D].硕士学位论文.兰州:甘肃农业大学,2005.
[20] CHAUCHEYRAS-DURAND F,MASSÉGLIA S,FONTY G.Effect of the microbial feed additiveSaccharomycescerevisiaeCNCM I-1077 on protein and peptide degrading activities of rumen bacteria grown in vitro[J].Current Microbiology,2005,50(2):96-101.
[21] 肖曼,高振华,张少成,等.酵母培养物对肉仔鸡免疫功能、抗氧化及血清生化指标的影响[J].广东农业科学,2013,40(5):103-106.
[22] 张培松,周玉香,王洁.三种日粮添加物对滩羊血液抗氧化性能的影响[J].家畜生态学报,2013,34(6):44-47.
[23] FLOHÉ L,GÜNZLER W A.Assays of glutathione peroxidase[J].Methods in Enzymology,1984,105:114-120.
[24] 王兰惠.灌注酵母培养物对绵羊血液生化指标、免疫及抗氧化功能的影响[D].硕士学位论文.长春:吉林农业大学,2015.
[25] 张学峰,王兰惠,周雪飞,等.瘤胃灌注酵母培养物对绵羊血液生化指标和免疫及抗氧化功能的影响[J].中国畜牧杂志,2016,52(9):62-65.
[26] 熊皓平,杨伟丽,张友胜,等.天然植物抗氧化剂的研究进展[J].天然产物研究与开发,2001,13(5):75-79.
[27] HOLDOM M D,LECHENNE B,HAY R J,et al.Production and characterization of recombinantAspergillusfumigatusCu,Zn superoxide dismutase and its recognition by immune human sera[J].Journal of Clinical Microbiology,2000,38(2):558-562.
[28] FAHEY R C.Novel thiols of prokaryotes[J].Annual Review of Microbiology,2001,55(1):333-356.
[29] 刘丽,刘倩.酵母及其培养物在动物生产中的应用[J].上海畜牧兽医通讯,2012(4):57-58.
[30] 王学东,李彪,戴晋军.活性干酵母在养猪中的应用[J].养猪,2009(4):9-10.
[31] 范秀敏,陈翠玲,张慧,等.酵母培养物在仔猪生产中的应用[J].饲料博览,2012(10):33-35.
[32] ZHANG A Z,LU D X,DA C,et al.Effects of yeast culture on immune indices of cashmere goats[J].Chinese Journal of Animal Nutrition,2008,20(2):163-169.
*Corresponding author, assistant professor, E-mail: xulanjiao1314@163.com
(责任编辑 菅景颖)
Effects of Yeast Culture on Performance, Antioxidant Capacity and Immune Function ofJinjiangYellow Cattle during Growing Period
CHEN Zuodong1ZHOU Shan1ZHAO Xianghui1YANG Shitang2QU Mingren1WEN Luhua1XU Lanjiao1*
(1.JiangxiProvinceKeyLaboratoryofAnimalNutrition/EngineeringResearchCenterofFeedDevelopment,JiangxiAgriculturalUniversity,Nanchang330045,China; 2.Gao’anYufengAgriculturalandLivestockCo.,Ltd.,Gao’an330800,China)
This study was conducted to investigate the effects of yeast culture on performance, antioxidant capacity and immune function ofJinjiangcattle during growing period, which would provide technical support for the diet formulation ofJinjiangcattle and the breeding of growing cattle. Sixteen 6-month-oldJinjiangcattle with about 140 kg body weight were randomly divided into 2 groups including control group and experimental group, and each group had 10 cattle. The cattle in the control group were fed a basal diet. For experimental group, yeast culture (30 g per cattle per day) was added into the basal diet. The experiment lasted for 60 days. The results showed as follows: 1) the average daily gain in the experimental group was significantly higher than that in the control group (P<0.05). 2) Compared with the control group, the apparent digestibility of dry matter (DM) and crude protein (CP) in the experimental group was significantly increased (P<0.05), but there was no significant difference in the apparent digestibility of organic matter (OM), neutral detergent fiber (NDF) and acid detergent fiber (ADF) between control group and experimental group (P>0.05). 3)On day 30 and 60 of experiment, compared with the control group, the activity of serum total superoxide dismutase (T-SOD) in the experimental group was significantly increased (P<0.05), the serum malondialdehyde (MDA) content in the experimental group was decreased, but the difference was not significant (P>0.05), and the activity of serum glutathione peroxidase (GSH-Px) in the experimental group had no significant difference (P>0.05). 4) Serum immunoglobulin (Ig) A content on day 30 of experiment in experimental group was significantly higher than that in control group (P<0.05), and serum IgG content on day 30 and 60 of experiment in experimental group had the trend of increase compared with control group, but the difference was not significant (P>0.05). In addition, there was no significant difference in serum IgM content on day 30 and 60 of experiment between control group and experimental group (P>0.05). In conclusion, diet supplemented with 30 g yeast culture per day per cattle can promote the digestion of nutrients in the diet, enhance the antioxidant capacity and immune function, and then improve the performance ofJinjiangcattle.[ChineseJournalofAnimalNutrition, 2017, 29(5):1767-1773]
Jinjiangcattle; yeast culture; performance; antioxidant capacity; immune function
10.3969/j.issn.1006-267x.2017.05.037
2016-11-17
国家公益性行业(农业)科研专项(201303143);广昌县肉牛饲料研制与营养(09005392);国家现代肉牛牦牛产业技术体系项目(CAR-38);江西省研究生创新专项(YC2015-S178)
陈作栋(1991—),男,江苏镇江人,硕士研究生,从事反刍动物营养研究。E-mail: 289411078@qq.com
*通信作者:许兰娇,助理研究员,E-mail: xulanjiao1314@163.com
S816
A
1006-267X(2017)05-1767-07

