免疫方式对Iss抗体产生的影响
樊琛+徐旺烨+曾庆华+王会+郑焕芹
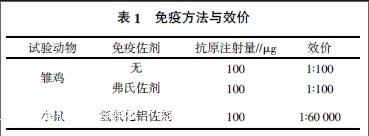
摘要:为获得抗大肠杆菌Iss蛋白的抗体,将纯化的GST-Iss蛋白分别免疫雏鸡及小鼠。结果显示,无免疫佐剂、弗氏佐剂免疫雏鸡所产生的Iss抗血清效价仅为1∶100,氢氧化铝佐剂免疫小鼠所产生的Iss抗血清效价为1∶60 000。Iss融合蛋白采用氢氧化铝佐剂免疫小鼠,可获得更强的体液免疫应答,抗体效价更高。
关键词:Iss抗体;免疫佐剂;免疫动物
中图分类号:S852.4+3 文献标识码:A 文章编号:0439-8114(2017)07-1307-02
DOI:10.14088/j.cnki.issn0439-8114.2017.07.027
The Influence of Immune Methods on Iss Antibody
FAN Chen1,XU Wang-ye2,ZENG Qing-hua1,WANG Hui1,ZHENG Huan-qin1
(1.Agricultural College,Liaocheng University,Liaocheng 252059,Shandong,China;
2.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
Abstract: In order to obtain the antibody against the Iss protein of E. coli,the purified GST-Iss protein was immunized to chicken and mouse respectively. The results showed that Iss antiserum titer of the immune adjuvant-free,Freund's adjuvant immunized chicken was just 1∶100,the aluminum hydroxide adjuvant immunized mice generated Iss titer of antiserum to 1∶60 000. The Iss fusion protein using aluminum hydroxide adjuvant immunized mice can obtain stronger humoral immune responses,antibody titer was higher.
Key words: Iss antibody; immune adjuvant; immune animal
大腸埃希氏菌(Escherichia coli)通常称为大肠杆菌,属于肠道杆菌中的一种,当饲养环境差,通风不好,营养缺乏或应激等情况出现会诱发大肠杆菌病,为人兽共患且危害食品安全[1-3]。进入血流是细菌发挥其致病作用的关键一步,在条件适合时E. coli从肺泡毛细血管进入血循环,引起菌血症,从而在全身组织内增殖,当机体抵抗力降低时,E. coli大量繁殖引起败血症。一旦病原体获得到血流的通路,它将面对血清的抑菌作用和杀菌作用[4,5]。Iss蛋白为大肠杆菌毒力岛的iss基因(increased serum survival gene)所编码的外膜蛋白,可增强大肠杆菌在血清中的存活能力,是大肠杆菌的重要毒力因子之一[6]。本试验以Iss融合蛋白为抗原,探讨免疫动物与免疫佐剂对Iss抗体产生水平的影响。
1 材料与方法
1.1 抗原
GST-Iss融合蛋白由聊城大学食品安全教研室进行分离纯化,溶解于PBS溶液中,其浓度为1.3 mg/mL。
1.2 试验动物
1日龄SPF雏鸡购于聊城阳谷;4~6周龄小鼠为东北农业大学动物医学院饲养。
1.3 主要试剂
碳酸钠、碳酸氢钠购自Biotopped公司;兔抗鸡gY++(IgG)(H+IL)购自Abcam;TMB染色液购自Beyotime Biotechnology;脱脂奶粉购自伊利乳业有限责任公司。
1.4 抗血清的制备
1)鸡-无免疫佐剂。将1日龄SPF雏鸡饲养14 d,分为空白、对照、试验3组。空白组10只,不注射;对照组10只,肌肉注射PBS溶液100 μL/只;试验组10只,肌肉注射融合蛋白100 μL/只(100 μg/只)。对照组及试验组每隔一周免疫一次,并取血直到四免,四免后5 d取血。
2)鸡-弗氏佐剂。取两支灭过菌的管,分别标记对照组、试验组。对照组等量加入PBS溶液、弗氏佐剂,试验组等量加入融合蛋白、弗氏佐剂,乳化[7]。将1日龄SPF雏鸡饲养14 d,分为空白、对照、试验3组。空白组10只,不注射;对照组10只,肌肉注射PBS溶液200 μL/只;试验组10只,肌肉注射融合蛋白200 μL/只(100 μg/只)。对照组及试验组每隔一周免疫一次,并取血直到四免,四免后5 d取血。一免佐剂为完全弗氏佐剂,二免后为不完全弗氏佐剂。
3)小鼠-氢氧化铝佐剂。对照组等量加入PBS溶液、氢氧化铝佐剂,试验组等量加入融合蛋白、氢氧化铝佐剂,乳化[7]。4~6周龄小鼠每7 d免疫一次,连免4次,腹腔100 μL,颈后皮下、腹股沟皮下各50 μL,四免后加强腹腔100 μL,加强免后3 d眼球采血制血清。
1.5 间接ELISA检测抗体效价
0.05 mol/L pH 9.6碳酸盐包被缓冲液将抗原稀释至蛋白质含量为10 μg/mL。在每个聚苯乙烯板的反应孔中加0.1 mL,4 ℃过夜。次日,弃去孔内溶液,洗涤3次。加倍比稀释的待检样品及1∶100稀释的阴性血清0.1 mL于上述反应孔中,37 ℃孵育1 h。加入1∶2 000酶标抗体0.1 mL,37 ℃孵育1 h,洗涤。加入TMB底物溶液0.1 mL,37 ℃ 30 min。各反应孔中加入2 mol/L硫酸0.05 mL,于450 nm处以空白调零后测各孔OD值。计算P/N≥2.1时的最高稀释度作为抗体效价[8]。
2 结果与分析
将Iss融合蛋白无免疫佐剂按常规程序肌肉注射免疫雏鸡,四免后取血经间接ELISA检测,抗血清效价为1∶100;Iss融合蛋白加入弗氏佐剂,按常规程序肌肉注射免疫雏鸡所产生的Iss抗血清,与无免疫佐剂时相近。Iss融合蛋白加入氢氧化铝佐剂按常规程序免疫小鼠所产生的Iss抗血清效价为 1∶60 000,具体见表1。从表1可以看出,3种免疫方式所用的Iss融合蛋白免疫量相同,免疫佐剂及免疫动物有差异。在对雏鸡进行免疫时,弗氏佐剂组与无免疫佐剂组的效价一样,弗氏佐剂未能明显提高Iss抗体效价。采用氢氧化铝佐剂对小鼠进行免疫时,Iss抗体效价达到1∶60 000,抗体效价明显提高。
李荣贞等[8]通过对比酶联免疫法与小鼠血清中和试验法所测定的破伤风抗体效价,发现酶联免疫法与中和试验法所测得的破伤风抗体效价结果相关性高,酶联免疫法测得实验数据RSD<10%,表明酶联免疫法真实可靠。侯伟杰等[7]以大肠埃希菌、金黄色葡萄球菌、凝固酶阴性表皮葡萄球菌及产色葡萄球菌,经甲醛37 ℃灭活,分别与铝胶盐、蜂胶和转移因子混合制备铝胶盐佐剂疫苗、蜂胶佐剂疫苗和转移因子佐剂疫苗,结果显示,铝胶盐佐剂疫苗刺激机体产生的抗体水平在3个免疫组中最高。韩露等[9]用磷酸铝(AP)、不同浓度磷酸盐处理的氢氧化铝(PTAH)以及氢氧化铝(AH)佐剂吸附百白破抗原,检测不同佐剂对各抗原的吸附率;制备不同佐剂类型和吸附率的制剂腹腔免疫NIH小鼠,ELISA法测定免疫后各组小鼠血清抗体滴度,结果表明,铝佐剂吸附力不影响抗原免疫原性。邓中华等[10]探讨铝佐剂对HBoV1 VP2 VLPs诱导小鼠免疫应答的影响,加明矾佐剂肌肉注射免疫,结果显示,明矾佐剂使HBoV1 VP2 VLPs诱导的体液免疫反应增强而细胞免疫反应减弱。
3 小结
在本试验中,分别采用雏鸡与小鼠作为试验动物,氢氧化铝、弗氏佐剂为免疫佐剂。结果显示,加入氢氧化铝佐剂免疫小鼠,可获得较强的体液免疫应答,抗体效价较高。试验仅探讨了免疫佐剂及免疫动物对抗体产生水平的影响,后续试验可继续以小鼠作为试验动物、氢氧化铝为佐剂,探讨免疫剂量、免疫途径等因素对抗体水平的影响。
参考文献:
[1] NOLAN L K,WOOLEY R E, GIDDINGS C W,et al. Characterization of an avirulent mutant of a virulent avian Escherichia coli isolate[J].Avian Diseases,1994,38(1):146-150.
[2] CHUBA P J,LEON M A,BANERJEE A,et al. Cloning and DNA sequence of plasmid determinant iss,coding for increased serum survival and surface exclusion,which has homology with lambda DNA[J].Molecular & General Genetics,1989,216(2-3):287-292.
[3] JOHNSON T J,SUBH ASHINIE K,YVONNE W,et al. The genome sequence of avian pathogenic Escherichia coli strain O1∶K1∶H7 shares strong similarities with human extraintestinal pathogenic E. coli genomes[J].J Bacteriol,2007,189(8):3228-3236.
[4] 樊 琛,刘桂芹,王亚君,等.Iss蛋白在鸡源大肠杆菌不同毒力菌株中的检测[J].畜牧与兽医,2010,4(2):10-13.
[5] BORST L B,M MITSU S,SHIVARAMU K,et al. A chicken embryo lethality assay for pathogenic Enterococcus cecorum[J].Avian Diseases,2014,58(2):244-248.
[6] 樊 琛,徐旺燁,李丹丹,等.PCR方法检测大肠杆菌iss基因的缺陷及改进[J].江苏农业科学,2015,43(11):69-70.
[7] 侯伟杰,高 洋,高晶晖.三种佐剂对奶山羊乳房炎灭活疫苗免疫效果的影响[J].动物医学进展,2015,36(1):45-48.
[8] 李荣贞,赵 军,李庆英.酶联免疫法与中和实验法检测破伤风抗体效价[J].药学研究,2015,34(7):381-383.
[9] 韩 露,邵忠琦,司伟雪.铝佐剂类型及吸附率对吸附无细胞百白破联合疫苗免疫原性的影响[J].免疫学杂志,2015,31(7):580-584.
[10] 邓中华,段招军,谢志萍.铝佐剂对HBoV1 VP2 VLPs诱导小鼠免疫应答的影响[J].中国免疫学杂志,2016,32(1):56-58,64.

