不同品种枣黄酮及多糖体外抗氧化性评价
吴小燕+王仁才+刘琼
摘要:采用超声法提取3个品种枣(Zizphus jujube Mill)中黄酮、多糖并测定其含量,以维生素C作为阳性对照,测定其黄酮及多糖的还原力与对羟基自由基、超氧阴离子自由基及DPPH自由基的清除能力,比较其体外抗氧化性能。结果表明,小米枣黄酮、多糖含量分别为0.96、7.24 mg/g,明显高于其余两个品种;不同品种枣黄酮及多糖的抗氧化性均与浓度呈正相关,且同一品种枣黄酮抗氧化性强于多糖;不同品种枣抗氧化性与黄酮及多糖的含量呈正相关;小米枣黄酮浓度为1.00 mg/mL时,其对超氧阴离子、DPPH、OH自由基的清除率分别为77.37%、58.81%、56.98%,均低于维生素C。小米枣中的黄酮、多糖化合物具有良好的抗氧化性能,为其在抗衰老、抗肿瘤等方面的应用研究提供了相关理论依据。
关键词:枣(Zizphus jujube Mill);黄酮;多糖;维生素C;抗氧化能力
中图分类号:S665.1;R284 文献标识码:A 文章编号:0439-8114(2017)07-1330-04
DOI:10.14088/j.cnki.issn0439-8114.2017.07.034
Evaluation of in Vitro Antioxidant Activity of Flavonoids and Polysaccharides from Different Varieties of Jujube
WU Xiao-yan, WANG Ren-cai, LIU Qiong
(College of Horticulture and Landscape, Hunan Agricultural University, Changsha 410128, China)
Abstract: Using ultrasonic method to extract the flavonoids and polysaccharides from 3 varieties of jujube and determine their contents, using VC as positive control, to determine the reducing power and hydroxyl radical, superoxide anion radical and DPPH radical scavenging capacity of flavonoids and polysaccharides from different varieties of jujube. Results showed that the contents of flavonoids and polysaccharides of Millet jujube was higher than the other two varieties significantly, their contents were 0.96 mg/g,7.24 mg/g. The antioxidant activity of flavonoids and polysaccharides was positively correlated with the concentration of different varieties of jujube. The antioxidant activity of flavonoids was stronger than that of polysaccharide in the same cultivar, the antioxidant activity of different cultivars was positively correlated with the contents of flavonoids and polysaccharides. When the concentration of flavonoids was 1.00 mg/mL,the scavenging rates of superoxide anion,DPPH and OH radical were 77.37%,58.81%,56.98%,which were lower than those of VC. The flavonoids and polysaccharide compounds in Millet jujube have good antioxidant properties, it provides the theoretical basis for its application in anti aging, anti tumor and so on.
Key words: jujube(Zizphus jujube Mill);flavonoids;polysaccharides;VC;antioxidant capacity
枣(Zizphus jujube Mill)又名紅枣、大枣等,为鼠李科属小乔木植物枣树的果实,是目前农业、林业发展项目中的重要树种[1]。枣作为国家卫生部批准的药食两用果品[2],有悠长的种植历史,在中国南北各地都有种植。枣的营养与功能成分主要有维生素、多糖类[3,4]、膳食纤维、黄酮类[5]、芦丁[6]、生物碱类[7]、多酚类[8]、皂苷类[9]、有机酸、环磷酸腺苷(cAMP)[10]等,其中对多糖类与黄酮类的研究最多。黄酮类化合物具有抗癌、抗肿瘤、抗心脑血管疾病、免疫调节、抗氧化、抗衰老、抗辐射等作用[11,12]。多糖类化合物具有养心安神、缓和药性[13]、补气养血、抗氧化延缓衰老[14]、抗肿瘤[15,16]等作用。湖南枣品种资源丰富,其中衡阳市的地方品种由于其黄酮与多糖含量较高而备受关注。为促进中国南方枣资源的利用及对枣种质资源的挖掘,本试验研究探讨了湖南衡阳不同品种枣黄酮、多糖的体外抗氧化性能,为促进南方优质品种枣工业化生产提供依据。
1 材料与方法
1.1 材料与试剂
小米枣、药枣、糖枣(均采自湖南省衡阳市)的黄酮及多糖提取物粉末;无水乙醇、浓硫酸、蒽酮、葡萄糖、芦丁、亚硝酸钠、硝酸铝、氢氧化钠、铁氰化钾、三氯乙酸、DPPH、三氯化铁、磷酸一氢钠、磷酸二氢钠、邻苯三酚、盐酸、水杨酸、硫酸亚铁、双氧水、维生素C,均购自国药集团化学试剂有限公司,分析纯(AR)。
1.2 仪器与设备
ZW1105051705型紫外可见分光光度计(上海光谱仪器有限公司);SB-3200D型超声波清洗机(宁波新芝生物股份有限公司);AUW220D型电子天平、DR-1001型旋转蒸发仪、冷冻干燥机、TG16型台式高速离心机(郑州长城科工贸有限公司)。
1.3 方法
1.3.1 芦丁标准曲线的绘制 以甲醇为溶剂配制质量浓度为0.2 mg/mL的芦丁对照品贮备液,分别精密量取0.5、1.0、1.5、2.0、2.5、3.0 mL对照品溶液于6只10 mL试管中,加入5%亚硝酸钠0.3 mL,摇匀,放置6 min后加入10%硝酸铝0.3 mL,摇匀,放置6 min,再加入10%的氢氧化钠溶液4.0 mL,并用去离子水定容至10 mL,摇匀,放置15 min,以去离子水作为空白,在510 nm处测定其吸光度。3次测量取平均值。
1.3.2 葡萄糖标准曲线的绘制 以去离子水为溶剂配制成质量浓度为1.0 mg/mL的葡萄糖对照品贮备液,分别精密量取0.2、0.4、0.8、1.2、1.4、1.6、2.0 mL对照品溶液于7只10 mL玻璃试管中,加去离子水溶解并定容至10 mL,摇匀。分别取上述7种梯度溶液各0.5 mL,空白对照为0.5 mL去离子水,均加入4.0 mg/mL蒽酮-硫酸试剂4.0 mL,立即盖上塞子并摇匀,置于沸水浴中加热3 min,取出用自来水冷却到室温后立即测定其在620 nm处的吸光度。3次测量取平均值。
1.3.3 枣黄酮、多糖的提取 分别称适量不同品种枣于锥形瓶中,加入16倍量60%乙醇溶液,在超声功率为700 W,温度为60 ℃,提取时间为20 min下提取2次,抽滤,合并滤液并浓缩,得到黄酮、多糖混合浓缩液,往浓缩液中加入1.0%的三氯乙酸(TCA)溶液离心除去蛋白质,然后用95%的乙醇沉淀浓缩液中的多糖,并对多糖进行脱色,然后真空干燥成多糖粉末;分离出多糖后的上清液浓缩至无醇味后,稀释过X-5大孔吸附树脂,得到纯化的黄酮溶液,将其真空干燥成黄酮粉末。称取适量黄酮、多糖粉末用去离子水配制成一定浓度的溶液待测。
1.3.4 抗氧化活性测定 不同品种枣黄酮、多糖与维生素C的还原能力测定参照郝旭梅等[17]方法进行;DPPH自由基清除力测定参照刁静静等[18]试验方法进行;OH自由基清除力测定参考杨方美等[19]报道的方法;超氧阴离子自由基清除力测定参照李斐菲等[20]的试验方法进行。
2 结果与分析
2.1 芦丁标准曲线回归方程
采用亚硝酸钠-硝酸铝-氢氧化钠比色法得到芦丁标准曲线回归方程为y=11.475x+0.007 3(R2=0.999 3)。
2.2 葡萄糖标准曲线回归方程
采用硫酸-蒽酮比色法得到无水葡萄糖的标准曲线回归方程为y=4.452x-0.045(R2=0.999 1)。
2.3 不同品种枣黄酮、多糖含量
不同品种枣黄酮、多糖含量测定结果见表1。由表1可知,不同品种枣黄酮含量范围在0.84~0.96 mg/g,其高低顺序为小米枣>药枣>糖枣;不同品种枣多糖含量范围在5.03~7.24 mg/g,其高低顺序为小米枣>糖枣>药枣;3个品种枣中,小米枣的黄酮、多糖含量明显高于其余两个品种。
2.4 不同品种枣黄酮、多糖还原力
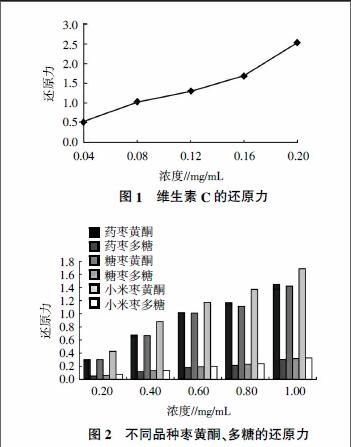
由图1可知,在试验选取的浓度范围(0.04~0.20 mg/mL)内,当浓度较低时,维生素C的还原力相对较弱,随着浓度的增大,其还原力逐渐增强,当浓度为0.20 mg/mL时,其还原力高达2.532。由图2可知,不同品种枣黄酮及多糖的还原力均与浓度呈正相关,且同一品种枣黄酮还原力远大于多糖的还原力;不同品种枣黄酮还原力强弱顺序为小米枣>药枣>糖枣,不同品种枣多糖还原力强弱为小米枣>糖枣>药枣,说明不同品种枣还原力强弱与黄酮及多糖含量呈正相关。其中小米枣黄酮还原力明显高于其余品种枣的还原力,小米枣黄酮浓度为1.0 mg/mL时,还原力为1.697,与0.16 mg/mL的维生素C还原力相当,说明维生素C的还原力为同等条件下小米枣黄酮的6倍。
2.5 DPPH自由基清除率
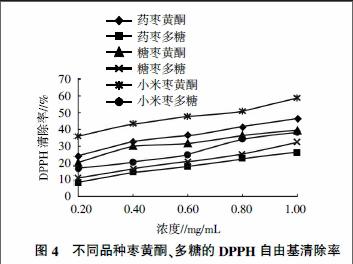
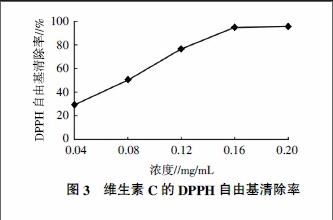
由图3可知,在试验选取的浓度范围内,维生素C对DPPH自由基的清除率随着浓度的增加逐渐增强后趋于稳定,当维生素C浓度为0.20 mg/mL时,其对DPPH的清除率为95.11%。由图4可知,不同品种枣黄酮、多糖对DPPH的清除率均随浓度的增加而增强,当浓度达到一定值后,清除率增加缓慢并趋于稳定,同一品种枣黄酮对DPPH的清除率均高于多糖;不同品种枣对DPPH的清除率強弱与黄酮及多糖含量呈正相关。其中小米枣黄酮浓度为0.8 mg/mL时清除率为51.06%,与0.08 mg/mL的维生素C对DPPH的清除率相当,说明维生素C对DPPH的清除率为同等条件下小米枣黄酮的10倍。
2.6 OH自由基清除率
由图5可知,在试验选取的浓度范围内,维生素C对OH自由基的清除率随着浓度的增加逐渐增强并趋于稳定,当维生素C浓度为1.00 mg/mL时,其对OH自由基的清除率为82.63%。由图6可知,不同品种枣的黄酮及多糖对OH自由基的清除率均随浓度的增加而逐渐增强,但3个品种枣黄酮对OH自由基的清除率增加幅度比多糖缓慢,当浓度达到一定值后,清除率均趋于稳定,且同一品种枣的黄酮对OH自由基的清除率均高于多糖;不同品种枣对OH自由基的清除率强弱与黄酮及多糖含量呈正相关。当小米枣黄酮浓度为1.00 mg/mL时,对OH自由基的清除率为56.98%,低于同浓度下维生素C对OH自由基的清除率。
2.7 超氧阴离子自由基清除率
由图7可知,在试验浓度范围内,维生素C对超氧阴离子自由基的清除率随着浓度的增加逐渐增强后趋于稳定,当维生素C浓度为0.20 mg/mL时,其对超氧阴离子的清除率为94.72%。由图8可知,不同品种枣黄酮及多糖在低浓度时对超氧阴离子的清除率均随浓度的增加而缓慢增强,超过一定浓度后,随浓度增加清除率增加比较明显,且同一品种枣黄酮对超氧阴离子自由基的清除率均高于多糖;不同品种枣对超氧阴离子自由基清除力强弱与黄酮及多糖的含量呈正相关。小米枣黄酮在浓度为1.00 mg/mL时,对超氧阴离子自由基清除率为77.37%,相当于0.12 mg/mL的维生素C对超氧阴离子自由基的清除率,说明维生素C对超氧阴离子自由基的清除率为同等条件下小米枣黄酮的8倍。
3 小结与讨论
人体内的自由基,特别是活性氧自由基的代谢异常,常会引发一些心脑血管病、癌症等疾病,清除体内多余自由基有利于人体健康,研究自由基清除剂已成为研究者关注的热点[21,22]。植物体内的次生代谢产物,由于能提供活泼的氢而中止自由基连锁反应,具有良好的自由基清除效果[23]。近年来,国内外在植物多酚清除自由基方面的研究报道较多,如苹果多酚、茶多酚[24,25]等。但对枣中多酚及多糖的抗氧化性报道相对较少,本研究以湖南衡阳地区不同品种枣为研究对象,全面考察了其黄酮与多糖的还原力,清除羟基、超氧阴离子、DPPH自由基的能力,为枣功能成分产品的研究提供了有力依据。采用超声法提取枣中的黄酮及多糖,分别用亚硝酸钠-硝酸铝-氢氧化钠比色法与硫酸-蒽酮法测定黄酮、多糖含量。结果表明,3个品种枣中,小米枣中黄酮及多糖的含量均高于其余两个品种。小米枣中黄酮、多糖含量分别为0.96、7.24 mg/g。
本试验将维生素C作为对照,综合考察了3个品种枣的体外抗氧化性。结果显示,小米枣的体外抗氧化性能明显强于糖枣与药枣,说明3个品种枣中,小米枣的开发利用价值较高;不同品种枣抗氧化性强弱与黄酮及多糖含量均呈正相关;3个品种枣黄酮及多糖的还原力、清除羟基自由基、超氧阴离子自由基及DPPH自由基的能力在试验浓度范围内均与浓度呈正相关,且均低于维生素C的抗氧化性;同一品种枣黄酮的抗氧化性明显高于多糖,若将黄酮、多糖复合在一起作为天然抗氧化剂时,黄酮将作为主抗氧化剂发挥作用,而多糖作为副抗氧化剂发挥作用,两者协同可发挥最佳抗氧化性能;当浓度为1.00 mg/mL时,小米枣黄酮的还原力、对超氧阴离子、DPPH及OH自由基的清除率分别为1.697、77.37%、58.81%、56.98%,均低于维生素C的抗氧化性,说明小米枣黄酮与多糖均具有一定的体外抗氧化性,但还需在此基础上进一步提高其纯度或扩大浓度范围,以得到黄酮、多糖发挥抗氧化性的最佳浓度,并将两者复配在一起发挥协同增效作用。由于本试验采用的均为体外化学方法,因此不能完全代表枣黄酮及多糖在体内清除自由基的实际情况,但是为进行枣功能成分的相关保健品的研究开发提供了参考。
参考文献:
[1] 郭 盛,段金廒,钱大玮,等.枣属植物化学成分研究进展[J].国际药学研究杂志,2013,40(6):702-710.
[2] 刘西建,张 艳.大枣药用历史沿革[J].陕西中医,2011,32(3):352-353.
[3] 赵爱玲,李登科,王永康,等.枣树不同品种、发育时期和器官的水溶性多糖含量研究[J].山西農业科学,2012,40(10):1040-1043.
[4] 陈 熹,李玉洁,杨 庆,等.大枣现代研究开发进展与展望[J].世界科学技术-中医药现代化,2015,17(3):687-691.
[5] 袁亚娜,张平平,何庆峰,等.冬枣黄酮的分析及体外抗氧化活性[J].食品科学,2013,34(17):70-73.
[6] 耿武松,王雨艨,史学礼,等.不同来源大枣中有效成分芦丁含量的比较研究[J].现代中药研究与实践,2011,25(6):69-71.
[7] 韩燕霞,郭增军,张 卉,等.阳离子交换树脂提取拐枣七中总生物碱的工艺研究[J].中国现代应用药学,2012,29(7):624-627.
[8] 郭 英,贝玉祥,王雪梅,等.超声波法提取广枣多酚的研究[J].云南中医中药杂志,2008,29(8):36-37.
[9] 王旭峰,何计国,陈 阳,等.酸枣仁皂苷的提取及改善睡眠功效的研究[J].食品科学,2006,27(4):226-229.
[10] 赵 堂,郝凤霞,杨敏丽,等.几种红枣中生物活性物质环磷酸腺苷的含量分析[J].湖北农业科学,2011,50(23):4955-4957.
[11] 额 都,张 彬,刘继军,等.正交试验优选益母草的提取工艺研究[J].中国民族医药杂志,2010,16(2):40-41.
[12] 陈 磊.洋葱黄酮的提取条件及抗氧化活性的研究[J].食品工业科技,2013,34(16):91-94.
[13] 王荣刚.大枣多糖生物学活性的研究进展[J].兽医导刊,2015(14):18.
[14] 亓树艳,王 荔,莫晓燕.大枣多糖的提取工艺及抗氧化作用研究[J].食品与机械,2012,28(4):117-120.
[15] 廉宜君,李炳奇,肖芙蓉,等.沙枣多糖对小鼠免疫功能影响的研究[J].时珍国医国药,2009,20(5):1126-1127.
[16] 王统一,赵 兵,王玉春.多糖免疫调节和抗肿瘤研究进展[J].过程工程学报,2006,6(4):674-682.
[17] 郝旭梅,鲍建才,杨智慧,等.无梗五加叶体外抗氧化活性研究[J].包装与食品机械,2011,29(4):1-5.
[18] 刁静静,于 伟,张丽萍.豌豆蛋白水解物的分离及其抗氧化活性的研究[J].包装与食品机械,2013,31(3):25-29.
[19] 杨方美,王 林.鼠尾藻多糖的制备及其抗氧化活性[J].食品科学,2005,26(2):224-227.
[20] 李斐菲,吴拥军,屈凌波,等.中药巴戟天抗自由基活性的研究[J].光谱实验室,2005,22(3):553-555.
[21] 谭榀新,叶 涛,刘湘新,等.植物提取物抗氧化成分及机理研究进展[J].食品科学,2010,31(15):288-292.
[22] 吕双双,李书国.植物源天然食品抗氧化剂及其应用的研究[J].粮油食品科技,2013,21(5):60-65.
[23] 郑 萍.天然抗氧化剂的应用与发展[J].科技展望,2016(1):123-124.
[24] 冯 涛,杨 容,李越敏,等.苹果多酚提取物抗氧化活性研究[J].食品研究与开发,2008,29(12):189-192.
[25] 邬新荣,王岳飞,张士康,等.茶多酚保健功能研究进展与保健食品开发[J].茶叶科学,2010,30(S1):501-505.

