氨基隐性孔雀石绿抗体的制备及ELISA方法的建立
常超+张佳艳+程时杰+伍金娥

摘要:以N,N-二甲基苯胺、对硝基苯甲醛为原料,合成改造了氨基隐性孔雀石绿半抗原,并通过紫外、红外、质谱鉴定。结果表明,氨基隐性孔雀石绿半抗原改造成功。采用重氮化法合成了氨基隐性孔雀石绿人工抗原,并通过紫外光谱进行鉴定,结果显示偶联蛋白成功。免疫大白兔制备了隐性孔雀石绿抗体,抗体效价达6.4×104。建立了隐性孔雀石绿ELISA方法,最低检测线为0.1 μg/L。
关键词:孔雀石绿;隐性孔雀石绿;抗体;ELISA
中图分类号:O657.7+3 文献标识码:A 文章编号:0439-8114(2017)07-1340-05
DOI:10.14088/j.cnki.issn0439-8114.2017.07.036
Preparation of Antibody of Amino-Leucomalachite Green
and Development of ELISA Method
CHANG Chao, ZHANG Jia-yan, CHENG Shi-jie, WU Jin-e
(College of Food Science and Technology, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract: With N,N-dimethylanilin and p-nitrobenzaldehyde as raw materials,the hapten of amino-leucomalachite green (NH2-LMG) was synthesized and then was identified with ultraviolet,infrared and mass spectrum. The results showed that the artificial antigen of NH2-LMG was successfully synthesized by diazotization method and was identified by ultraviolet spectrum,which indicated the success of the coupling protein. The antibody of NH2-LMG was prepared with immune New Zealand white rabbits,and the antibody titer reached 6.4×104. The ELISA method was developed, with the limit of detection of 0.1 μg/L.
Key words: malachite green; leucomalachite green; antibody; enzyme-linked immunosorbent assay
孔雀石绿(Malachite Green,MG)是合成的三苯甲烷类染料,因具有高效广谱杀菌作用而曾广泛应用于水产养殖行业。然而,孔雀石绿在水生动物体内会被代谢成隐性孔雀石绿(Leucomalachite Green,LMG),其代谢产物被视为残留标示物,孔雀石绿(图1)和隐性孔雀石绿(图2)具有致畸致癌致突变的毒性[1-4],包括中国在内的许多国家都已严禁使用。但由于其价格便宜,违禁使用的事件屡有发生,给人类的健康带来巨大的隐患。目前,国内外对三苯甲烷类物质的检测主要运用色谱技术,如HPLC、LC-MS等[5-10],中国颁布的检测标准SN/T 1479-2004和GB/T 20361-2006[11,12]也主要采用仪器方法。仪器方法虽然灵敏度高、准确性好,但需要昂贵的仪器,样品处理复杂,不适合大量样品的筛选。酶联免疫吸附测定法(ELISA)因具有快速、灵敏、高效等优点,用于大批量药物残留筛选越来越广泛。国内外已经开始研发隐性孔雀石绿ELISA方法,但在半抗原改造时大多数是在苯环引入羧基[13-18]。为了能够筛选出更灵敏的抗体,本试验设计在苯环上引入硝基,并运用紫外、红外和质谱对半抗原改造进行鉴定,采用重氮化法合成人工抗原,并对抗体进行筛选,建立了隐性孔雀石绿ELISA方法,为开发更灵敏的隐性孔雀石绿试剂盒奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验动物 2月龄雄性健康新西兰大白兔,体重1.5±0.5 kg,购于湖北省疾病预防控制中心。
1.1.2 试剂 对硝基苯甲醛、N,N-二甲基苯胺、二甲基亚砜等,国药集团化学试剂有限公司上海分公司;弗氏完全佐剂、弗氏不完全佐剂、牛血清蛋白(BSA)、卵清蛋白(OVA)等,Sigma公司;羊抗兔IgG-辣根过氧化物酶偶合物(GaR IgG-HRP),碧云天生物技术研究所。
1.1.3 仪器 NEXUS670型傅里叶红外光谱仪(美国Nicolet仪器公司);LTQ XL型高效液相色谱-质谱联用仪(美国Thermo Fisher Scientific公司);Eimer Lambda25型紫外可见吸收光谱仪(美国Perkin Eimer公司);MagenllanCE 2.5型酶标仪(瑞士SUNRISE公司等)。
1.2 方法
1.2.1 硝基化隱性孔雀石绿的合成及鉴定 硝基化隐性孔雀石绿(NO2-LMG)合成路线见图3。称取对硝基苯甲醛3.63 g,N,N-二甲基苯胺15 mL,无水ZnCl2 8.00 g,无水乙醇150 mL于圆口烧瓶中,氮气保护100 ℃下回流24 h,反应结束旋转蒸发掉溶剂后将其置于冰箱中,24 h出现沉淀,抽滤后得到黄色沉淀,用丙酮和水的混合溶液对NO2-LMG粗产物作重结晶。产物经紫外、红外、质谱鉴定,液相色谱测定其含量。液质联用仪的色谱条件:柱温20 ℃;进样量10 μL;流速0.2 mL/min;流动相为乙腈+0.05 mol/L乙酸铵缓冲液(pH 4.5,75∶25)。质谱条件:离子源ESI(+):喷雾电压4.5 kV;毛细管电压16.5 V;毛细管电流温度300 ℃;鞘气30 arb;辅助气反吹气流量0 arb;源内碰撞电压8.0 V;毛细管透镜电压55 V。
1.2.2 氨基化隐性孔雀石绿的合成及鉴定 称取0.75 g硝基隐性孔雀石绿,2.24 g铁粉,浓盐酸2 mL,去离子水10 mL于80 ℃下回流反应8 h。反应结束后趁热过滤掉铁粉,母液置于冰箱中,3 h内出现浅绿色沉淀,抽滤,水洗3次,真空冷冻干燥后得到氨基隐性孔雀石绿粗产物(NH2-LMG)。产物经紫外、红外、质谱鉴定。质谱鉴定条件同“1.2.1”。
1.2.3 人工抗原的合成及鉴定 使用重氮化法将NH2-LMG上的氨基与蛋白质上的羧基进行偶联。取氨基隐性孔雀石绿34.5 mg溶于10 mL预冷的浓盐酸中,充分溶解。在4 ℃的条件下逐滴向其加入0.1 mol/L的亚硝酸钠溶液,期间用碘化钾试纸检验,变为深蓝色终止滴加。用浓度为0.01 mol/L的氢氧化钠溶液调节上清液pH至7,为A液。将135 mg BSA溶解于10 mL的PBS缓冲液当中,为B液。4 ℃磁力搅拌下,将A液缓慢倒入B液中,反应过夜, 4 000 r/min离心10 min,取上清液于pH为7.4的PBS缓冲液中透析,产物经紫外光谱鉴定。
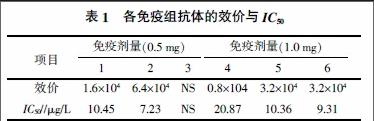
1.2.4 动物免疫试验 6只2月龄体重1.5±0.5 kg 的雄性健康新西兰大白兔,用NH2-LMG-BSA免疫,设计两个剂量(0.5 mg/只、1.0 mg/只),每个剂量各3只,免疫时间间隔均为1个月。基础免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂。从第三次免疫开始,每次免疫后7~10 d耳静脉采血,直接ELISA测定各抗体效价。间接竞争ELISA测定IC50。
1.2.5 方法的建立 采用方阵滴定法和间接竞争ELISA法优化抗原包被浓度、抗体工作浓度。在上述最佳条件下,将LMG母液稀释成0、0.1、0.4、1.6、6.4和25.6 μg/L,按间接竞争ELISA方法进行测定,以LMG溶液浓度的对数为横坐标,抑制率为纵坐标,绘制标准曲线,其中抑制率=100%×B/B0, B0和B分别为零标准孔和含药物孔所对应的吸光度。
2 结果与分析
2.1 硝基隐性孔雀石绿结构表征
KBr压片,测得目标化合物的红外光谱见图4。图谱显示1 340、1 690、1 600~1 400 cm-1处有强吸收峰,1 340 cm-1为NO2的伸缩振动峰,1 690 cm-1为C=O的伸缩振动峰,1 600~1 400 cm-1为苯环上的C=C的伸缩振动峰,与硝基隐性孔雀石绿的官能团一致。
目标化合物液相色谱图(图5)显示出峰时间为3.11 min,质谱鉴定显示一级质谱图(图6)中得到一相对分子质量为376.02的离子峰,该相对分子质量与硝基隐性孔雀石绿相对分子质量一致。以母离子m/z 376.2进行二级质谱鉴定(图7):m/z 361.04(M+-CH3),m/z 239.09(M+-NO2-C6H4-CH3),多级质谱分析显示硝基隐性孔雀石绿合成成功。
2.2 氨基隐性孔雀石绿结构表征
KBr压片,测得目标化合物的红外光谱见图8。图谱显示3 433、3 353、1 690、1 600~1 400 cm-1处有强吸收峰,3 433 cm-1与3 353 cm-1为NH2的伸缩振动峰,1 690 cm-1为C=O的伸缩振动峰,1 400~600 cm-1为苯环上的C=C的伸缩振动峰,与氨基隐性孔雀石绿的官能团一致。
目标化合物液相色谱图(图9)显示出峰时间为1.938 min,质谱鉴定显示一级质谱图(图10)得到一分子量为346.12的离子峰,该分子量与氨基隐性孔雀石绿分子量一致。以母离子m/z 346.1进行二级质谱鉴定(图11):m/z 331.13(M+-CH3),多级质谱分析显示氨基隐性孔雀石绿合成成功。
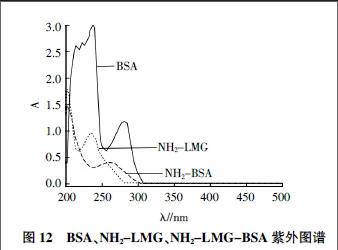
2.3 人工抗原结构表征
免疫原NH2-LMG-BSA紫外图谱见图12。BSA最大吸收波长为280 nm,NH2-LMG-BSA最大吸收波长为259 nm,载体偶联半抗原后最大吸收波长发生明显改变,初步证明NH2-LMG与BSA偶联成功。
2.4 抗体质量
免疫4次后,直接ELISA 测定各免疫组效价,间接竞争ELISA测定IC50,结果见表1。结果显示除了低剂量组(0.5 mg)中免疫兔Rab-3没有免疫反应,其他免疫兔均有反应。免疫兔Rab-2产生的抗体灵敏度更高,建议选择该抗体。通过测定交叉反应率,显示该抗体除了对隐性孔雀石绿(100%)以及原型药孔雀石绿(30%)有反应,对其他药物没有交叉反应(<0.01%)。
2.5 方法的建立
2.5.1 抗原最佳包被浓度 方阵滴定确定抗原包被浓度结果见表2。OD值在1.000左右的包被抗原浓度为500 μg/L,以500 μg/L为中心浓度,包被300、400、500、600、700 μg/L 5个浓度作间接竞争ELISA,测定IC50。见表3。结果表明,包被400 μg/L的抗原,IC50最小,抗体反应最灵敏。
2.5.2 抗体最佳工作浓度 方阵滴定确定抗体工作浓度结果见表1。OD值在1.0左右的抗体工作浓度为3.2×104,以3.0×104为中心浓度,设计2.0×104、2.5×104、3.0×104、3.5×104、4.0×104 5个浓度作间接竞争ELISA,结果见图4。结果表明,抗体稀释2.5×104,IC50最小,抗体反应最灵敏。
2.5.3 标准曲线 以抑制率为纵坐标,LMG浓度的對数作为横坐标作标准曲线,结果见图13。曲线在0.1~25.6 μg/L趋近直线,线性关系好。
3 小结
建立小分子化合物免疫化学最为关键的技术是获得高质量的抗体,而高质量的抗体取决于小分子半抗原的改造和人工抗原的合成。孔雀石绿的残留标示物是其代谢产物隐性孔雀石绿,隐性孔雀石绿结构本身不含有羧基和氨基等活性基团与蛋白质偶联,因此必须对隐性孔雀石绿半抗原进行结构改造引入羧基或氨基。已报道的孔雀石绿半抗原改造大多数是引入羧基,本研究选择N,N-二甲基苯胺、对硝基苯甲醛,合成了氨基隐性孔雀石绿半抗原,并通过紫外、红外、质谱进行鉴定,重氮化法将氨基隐性孔雀石绿与蛋白偶联,通过紫外和动物免疫试验显示隐性孔雀石绿半抗原和人工抗原合成成功。选择最优的抗体建立了间接竞争ELISA,检测范围0.1~25.6 μg/L,检测能力0.1 μg/L,为进一步开发隐性孔雀石绿检测试剂盒提供了技术支撑。
参考文献:
[1] CULP S J,BLANKENSHIP L R,KUSEWITT D F,et al.Toxicity and metabolism ofmalachite green and leucomalachite green during short-term feeding to Fischer 344 rats and B6C3F1 mice[J].Chemico Biological Interactions,1999,122(3):153-170.
[2] MAJANATHA M G,SHELTON S D. Carcinogenicity of malachite green chloride and leucomalachite green in B6C3F1 mice and F344 rats[J].Food and Chemical Toxicology,2006,44(8):1204-1212.
[3] MITTELSTAEDT R A,MEIN W,SHADDOCK J G,et al. Genotoxicity ofmalachite green and leucomalachite green in female Big BlueB6C3F1 mice[J].Mutation Research,2004,561(1-2): 127-138.
[4] CULP S J,BELAND F A,HEXICH R H,et al.Mutagenicity and carcinogenicity in relation to DNA adduct formation in rats fed leucomalachite green[J].Mutation Research,2002,506-507(2):55-63.
[5] MITROWSKA K,POSYNIAK A,ZMUDZKI J. Determination of alachite green and leucomalachite green in carp muscle by liquid chromatography with visible and fluorescence detection[J]. Journal of Chromatography A,2005,1089:187-192.
[6] TARBIN J A,BARNES K A,BYGRAVE J,et al. Screening and confirmation of triphenylmethane dyes and theirleucometabolites in trout muscle using HPLC-vis and ESPLCMS[J]. Analyst, 1998,123(12):2567-2571.
[7] VALLE,CECILIA D,ANTONIO L Z,et al. Determination of the sum of malachite green and leucomalachite green in salmon muscle by liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry[J]. Journal of Chromatography A, 2005,1067(1-2):101-105.
[8] GERALDINE D,PATRICK P J,CONOR D,et al. Confirmatory analysis of malachite green, leucomalachite green, crystal violet and leucocrystal violet in salmon by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta,2007, 586(1-2):411-419.
[9] LEE K C,WU J L,CAI Z W.Determination of malachite green and leucomalachite green in edible goldfish muscle by liquid chromatography-ion trap mass spectrometry[J].Journal of Chromatography B,2006,843(2):247-251.
[10] VANDERIET J M,MURPHY C J,PEARCE J N,et al. Determination of malachite green and leucomalachite green in a variety of aquacultured products by liquidchromatography with tandem mass spectrometry detection[J].J AOAC Int,2005,88(3):744-749.
[11] SN/T 1479-2004,進出口水产品中孔雀石绿残留检测[S].
[12] GB/T 20361-2006,水产品中孔雀石绿和结晶紫残留量的测定高效液相色谱荧光检测法[S].
[13] YANG M C,FANG J M,KUO T F,et al. Production of anti-bodies for selective detection of malachite green and the related triphenylmethane dyes in fish and fishpond water[J].Journal of Agricultural and Food Chemistry,2007,55(22):8851-8856.
[14] XING W W,HE L,YANG H,et al. Development of a sensitive and group-specificpolyclonal antibody-based enzyme-linkedimmunosorbent assay(ELISA) for detectionofmalachite green and leucomalachite greenin water and fish samples[J]. Journal of the Science of Food and Agriculture,2009,89: 2165-2173.
[15] OPLATOWSKA M,CONNOLLY L,STEVENSON P,et al.Development and validation of a fast monoclonal based disequilibrium enzyme-linked immunosorbent assay for the detection of triphenylmethane dyes and their metabolites in fish[J].Analytica Chimica Acta,2011,698:51-60.
[16] 王 权,李 健,郭德华,等.无色孔雀石绿免疫原的合成与鉴定[J].中国兽医科学,2007,37(6):534-538.
[17] 沈玉栋,王 宇,孙元明,等.隐性孔雀石绿半抗原及全抗原设计、合成及鉴定[J].食品科学,2008,29(7):263-266.
[18] 梁莉甜,刘志国,付云洁,等.隐性孔雀石绿多克隆抗体的制备及鉴定[J].食品科学,2013,34(7):227-230.

