循环microRNA-122a和microRNA-6086在肝癌诊断及预后中的作用
张楚红,胡 甜,阳学风,李 赛,吕 秀,贺 莎,严汉兴,谭贻兮,陈荣如,文美玲,李金成,左建宏
(1.南华大学附属南华医院,衡阳 421000;2.南华大学医学院,衡阳 421000;3.邵阳学院医学部,邵阳422000)
循环microRNA-122a和microRNA-6086在肝癌诊断及预后中的作用
张楚红1,2,胡 甜1,2,阳学风1,李 赛1,吕 秀1,贺 莎1,严汉兴1,谭贻兮1,陈荣如1,文美玲1,李金成3,左建宏1,2
(1.南华大学附属南华医院,衡阳 421000;2.南华大学医学院,衡阳 421000;3.邵阳学院医学部,邵阳422000)
目的:检测肝癌患者血清中miR-122a、 miR-6086含量,研究其在肝癌诊断及预后中的作用。方法:采用 real-time PCR方法进一步检测血清中 miR-122a和 miR-6086的表达水平。 结果:观察组血清中 miRNA-122a的相对含量低于对照组;miR-6086 的含量高于对照组,差异均有统计学意义;统计分析发现,在不同年龄、分期、分型、肿瘤大小及AFP水平、肝功能等,患者间相对表达量差异均无统计学意义;MiRNA-122a的AUC面积为0.842,大于miRNA-6086 的0.782 AUC面积,且对原发性肝癌的诊断的敏感性高于miRNA-6086,特异度无明显区别;MiRNA-6086的表达量越高患者的生存时间越短,相反表达量越低生存时间越长;miRNA-122a的表达量较正常人下调,但是其生存曲线上低表达量生存时间长于高表达的生存时间。结论:MiRNA-6086、miRNA-122a的表达水平较正常人有显著差异,可以作为肝癌诊断及预后的新指标。
肝癌;MiR-122a;MiR-6086
肝细胞癌(HCC)是消化道最常见的恶性肿瘤,具有侵袭性高、转移率高、病死率高,5年生存率低的特点[1-2]。全世界每年约有70 万人死于HCC,高居全球恶性肿瘤相关死亡率的第3位[3]。目前HCC患者早期手术切除的5年生存率不到80%[4],肝移植后的5 年生存率只有70%左右,而经皮射频消融术后5年生存率仅有50%[5]。通常在肝癌早期无特异性症状,一旦发现则进入晚期,进而失去手术时期[6]。因此寻找新的、灵敏度高的诊断方法,对肝癌的早期诊断,指导治疗极为重要[7]。
MicroRNA是一类广泛存在于真核生物中序列高度保守的内源性单链非编码RNA,长约 20 ~ 24 个核苷酸,它主要通过与靶基因信使RNA的 3'非翻译区部分或完全互补结合抑制信使RNA的翻译或使其降解,从而在转录后水平调控靶基因的表达[8-9]。MiRNA存在各种体液中如血液、尿液、眼泪等,并且能在其中稳定表达[10]。MiRNA参与肿瘤的生物调控机制,有癌基因和抑癌基因作用[11-12],检测相关miRNA不仅可以优化肿瘤诊断和个体化治疗,而且可以作为判断疾病预后的工具[13-14]。越来越多的研究证实了肝癌组织与正常组织中的miRNA表达具有显著差异,miRNA在肝癌的发生、分化、浸润转移和凋亡阶段起着重要的调控作用[15]。
1 资料与方法
1.1 一般资料 将 2014 年 10 月~2015 年 12 月在南华大学附属南华医院确诊并接受治疗的 45 例肝癌患者纳入实验组。纳入标准:①结合临床症状、 体征,实验室检测及影像学、病理学检查确诊为肝癌;②取得患者知情同意。 参照观察组患者的基本资料,选择同期在我院体检的45例健康者纳入研究的对照组。
1.2 材料 所有实验材料均购买于QLAGEN GMBH德国公司,包括miRNA 提取、 cDNA 合成以及 real-time PCR 检测的试剂盒。荧光定量PCR 仪为 美 国 Life Technologies Applied 公 司 的Biosystems-7500 实时荧光定量 PCR 仪。
1.3 实验方法 1.3.1 样本收集 观察组患者于确诊后采集外周血3 mL,对照组患者于体检时采集外周血3mL,室温下离心机3600转离心5分钟,取上层血清保存于-80℃冰箱,用于 microRNA 检测。
1.3.2 MicroRNA 含量检测 取出已离心好的血清再次离心,按照文献的方法用QIAZOL法提取血液样本的 RNA,按1:5比例加入QIAZOL提取总 mRNA,再用75%乙醇洗涤沉淀出 mRNA 后,用DEPC水溶解待用。按照QLAGEN逆转录试剂盒的方法,在普通 PCR 仪上将溶解的总 RNA 为模版,加入试剂盒提供的逆转录酶、dNTP 以及反应缓冲液,将 mRNA逆转录成cDNA,-20 °C 保存待用。检测时采用 miRNA 荧光定量 PCR 检测试剂盒进行 real time-PCR 检测。
1.4 统计方法 采用 SPSS 18.0 软件,T检验方法分析所有数据,采用(均数 ± 标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 MiRNA-6086、miRNA-122a表达水平的检测在正常人与原发性肝癌患者血清中的PCR的荧光信号达阈值后,读出各组血清 miRNA-6086、miRNA-122a达到荧光阈值所需循环数(Ct)值,根据方法中的公式算出血清miRNA-6086、miRNA-122a 的△CT。如表1所示原发性肝癌患者血清miRNA-6086 水平与正常人血清中相比,明显升高,统计学上差异显著意义(P<0.05);而血清miRNA-122a水平与正常人血清中相比,明显下调,统计学上有显著差异(P<0.05)。

表1 原发性肝癌患者与正常人MiRNA -6086 、MiRNA-122a △CT的比较
将肝癌血清miRNA-6086、miRNA-122a的△CT分别与正常组的△CT比较,差异有统计学意义,进一步做统计图直观表达(如图1),肝癌miR-6086表达明显高于正常人;miRNA-122a表达低于正常人。

图1 肝癌患者与正常人血清miRNA散点图注:A代表miRNA-6086,B代表miRNA-122a
2.2 原发性肝癌患者循环miR-6086、miR-122a与其临床病理资料相关性分析 对血清miR-6086、miRNA-122a在不同临床病理特征中的△CT差异的比较采用SPSS18.0软件。统计分析发现(表2),在不同年龄、分期、分型、肿瘤大小及AFP水平、肝功能等,患者间相对表达量差异均无统计学意义(P>0.05)。
2.3 血清miRNA-6086、miRNA-122a在肝癌诊断中的ROC曲线分析 应用ROC曲线分析显示,在区分肝癌患者与正常人时,miR-6086 AUC(曲线下面积)为0.782(95CI:0.688~0.875,P<0.001)(图2A),敏感度为71.10%,特异度为71.10%;miRNA-122a的AUC为0.842(95CI:0.756~0.928,P<0.001)(图2B),敏感度为95.60%,特异度为71.10%。为进一步探讨miRNA 与AFP之间关系,我们将miRNA-6086和miRNA-122a分别联合AFP做ROC曲线分析。miRNA-6086联合AFP的曲线下面积为0.888(95CI:0.824~0.952,P<0.001)(图2C),敏感度为71.10%,特异度为91.10%;MiRNA-122a联合AFP的曲线下面积为0.913(95CI:0.854~0.972,P<0.001)(图2D),敏感度为95.60%,特异度为83.30%。

表2 血清miR-6086、miR-122a与肝癌临床病理资料相关性分析
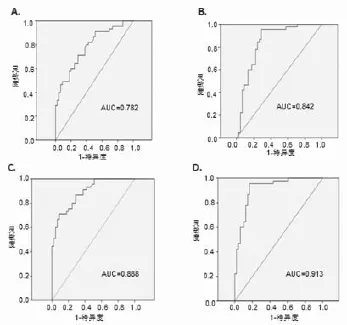
图2 肝癌患者与正常人血清miRNA的ROC曲线图注:A代表miRNA-6086,B代表miRNA-122a;C代表miRNA-6086联合AFP,D代表miRNA-122a联合AFP
2.4 循环miRNA-6086及miRNA-122a对原发性肝癌患者生存期限关系的分析 我们将肝癌患者的预后与miRNA-6086及miRNA-122a的表达量做了统计分析。以miRNA-6086及miRNA-122a的平均△CT为界,经统计分析发现:肝癌患者miRNA-6086的表达量越高患者的生存时间越短,相反表达量越低生存时间越长,P<0.05(图3A)。 肝癌患者血清miRNA-122a的表达量较正常人下调,但是其生存曲线上低表达量肝癌患者生存时间长于高表达量患者的生存时间,P<0.05(图3B)。

图3 肝癌患者与正常人血清miRNA生存期限图注:A代表miRNA-6086,B代表miRNA-122a
3 讨论
肿瘤引起患者死亡最主要的原因在于其无限的生长及易转移造成相应并发症引起患者一系列的临床症状,进而导致患者死亡。这一过程受多种基因的调控,因此对肝癌生物标记物的研究有重要意义,有助于进一步诊断肝癌并判断患者预后[16]。
目前临床上常用的肝癌诊断标记物为甲胎蛋白(AFP)、 血清谷氨酰转肽酶(GGT)、胰岛素生长因子(IGF)、转化生长因子(TGF)等[17],然而这些诊断标记物的敏感度和特异度并不十分理想,如AFP 在妊娠妇女、急慢性肝炎、生殖腺肿瘤和胃肠道肿瘤等人群中也可能升高[18-19]。研究表明[20],外周血中的miRNA不被RNA酶裂解,因此通过外周血检测 miRNA,可以用于恶性肿瘤的筛查和诊断。研究报导一些 miRNA 与HCC 的发生、发展、组织分型 分化程度密切相关[21],具有组织特异性,提示 miRRNA 可在 HCC 的早期诊断及预后判断方面极具临床价值。
目前肝功能指标、门静脉高压、肿瘤状态以及体能状态等临床表现均被作为肝癌预后判断和治疗选择的参考因素,miRNA可用来改进肝癌分类和预后风险分级[22]。本实验发现肝癌患者血清miRNA-122a水平与正常人血清相比,明显下调,统计学上有显著意义,与前人研究结果比较一致[23-24];但其与患者年龄、分期、分型、肿瘤大小及AFP水平无统计学意义,尚无其他有关此方面的实验研究报道。
同样目前尚未明确发现肝癌患者血清miRNA-6086的研究报道,我们的实验结果表明:原发性肝癌患者血清miRNA-6086水平与正常人血清中相比,明显升高,有统计学上意义,但与患者年龄、分期、分型、肿瘤大小、AFP水平及肝功能等均无统计学意义。比较miRNA-122a与miRNA-6086的ROC曲线,我们发现miRNA-122a的AUC面积大于miRNA-6086 AUC面积,因此推测它对原发性肝癌的诊断性越好。MiRNA-6086和miRNA-122a分别联合AFP做ROC曲线分析提示两者的AUC面积均较单独分析时增大,特异度均较单独分析时提高,灵敏度没有改变,证明microRNA联合AFP可以提高对肝癌诊断的特异度。肝癌患者循环miRNA-6086较正常人表达上调,其表达量越高生存期限越短;但是肝癌患者循环miRNA-122a较正常人表达量下调,且表达量越低生存时间反而越长。综上本研究证实,循环MiRNA-6086、MiRNA-122a的表达水平较正常人有显著差异,可以作为诊断肝癌及判断预后的参考。
[1] Wang CM, Wang Y, Fan CG, et al. miR-29c targets TNFAIP3, inhibits cell proliferation and induces apoptosis inhepatitis B virus-related hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2011, 411: 586-592.
[2] Song P, Feng X, Zhang K, et al, Screening for and surveillance of highrisk patients with HBV- related chronic liver disease: promoting the early detection of hepatocellular carcinoma in China[J]. Biosci Trends, 2013, 7(1): 1-6.
[3] Qu Yachao, L Yu Jun. Research progress in serum microRNA detection for diagnosis of hepatocellular carcinoma[J]. Chinese Journal of Clinical Hepatology.2014, 30(3): 228-232.
[4] Xi X, Siyu C. Research progress of microRNA and hepatocellular carcinoma[J]. Journal of basic and Clinical Oncology.2014, 27(05): 447-450.
[5] Fomer A, Diaz-Gonzalez A, Liccioni A, et al. Prognosis prediction and staging[J]. Best Pract Res Clin Gastroenterol, 2014, 28(5): 855-865.
[6] Caturegli P, De Remigis A, Rosen R. Hashimoto thyroiditis: Clinical and diagnostic criteria[J]. Autoimmun Rev, 2014, 13(4-5): 391-397.
[7] Yamamoto M, Tabeya T, Naishiro Y, et al. Value of serum IgG4 in the diagnosis of IgG4-related disease and in differentiation from rheumatic diseases and other diseases[J]. Mod Rheumatol, 2012, 22: 419-425.
[8] Giordano S, Columbano A. MicroRNAs: new tools for diagnosis prognosis, and therapy in hepatocellular carcinoma ? [J]. Hepatology, 2013, 57(2): 840-847.
[9] Volinia S, Calin GA, Liu CG, et al. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proc Natl Acad Sci U S A, 2006, 103(7): 2257-2261.
[10] McDonald JS, Milosevic D, Reddi HV, et al. Analysis of circulating microRNA: preanalytical and analytical challenges[J]. Clin Chem, 2011, 57(6): 833 840.
[11] Li DS, Ouyang XH, Dong PD, et al. Advances in research on the effect of micro RNA and anti tumor drugs [J]. Chinese Journal of Clinicians (electroniclectronicedition), 2012, 6(12): 3353-3355.
[12] Wen W, Chen GD, He GS HE J. Application of miRNA in the prognosis of patients with hepatocellular carcinoma [J]. CHINA MEDICINE AND PHARMACY.2014, 4(03): 37-39.
[13] Hou J, Cao XT. MicroRNAs in the management of hepatocellular car-cinoma: New opportunities and challenges[J]. Chin J Cancer Biother [J].2015, 22(01): 1-7.
[14] Han i, Liu Y, Chu HY, Chen C. Research progress of micro RNA in the early diagnosis and prognosis of hepatocellular carcinoma[J]. Chin J Clin Lab Sci, 2015, 33(06): 457-459.
[15] Pineau P, Volinia S, McJunkin K, et al. MiR-221 overexpression contributes to liver tumorigebesis[J]. Proc Natl Acad Sci USA.2010, 107(1): 264-269.
[16] Li ZW, Wu Tao, Fu YX, Wu SW. Expression and role of MicroRNA-31 in hepatocellular carcinoma[J]. Chinese Journal of Clinical Pharmacology and Therapeutics.2015, 20(10): 1098-1101.
[17] Pang XP. Researches of the role of microRNAs in hepatocellular carcinoma. Strait Pharmaceutical Journal [J].2014, 26(02): 87-89.
[18] Deng ZHL, Sun J, Ying L, et al. screening and validate MicroRNA associated with early Recurrence after Radical surgery primary hepatocellular carcinoma. Journal of Sun Yat-Sen University[J].2012, 33(4): 494-498.
[19] Zheng Y, Yin L, Chen H, et al. miR-376a suppresses proliferation and induces apoptosis in hepatocellular carcinoma[J]. FEBSLett, 2012, 586(16): 2396-2403.
[20] Mraz M, Malinova K, Mayer J, et al. MicroRNA isolation and stability in stored RNA samples[J]. Biochem Biophys Res Commun, 2009, 390(1): 1 4.
[21] Qi W, Liang W, Jiang H, et al. The function of miRNA in hepaticcancer stem cell[J]. Biomed Res Int, 2013, 2013: 358902.
[22] Song L, Wang Z, Zhang HL . The role of microRNA in the diagnosis, treatment and prognosis of hepatocellular carcinoma. Malignant·transformation·mutation[J].2015, 27(4): 325-328.
[23] Hsu SH, Wang B, Kota J, et al. Essential metabolic, antiinflammatory, and antitumorigenic functions of miR-122 in liver[J]. . J Clin Invest.2012; 122: 2871-2883.
[24] Tsai WC, Hsu SD, Hsu CS, et al. MicroRNA-122 plays a critical role in liver homeostasis and hepatocarcinogenesi[J]. s. J Clin Invest.2012; 122: 2884-2897.
Role of circulating miRNA-122a and miRNA - 6086 in diagnosis and prognosis of hepatocellular carcinoma
Zhang Chu-hong1, 2, Hu Tian1, 2, Yang Xue-feng1, Li Sai1, Lv Xiu1, He Sha1, Yan Han-xing1, Tan Yi-xi1, Chen Rong-ru1, Wen Mei-ling1, Li Jin-cheng3, Zuo Jian-hong1, 2
(1. Nanhua Hospital of University of South China, Hengyang 421000, China; 2. Medical College of University of South China, Hengyang 421000, China; 3. Shaoyang University, shaoyang 422000, China)
Objective The purpose of this study is to investigate the expression of miRNA-6086, miRNA-122a in the serum of normal and primary hepatocellular carcinoma, and to research the relationship between the diagnosis and prognosis of hepatocellular carcinoma. Methods The miR-122a and miR-6086 in serum were detected by real-time PCR method. Results The relative content of miRNA-122a in the experimental group was lower than that of the control group, but the content of miR-6086 was higher than that of the control group and the difference both were statistically significant. Statistical analysis revealed that there were no significant differences in the relative expression of the patients in different age, stage, classification, tumor size, AFP level, liver function and so on. AUC MiRNA-122a area was 0.842, greater than the 0.782 AUC area of miRNA-6086, which the sensitivity of the diagnosis of HCC was higher than miRNA-6086 and no significant difference in specificity. The higher expression level of miRNA-6086, HCC patients have shorter of survival time; the lower of expression level, HCC patients have longer of survival time. Although the expression level of miRNA-122a was down regulated, the lower expression of patients have longer survival time than the higher expression survival time. Conclusion MiRNA-122a and miRNA-6086 expression levels in the serum of HCC were significantly different from those of normal persons, which could be used as potential targets for the diagnosis and prognosis of HCC.
primary hepatocellular carcinoma; MiRNA-122a; MiRNA-6086
R735.7
A
1673-016X(2017)02-0012-05
2016-11-20
国家自然科学基金(81272960);湖南省科技厅重点项目(2013WK2010,2014SK2015)和天晴肝病研究基金
李金成,E-mail:hnsyljc63@163.com;左建宏,E-mail: 632138414@qq.com

