40%DCP溶液的热分解模型
董泽,陈利平,陈网桦,马莹莹
40%DCP溶液的热分解模型
董泽1,陈利平1,陈网桦1,马莹莹2
(1南京理工大学化工学院,江苏南京210094;2索尔维投资有限公司(中国),上海201108)
准确的热分解动力学模型有助于人们采取各种安全措施预防和控制物料热失控导致的燃烧爆炸事故。以40%过氧化二异丙苯(DCP)的2,2,4-三甲基戊二醇二异丁酯(DIB)溶液为研究对象,运用差示扫描量热仪(DSC)和绝热量热设备(VSP2)进行了量热实验,并采用TSS软件(Thermal Safety Software)对数据进行动力学分析,建立了两种分解模型:“级+级”模型(模型1)和“级+自催化”模型(模型2),采用Friedman法和非线性拟合方法求算其动力学参数。在运用所建立的两种模型拟合曲线时,发现两种模型对同种量热模式数据拟合的相关系数非常接近,说明单一量热模式在求算动力学上存在局限性。联合采用基于动态扫描模式的DSC数据及基于绝热模式的VSP2数据共同求算动力学,发现相对于模型2,模型1可以更好地反映分解过程,其两步反应的活化能分别为115.5 kJ·mol-1和135.7 kJ·mol-1,指前因子的对数分别为28.3和31.6,反应级数分别为0.40和0.84。研究结果表明采用基于不同量热模式的数据求算动力学有助于确定正确的动力学模型,从而获得准确的动力学参数,并克服单一量热模式下动力学求算的局限性。
热分解;量热模式;40%DCP溶液;动力学;分解模型
引 言
建立准确的动力学模型有助于人们了解物质分解的各种行为,有助于采取各种安全措施预防和控制物质热失控事故,因而对物质热安全性的研究具有重要的现实意义。求解分解反应动力学参数通常分为无模型方法和模型拟合方法。无模型方法是指在不知道确切动力学模型的情况下获得活化能,当然,这并不意味着无模型方法不能用来确定反应模型,只要在整个反应进程中,活化能的值不发生较大变化,即可认为分解反应满足用单步反应动力学描述的条件,从而可以方便地采用Malek方法[1]确定反应模型和指前因子。国际动力学委员会(ICTAC)建议采用包括Friedman方法[2]、Ozawa-Flynn-Wall方法[3-4]在内的等转化率方法对上述条件进行有效性验证[5-7]。而当反应不能仅用一个单步反应模型和一组Arrhenius参数描述时,即出现多步反应动力学情形时,动力学模型的求解只能采用模型拟合方法。模型拟合方法又可以分为线性模型拟合方法和非线性模型拟合方法。线性模型拟合方法[8-9]通过取对数等数学手段,把反应速率方程转化为线性方程;该方法更适合用于单步动力学求算,多步反应往往很难被线性化。非线性模型拟合方法通过使拟合数据与测试数据间的差异最小化来实现,适用于单步和多步反应动力学求算。模型拟合方法的关键在于动力学模型的确定,特别是多步反应模型的情况,每一步都需要确定一个合适的反应模型。不恰当的反应动力学模型往往导致动力学求解的完全错误。
然而模型的建立通常十分困难,有时不同的反应模型都能较好地描述反应,对于多步反应动力学模型的建立就更是如此。针对这种情况,本文以40%过氧化二异丙苯(DCP)的2,2,4-三甲基戊二醇二异丁酯(DIB)溶液(以下简称40%DCP溶液)为研究对象开展动力学筛选研究,其中,DCP是一种典型的有机过氧化物,常用于各种不同的树脂中来改善材料的物理性质[10],国内外学者基于不同的量热设备研究了DCP、DCP溶液的热分解性能及热力学和动力学参数[11-15]。DIB则是一种常用的工业溶剂和环保增塑剂,能较好地溶解过氧化二异丙苯,保证DCP是以溶液形式进行分解的,且其沸点较高,产生的蒸气压较小,而不会对产气的DCP分解产生影响。利用基于动态扫描模式的差示扫描量热仪(DSC)和基于绝热模式的绝热量热设备(VSP2),进行了量热实验,并且采用基于两种模式的测试结果对反应动力学模型进行求解,以期筛选出正确的动力学模型,并拟合获得相应的动力学参数。
1 试剂及测试条件
1.1 试剂
DIB的纯度为98.5%,密度为0.941 g·ml-1,沸点为280℃,CAS号为6846-50-0。DCP的纯度为98%,密度为1.56 g·ml-1,熔点在40℃左右,CAS号为80-43-3。生产商都为阿拉丁试剂公司。
1.2 测试条件
所用DSC型号为200F3,由德国Netzsch公司生产,样品池为高压316不锈钢坩埚,样品质量(8.000±0.020) mg,温度范围30~200℃,动态温升速率分别用1、2、4、8 K·min-1。
所用VSP2由美国Fauske公司开发生产,采用薄壁316不锈钢球为测试球,实验所用测试球的质量为39.75 g,容积为115 ml,所用样品质量为44.07 g,温度范围30~300℃。升温程序为:30~100℃,2 K·min-1线性升温;100~300℃用加热-等待-搜索模式,搜索的灵敏度为0.1 K·min-1 [16]。
2 结果与讨论
2.1 DSC结果及分析
DSC动态模式下得到的40%DCP溶液测试曲线见图1、图2,其中,图1是放热速率与温度的曲线(原始测试曲线),图2是放热速率与时间的曲线(已取基线,并截取了放热段,由于图1曲线有重合且不够清晰,故附加了图2)。从图2中明显观察到40%DCP溶液的放热曲线包含两个相互叠加的放热峰,第1个放热峰尚未结束,第2段放热已经开始。在图1中,主峰(第2个分解峰)的起始分解温度随温升速率的增大而升高,其范围为131~140℃,放热量的平均值为340 J·g-1,与文献中DCP的分解温度放热量非常接近[17-21];次峰(第1个分解峰)的起始温度也随温升速率增大而升高,其范围为105~115℃,放热量的平均值为7 J·g-1(具体见表1)。为了了解次峰的形成原因,在2 K·min-1升温速率下,对DIB溶剂进行了动态DSC测试,结果见图3,发现DIB在120~170℃范围内有一段微弱的放热过程,其起始温度为122.5℃,比40%DCP溶液中次峰的起始分解温度略高,比放热量为5.4 J·g-1,与40%DCP溶液中次峰的放热量比较接近,从而判断次峰是由DIB放热引起,相关结果见表2。

表1 40% DCP溶液动态DSC实验数据

表2 98.5%DIB溶剂动态DSC实验数据
按照ICTAC的建议,采用无模型的Friedman法[22]求取动态模式下40%DCP溶液的活化能值,该方法中活化能会随着温度与转化率的变化而变化[23-26],其求解公式见式(1)

式中,为转化率;a为指前因子,s-1;为理想气体常数,J·(mol·K)-1;()为机理函数;a为活化能,kJ·mol-1;a为温度,K;为时间,s。
由于反应最初和结束阶段实验的误差较大,因此仅分析范围为0.10~0.90的情况,经计算,活化能的值为115~145 kJ·mol-1,且随着反应进度呈现很大波动,说明40%DCP溶液的分解反应机理不符合单步动力学模型,具体结果见图4。
2.2 VSP2结果
40%DCP溶液的VSP2实验曲线见图5,经过一段时间的加热-等待-搜索循环后,样品在121.5℃测试到放热信号,之后温度和压力持续上升;在155.2℃时,温度和压力陡然上升,温升速率突然变大,经过1.6 min在241.5℃左右放热结束;样品的最大温升速率达到10.3℃·min-1,最大压升速率达到2.65 MPa·min-1。
2.3 TSS软件求解动力学
2.3.1 动力学模型及求解原理 采用TSS软件(Thermal Safety Software)对40%DCP溶液分解的动力学进行求解。该高等热分析软件应用广泛、功能强大,主要通过对物质分解过程的模拟来验证所建立动力学模型的正确性,并从拟合结果中得到模型相关的动力学参数。软件中包含有多种类型的分解模型,如-order模型、自催化模型、Erofeev模型(适用于颗粒固体的表面分解动力学)、Jander模型(适用于分散控制的动力学)等[27]。
对于-order模型,反应速率的表达式见式(2)
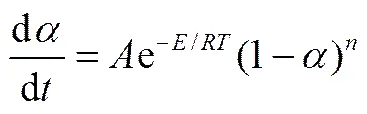
其中,为级反应的反应级数。
对于自催化模型,反应速率的表达式见式(3),右侧第1项表示自催化模型中引发反应的速率,第2项表示自催化反应的反应速率。令=1/2,即自催化因子[28-30],其具体表述见式(4)。式中,E为引发反应与自催化反应活化能的差值。综合式(3)~式(5),自催化的反应速率可由式(6)表示。

(4)
E=1-2(5)
令=2,=2
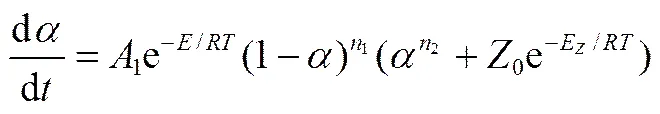
其中,1、2分别表示引发反应和自催化反应的指前因子,1、2为各自的活化能,1、2为反应的反应级数。
热平衡方程的公式为
在有了动力学模型后,将其与热平衡方程式(7)结合。其中,转化率和样品温度s是由实验测得;在动态测试中(q为任意时刻的放热速率),在绝热测试中=(T-0)/Dad(T是放热开始后任意时刻的温度,0是起始分解温度,Dad是放热段的总温升)。对于绝热的VSP2来说,体系内不存在温差从而不需要考虑热传导,只需拟合∞即可。而对于动态DSC,∞可以通过测试直接得到。因此,动力学参数0、、等只需在给出初始猜测值的基础上进行非线性拟合即可获得。这部分工作主要借助TSS完成。
2.3.2 40%DCP溶液的动力学研究 在对40%DCP溶液的DSC和VSP2数据单独进行动力学建模时,发现有两种模型可以较好地描述测试结果,分别是“级+级”模型(模型1)和“级+自催化”模型(模型2)。其中模型1中的两个级反应分别是A(DIB)→B和E(DCP)→F;模型2中级反应指的是A(DIB)→B,自催化反应指的是E(DCP)→F。
用两种模型分别对动态DSC和绝热VSP2数据进行非线性拟合,得到4组动力学参数和4组拟合的动力学曲线,见表3和图6~图9。

表3 动力学参数模拟结果
结果表明:两种模型对DSC数据的相关系数分别为0.9992和0.9994;对VSP2数据的拟合相关系数分别为0.9781和0.9726。显然,单从拟合的相关系数上来看,这两种模型都很适合描述40%DCP溶液在动态模式和绝热模式下的分解。然而,理论上来说,物质分解的模型不会因为量热模式不同而改变,因而两种模型中必定有一个是不完全符合实际分解过程的。另外,两种模型对同种量热模式下测试数据的相关系数非常接近,这从一个侧面说明了利用单一量热模式的测试数据研究物质分解动力学是存在局限性的。
为此,采用同种模型同时对绝热数据和动态数据共同求算动力学,以进一步筛选正确的动力学模型并求算准确的动力学参数。这种方法需要用一种模型同时对绝热和动态数据进行拟合,通过不断改变模型中的动力学参数,使拟合结果达到最优,即拟合曲线同时与两种量热模式测试曲线的相关系数最大,并获得相应的动力学参数,拟合曲线见图10~图13。经计算,模型1和模型2拟合的相关系数分别为0.9798和0.9096,显然,模型1的拟合结果明显优于模型2,因此,可以认为40%DCP溶液分解过程应遵循模型1,具体动力学参数见表3。
从6组动力学参数对比中,发现模型1在对不同数据进行拟合后的结果是比较稳定的,动力学参数相差不大,而模型2的参数结果却出现了较大的波动,这也从侧面反映出模型1是40%DCP分解的准确动力学模型,与文献[11-14]中纯DCP或DCP溶液的分解模型相符。
3 结 论
(1)DSC的结果表明,40%DCP溶液的分解由两个峰组成,第1个峰由溶剂的变化引起,第2个峰为DCP的分解。溶液中DCP分解的起始分解温度为(135.0±5.0)℃,峰温范围为(162.0±8.0)℃,放热量为(342.0±6.0) J·g-1。VSP2绝热量热实验结果表明,40%DCP溶液的起始分解温度为121.5℃,最大温升速率对应的温度为155.2℃。
(2)建立了两种分解模型,模型1为“级+级”,模型2为“级+自催化”。在动态DSC数据动力学拟合的结果中,模型1、2的拟合相关系数分别为0.9992、0.9994。尽管拟合相关系数高,却并不能说明所筛选的动力学模型是可靠的,表明基于单一量热模式的测试数据在进行动力学计算中存在局限性。VSP2的动力学分析结果也同样验证了这一结论。
(3)同时对动态和绝热测试结果进行动力学计算的结果表明,模型1(相关系数为0.9798)明显优于模型2(相关系数为0.9096),说明同时采用两种量热模式的测试数据分析动力学是可行的,可以避免单一量热模式在模型筛选上的局限性问题。
(4)40%DCP溶液热分解的动力学可以表述为:
反应1
A(DIB)→B (级反应)
d/d=exp(28.3)exp(-115500/)(1-)0.40
反应2
E(DCP)→F (级分解反应)
d/d=exp(31.6)exp(-135700/)(1-)0.84
References
[1] MALEK J. The kinetic analysis of non-isothermal data[J]. Thermochimica Acta, 1992, 200(92): 257-269.
[2] SBIRRAZZUOLI N. Is the Friedman method applicable to transformations with temperature dependent reaction heat?[J]. Macromolecular Chemistry and Physics, 2007, 208(14): 1592-1597.
[3] OZAWA T. A new method of analyzing thermogravimetric data[J]. Bulletin of the Chemical Society of Japan, 1965, 38(11): 1881-1886.
[4] FLYNN J H, WALL L A. General treatment of the thermogravimetry of polymers[J]. Journal of Research of the National Bureau of Standards- Physics & Chemistry, 1966, 70A(6): 487-522.
[5] VYAZOVKIN S, BURNHAM A K, CRIADO J M,. ICTAC kinetics committee recommendations for performing kinetic computations on thermal analysis data[J]. Thermochimica Acta, 2011, 520(1/2): 1-19.
[6] VYAZOVKIN S. Modification of the integral isoconversional method to account for variation in the activation energy[J]. Journal of Computational Chemistry, 2001, 22(2): 178-183.
[7] BUDRUGEAC P. Differential non-linear isoconversional procedure for evaluating the activation energy of non-isothermal reactions[J]. Journal of Thermal Analysis and Calorimetry, 2002, 68(1): 131-139.
[8] PEREZMAQUEDA L A, CRIADO J M, GOTOR F J,. Advantages of combined kinetic analysis of experimental data obtained under any heating profile[J]. Journal of Physical Chemistry A, 2002, 106(12): 2862-2868.
[9] PEREZMAQUEDA L A, SANCHEZJIMENEZ P E, CRIADO J M. Combined kinetic analysis of solid-state reactions: a powerful tool for the simultaneous determination of kinetic parameters and the kinetic model without previous assumptions on the reaction mechanism[J]. Journal of Physical Chemistry A, 2006, 110(45): 12456-62.
[10] WU K W, HOU H Y, SHU C M. Thermal phenomena studies for dicumyl peroxide at various concentrations by DSC[J]. Journal of Thermal Analysis & Calorimetry, 2006, 83(1): 41-44.
[11] SOMMA I D, MAROTTA R, ANDREOZZI R,. Dicumylperoxidethermal decomposition in cumene: development of a kinetic model[J]. Industrial & Engineering Chemistry Research, 2012, 51(22): 601-609.
[12] LV J Y, CHEN L P, CHEN W H,. Kinetic analysis and self-accelerating decomposition temperature (SADT) of dicumylperoxide[J]. Thermochimica Acta, 2013, 571(20): 60-63.
[13] WU S H, SHYU M L, YETPOLE I,. Evaluation of runaway reaction for dicumyl peroxide in a batch reactor by DSC and VSP2[J]. Journal of Loss Prevention in the Process Industries, 2009, 22(6): 721-727.
[14] TALOUBA I B, BALLAND L, MOUHAB N,. Kinetic parameter estimation for decomposition of organic peroxides by means of DSC measurements[J]. Journal of Loss Prevention in the Process Industries, 2011, 24(4): 391-396.
[15] ZANG N. Thermal stability analysis of dicumylperoxide[J]. Lecture Notes in Electrical Engineering, 2012, 137: 279-286.
[16] ASKONAS C F, BURELBACH J P, LEUNG J C. The versatile VSP2: a tool for adiabatic thermal analysis and vent sizing applications[C]// 28th Annual North American Thermal Analysis Society (NATAS) Conference. Orlando, Florida, 2000: 4-6.
[17] WU S H, WANG Y W, WU T C,. Evaluation of thermal hazards for dicumyl peroxide by DSC and VSP2[J]. Journal of Thermal Analysis & Calorimetry, 2008, 93(1): 189-194.
[18] HOU H Y, LIAO T S, DUH Y S,. Thermal hazard studies for dicumyl peroxide by DSC and TAM[J]. Journal of Thermal Analysis & Calorimetry, 2006, 83(1): 167-171.
[19] WU K W, HOU H Y, SHU C M. Thermal phenomena studies for dicumyl peroxide at various concentrations by DSC[J]. Journal of Thermal Analysis & Calorimetry, 2006, 83(1): 41-44.
[20] LU K T, CHU Y C, CHEN T C,. Investigation of the decomposition reaction and dust explosion characteristics of crystalline dicumylperoxide[J]. Journal of Hazardous Materials, 2008, 161(1): 246-56.
[21] VALDES O J R, MORENO V C, WALDRAM S P,. Experimental sensitivity analysis of the runaway severity of dicumyl peroxide decomposition using adiabatic calorimetry[J]. Thermochimica Acta, 2015, 617(4): 510-513.
[22] FRIEDMAN H L. Kinetics of thermal degradation of char-forming plastics from thermogravimetry. Application to a phenolic plastic[J]. Journal of Polymer Science Part C Polymer Symposia, 2007, 6(1): 183-195.
[23] VYAZOVKIN S. Kinetic concepts of thermally stimulated reactions in solids[J]. International Reviews in Physical Chemistry, 2010, 19(1): 45-60.
[24] VYAZOVKIN S. On the phenomenon of variable activation energy for condensed phase reactions[J]. New Journal of Chemistry, 2000, 24(11): 913-917.
[25] VYAZOVKIN S. Chapter 13-Isoconversional Kinetics// Handbook of Thermal Analysis & Calorimetry[M]. Amsterdam: Elsevier, 2008, 5(8): 503-538.
[26] VYAZOVKIN S, SBIRRAZZUOLI N. Isoconversional kinetic analysis of thermally stimulated processes in polymers[J]. Macromolecular Rapid Communications, 2006, 27(18): 1515-1532.
[27] KOSSOY A, KOLUDAROVA E. Specific features of kinetics evaluation in calorimetric studies of runaway reactions[J]. Journal of Loss Prevention in the Process Industries, 1995, 8(4): 229-235.
[28] RODUIT B, HARTMANN M, FOLLY P,. Prediction of thermal stability of materials by modified kinetic and model selection approaches based on limited amount of experimental points[J]. Thermochimica Acta, 2014, 579(5): 31-39.
[29] RODUIT B, HARTMANN M, FOLLY P,. Thermal decomposition of AIBN, Part B: Simulation of SADT value based on DSC results and large scale tests according to conventional and new kinetic merging approach[J]. Thermochimica Acta, 2015, 355: 6-24.
[30] MOUKHINA E. Thermal decomposition of AIBN, Part C: SADT calculation of AIBN based on DSC experiments[J]. Thermochimica Acta, 2015, 621: 25-35.
Thermal decomposition model for solution of 40% dicumyl peroxide
DONG Ze1,CHEN Liping1,CHEN Wanghua1,MA Yingying2
(1School of Chemical Engineering, Nanjing University of Science & Technology, Nanjing 210094, Jiangsu, China;2Solvay (China) Co., Ltd., Shanghai 201108, China)
An accurate thermal decomposition model helps people take measures of prevention and controlling the burning and explosion accidents, which are caused by thermal run away of materials. This paper mainly studied a sample: 40%DCP solution (dicumyl peroxide dissolved in 2,2,4-trimethyl-1,3-pentanediol diisobutyrate). Experiments were performed with two devices, differential scanning calorimeter (DSC) and vent sizing package 2 (VSP2), analyzed the kinetics by TSS (Thermal Safety Software) and established two decomposition models: model 1 “-order followed with-order” and model 2 “-order followed with autocatalysis”, then, the kinetic parameters were estimated by Friedman method and non-linear simulation method. From simulated curves, both models described the decomposition curve for dynamic calorimetry mode or adiabatic calorimetry mode well, which illustrated the limitation of kinetics study for single calorimetric mode. Therefore, paper proposed a method that estimated the parameters based on both dynamic calorimetry mode and adiabatic calorimetry mode decomposition curves, found that only model 1 explained the decomposition well. Therefore, 40%DCP decomposition can be expressed as model 1, in which the activation energy for two steps are 115.5 kJ·mol-1and 135.7 kJ·mol-1, the natural logarithm of pro-exponential factor are 28.3 and 31.6, and reaction order are 0.40 and 0.84. This study proved that estimation of kinetic parameters with two different calorimetry modes can help determine right kinetic model, obtain accurate kinetic parameters, and overcome the limitation of kinetics study with single calorimetric mode.
thermal decomposition; calorimetry mode; 40%DCP solution; kinetics; decomposition model
10.11949/j.issn.0438-1157.20161516
TQ 013.1;TQ 013.2
A
0438—1157(2017)05—1773—07
陈利平。
董泽(1991—),男,博士研究生。
2016-10-27收到初稿,2016-12-22收到修改稿。
2016-10-27.
Prof. CHEN Liping, clp2005@hotmal.com

