GO@MIL-101的制备及其对水中Cr(Ⅵ)的去除
王亮,田聃,刘安琪,赵斌,马树双,李君敬,张朝晖,惠旭
GO@MIL-101的制备及其对水中Cr(Ⅵ)的去除
王亮1,2,田聃1,2,刘安琪1,2,赵斌1,2,马树双2,李君敬1,2,张朝晖1,2,惠旭2
(1省部共建分离膜与膜过程国家重点实验室,天津300387;2天津工业大学环境与化学工程学院,天津300387)
通过水热法制备了掺杂氧化石墨烯(GO)的金属有机框架GO@MIL-101,并考察了GO掺杂量对GO@MIL-101形貌和性质的影响规律。GO的掺杂影响了MIL-101晶体的形成过程。随着GO掺杂量的增加,GO@MIL-101晶体的完整性降低、粒径减小,团聚现象越发显著。GO@MIL-101能够有效去除溶液中的Cr(Ⅵ),该过程符合拟二级动力学方程。由Langmuir吸附等温线拟合得到的最大吸附量与GO掺杂量有关,在2%[相对于Cr(NO3)3·9H2O质量]时达到最大,这与此时GO@MIL-101同时具有较大的比表面积和较大的孔体积有关。Cr(Ⅵ)的去除过程伴随着溶液中浓度的升高以及pH的下降,电荷平衡计量分析表明MIL-101和GO@MIL-101对Cr(Ⅵ)的去除机制相同,主要依靠MIL-101的离子交换作用,并且所去除的Cr(Ⅵ)以形式存在于固相中。
MIL-101;氧化石墨烯;Cr(Ⅵ);离子交换
引 言
水体Cr(Ⅵ)污染主要来自电镀、制革、催化等化工行业的排放,对生物有致癌性和致畸性[1-2]。去除水中Cr(Ⅵ)方法主要有离子交换法、电解法、化学共沉淀法、吸附法等[3-5]。其中,吸附法具有操作灵活、简便、高效、安全等优点,而被广泛应用于废水处理中。用于水中Cr(Ⅵ)去除的吸附剂主要有活性炭[6]、氧化铝[7]、天然矿物[8]等。
金属有机框架(MOFs)是由有机配体和无机金属节点连接而成的多孔晶态材料,具有比表面积大、孔道结构均匀、孔径可调节的特点。其中,MIL-101(Cr)含有大量未饱和金属位点并且水热稳定性高,可用于水中污染物的富集和去除[9]。Chen等[10]以MIL-101(Cr)吸附水溶液中的二甲酚橙,结果表明该过程符合拟二级动力学模型以及Langmuir吸附等温线方程,MIL-101(Cr)与二甲酚橙间的电荷作用是吸附的主导机理。
氧化石墨烯(GO)是一种软性的二维碳纳米材料,含有大量环氧基、羧基等含氧官能团,并且比表面积大、机械强度高、导电性好。GO与MOFs掺杂后能使复合材料的比表面积显著提高,对于气体的净化分离性能得以改善。例如,Bandosz等[11]成功合成GO@MOF-5及GO@HKUST-1用于氨气吸附研究,GO的添加使MOFs与GO界面处孔的活性更高,与氨气的作用力更强。在水处理中,GO@MOFs的应用研究多集中在有机污染物去除方面[12-13],对于无机离子型污染物的去除研究相对较少。
本研究通过水热合成法制备了GO@MIL-101,讨论了GO添加量对MIL-101晶体形貌的影响,并将该复合材料用于水中Cr(Ⅵ)的去除,通过热力学、动力学和电荷平衡计量关系探讨GO@MIL-101去除Cr(Ⅵ)的机理。
1 材料与方法
1.1 实验试剂及材料
对苯二甲酸、Cr(NO3)3·9H2O为分析纯,石墨粉为优级纯,购自阿拉丁试剂公司。HF、NaNO3、KMnO4、H2O2、K2Cr2O7均为分析纯,购自国药集团北京化学试剂公司。
1.2 材料制备及表征
GO采用改进的Hummers法合成[14]。MIL-101采用水热合成法合成[15],具体方法如下:称取0.3322 g对苯二甲酸,0.8004 g Cr(NO3)3·9H2O于高压反应釜中,再向其中加入0.1 ml氢氟酸和14 ml高纯水,经超声处理30 min后置于电热鼓风干燥箱 200℃反应10 h,冷却至室温后取出并进行纯化, 干燥后得绿色晶体。在制备GO@MIL-101时, GO在反应初加入反应釜中,其余步骤与制备MIL-101相同。制得GO添加量为1%、2%、5% [相对于Cr(NO3)3·9H2O质量]的复合材料, 分别记作1%GO@MIL-101、2%GO@MIL-101、5%GO@MIL-101。
采用X射线粉末衍射仪(XRD)(D/MAX-2500,日本理学)、傅里叶变换红外光谱仪(FT-IR)(Nicolet6700,美国热电)、场发射扫描电子显微镜(FE-SEM)(S-4800,日本日立)和透射电子显微镜(TEM)(H7650,日本日立)对制备材料进行表征。采用全自动物理化学吸附仪(AUTOSORBIQ,美国康塔)测定制备材料的比表面积及孔径分布。水样中Cr(Ⅵ)和浓度分别采用二苯碳酰二肼分光光度法和离子色谱法测定(ICS-1100,美国戴安)。
1.3 吸附实验
称取一定量的MIL-101和GO@MIL-101分别投加到含有一定浓度K2Cr2O7溶液的三角瓶中进行吸附实验,恒温摇床设定温度为30℃、转速为200 r·min-1。实验过程不对pH进行控制。吸附后的水样以0.45 μm滤膜过滤后进行分析。
2 结果与讨论
2.1 XRD
图1为GO、MIL-101和GO@MIL-101的XRD谱图。实验制得GO衍射峰211.5°,与文献[16]报道的GO的多层结构衍射峰一致,表明GO合成成功。MIL-101在3.4°、5.2°、8.5°和9.1°(2)处出现明显衍射峰与文献[17]报道一致,表明MIL-101合成成功。在GO@MIL-101的XRD谱图中,GO的多层结构特征峰基本消失,这可能是因为复合材料中GO含量较低或GO经超声分散后以单层结构为主所致[18];而MIL-101的衍射峰在复合后仍存在,但强度显著降低,表明GO的加入在一定程度上影响了MIL-101晶体的完整度。
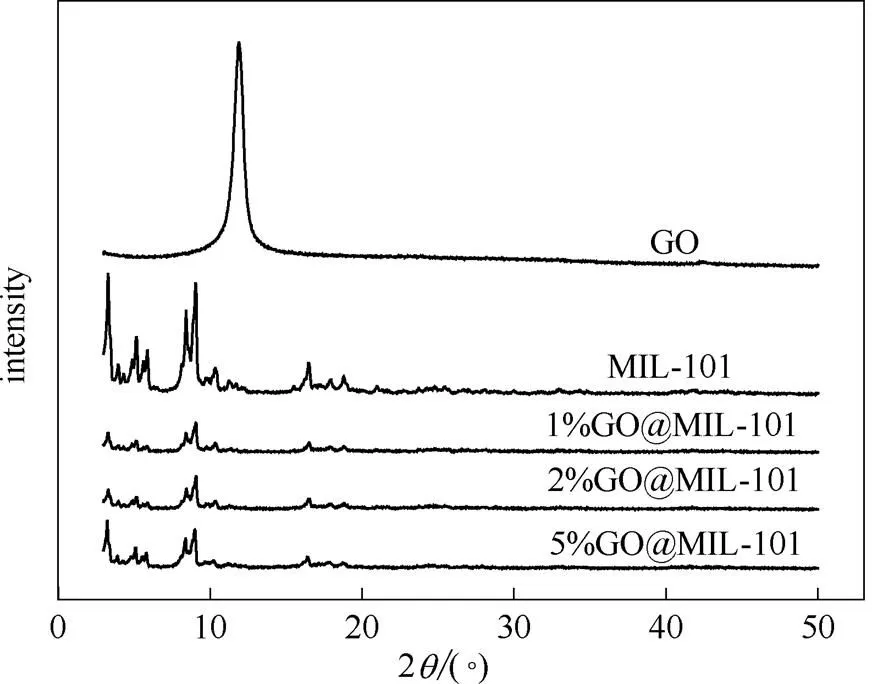
图1 GO、MIL-101以及GO@MIL-101的XRD谱图
2.2 SEM
图2为MIL-101和GO@MIL-101的SEM图。MIL-101呈规则的正八面体结构,晶体成型性好且形貌完整,其粒径尺寸在300~700nm之间,与文献[17]报道的MIL-101结构一致。

图2 MIL-101和GO@MIL-101的SEM图
GO掺杂后,GO@MIL-101微观形态仍呈颗粒结构,但粒径明显降低。1%GO@MIL-101的粒径减小至200 nm。此后随GO掺杂量的增加,GO@MIL-101粒径继续小幅下降。MIL-101的正八面体结构也在掺杂GO后被逐渐破坏,晶体的规则性和完整性下降,这与XRD的结果相一致。对于5%GO@MIL-101而言,其微观形态不再是棱角分明的正八面体结构。Sun等[17]也发现随着GO添加量的提高,MIL-101粒径减小,且晶体结构愈发不规则,这可能是因为GO中的含氧基团与MIL-101的中心金属离子Cr(III)发生配位作用,从而影响了MIL-101晶核的形成与生长。
2.3 TEM
图3为GO、MIL-101和GO@MIL-101的TEM照片。MIL-101呈八面体结构,这与SEM图像一致。GO掺杂使所形成的GO@MIL-101晶体规则性明显降低,原有的八面体结构被不规则的晶体颗粒取代,并且粒径减小。随着GO投加量增加,GO@MIL-101的团聚现象愈发明显,这一方面是由于颗粒粒径减小至100 nm以下导致的团聚,另一方面可能是由于GO片层上的含氧基团参与到多个MIL-101的形成过程所致。

图3 GO、MIL-101和GO@MIL-101的透射电镜图
2.4 比表面积
图4为MIL-101和GO@MIL-101的N2吸附脱附等温曲线。少量GO的掺杂(1%GO@MIL-101和2%GO@MIL-101)能提高MIL-101的N2吸附量,即提高材料的比表面积;而当GO掺杂量较大时(5%GO@MIL-101),较之少量掺杂,N2吸附量下降,材料比表面积降低。由等温线计算得到的比表面积如表1所示。MIL-101的BET比表面积为2078 m2·g-1,这与文献[9,19]报道值相接近。与MIL-101相比,2%GO@MIL-101的比表面积增加了37%。这可能与GO@MIL-101粒径减小有关。通常而言,材料粒径越小,所具有的比表面积越大。而对于5%GO@MIL-101,颗粒的高度团聚导致其比表面积相对于2%GO@MIL-101明显下降;另一方面,高比例的GO分散于反应体系中,其片层上的含氧基团与Cr3+离子发生配位,影响了MIL-101晶体的形成,晶体结构不完整,也会导致比表面积减小[20]。随着GO添加量的增多,复合吸附剂的总孔体积不断增大,这可能是因为GO为MIL-101晶体提供了新的结晶位点,导致晶体的孔隙率增加,从而提高了复合材料的总孔体积[21]。5%GO@MIL-101等温线中的滞后环也表明其中微孔结构的增多,这些微孔可能是介于MIL-101与GO两相的新孔[22]。
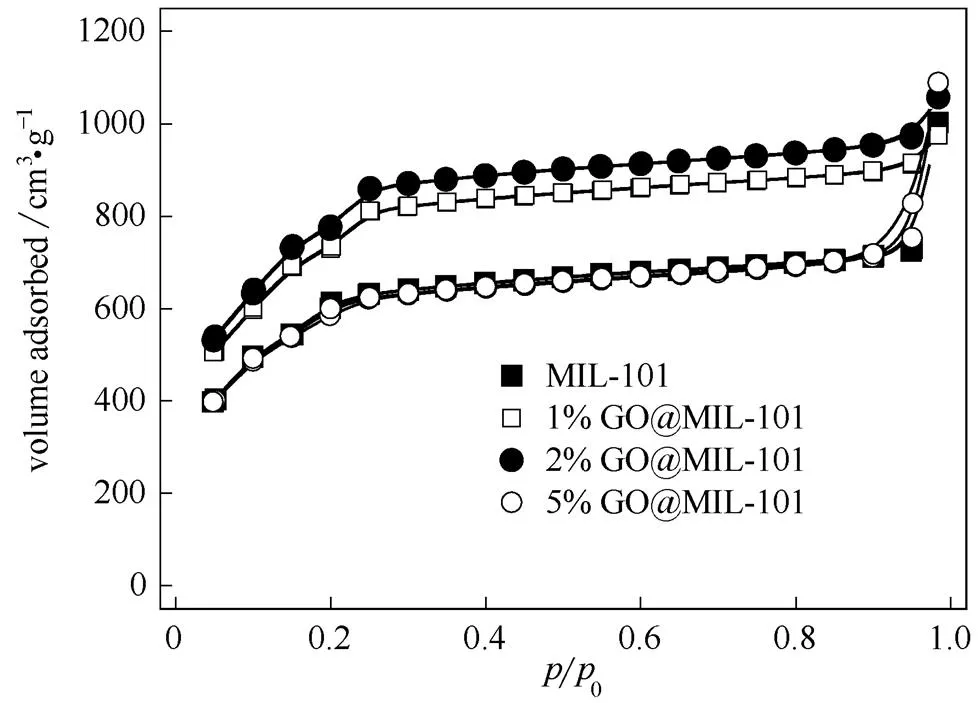
图4 MIL-101和GO@MIL-101的N2吸附脱附等温线
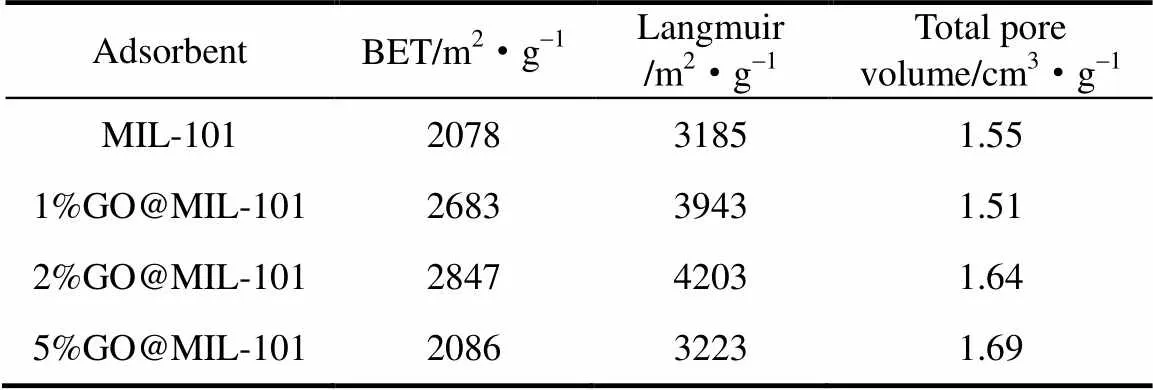
表1 MIL-101和GO@MIL-101的孔隙结构参数
2.5 Cr(Ⅵ)去除动力学
由图5可见,MIL-101和GO@MIL-101对溶液中Cr(Ⅵ)的去除在90 min内基本到达平衡,其中前10 min内为快速去除阶段,之后去除速率趋缓并逐步达到平衡。这与活性氧化铝对Cr(Ⅵ)的吸附动力学过程相近[7]。对该动力学过程以拟一级动力学方程[式(1)]和拟二级动力学方程[式(2)]进行拟合,结果如表2所示。
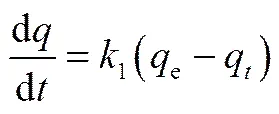
(2)
与拟一级动力学方程相比,拟二级动力学方程对Cr(Ⅵ)去除过程的拟合结果更好,相关系数2>0.97。GO掺杂量对材料平衡吸附量影响显著。2%GO@MIL-101表现出最好的去除Cr(Ⅵ)效果,与MIL-101相比,平衡吸附量提高32%。5%GO@MIL-101次之,而1%GO@MIL-101的平衡吸附量与MIL-101相比略有降低。这与2%GO@MIL-101同时具有较大的比表面积和较大的孔体积有关。通常而言,吸附剂比表面积越大、孔体积越大,能够提供的吸附活性位点越多,吸附速率越快,平衡吸附量也越大。

表2 MIL-101和GO@MIL-101去除溶液中Cr(Ⅵ)的动力学方程拟合结果

图5 MIL-101和GO@MIL-101去除溶液中 Cr(Ⅵ)的动力学过程
2.6 Cr(Ⅵ)去除等温线
图6为30℃下MIL-101和GO@MIL-101去除溶液中Cr(Ⅵ)的吸附等温线,Langmuir模型[式(3)] 和Freundlich模型式[式(4)]均能对该曲线进行较好的拟合,相关系数2>0.95。
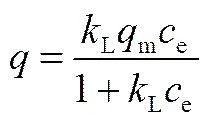
(4)
由Langmuir模型拟合结果看出,30℃下MIL-101、1%GO@MIL-101、2%GO@MIL-101、5%GO@MIL-101对Cr(Ⅵ)的最大吸附量分别为106.9、86.2、124.6、120.1 mg·g-1。1% GO@MIL-101的最大吸附量最低,这可能是因为少量的GO阻塞了MIL-101晶体上与Cr(Ⅵ)的接触位点。随着GO掺杂量增大,由于比表面积和孔体积的增大,MIL-101中的吸附活性位点暴露得更加充分,表现为最大吸附量的增大。2%GO@MIL-101对Cr(Ⅵ)的最大吸附量高于文献中报道的坡缕石(58.5 mg·g-1)[23]和改性壳聚糖(68.3 mg·g-1)[24]。
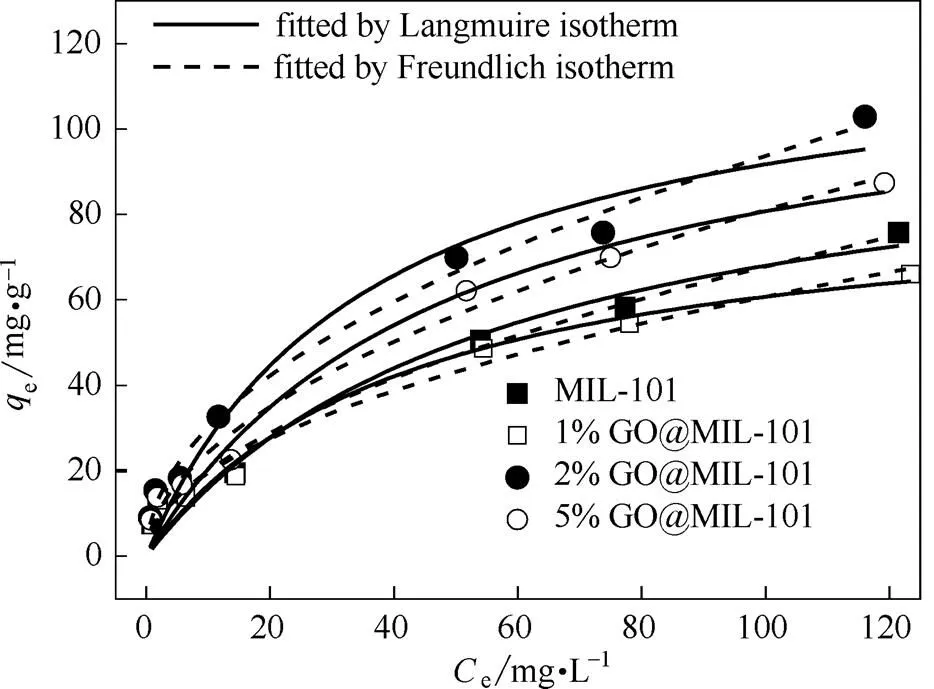
图6 MIL-101和GO@MIL-101对溶液中Cr(Ⅵ)的吸附等温线(30℃)
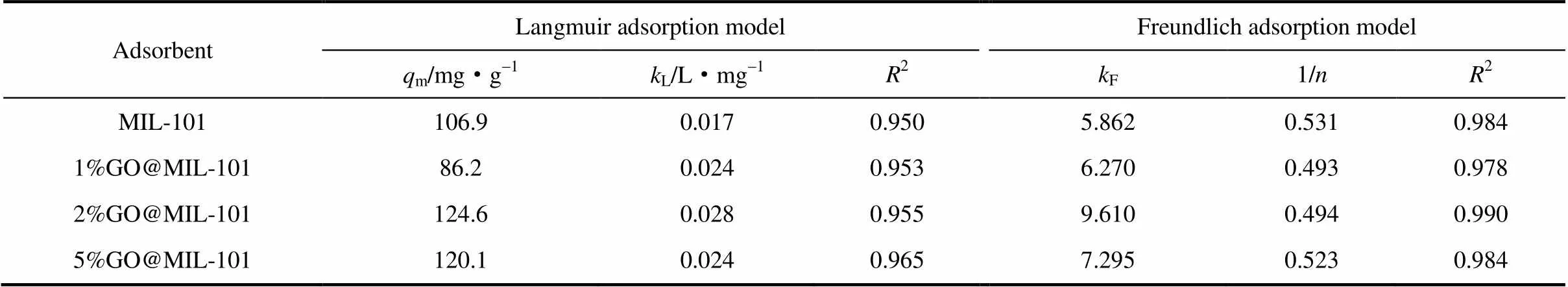
表3 MIL-101和GO@MIL-101去除溶液中Cr(Ⅵ)的吸附等温线拟合结果(30℃)
2.7 电荷平衡计量关系
以MIL-101和2%GO@MIL-101为例对其去除溶液中Cr(Ⅵ)的电荷平衡计量关系进行分析。平衡后的溶液中检测到的释放以及pH的降低。图7为MIL-101和2%GO@MIL-101在不同投加量下去除Cr(Ⅵ)达到平衡后,溶液中Cr(Ⅵ)和浓度变化以及pH变化趋势。随着MIL-101和2%GO@MIL-101投加量的增加,液相Cr(Ⅵ)浓度逐步降低,浓度同步升高,pH下降越发显著。在所制备的MIL-101中存在用于平衡Cr(Ⅲ)残余电荷的。Cr(Ⅵ)去除过程中这部分的释放表明离子交换是MIL-101和GO@MIL-101去除Cr(Ⅵ)的重要机制。已有研究指出,离子交换是MOFs材料去除水中离子型污染物的重要机制之一[25-26]。不同MIL-101和GO@MIL-101投加量下平衡溶液中Cr(Ⅵ)和浓度变化间存在线性关系(图7中虚线),斜率为0.57,并且GO掺杂不会引起该线性关系的显著变化,这表明MIL-101和GO@MIL-101对Cr(Ⅵ)的去除机制相同,主要依靠MIL-101的离子交换作用,而GO掺杂只是调节了材料微观结构,并未直接参与到Cr(Ⅵ)的去除过程。
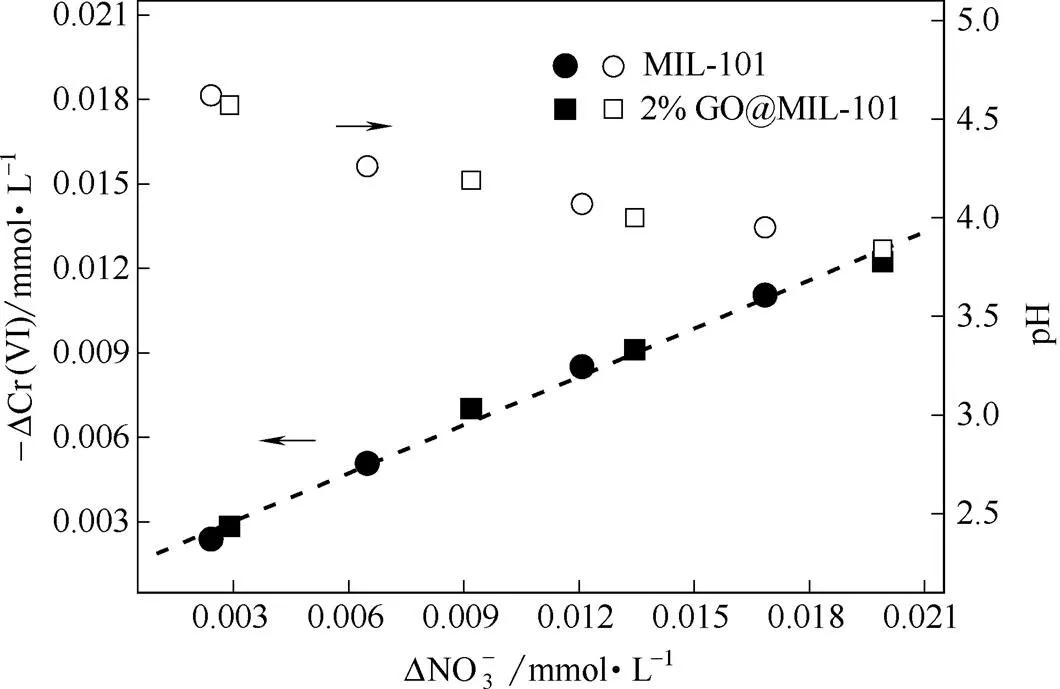
图7 MIL-101和2%GO@MIL-101去除Cr(Ⅵ)过程中释放与pH变化
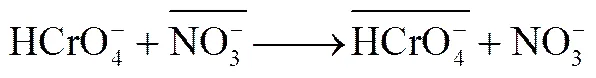
(6)
3 结 论
通过水热合成法制备了不同GO掺杂量的GO@MIL-101复合材料,并将其应用于水中Cr(Ⅵ)的去除,得到主要结论如下:
(1)GO中的含氧基团与MIL-101中的Cr(III)发生配位作用,影响了MIL-101晶核的形成与生长,晶体的完整性随GO掺杂量的增多逐步降低,粒径逐步减小,团聚现象越发显著。
(2)与MIL-101相比,2%GO@MIL-101的比表面积增加了37%。对于5%GO@MIL-101而言,颗粒的高度团聚以及晶体结构的不完整导致其比表面积明显下降,但介于MIL-101与GO两相的微孔结构的增多使其具有最大的孔体积。
(3)GO@MIL-101去除溶液中Cr(Ⅵ)的过程在90 min内基本到达平衡,符合拟二级动力学方程。由Langmuir等温线拟合得到的2%GO@MIL-101对Cr(Ⅵ)的最大吸附量为125 mg·g-1,比MIL-101提高了20%。
(4)MIL-101和GO@MIL-101对Cr(Ⅵ)的去除主要依靠MIL-101的离子交换作用,而GO掺杂只是调节了材料微观结构,并未直接参与到Cr(Ⅵ)的去除过程。所去除的Cr(Ⅵ)以形式存在于固相中,并伴随溶液pH的下降。
符 号 说 明

Ce——吸附平衡时吸附质的浓度,mg·L-1 kF——Freundlich吸附常量 kL——Langmuir吸附常数,L·mg-1 k1——拟一级吸附速率常数,min-1 k2——拟二级吸附速率常数,g·mg-1·min-1 1/n——表示吸附强度或吸附剂表面的不均匀程度 qe——吸附平衡时单位质量吸附剂的吸附量,mg·g-1 qm——吸附剂的饱和吸附量,mg·g-1 qt——时间为t时的单位质量吸附剂的吸附量,mg·g-1 t——吸附时间,min
References
[1] JOMOVA K, VALKO M. Advances in metal-induced oxidative stress and human disease [J].Toxicology, 2011, 283 (2): 65-87.
[2] ARITA A, COSTA M. Epigenetics in metal carcinogenesis: nickel, arsenic, chromium and cadmium [J]. Metallomics, 2009, 1 (3): 222-228.
[3] RENGARAJ S, YEON K H, MOON S H. Removal of chromium from water and wastewater by ion exchange resins [J]. Journal of Hazardous Materials, 2001, 87 (1): 273-287.
[4] PARGA J R, COCKE D L, VALVERDE V,. Characterization of electrocoagulation for removal of chromium and arsenic [J]. Chemical Engineering & Technology, 2005, 28 (5): 605-612.
[5] GUPTA V K, GUPTA M, SHARMA S. Process development for the removal of lead and chromium from aqueous solutions using red mud-an aluminium industry waste [J]. Water Research, 2001, 35 (5): 1125-1134.
[6] 荆国华, 董梅霞, 周作明,等. 超声波对活性炭吸附/脱附Cr(Ⅵ)的影响 [J]. 化工学报, 2009, 60 (11): 2805-2812. JING G H, DONG M X, ZHOU Z M,. Effects of ultrasound on adsorption and desorption of chronmium(Ⅵ) on activated carbon [J]. CIESC Journal, 2009, 60 (11): 2805-2812.
[7] 谭秋荀, 张可方, 赵焱, 等. 活性氧化铝对六价铬的吸附研究 [J]. 环境科学与技术, 2012, 35 (6): 130-133. TAN Q X, ZHANG K F, ZHAO Y,. Adsorption of hexavalent chromium by activated alumina [J]. Environmental Science & Technology, 2012, 35 (6): 130-133.
[8] ZHAO Y, YANG S, DING D,. Effective adsorption of Cr(Ⅵ) from aqueous solution using natural Akadama clay [J]. Journal of Colloid and Interface Science, 2013, 395: 198-204.
[9] HONG D Y, HWANG Y K, SERRE C,. Porous chromium terephthalate MIL-101 with coordinatively unsaturated sites: surface functionalization, encapsulation, sorption and catalysis [J]. Advanced Functional Materials, 2009, 19: 1537-1552.
[10] CHEN C, ZHANG M, GUAN Q,. Kinetic and thermodynamic studies on the adsorption of xylenol orange onto MIL-101(Cr) [J]. Chemical Engineering Journal, 2012, 183 (8):60-67.
[11] BANDOSZ T J, PETIT C. MOF/graphite oxide hybrid materials: exploring the new concept of adsorbents and catalysts [J]. Adsorption-Journal of the International Adsorption Society, 2011, 17 (1):5-16.
[12] LI L, LIU X L, GENG H Y,. A MOF/graphite oxide hybrid (MOF: HKUST-1) material for the adsorption of methylene blue from aqueous solution [J]. Journal of Materials Chemistry A, 2013, 1 (35): 10292-10299.
[13] LI L, SHI Z, ZHU H,. Adsorption of azo dyes from aqueous solution by the hybrid MOFs/GO [J]. Water Science and Technology, 2016, 73 (7): 1728-1737.
[14] HUMMERS J W S, OFFEMAN R E. Preparation of graphitic oxide [J]. Journal of the American Chemical Society, 1958, 80 (6): 1339-1339.
[15] FEREY G, MELLOT-DRAZNIEKS C, SERRE C,. A chromium terephthalate-based solid with unusually large pore volumes and surface area [J]. Science, 2005, 309 (5743): 2040-2042.
[16] SHIH Y C, KE C Y, YU C J,. Combined Tween 20-stabilized gold nanoparticles and reduced graphite oxide–Fe3O4nanoparticle composites for rapid and efficient removal of mercury species from a complex matrix [J]. ACS Applied Materials & Interfaces, 2014, 6 (20): 17437-17445.
[17] SUN X, XIA Q, ZHAO Z,. Synthesis and adsorption performance of MIL-101(Cr)/graphite oxide composites with high capacities of-hexane [J]. Chemical Engineering Journal, 2014, 239: 226-232.
[18] PETIT C, BANDOSZ T J. Synthesis, characterization, and ammonia adsorption properties of mesoporous metal-organic framework MIL(Fe)-graphite oxide composites: exploring the limits of materials fabrication [J]. Advanced Functional Materials, 2011, 21 (11): 2108-2117.
[19] GU X, LU Z H, JIANG H L,. Synergistic catalysis of metal-organic framework-immobilized Au-Pd nanoparticles in dehydrogenation of formic acid for chemical hydrogen storage [J]. Journal of the American Chemical Society, 2011, 133 (31):11822-5.
[20] ZHAO N, WEI N, LI J,. Surface properties of chemically modified activated carbons for adsorption rate of Cr(Ⅵ) [J]. Chemical Engineering Journal, 2005, 115 (1): 133-138.
[21] ZHOU X, HUANG W, SHI J,. A novel MOF/graphene oxide composite GrO@MIL-101 with high adsorption capacity for acetone [J]. Journal of Materials Chemistry A, 2014, 2 (13): 4722-4730.
[22] SEREDYCH M, PETIT C, TAMASHAUSKY A V,. Role of graphite precursor in the performance of graphite oxides as ammonia adsorbents [J]. Carbon, 2009, 47 (2): 445-456.
[23] POTGIETER J H, POTGIETER-VERMAAK S S,. Heavy metals removal from solution by palygorskite clay [J]. Minerals Engineering, 2006, 19 (5): 463-470.
[24] SPINELLI V A, LARANJEIRA M C M, FÁVERE V T. Preparation and characterization of quaternary chitosan salt: adsorption equilibrium of chromium (Ⅵ) ion [J]. Reactive and Functional Polymers, 2004, 61 (3): 347-352.
[25] HE Y C, YANG J, KAN W Q,. A new microporous anionic metal-organic framework as a platform for highly selective adsorption and separation of organic dyes [J]. Journal of Materials Chemistry A, 2015, 3 (4): 1675-1681.
[26] NALAPARAJU A. Ion exchange in metal-organic framework for water purification: insight from molecular simulation [J]. The Journal of Physical Chemistry C, 2012, 116 (12): 6925-6931.
[27] PISMENSKAYA N, LAKTIONOV E, NIKONENKO V,. Dependence of composition of anion-exchange membranes and their electrical conductivity on concentration of sodium salts of carbonic and phosphoric acids [J]. Journal of Membrane Science, 2001, 181 (2): 185-197.
Preparation of graphene oxide@MIL-101 composite and its performance in Cr(Ⅵ) removal from aqueous solution
WANG Liang1,2, TIAN Dan1,2, LIU Anqi1,2, ZHAO Bin1,2, MA Shushuang2, LI Junjing1,2, ZHANG Zhaohui1,2, HUI Xu2
(1State Key Laboratory of Separation Membranes and Membrane Processes, Tianjin 300387, China;2School of Environmental and Chemical Engineering, Tianjin Polytechnic University, Tianjin 300387, China)
A novel composite (GO@MIL-101) containing metal organic framework (MIL-101) and graphene oxide (GO) was prepared by hydrothermal method. The effects of GO concentration on the composite morphology and structure were investigated. The doping of GO affected the crystallization of MIL-101 and its integrity reduced with the increase in GO concentration. The crystal size decreased and the agglomeration phenomenon became significant. GO@MIL-101 can be used to remove Cr(Ⅵ) from aqueous solution, and the removal kinetics can be fitted by the pseudo-second-order kinetic model. The maximum Cr(Ⅵ) uptake capacity obtained by Langmuir adsorption isotherm depended on the GO concentration. When the GO concentration of 2% [based on the mass of Cr(NO3)3·9H2O] was applied, GO@MIL-101 exhibited higher Cr(Ⅵ) uptake capacity compared to MIL-101 due to its larger specific surface area and pore volume. The removal of Cr(Ⅵ) was accompanied by the release ofand the decrease of pH. The charge balance analysis indicated that the removal mechanism involved in the Cr(Ⅵ) removal by MIL-101 and GO@MIL-101 was mainly ion exchange. The removed Cr(Ⅵ) existed in the form ofin the adsorbent.
MIL-101; GO; Cr(Ⅵ); ion exchange
10.11949/j.issn.0438-1157.20161481
X 522
A
0438—1157(2017)05—2105—07
王亮(1979—),男,博士,教授。
国家自然科学基金项目(51638011,51478314, 51138008);国家重点基础研究发展计划项目(2016YFC0400503);天津市自然科学基金项目(14JCQNJC09000);天津市科技计划项目(14ZCDGSF00128)。
2016-10-20收到初稿,2016-12-06收到修改稿。
2016-10-20.
WANG Liang, mashi7822@163.com
supported by the National Natural Science Foundation of China (51638011, 51478314, 51138008), the National Basic Research Program of China (2016YFC0400503), Tianjin Natural Science Foundation (14JCQNJC09000, 14ZCDGSF00128).

