氮胁迫条件下水稻理想株型基因ipa1对氮代谢的影响
赵双双++刘雷++何永刚++蔡海亚++章志宏

摘要:利用水稻(Oryza sativa L.)近等基因系NIL-IPA1和NIL-ipa1,研究在施氮與不施氮条件下,理想株型调控基因ipa1在水稻快速分蘖期对氮代谢的影响。结果发现,在施氮条件下,相对于NIL-IPA1植株,NIL-ipa1水稻植株中谷氨酰胺合成酶(Glutamine synthetase,GS)、NADH谷氨酸合酶(NADH-glutamate synthase,NADH-GOGAT)的活性降低,叶片中游离氨基酸含量减少,但NADH谷氨酸脱氢酶(NADH-glutamate dehydrogenase,NADH-GDH)、NAD+谷氨酸脱氢酶(NAD+-glutamate dehydrogenase,NAD+-GDH)活性升高,表明ipa1能够降低水稻植株氮素同化效率,同时提高氮素重复利用率。在不施氮条件下,NIL-IPA1和NIL-ipa1植株GS活性提高,NADH-GOGAT、NADH-GDH、NAD+-GDH活性降低,可溶性蛋白和游离氨基酸含量减少,同时发现在NIL-ipa1植株中GS、NADH-GOGAT活性变化相对较小,NAD+-GDH活性相对较低,游离氨基酸含量相对较高,表明ipa1能够降低氮胁迫对水稻植株氮同化效率的影响,提高水稻植株对低氮胁迫的抗性。
关键词:水稻(Oryza sativa L.);理想株型;ipa1基因;氮胁迫;分蘖;氮代谢
中图分类号:Q945.13;S511 文献标识码:A 文章编号:0439-8114(2017)08-1427-05
DOI:10.14088/j.cnki.issn0439-8114.2017.08.007
Effects of Ideal Plant Architecture Gene ipa1 on Nitrogen Metabolism under Nitrogen Stress Condition
ZHAO Shuang-shuang1,LIU Lei1,HE Yong-gang1,CAI Hai-ya2,ZHANG Zhi-hong1
(1.College of Life Sciences,Wuhan University, Wuhan 430072,China;2.Institute of Food Crops,Hubei Academy of Agricultural Sciences/Hubei Key Laboratory of Food Crop Germplasm and Genetic Improvement,Wuhan 430064,China)
Abstract: In the present study,under nitrogen deficiency and fertilization conditions,the effects of ipa1 on nitrogen metabolism at rapid tillering stage of rice near-isogenic lines NIL-IPA1 and NIL-ipa1 were analyzed. Under nitrogen fertilization condition, although the activities of glutamine synthetase(GS),NADH-glutamate synthase (NADH-GOGAT) and the content of free amino acid were significantly reduced,the activities of NADH-glutamate dehydrogenase(NADH-GDH) and NAD+-glutamate dehydrogenase(NAD+-GDH) were increased in the NIL-ipa1 plants when compared with NIL-IPA1 plants. This result indicated that ipa1 improved the nitrogen recycling efficiency,although the efficiency of nitrogen assimilation was reduced in NIL-ipa1 plants. When the rice plants were cultivated under the nitrogen deficiency condition,the GS activity was increased,the activities of NADH-GOGAT,NADH-GDH and NAD+-GDH were reduced. Meanwhile,although the contents of soluble protein,free amino acid were decreased in NIL-IPA1 and NIL-ipa1 plants,the change of GS,NADH-GOGAT activities were relatively limited,the NAD+-GDH activity was lower and the content of free amino acid was higher in NIL-ipa1 plants when compared with NIL-IPA1 plants. The result suggested that ipa1 gene could lighten the impact of nitrogen deficiency stress on the nitrogen assimilation ability of rice plants and enhance their resistance to nitrogen stress.
Key words: rice(Oryza sativa L.); ideal plant type; ipa1 gene; nitrogen stress; tiller; nitrogen metabolism
植物生长所需的大量元素中,氮(N)是蛋白质、核酸、叶绿素、酶和部分植物激素的重要组成部分,它决定了植物的形态特征,是影响植物生长和产量形成的首要因素。在植物的生长发育过程中,活细胞的各种代谢活动以及细胞器的形成,都需要氮素的参与[1,2]。植物根部吸收的游离氮在转化为有机氮后才能被植物体利用,该过程由一系列酶催化完成,研究表明谷氨酰胺合成酶(Glutamine synthetase,GS)和谷氨酸合酶(Glutamate synthase,GOGAT)是氮同化的关键酶。其中GS可以催化NH4+与谷氨酸结合形成谷氨酰胺,而GOGAT可以促使2-酮戊二酸(2-Oxoglutarate,2-OG)与谷氨酰胺之间的氨基相互转换生成谷氨酸,在植物体内,这两种反应通常偶联在一起,被称为GS/GOGAT循环[3,4],通过该循环植物体将无机氮转化为有机氮。此外,谷氨酸脱氢酶(Glutamate dehydrogenase,GDH)在维持植物体氮平衡中也起着重要作用,当植物体内氮素含量过高时,GDH能催化NH4+与2-OG结合形成谷氨酸,并将谷氨酸转运到植物体其他组织内贮存,以防止NH4+含量过高对植物产生毒害作用;当植物体氮素含量降低时,GDH分解谷氨酸为氮代谢反应提供氮素[5,6],从而保证氮代谢的正常运转。在植物体内,游离氨基酸是含氮化合物的主要形式,其含量变化影响着植物体的各种代谢反应,对游离氨基酸含量的测定有助于了解植物体对氮素的吸收、运输和同化能力[7]。
水稻(Oryza sativa L.)理想株型调控基因IPA1含有小RNA(OsmiR156)的靶位点,该靶位点突变后,扰乱了OsmiR156对IPA1基因转录本的剪切作用,显著改变了水稻株型等一系列农艺性状。研究表明,当IPA1突变为ipa1后,水稻植株将表现出茎秆粗壮、分蘖减少、每穗颖花数增多等一系列理想株型的特点[8,9]。迄今为止,理想株型调控基因ipa1对水稻氮代谢的影响还不清楚。为此,本研究利用水稻理想株型调控基因IPA1/ipa1构建了1对近等基因系(Near Isogenic Lines,NILs),通过分析施氮与不施氮条件下NILs植株中氮代谢关键酶活性及代谢产物的变化,揭示了氮胁迫条件下水稻理想株型调控基因ipa1对水稻氮代谢的影响。
1 材料与方法
1.1 供试材料
供试材料为含有水稻理想株型调控基因IPA1/ipa1的水稻1对近等基因系材料:NIL-IPA1和NIL-ipa1。该近等基因系来源于籼稻品种黄华占(含野生型IPA1)和粳稻品系少蘖粳(ipa1供体)杂交产生的F1代植株,黄华占/少蘖粳 F1植株与黄华占回交形成BC1F1,经过连续自交后在黄华占/少蘖粳 BC1F6群体中筛选出IPA1位点杂合的单株,而后从该单株的后代中筛选出含有纯合ipa1及IPA1的植株形成近等基因系NIL-ipa1及NIL-IPA1。
1.2 试验材料种植与处理
供试水稻材料于2015年1月7日直播于62.0 cm×36.5 cm×12.0 cm的塑料盆中,温室培养(温室控温20~30 ℃,光照14 h/d,黑暗10 h/d)。并于播种后20 d(1月27日)根据单株基因型分类移栽种植,每穴1株,每盆共计15株,株行距为10.5 cm×12.0 cm。供试水稻材料设置施氮和不施氮两个处理,每个处理采用3次重复。施氮组于播种后48 d(2月24日)、62 d(3月10日)施肥2次,施肥时每盆加入氮(N)肥6.8 g、磷(P2O5)肥3.4 g和钾(K2O)肥3.8 g。不施氮组施肥时只加入等量磷(P2O5)、钾(K2O)肥。期间根据土壤湿度补充水分,以保证水稻植株正常生长。
1.3 取样及测定方法
播种后51 d(2月27日)开始统计单株茎蘖数,随后每7 d统计1次,每个处理统计45株,共统计4次。播种后58 d(3月6日)取样,用于GS、NADH-GOGAT、NADH-GDH、NAD+-GDH活性及游离氨基酸、可溶性蛋白含量的测定。
粗酶液提取及保存参考卢永恩[10]的方法,谷氨酰胺合成酶(GS)活性檢测参考Rhodes等[11]报道的方法,NADH-GOGAT活性测定参照Hecht等[12]的方法进行。NADH-GDH活性测定参照Turano等[13]的方法进行,NAD+-GDH活性测定参照Loulakakis等[14]方法进行。可溶性蛋白质、游离氨基酸的提取及检测参考李合生[15]的方法进行。
2 结果与分析
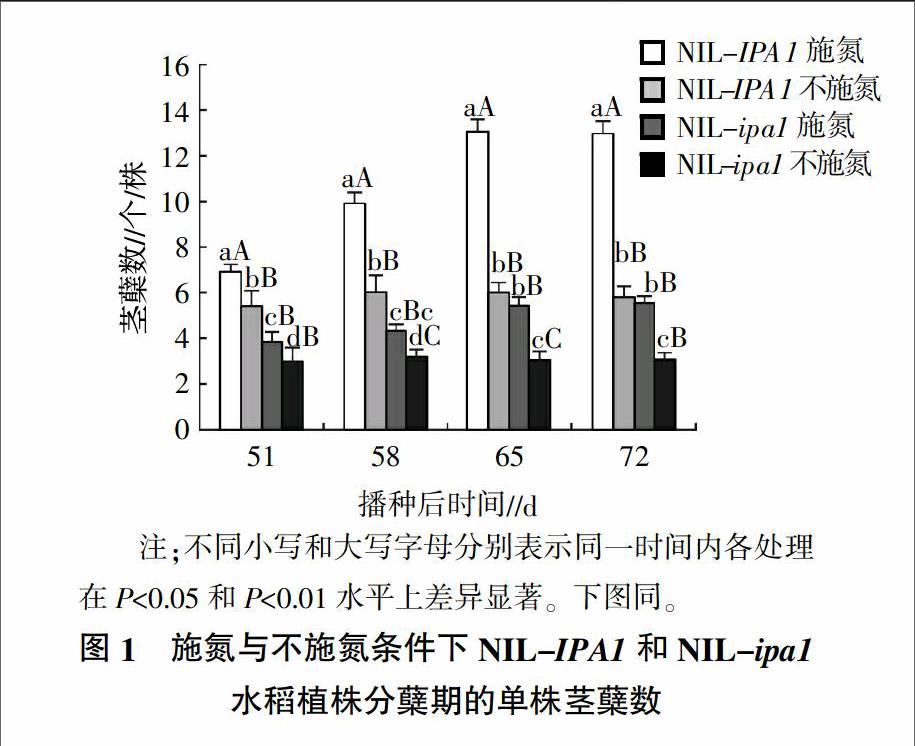
2.1 氮胁迫条件下ipa1对水稻植株分蘖的影响
在施氮与不施氮条件下,NIL-IPA1和NIL-ipa1植株在播种后51~65 d的茎蘖数均有所增长(图1)。在施氮条件下,NIL-IPA1植株茎蘖数从播种后51 d的6.9个增长到播种后65 d的13.2个,NIL-ipa1植株茎蘖数从播种后51 d的3.8个增长到播种后65 d的5.4个。在不施氮条件下,NIL-IPA1植株茎蘖数从播种后51 d的5.4个增加到播种后65 d的6.0个,NIL-ipa1植株茎蘖数从播种后51 d的2.9个增加到播种后65 d的3.1个。而在播种后65~72 d,NIL-IPA1和NIL-ipa1茎蘖数都停止增长(图1)。对比上述施氮与不施氮条件下NILs植株茎蘖数可以发现,ipa1对水稻植株分蘖发生具有明显的抑制作用。
同时,在不施氮的条件下,NIL-IPA1茎蘖数在播种后65和72 d相比施氮分别减少了54.1%和55.6%;而NIL-ipa1茎蘖数在播种后65和72 d与施氮组相比仅减少了43.6%和45.2%;表明NIL-ipa1植株分蘖的发生受氮胁迫影响相对较小。
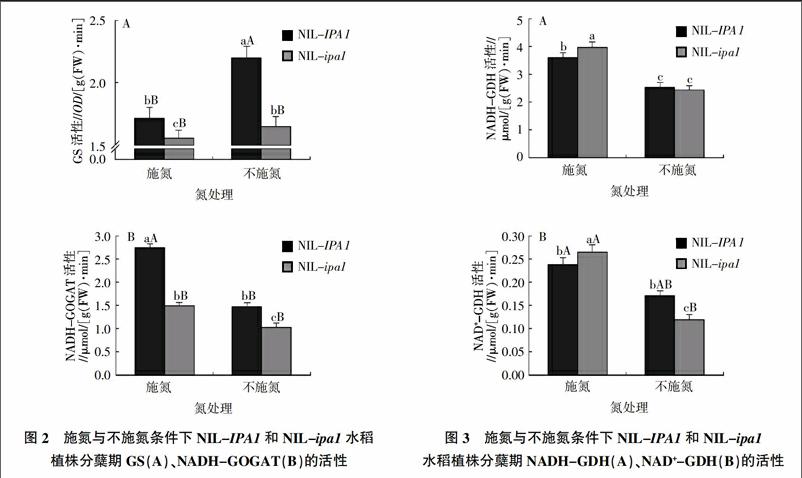
2.2 氮胁迫条件下ipa1对水稻植株GS、NADH-GOGAT活性的影响
GS、GOGAT是与氮同化相关的酶,其活性高低决定了植物对氮素的同化效率。从图2可以看出,在施氮条件下,NIL-ipa1植株GS、NADH-GOGAT活性在播种后58 d均要显著低于NIL-IPA1,其活性相对NIL-IPA1植株分别降低了9.5%和45.9%;在不施氮条件下,NIL-ipa1植株GS、NADH-GOGAT活性在播种后58 d均也要显著低于NIL-IPA1,其活性相对NIL-IPA1植株分别降低了25.3%和30.2%,表明无论在施氮与不施氮条件下,ipa1降低了水稻植株对氮素的同化效率。
在氮胁迫条件下,NIL-IPA1和NIL-ipa1植株GS活性均显著提高,其活性相对施氮处理分别增加了28.4%和6.1%,而NADH-GOGAT活性均显著降低,相对施氮处理分别减少了46.4%和30.7%,表明氮胁迫提高了NIL-IPA1和NIL-ipa1植株将NH4+同化为谷氨酰胺的能力,同时降低了谷氨酸的合成能力。但与NIL-IPA1植株相比,NIL-ipa1植株GS、NADH-GOGAT活性受氮胁迫的影响较小,表明ipa1能够提高水稻植株对于氮胁迫的耐受性。
2.3 氮胁迫条件下ipa1对水稻植株NADH-GDH、NAD+-GDH的影响
GDH在维持植物体内氮代谢的平衡方面具有重要作用,它既可催化2-OG与NH4+缩合形成谷氨酸,也可以催化谷氨酸分解产生2-OG与NH4+。在施氮条件下,NIL-ipa1植株中NADH-GDH、NAD+-GDH的活性在播种后58 d都要显著性高于NIL-IPA1植株(图3),其活性相对NIL-IPA1植株分别提高了10.2%和11.6%;在不施氮条件下,NIL-ipa1植株NADH-GDH活性与NIL-IPA1植株不存在差异,但是NAD+-GDH活性减少了31.2%,由此可见,在施氮条件下,ipa1植株的衰老组织和器官对含氮物质的分解再利用能力较强,而在不施氮条件下,ipa1植株对含氮化合物的分解能力降低。
在氮胁迫条件下,NIL-IPA1植株NADH-GDH、NAD+-GDH活性相比施氮条件下分别减少了29.8%和27.9%,而NIL-ipa1植株NADH-GDH、NAD+-GDH活性相比施氮组分别减少了39.1%和55.6%,表明氮胁迫下,ipa1植株对氮素的需求量较低,低活性NAD+-GDH分解谷氨酸所产生的少量NH4+即可满足水稻植株对氮素的需求。
2.4 氮胁迫条件下ipa1对水稻植株氮代谢产物含量的影响
可溶性蛋白、游离氨基酸分别是植物体内含氮化合物的主要贮存物和主要转运物;在施氮条件下,NIL-ipa1植株可溶性蛋白含量要显著高于NIL-IPA1植株,游离氨基酸含量要显著低于NIL-IPA1植株(图4);在不施氮条件下,NIL-ipa1植株可溶性蛋白含量与NIL-IPA1植株不存在显著性差异,但游离氨基酸含量要显著性高于NIL-IPA1植株,表明ipa1植株在正常氮素条件下可将氮素以蛋白质的形式贮存在叶片中,而在缺氮条件下,则氮素更多的以游离氨基酸的形式存于叶片中。
在不施氮条件下,NIL-IPA1和NIL-ipa1植株可溶性蛋白含量、游离氨基酸含量虽都有所减少,但NIL-IPA1植株可溶性蛋白含量相对施氮降低了15.8%,游离氨基酸含量相对施氮减少了42.6%,而NIL-ipa1植株可溶性蛋白量相对施氮减少了27.1%,游离氨基酸含量相对减少了25.5%,表明在氮胁迫条件下,ipa1能够增强植株对于氮素的再利用能力。
3 讨论
氮是影响水稻分蘖的重要因素,外界环境中的氮素主要通过影响植物体内含氮化合物的水平来调节分蘖的发生,水稻某节位分蘖能否形成,及分蘖芽能否正常发育与水稻叶片、叶鞘中含氮量密切相关[16,17]。刘杨等[18]以不同水稻品系为材料进行研究发现,外界环境氮素水平降低,会导致水稻分蘖芽进入休眠状态。王晓宇等[19]以小麦为材料研究发现,叶片氮含量、氨基酸含量降低不利于分蘖形成及幼穗分化。本研究表明,在氮胁迫条件下,NIL-IPA1和NIL-ipa1植株茎蘖数减少,可能就是由于游离氨基酸含量、可溶性蛋白含量降低引起的。此外,在氮胁迫条件下,NIL-ipa1中游离氨基酸含量减少量相对较少,可见,ipa1能够降低氮胁迫对植株氮代谢的影响。除了环境因素,基因是影响水稻分蘖的内在因素。本研究表明,在施氮和不施氮条件下,NIL-ipa1植株的茎蘖数显著少于NIL-IPA1植株,表明ipa1对水稻分蘖发生具有明显的抑制作用,这点与Miura等[8]和Jiao等[9]的研究结果类似,其研究表明,OsSPL14/IPA1突变为ipa1后,OsSPL14表达量升高,导致水稻分蘖数减少。但相比NIL-IPA1,氮胁迫对NIL-ipa1植株分蘖的发生影响较小,表明ipa1能够显著减少水稻分蘖发生对氮素的需求量。
氮代谢强弱是影响水稻分蘖的重要因素,GS、NADH-GOGAT在氮代谢中扮演着重要角色。其活性高低与水稻分蘖数多少密切相关,在常氮条件下,GS和NADH-GOGAT活性缺失,将导致水稻体内游离氨基酸、可溶性蛋白含量降低[20,21]。在本研究中,NIL-ipa1植株分蘖数减少的另一个原因可能是播种后58 d GS及NADH-GOGAT活性降低,引起NIL-ipa1植株游离氨基酸含量降低,减少了对分蘖发生所需氮素的供应,导致分蘖芽无法正常侧生。另外,有研究表明,植株在出现氮饑饿时会使体内2-OG含量升高[22],进而提高其GS活性,增强植株对氮素的同化效率,提高植物体内氮素水平[23,24],以满足水稻快速分蘖对含氮化合物的需求。罗凤等[25]以水稻为材料研究也表明,在短期缺氮的条件下,氮素缺乏会引起水稻地上部分GS活性升高,NADH-GOGAT活性降低。本研究表明,氮胁迫能够提高NIL-IPA1和NIL-ipa1植株GS活性,同时降低NADH-GOGAT活性,但与NIL-IPA1植株相比,NIL-ipa1植株中这两种酶活性变化量相对较小,说明ipa1能够降低水稻植株对于氮胁迫的敏感性,间接表明ipa1植株在快速分蘖期对氮素的需求量较低。
GDH是催化2-OG與NH4+可逆的缩合形成谷氨酸的酶[26],其在衰老组织和器官的氮素再利用上起着关键作用[27],同时GDH在植物抵御不良环境胁迫时也起到重要的调节作用[28]。通过转基因等方式提高GDH活性可以增加植物对氮素的利用率,同时也能提高植物的生长速率[29-31]。本研究表明,在施氮条件下,NIL-ipa1植株的NADH-GDH、NAD+-GDH活性较高,表明NIL-ipa1植株对氮素的重复利用能力较强。而在氮胁迫条件下,NIL-ipa1中NAD+-GDH活性相对降低,表明其通过谷氨酸分解产生NH4+的量相对较少,这也可能是其在氮胁迫条件下GS、NADH-GOGAT活性相对较低的原因之一,同时本研究也表明NIL-ipa1植株在快速分蘖期对氮素的需求量较少,不需要大量分解谷氨酸即可满足水稻分蘖对氮素的需求。
参考文献:
[1] TABUCHI M,ABIKO T,YAMAYA T. Assimilation of ammonium ions and reutilization of nitrogen in rice(Oryza sativa L.)[J]. J Exp Bot,2007,58(9):2319-2327.
[2] CRAWFORD N M,FORDE B G. Molecular and developmental biology of inorganic nitrogen nutrition[J].Arabidopsis Book,2002, 1:e0011.
[3] BAO A,ZHAO Z,DING G,et al. The stable level of glutamine synthetase 2 plays an important role in rice growth and in carbon-nitrogen metabolic balance[J].Int J Mol Sci,2015,16(6):12713-12736.
[4] YAMAYA T,KUSANO M.Evidence supporting distinct functions of three cytosolic glutamine synthetases and two NADH-glutamate synthases in rice[J].J Exp Bot,2014,65(19):5519-5525.
[5] DUBOIS F,TERC?魪-LAFORGUE T,GONZALEZ-MORO M B, et al. Glutamate dehydrogenase in plants:Is there a new story for an old enzyme?[J]. Plant Physiology & Biochemistry,2003, 41(s6-7):565-576.
[6] KUMAR R G,SHAH K,DUBEY R S. Salinity induced behavioural changes in malate dehydrogenase and glutamate dehydrogenase activities in rice seedlings of differing salt tolerance[J].Plant Science,2000,156(1):23-34.
[7] 盛 坤.两种穗型冬小麦品种碳氮代谢与分蘖成穗关系的研究[D].郑州:河南农业大学,2009.
[8] MIURA K,IKEDA M,MATSUBARA A,et al.OsSPL14 promotes panicle branching and higher grain productivity in rice[J].Nat Genet,2010,42(6):545-549.
[9] JIAO Y,WANG Y,XUE D,et al. Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J].Nat Genet,2010,42(6):541-544.
[10] 卢永恩.水稻谷氨酸合酶基因和胞质异柠檬酸脱氢酶基因的功能研究以及氨基酸转运蛋白基因家族分析[D].武汉:华中科技大学,2014.
[11] RHODES D,RENDO G A,STEWART G R. The control of glutamine synthetase level in Lemna minor L[J].Planta,1975, 125:201-211.
[12] HECHT U,OELMTTLLER R,SCHMIDT S,et al. Action of light, nitrate and ammonium on the levels of NADH- and ferredoxin-dependent glutamate synthases in the cotyledons of mustard seedlings[J].Planta,1988,175:130-138.
[13] TURANO F J,DASHNER R,UPADHYAYA A,et al. Purification of mitochondrial glutamate dehydrogenase from dark-grown soybean seedlings[J].Plant Physiol,1996,112:1357-1364.
[14] LOULAKAKIS K A,ROUBELAKIS-ANGELAKIS K A. Intracellular localization and properties of NADH-glutamate dehydrogenase form Vitis vinifera L.:Purification and characterization of the major leaf isoenzyme[J].Journal of Experimental Botany,1990,41:1223-1230.
[15] 李合生.植物生理生化实验原理及技术[M].北京:高等教育出版社,2006,182-194.
[16] 蒋彭炎,洪晓富.水培条件下氮浓度对水稻氮素吸收和分蘖发生的影响研究[J].作物学报,1997,23(2):191-199.
[17] GUEYE T,BECKER H.Genetic variation in nitrogen efficiency among cultivars of irrigated rice in Senegal[J]. Journal of Agricultural Biotechnology & Sustainable Development,2011, 3(3):35-43.
[18] 刘 杨,王强盛,丁艳锋,等.氮素和6-BA对水稻分蘖芽发育的影响及其生理机制[J].作物学报,2009,35(10):1893-1899.
[19] 王晓宇,冯 伟,郭天财,等.两种穗型小麦品种分蘖衰亡进程中茎蘖碳氮代谢的差异[J].西北农业学报,2010,19(11):38-42.
[20] BAO A,ZHAO Z,DING G,et al. Accumulated expression level of cytosolic glutamine synthetase 1 gene(OsGS1;1 or OsGS1;2) alter plant development and the carbon-nitrogen metabolic status in rice[J].PLoS One,2014,9(4):e95581.
[21] LU Y,LUO F,YANG M,et al. Suppression of glutamate synthase genes significantly affects carbon and nitrogen metabolism in rice(Oryza sativa L.)[J]. Sci China Life Sci, 2011,54(7):651-663.
[22] DOM1′NGUEZ-MART1′N M A,LO′PEZ-LOZANO A,DIEZ J,et al. Physiological regulation of isocitrate dehydrogenase and the role of 2-oxoglutarate in Prochlorococcus sp. Strain PCC 9511[J].Plos One,2014,9(7):e103380.
[23] 鲍世颖,袁永泽,周志鹏,等.2-酮戊二酸对水稻根部碳-氮代谢重要酶的活性影响[J].武汉大学学报,2006,52(6):763-766.
[24] 包爱丽.超量表达氮代谢关键基因对水稻碳氮代谢的影响[D].武汉:华中农业大学,2013.
[25] 罗 凤,卢永恩,杨 猛,等.氮胁迫对水稻营养生长期氮代谢及相关基因表達量的影响[J].华中农业大学学报,2012,31(1):16-22.
[26] DU C,LIN J,YANG Y,et al. Molecular cloning, characterization and function analysis of a GDH gene from Sclerotinia sclerotiorum in rice[J].Mol Biol Rep,2014,41(6):3683-3693.
[27] REFOUVELET E,DAGUIN F. Polymorphic glutamate dehydrogenase inlilac vitroplants as revealed by combined preparative IEF and native PAGE:Effect of ammonium deprivation;darkness and atmospheric CO2 enrichment upon isomerization[J].Physiol Plant,1999,105:199-206.
[28] KWINTA J,BIELAWSKI W.Glutamate dehydrogenase in higher plants[J].Acta Physiologiae Plantarum,1998,20(4):453-463.
[29] ZHOU Y,LIU H, ZHOU X,et al. Over-expression of a fungal NADP(H)-dependent glutamate dehydrogenase PcGDH improves nitrogen assimilation and growth quality in rice[J]. Molecular Breeding,2014,34(2):335-349.
[30] ZHOU X,LIN J,ZHOU Y,et al. Overexpressing a fungal CeGDH gene improves nitrogen utilization and growth in rice[J].Crop Science,2015,55(2):811.
[31] KISAKA H,KIDA T,MIWA T. Transgenic tomato plants that overexpress a gene for NADH-dependent glutamate dehydrogenase (legdh1)[J].Breeding Science,2007,57(2):101-106.

