白玉龙火龙果不同外植体的离体培养
谢志亮 曾光辉 余宏傲 吴振旺


摘要:[目的]研究白玉龙火龙果子叶、下胚轴及子叶节的不定芽诱导及茎段增殖技术,为白玉龙火龙果的品种改良及快繁育苗提供技术支持。[方法]以白玉龙火龙果种子培育的无菌苗为材料,采用正交试验设计分析不同培养基、不同植物生长调节剂与浓度及其组合对白玉龙火龙果子叶、下胚轴及子叶节不定芽诱导及茎段增殖与生根的影响。[结果]白玉龙火龙果子叶、下胚轴及子叶节均能直接诱导不定芽发生。其中,16个正交处理均能诱导子叶节不定芽发生,其最优诱导培养基为WPM+0.50 mg/L TDZ+0.50 mg/L CPPU+0.05 mg/L 6-BA+I.0 mg/L NAA,诱导率为87.1%-100.0%;子叶仅1个处理未能诱导出不定芽,最高诱导率为36.0%,其最优诱导培养基为1/2MS+0.50 mg/L TDZ+0.05mg/L CPPU+2.00 mg/L 6-BA+0 mg/L NAA;下胚轴仅5个处理能诱导出不定芽,最高诱导率仅3.0%,其最优诱导培养基为1/2MS+0.05 mg/L TDZ+2.00 mg/L CPPU+I.00 mg/L 6-BA+1.0 mg/L NAA。茎段去顶处理有利于腋芽的诱导萌发,去顶处理的最大增殖系数为4.2,不去顶处理的最大增殖系数为3.1,其最优增殖培养基为WPM+0.50 mg/L 6-BA+0.05 mg/L IBA。NAA处理能促进茎段生根,适宜的生根培养基为1/2MS+0.1-0.5 mg/L NAA,生根率达100.0%。[结论]不同基本培养基、植物生长调节剂与浓度及其组合均能诱导白玉龙火龙果子叶、下胚轴和子叶节不定芽发生及茎段芽增殖和不定根产生。其中,不定芽诱导以子叶节最易诱导发生,其次为子叶,下胚轴较难;茎段芽增殖和不定根诱导均较容易。
关键词:火龙果;离体培养;子叶;下胚轴;子叶节;不定芽诱导
0引言
[研究意义]火龙果是仙人掌科(Cactaceae)量天尺属(Hylocereus undatus)和蛇鞭柱属(Seleniere us mejalantous)多年生攀援性肉质植物,主要有红皮白肉、黄皮白肉和红皮红肉三大类。白玉龙属于红皮白肉类火龙果,白花结实,个大,产量高,抗病性强,耐储运,是目前我国种植面积最大、产量最高的火龙果主栽品种,而较受市场欢迎的红皮红肉类火龙果,因其白花不结实或结实率低,种植面积相对较小。因此,为满足消费者需求及促进火龙果产业健康发展,亟待利用现代生物技术进行火龙果品种遗传改良。[前人研究进展]通过不同6-BA浓度与NAA组合诱导火龙果带刺座茎段腋芽萌发与增殖,再经生根培养获得大量火龙果组培再生植株已有研究报道(黄青峰,2002;周传明等,2002;陈广超等,2003;余慧琳等,2009;黄春华等,2013)。黄红梅等(2012)采用一定浓度2,4-D与6-BA组合成功获得火龙果茎段和子叶愈伤组织,并通过6-BA与NAA组合成功诱导愈伤组织再分化。黄文静等(2013)采用1/2MS+0.5-2.5 mg/L 6-BA成功诱导了火龙果子叶节不定芽萌发。彭思维等(2015)采用适宜浓度的TDZ(苯基噻二唑基脲)、2,4-D和NAA组合,成功诱导获得了火龙果茎段愈伤组织及茎段丛生芽。[本研究切入点]目前,有关火龙果子叶及下胚轴不定芽诱导再生的研究鲜见报道。[拟解决的关键问题]以白玉龙火龙果无菌实生苗的子叶、胚轴和子叶节为试材,采用正交试验设计分析不同培养基、不同激素与浓度及其组合对其不定芽诱导及茎段增殖再生的影响,为利用现代生物技术进行火龙果品种改良及其种苗快繁提供技术支持。
1材料与方法
1.1试验材料
供试白玉龙火龙果(7年生)种植于浙江温州科技职业学院(温州市农业科学研究院)梧田基地设施大棚内,于2014年10-11月采摘自然成熟开裂的自花授粉果实为基本材料。
1.2试验方法
1.2.1无菌苗获得 参照谢志亮等(2016)的方法,将火龙果果实去除果皮后置于盆中反复用力揉搓果肉,利用清水浮力去除果肉组织,然后将种子置于纱布袋中反复用力挤压以除去种子表面粘状物,再用洁净自来水将种子冲洗干净,置于干净烧杯中,于超净工作台上用75%酒精消毒30 s,然后用0.1%HgCl2溶液消毒6-8 min,最后以無菌水清洗4-6次,育苗备用。
1.2.2子叶、下胚轴及子叶节不定芽诱导 采用L16(4)正交试验设计(表1)分析基本培养基、TDZ、氯吡脲(CPPU)、6-BA和NAA对白玉龙火龙果子叶、下胚轴及子叶节(切除幼苗和部分下胚轴)不定芽诱导的影响。无菌苗苗龄为25-30 d,每瓶接种6-9个外植体,每处理接种36个外植体。接种45 d后统计不定芽诱导率。
不定芽诱导率(%)=具不定芽的外植体数/接种总外植体数×100
1.2.3茎段培养 采用L9(3)正交试验设计(表2),分析基本培养基、6-BA和IBA对无菌苗茎段增殖培养和生根培养的影响。茎段分切除顶端优势与不切除顶端优势两个处理。接种45 d后统计增殖系数和生根率。
增殖系数=诱导的不定芽总数/接种外植体数
1.2.4不定根诱导 切取生长健壮的无根苗接种于添加不同NAA浓度的1/2MS+3.0%蔗糖+0.7%琼脂培养基上,NAA浓度设0.1、0.5、1.0、2.0和4.0 mg/L共5组处理,每组处理10瓶,每瓶接种4个外植体。30 d后观察不定根的生长情况,统计不定根的诱导率和生根数等。
生根率(%)=具不定根的外植体数/接种总外植体数×100
1.2.5培养条件 培养室温度(25±2℃),相对湿度保持在60%-80%,光照强度1500-3000 1X,光照时间14 h/d。
1.3统计分析
试验数据采用Excel 2007进行统计分析。
2结果与分析
2.1不同基本培养基及植物生长调节剂对白玉龙火龙果外植体不定芽诱导的影响
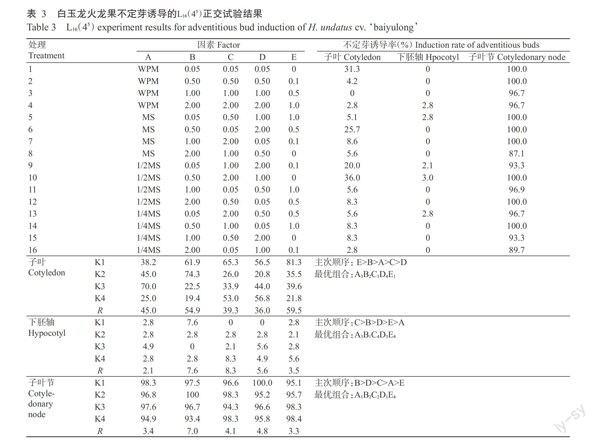
外植体材料和激素组合不同,其不定芽诱导的难易程度和诱导率也不一样。由表3和图1-A-图1-C可看出,子叶节最容易诱导发生不定芽,子叶次之,下胚轴最难诱导发生不定芽。从发生位置来看,子叶节诱导的不定芽位于与上胚轴相连的切口处,子叶诱导的不定芽发生于近轴端,下胚轴诱导的不定芽则发生于形态学上端(近子叶端)。
2.1.1对子叶节不定芽诱导的影响 由表3可知,以子叶节进行不定芽诱导,16个处理均有较高的不定芽诱导率(87.1%-100.0%),其中,处理1、2、5、6、7、10、12和14的不定芽诱导率均达100.0%;比较极差(R),发现影响子叶节不定芽诱导的主次因子排序为B>D>C>A>E,说明TDZ对子叶节不定芽诱导的影响最大其后依次为6-BA、CPPU、基本培养基和NAA。诱导白玉龙火龙果子叶节不定芽发生的最优组合为AIB2C2DIE4,即WPM+0.50 mg/L TDZ+0.50 mg/LCPPU+0.05 mg/L 6-BA+1.0 mg/L NAA为诱导子叶节不定芽发生的适宜培养基。
2.1.2对子叶不定芽诱导的影响 由表3可知,以子叶进行不定芽诱导,除处理3外,其余15个处理均能诱导出不定芽,其中又以处理10的诱导率最高,达36.0%;比较极差(R),发现影响白玉龙火龙果子叶不定芽诱导的主次因子排序为E>B>A>C>D,说明NAA对子叶不定芽诱导的影响最大,其次为TDZ,其后依次为基本培养基、CPPU和6-BA。诱导白玉龙火龙果子叶不定芽发生的最优组合为A382CID4EI,即1/2MS+0.50 mg/L TDZ+O.05 mg/L CPPU+2.00 mg/L6-BA+0 mg/L NAA为诱导子叶不定芽发生的适宜培养基。
2.1.3对下胚轴不定芽诱导的影响 由表3可知,以下胚轴进行不定芽诱导,仅处理4、5、9、10和13发生不定芽,且诱导率极低,最高的仅为3.0%;比较极差(R),发现影响下胚轴不定芽诱导的主次因子排序为C>B>D>E>A,说明CPPU对下胚轴不定芽诱导的影响最大,其后依次为TDZ、6-BA、NAA和基本培养基。诱导白玉龙火龙果下胚轴不定芽发生的最优组合为A3BIC4D3~,最口1/2MS+0.05 mg/L TDZ+2.00 mg/LCPPU+1.00 mg/L 6-BA+1.0 mg/L NAA为诱导下胚轴不定芽发生的适宜培养基。
2.2不同基本培养基及植物生长调节剂对白玉龙火龙果茎段增殖的影響
由表4可知,白玉龙火龙果茎段的增殖系数为0.8~4.2。其中,去除顶端生长点9个处理的增殖系数均比对应保留顶端生长点处理的增殖系数大(图1-D和图1-E);在去除顶端生长点的处理中,以处理4的增殖系数最大,为4.2,处理7的增殖系数最小,为1.5;在保留顶端生长点的处理中,以处理1和处理5的增殖系数最大,均为3.1,处理7的增殖系数最小,为0.8。比较极差(R),发现无论茎段去顶与否,影响茎段芽增殖的主次因子排序均为A>C>B,即依次为培养基、IBA和6-BA。白玉龙火龙果茎段增殖培养的最优组合为A1B1C2,即WPM+0.50 mg/L 6-BA+0.05mg/L IBA为白玉龙火龙果茎段增殖的最佳培养基。
2.3不同NAA浓度对白玉龙火龙果茎段不定根诱导的影响
火龙果不定根有两种,且均易发生,其中,从茎段切面伤口处发生的不定根生长较粗壮(图1-F),另一种细长毛状气生根发生部位不确定,在芽诱导与增殖、生根诱导及壮苗等培养过程中均有发生。
由表5可知,5个NAA浓度处理均能诱导不定根发生,但以低浓度(0.1-0.5 mg/L)NAA诱导效果较优,不定根诱导率达100.0%,平均根数也较多,根长目.粗壮。
2.4炼苗及移栽
选取健壮生根瓶苗至室外锻炼15 d左右,再逐步打开瓶盖,2-4 d后用清水清洗去除培养基,晾干后栽人草炭:珍珠岩:蛭石为1:1:1的基质中,浇透水,短时间遮荫管理,移栽成活率在90.0%以上。
3讨论
黄文静等(2013)以1/2MS+0.5-2.5 mg/L 6-BA为培养基进行火龙果子叶节不定芽诱导,可获得较高的诱导萌发率,每个子叶节可诱导发生1~4个不定芽,且随6-BA浓度增加,诱导率与不定芽数逐渐增加,以1.5 mg/L 6-BA的效果最佳,诱导萌发率达90.0%。本研究利用TDZ、6-BA、CPPU及NAA的16个正交处理组合也成功诱导火龙果子叶节不定芽萌发,且多个组合的诱导率达100.0%,大部分子叶节诱导出2个以上不定芽。
黄红梅等(2012)报道利用2,4-D与6-BA、6-BA与NAA组合成功诱导获得火龙果子叶愈伤组织且愈伤组织能再分化。本研究利用不同培养基与植物生长调节剂组合成功诱导火龙果子叶和下胚轴直接发生不定芽,但二者的不定芽诱导率均比子叶节低,尤其以下胚轴不定芽的诱导率更低。虽然16个子叶不定芽诱导处理中仅处理3未发生不定芽,但不定芽诱导率偏低,最高仅为36.0%;16个下胚轴不定芽诱导处理中仅5个处理发生不定芽,不定芽诱导率极低,最高仅为3.0%。从不定芽发生部位来看,子叶不定芽均发生于近轴端,下胚轴不定芽发生于下胚轴形态学上端即靠近子叶(子叶节)端,可能与子叶及下胚轴的连接处富有分生组织更有利于不定芽发生有关(范晨昕等,2008)。为提高火龙果子叶和下胚轴的不定芽诱导率及遗传转化效率,尚需在其外植体材料、培养条件、激素浓度与组合等方面进行深入探究。
目前,关于火龙果茎段增殖培养的研究较多,主要集中在直接诱导腋芽萌发而获得无根苗,而经由愈伤组织阶段再诱导分化形成不定芽较难(黄红梅等,2012;彭思维等,2015)。周传明等(2002)、陈广超等(2003)、余慧琳等(2009)、谢志亮等(2016)采用一定浓度的6-BA与NAA组合诱导火龙果腋芽可获得较高的诱导萌发率,且随6-BA浓度的升高,增殖系数增大,当6-BA浓度为10.0 mg/L、诱导后60 d统计的增殖系数达5.99,但苗长势较弱、分枝多,水浸状及玻璃化现象严重;从组培苗的数量和质量来看,火龙果增殖培养的6-BA浓度以0.5~2.0 mg/L为宜。本研究中,火龙果茎段切除顶端生长点更有利于其增殖,可能与顶端分生组织能合成生长素等植物激素,存在顶端优势,从而抑制侧芽的萌发有关。
黄青峰和余成章(2002)研究发现,利用低浓度NAA诱导火龙果生根效果最佳;而刘洪章等(2012)研究认为,IAA诱导火龙果生根效果明显优于NAA,且以1.0 mg/L IAA的诱导效果最佳;王云山等(2012)的研究结果也表明,IBA诱导火龙果茎段发生不定根的效果优于NAA,且以2.0 mg/L IBA诱导效果最佳,生根率为86.96%,IBA浓度大于4.0 mg/L时会抑制根的形成。本研究结果与上述研究结果相似,低浓度NAA能较好地诱导火龙果无根苗生根,在0.1-0.5 mg/L NAA浓度下,生根率达100.0%。
4结论
不同基本培养基、植物生长调节与浓度及其组合均能诱导白玉龙火龙果子叶、下胚轴及子叶节不定芽发生、茎段芽增殖和不定根产生。其中,子叶节最易诱导发生不定芽,其次为子叶,下胚轴较难;茎段芽增殖和不定根诱导均较容易。

