紫娇花挥发油成分的GC睲S分析及抗氧化能力测定
何月秋 林立 杜甜钿 黄艾

摘要: 采用水蒸气蒸馏法和固相微萃取法提取紫娇花不同部位的挥发油,结合气相色谱—质谱(GCMS)与计算机检索联用技术对其化学成分进行分析和鉴定,用面积归一化法测定各组分的相对含量,并对该挥发油清除DPPH·自由基能力和总抗氧化能力进行了研究。结果表明:紫娇花挥发油具有成分及相对含量差异大、成分较简单、化合物种类以含硫化合物为主的特点。两种方法在紫娇花不同部位挥发油中共检测出了16种化学成分,以硫醚类和含硫烃类化合物为主,相对含量占总成分在80%以上,其中Disulfide, bis(2sulfhydrylethyl)含量最高,其余许多成分还具有一定的药用价值。两种方法所得到的挥发油化学成分具有一定的差异性,固相微萃取法对醇类、醛类和酯类物质提取效果较好,而水蒸气蒸馏法对含硫烃类、硫醚类和萜类的提取效果更好。实验条件下紫娇花挥发油清除DPPH·自由基的IC50为17.46 mg·mL1,清除率可达54.86%;紫娇花挥发油在相同条件下较L抗坏血酸具有更强的总抗氧化力。该研究结果为进一步开发利用该植物资源提供了理论依据。
关键词: 紫娇花, 挥发油, 化学成分, 气相色谱—质谱(GCMS), 抗氧化能力
中图分类号: Q946.8
文献标识码: A
文章编号: 10003142(2017)05062707
Abstract: The essential oils of Tulbaghia violacea were obtained from different organs by steam distillation (SD) and solid phase microextraction (SPME), which were analyzed by gaschromatographymass spectrometry (GCMS), and the antioxidant activities of the essential oils were also investigated through the measurement of DPPH scavenging activity and total antioxidant capacity. The results showed that the compositions of the essential oils and their relative contents in different organs of T. violacea were significantly different, and totally sixteen compounds were indentified through two methods. Most of the ingredients in volatile oil were sulfide or sulfur compounds, accounting for more than 80% of the total composition, and the relative content of Disulfide, bis(2sulfhydrylethyl)was the highest. Some consitituents of the essential oils were valuable for pharmaceutical and for the production of spices. SPME was more effective for extraction of alcohols, aldehydes and esters, and SD was better for sulfur, sulfide and terpenoids extraction. IC50 for the essential oils on scavenging DPPH was 17.46 mg·mL1 and the scavenging rate against DPPH free radicals could reach 54.86%. The essential oils of T. violacea maintained higher antioxidant capacity than Lascorbic acid. Our analysis on the compositions and their relative contents of essential oils in T. violacea provides the information for further utilization of this plant.
Key words: Tulbaghia violacea, essential oil, chemical constituents, GCMS, antioxidant capacity
紫嬌花(Tulbaghia violacea),别名野蒜或非洲小百合,原产于南非,为石蒜科(Amaryllidaceae)多年生常绿球根花卉,株高45~60 cm,叶狭长线形,花紫红色,观赏价值极高,在我国主要用于园林绿化(何月秋等,2010)。紫娇花在南非为当地重要的传统药用植物(Van Wyk & Wink,2004),被用于治疗呼吸道感染、支气管炎、咳嗽、哮喘、胃溃疡以及肺结核等疾病(Van Wyk & Wink,2004;Hutchings et al,1996)。近年来,有研究揭示了紫娇花更多方面的药用价值(Olorunnisola et al,2011)。Raji et al(2010)研究表明紫娇花可用于治疗高血压和心脏病。紫娇花的乙醇提取液对于糖尿病的治疗具有潜在应用价值(Van Huyssteen et al, 2011)。在抗癌药物研究中,Lyantagaye(2013)发现紫娇花叶片提取物具有诱导癌细胞凋亡的作用。在对动脉粥样硬化大鼠的研究中,Olorunnisola(2012)研究表明紫娇花根茎的甲醇提取物可有效防止高脂饮食引起的主动脉病变、酶的消耗性肾小球硬化和肝损伤,原因可能是提取物中含有高抗氧化性成分。同时,紫娇花的挥发性成分也具有良好的抑菌效果(Bull et al,2005;Ncube et al,2012),特别是对金黄色葡萄球菌(Staphylococcus aureus)和草绿色链球菌(S. viridians)的一些耐药性菌株具有明显的抑制效果,而对HEK293和HepG2细胞株系的毒害作用则较小,表明该植物挥发油在抗生素药物开发中具有重要价值(Soyingbe,2013)。
目前,国内外有关植物挥发油研究的报道越来越多(周红艳,2014;Kezemi et al,2011;ValeSilva et al,2010),许多植物挥发性成分的药用价值也不断被发现(Chiara et al,2010;Kadri et al,2011)。然而,有关紫娇花挥发油成分的研究报道还不多(Soyingbe,2013)。本研究拟对紫娇花挥发性物质进行成分鉴定和相对含量分析,并研究其抗氧化能力,以期为今后紫娇花的开发利用提供一定的參考依据。
1材料与方法
1.1 材料、仪器和试剂
2015年8月于宁波奉化市采集当地栽植的紫娇花,经过宁波植物园徐绒娣副教授鉴定并确认。取其根、鳞茎、叶片、花瓣以及花梗等为实验材料,剪切后备用;乙酸乙酯为HPLC级,无水硫酸钠、DPPH、无水乙醇、L抗坏血酸均为AR级。
7890A/5977型GCMS联用仪(美国Agilent公司);手动SPME进样器(美国Supelco公司),萃取头为100 μm聚二甲基硅烷(PDMS),配50 μL硅胶垫螺纹口样品瓶(Supelco公司);电热恒温水浴锅(上海玺恒实业有限公司)。
1.2 方法
1.2.1 水蒸气蒸馏提取及GCMC操作根据《中国药典》2005年版一部附录XD挥发油测定甲法,准确称取200 g切碎的材料于1 000 mL圆底烧瓶中进行水蒸气蒸馏,得到特殊气味黄色油状液体,重复操作后混合所得提取物,用乙酸乙酯进行萃取和纯化,取上层溶液加入足量无水硫酸钠除去水分;剩下的溶液过滤膜除尽杂质后进行GCMS操作。
气相色谱条件:色谱柱为HP5MS毛细石英柱(30 m × 0.25 mm × 0.25 μm);自动进样器,进样量1 μL,气体流速为1.0 mL·min1;进样口、连接口温度250 ℃;柱温初始温度为40 ℃,保持1 min,以20 ℃·min1的速度升至100 ℃,保持1 min,再以6 ℃·min1的速度升到225 ℃。
质谱条件:离子源EI;电离能70 eV;离子源温度230 ℃;四极杆温度150 ℃;质量扫描范围15~500 amu;溶剂延迟时间为2 min。通过工作站的NIST图谱库进行初步检索,结合相关研究(林琳等,2008;郑福平等,2009)确定化合物成分,并根据峰面积归一化法计算每种成分的相对含量。
1.2.2 SPME萃取及GCMC操作将固相微萃取装置的萃取头插入气相色谱的进样口中,在250 ℃条件下老化30 min;同时,取切碎的紫娇花材料3 g放入50 mL样品瓶中,加入5 g的NaCl后盖上盖子;将老化好的萃取头插入样品瓶中,萃取头与样品保持1 cm的距离,40 ℃水浴恒温40 min;拔出萃取头,插入气相色谱进样口,250 ℃条件下解析5 min,再以与水蒸气提取物相同的GCMS条件进行挥发物的成分和相对含量分析。
1.2.3 清除DPPH自由基能力测定以紫娇花整株为材料,通过水蒸气蒸馏法得到挥发油,共提取10次,计算得油率为0.11%(V/W)。按Simelane et al(2007)和赵金伟等(2010)的方法测定紫娇花挥发油对DPPH的清除作用。配制不同浓度样品醇溶液,分别取1 mL样品液与1 mL浓度为18 μg·mL1的DPPH乙醇(95%)溶液混合,避光条件放置2 h,以不加精油样品的DPPH乙醇液为对照,在波长517 nm处测定各溶液的吸光度,平行测定3个样。
自由基清除率(%)=(1-Ai/A0) × 100%。
式中,A0为t=0时空白样的吸光度,Ai为t=2 h时样品的吸光度。以L抗坏血酸为对照物。
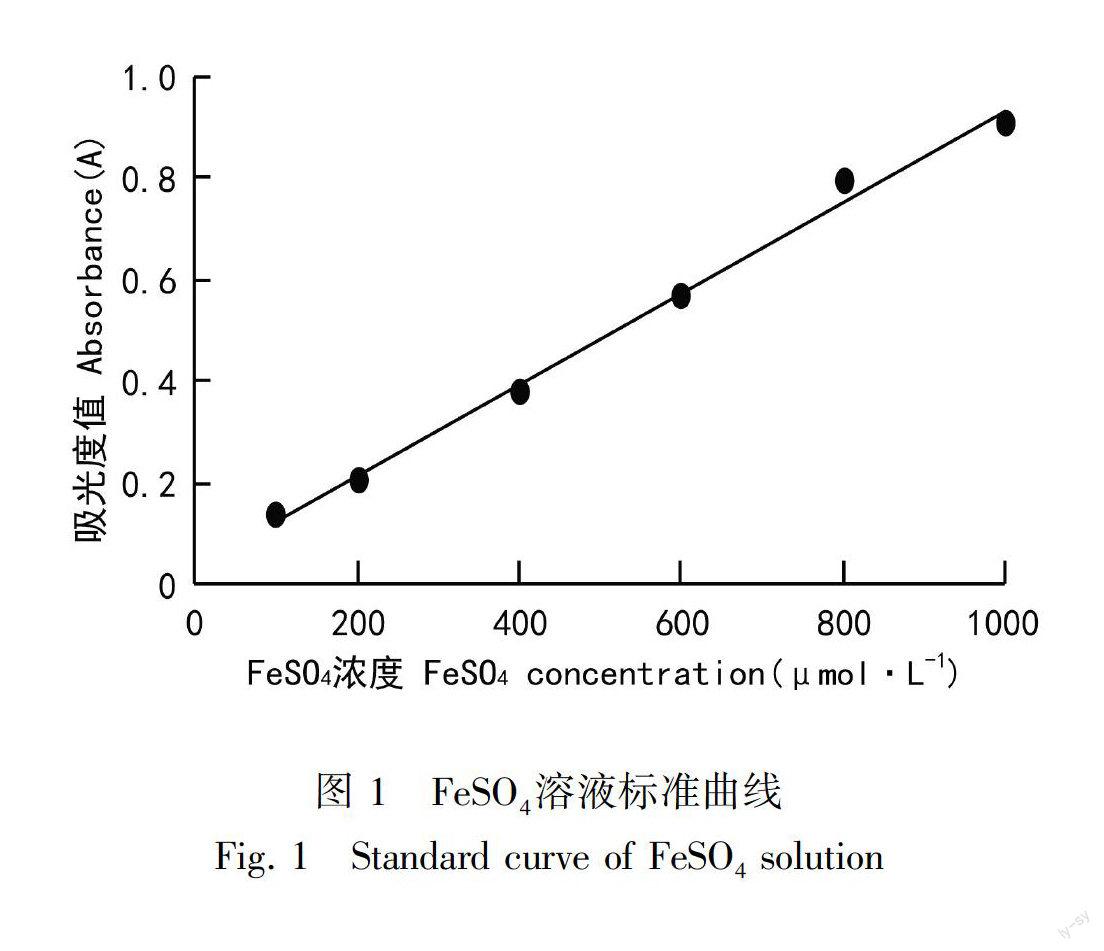
1.2.4 总抗氧化活性的测定参考卢赛赛等(2015)的方法,利用FRAP法进行挥发油抗氧化活性的测定,并以L抗坏血酸为对照。用70%乙醇溶解得到100~1 000 μmol·L1的FeSO4溶度,根据FRAP法加入工作液并在37 ℃下放置10 min,在593 nm测其吸光度值并绘制标准曲线(图1)。浓度与吸光度形成良好线性关系(R2 = 0.994),拟合方程y=0.000 8x+0.031,表明将吸光度值换算成样品的FeSO4浓度的方法是可行的。
用70%乙醇稀释挥发油至30%浓度,按标准曲线制作方法测定样品吸光度值,以1.0 mmol·L1 FeSO4为标准,样品抗氧化活性以达到同样吸光度所需FeSO4浓度表示,FeSO4浓度越大表示抗氧化能力越强。以100 mg·L1的L抗坏血酸为对照物。
2结果与分析
2.1 挥发油成分分析
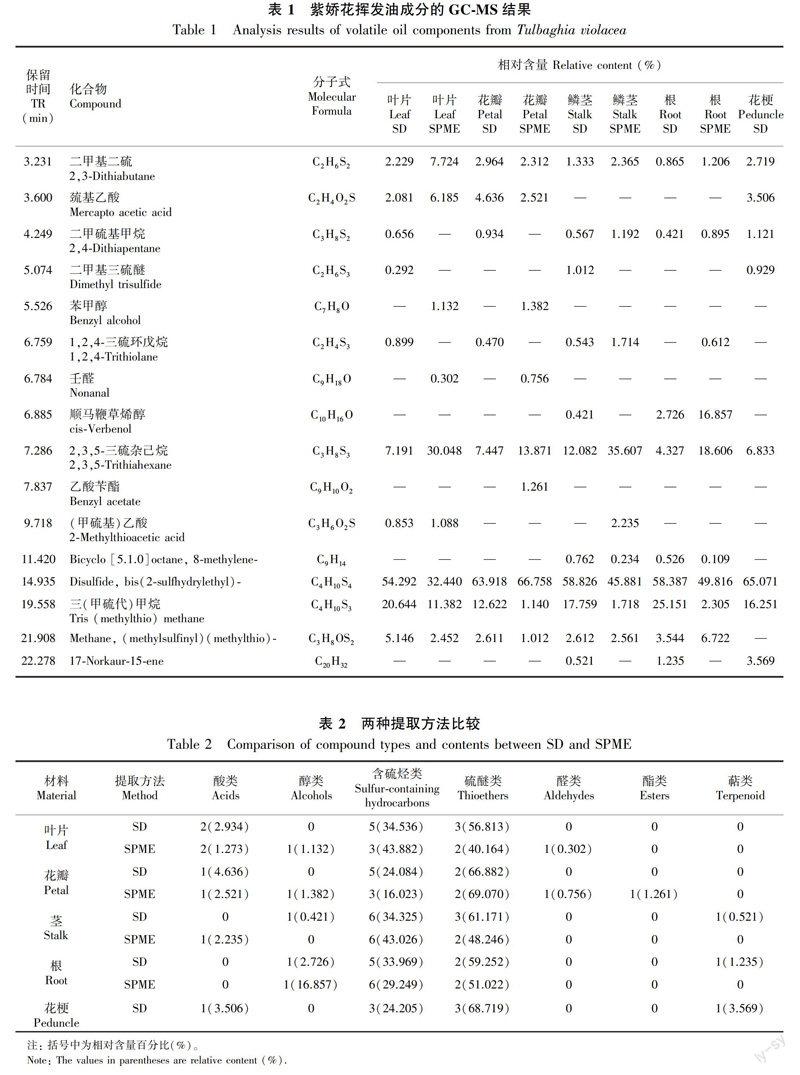
利用两种方法提取紫娇花不同部位挥发性成分并进行GCMS分析,得到总离子色谱图(图1为紫娇花叶片挥发油总离子色谱图)。利用NIST图谱库共鉴定出了16种化合物,包含有醇(2种)、酯(1种)、酸(2种)、醛(1种)、萜烯(1种)、烷烃(6种)以及硫醚类化合物(3种)。根据峰面积归一化法计算各化合物的相对含量。结果见表1。
水蒸气蒸馏和固相微萃取两种方法在紫娇花叶片、花瓣、鳞茎以及根中分别检测到了12种、11种、12种和10种化学物质。叶片挥发油中相对含量较高的成分有Disulfide, bis(2sulfhydrylethyl)、三(甲基硫代)甲烷、2,3,5三硫杂己烷、二甲基二硫和巯基乙酸等。花瓣挥发油种类与叶片相当,但不含有二甲基三硫醚和(甲硫基)乙酸2种成分。鳞茎和根中相对含量较高的成分也是Disulfide, bis(2sulfhydrylethyl)、三(甲基硫代)甲烷、2,3,5三硫杂己烷、二甲基二硫和Methane, (methylsulfinyl)(methylthio)等,但不含巯基乙酸、苯甲醇和壬醛,而含有花和叶中没有的顺马鞭草烯醇、Bicyclo [5.1.0]octane, 8methylene和17Norkaur15ene等成分。通过水蒸气蒸馏得到的紫娇花花梗挥发油中含有8种成分,相对含量较高的有Disulfide, bis(2sulfhydrylethyl)(65.071%)、三(甲基硫代)甲烷(16.251%)和2,3,5三硫杂己烷(6.833%)等。
2.2 两种提取方法比较
结合水蒸气蒸馏法和固相微萃取法,在紫娇花不同部位共检测到了16种成分,其中水蒸气蒸馏产物中检测到了13种成分,SPME萃取物中检测到了14种成分,两种方法得到的挥发油成分较相似,但各成分的相对含量有较大的差异(表2)。两种方法检测到相对含量最高的成分都为硫醚类,其次是含硫的烃类,两类成分占挥发油总量的80%以上,而萜类、酯类、醇类、醛类和酸类等成分含量较少。相比而言, SPME法对醇类、醛类和酯类显示出了更好
的吸附性,而水蒸气蒸馏法则对含硫烃类、硫醚类和萜类的提取效果更好。
2.3 清除DPPH自由基能力
紫娇花挥发油对DPPH自由基的清除率随挥发油浓度的增加而不断提高(图2),当浓度为20 mg·mL1时,清除率达到53%。随着挥发油量的继续增加,清除率略有上升,最终达54.86%。相比而言, L抗坏血酸清除DPPH自由基的能力更高,在浓度为20 mg·mL1时,清除率在85%以上。在0~20 mg·mL1范围内,挥发油和L抗坏血酸用量都与DPPH清除率成线性关系,得到两者清除率(Y)与挥发油体积(X)的回归方程分别为Y=2.220X+11.230(R2 = 0.972), Y=4.365X+3.783(R2=0.969)。对数据进行线性回归拟合分析后得到紫娇花挥发油的IC50为17.46 mg·mL1,L抗坏血酸IC50为10.59 mg·mL1,表明紫娇花挥发油清除DPPH自由基能力低于L抗坏血酸。
2.4 总抗氧化能力
紫娇花挥发油的总抗氧化能力随加样量的增加而增强(图4),在加樣体积为100 μL时,紫娇花挥发油对应的FeSO4浓度为L抗坏血酸在加样体积下的1.3倍。可见紫娇花挥发油的总抗氧化能力(FRAP值)比该浓度下的L抗坏血酸强。
3讨论
本研究中,紫娇花的挥发油共鉴定到16种成分,以含硫的硫醚类和烃类成分为主,含有少量的酸类、醛类、醇类和萜类等物质,该结果与Soyingbe et al(2013)的结果相似。但是,Soyingbe et al(2013)研究表明紫娇花的根茎挥发物中二甲硫基甲烷的相对含量较高,达51.04%, Olorunnisola et al(2012)对南非东开普敦紫娇花根茎挥发油的研究表明二甲硫基甲烷的相对含量为11.35%,而本研究中二甲硫基甲烷在根和茎中相对含量分别只有0.567%和0.421%,该结果可能为不同气候条件或生长阶段差异所致。本研究得到紫娇花挥发油中含量最高成分为Disulfide, bis(2sulfhydrylethyl),目前关于该物质的研究不多,有关其应用也不明确。此外,挥发油中还含有二甲硫基甲烷、乙酸苄酯、二甲基三硫醚等成分,在食品工业中使用较多,可用于香料(张洪亮等,2003)。挥发油中还含有二甲基二硫等具有抗菌、杀虫等功效成分。紫娇花挥发油中丰富的含硫类成分也使其具有类似于大蒜的气味(MartinezVelazquez et al,2011)。
清除DPPH自由基的能力和总抗氧化能力都可作为抗氧化活性的评价指标之一(卢赛赛等,2015)。FRAP结果显示紫娇花挥发油的总抗氧化能力较强,可能是由于紫娇花挥发油中存在对Fe2+具有较强螯合能力的成分,减少了Fe2+的氧化。Soyingbe et al(2013)对紫娇花的研究中发现其挥发油对NO自由基的清除效果也非常显著。而本研究中紫娇花挥发油对DPPH自由基的清除作用却较差,清除能力不如等浓度的L抗坏血酸,且具有饱和型特征,表明紫娇花挥发油对自由基的清除具有选择性。紫娇花挥发油清除自由基作用可能与其硫醚类物质含量较高有关,硫醚类物质可通过分解过氧化物达到抗氧化的作用(李炎等,1994)。近年来,硫醚类物质凭借其高效低毒的特性已在西方发达国家的食品行业中得到了广泛应用。紫娇花中硫醚类成分较高,在天然抗氧化剂方面具较大的开发价值。
4结论
紫娇花挥发油具有相对含量差异大、组成成分简单和硫醚类成分含量高等特点,其中含量最高的成分为Disulfide, bis(2sulfhydrylethyl),萜类、酸类和醇类等成分较少,其中许多成分可用抗菌药物、香精香料和天然抗氧化剂的制作。紫娇花挥发油总抗氧化能力较高,但对DPPH自由基清除作用不如等浓度L抗坏血酸强,清除DPPH自由基的IC50为17.46 mg·mL1。紫娇花挥发油对不同自由基的清除作用具有选择性。
参考文献:
BULL C, KEYSER Z, KLAASEN J, et al, 2005. Screening of Tulbaghia violacea and Tulbaghia simmleri plant extracts as antifungal agents against the fumonisin producing strain, Fusarium verticillioides MRCS26 [J]. S Afr J Sci, 101(7): 314.
CHIARA B, ANNELOES M, MOREL N, et al, 2010. Vasorelaxant activity of essential oils from Croton zambesicus and some of their constituents [J]. Plant Med, 76(14): 1506-1511.
HE YQ, ZHU ZY, ZHANG FT, 2010. Buds culture of Tulbaghia violacea in vitro and system establishment of plant regeneration [J]. Northern Hortic, (16): 151-154. [何月秋,祝志勇,章丰涛,2010. 紫娇花花蕾离体培养及再生体系的建立 [J]. 北方园艺,(16): 151-154. ]
HUTCHINGS A, SCOTT AH, LEWIS G, et al, 1996. Zulu medicinal plants. An inventory [M]. Scottsville: University of Natal Press.
KADRI A, INES BC, ZIED Z, et al, 2011. Chemical constituents and antioxidant activity of the essential oil from aerial parts of Artemisia herba Alba grown in Tunisian semiarid region [J]. Afr J Biotechnol, 10(15): 2923-2929.
KAZEMI M, MOHAMMAD D, ABOLFAZI D, et al, 2011. Composition, antimicrobial and antioxidant activities of the essential oil of Artemisia Kermanensis Podl., an endemic species from Iran [J]. J Med Plant Res, 5(18): 4481-4486.
LI Y, JIN ZL, 1994. Study on the antioxidant effect and safety of sulfur ether [J]. Chin Oils Fats, 19(2): 28-31. [李炎,金正林, 1994. 硫醚類物质对油脂的抗氧化作用和安全性研究 [J]. 中国油脂, 19(2): 28-31. ]
LIN L, JIANG HZ, LUO LQ, et al, 2008. GCMS analysis of the volatile oil from Bulbus allii Macrostemonis extracted by supercritical carbon dioxide [J]. Chin J Analy Lab, 27(1): 115-117. [林琳,蒋合众,罗丽勤,等,2008. 薤白挥发油成分的超临界CO2萃取及GCMS分析 [J]. 分析试验室, 27(1): 115-117. ]
LU SS, XU F, WANG HF, et al, 2015. Extraction and antioxidant activities of total flavonoids from Myrica rubra leaves [J]. J Fruit Sci, 32(3): 460-468. [卢赛赛,许凤,王鸿飞,等,2015. 杨梅叶中总黄酮提取及其抗氧化能力研究 [J].果树学报,32(3): 460-468. ]
LYANTAGAYE SL, 2013.MethylaDglucopyranoside from Tulbaghia violacea extract induces apoptosis in vitro in cancer cells [J]. Bangl J Pharmacol, 8: 93-101.
MARTINEZVELAZQUEZ M, ROSARIOCRUZ R, CASTILLOHERRERA G, et al, 2011. Acaricidal effect of essential oils from Lippia graveolens (Lamiales:Verbenaceae), Rosmarinus officinalis (Lamiales: Lamiaceae), and Allium sativum (Liliales: Liliaceae) against Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) [J]. J Med Entomol,48(4): 822-827.
NCUBE B, FINNIE JF, VAN STADEN J, 2012. In vitro antimicrobial synergism within plant extract combinations from three South African medicinal bulbs [J]. J Ethnopharmacol, 139(1): 81-89.
OLORUNNISOLA OS, BRADLEY G, AFOLAYAN AJ, 2011. Antioxidant properties and cytotoxicity evaluation of methanolic extract of dried and fresh rhizomes of Tulbaghia violacea [J]. Afr J Pharm Pharmacol, 5(22): 2490-2497.
OLORUNNISOLA OS, BRADLEY G, ANTHONY J, et al, 2012. Protective effect of Tulbaghia violacea Harv. on aortic pathology,tissue antioxidant enzymes and liver damage in dietinduced atherosclerotic rats [J]. Int J Mol Sci, 13: 12747-12760.
SIMELANE MBC, LAWAL OA, DJAROVA TG, et al, 2010. In vitro antioxidant and cytotoxic activity of Gunnera perpensa L. (Gunneraceae) from South Africa [J]. J Med Plants Res, 4(21) : 2181-2188.
SOYINGBE OS, OYEDEJI AO, BASSON AK, et al, 2013. Chemical composition, antimicrobial and antioxidant properties of the essential oils of Tulbaghia violacea Harv L.F. [J]. Afr J Microbiol Res, 7(18): 1787-1793.
RAJI IA, MUGABO P, OBIKEZE K, 2010. Effect of Tulbaghia violacea on the blood pressure and heart rate in male spontaneously hypertensive Wistar rats [J]. J Ethnopharmacol, 140 (1): 98-106.
VALESILVA LA, GONCALVES MJ, CAVALEIRO C, et al, 2010. Antifungal and activity of the essential oil of Thymus xviciosoi against Candida, Cryptococcus, Aspergillus and Dermatophyte species [J]. Plant Med, 76(9): 882-888.
VAV HUYSSTEEN M, MILNE PJ, CAMPBELL EE, et al, 2011. Antidiabetic and cytotoxicity screening of five medicinal plants used by traditional African health practitioners in the Nelson Mandela Metropole, South Africa [J]. Afr J Trad Compl Altern Med, 8(2): 150-158.
VAN WYK BE, GERICKE N, 2000. Peoples plants: a guide to useful plants of Southern Africa [M]. Pretoria: Brizza Publications: 351.
VAN WYK BE, WINK M, 2004. Medicinal plants of the world [M]. South Africa: Briza Publications.
ZHANG HL, WANG MY, 2003. Synthesis and rcfincmcnt of bcnzyl acctatc as pcrfumcs [J]. J Wuxi Voc lnst Comm Technol, 3(4):11-13. [张洪亮,王茂元,2003. 香料乙酸苄酯的合成和精制 [J]. 无锡商业职业技术学院学报, 3(4): 11-13. ]
ZHAO JW,LI JW, ZHANG X, 2010. Antioxidant activity study of phenolic compounds from pingguoli pear peels [J]. Food Sci, 31(17): 170-172. [赵金伟,李范洙,张先,2003. 苹果梨酚类物质抗氧化活性研究 [J]. 食品科学, 31(17): 170-172. ]
ZHENG FQ, SUN BG, LIU YP, et al, 2009. Analysis of volatlies in salted flowers of wild Chinese Chive by simultaneous distillation and extraction with Gas ChromatographyMass Spectrometry [J]. Food Sci, 30(22): 247-249. [鄭福平,孙宝国,刘玉平,等,2009. 同时蒸馏萃取气质联机分析腌渍野韭菜花香成分 [J].食品科学, 30(22): 247-249. ]
ZHOU HY, 2014. Extraction of volatile oil from Barbadoslily amaryllis root and leaves and composition comparison [J]. J Hubei Univ Nat, 32(3): 285-288. [周红艳, 2014. 朱顶红根和叶部挥发油提取与成分对比分析 [J]. 湖北民族学院学报, 32(3): 285-288. ]
HSIEH CL, TSENG MH, PAN RN, et al, 2011. Labdanecaryophyllic acid, a novel cytotoxic C35 terpenoid from Calocedrus macrolepis var. formosana [J]. Tetrahedron Lett, 52 (4): 515-517.
MOSMANN T, 1983. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays [J]. J Imm Methods, 65 (1): 55-63.
POPOVA MP, CHINOU IB, MAREKOV IN, et al, 2009. Terpenes with antimicrobial activity from Cretan propolis [J]. Phytochemistry, 70 (10): 1262-1271.
REED LJ, MUENCH H, 1938. A simple method of estimating fifty percent endpoints [J]. Am J Hyg, 27 (3): 493-497.
REN XY, YE Y, 2006. Labdane diterpenes from the seeds of Platycladus orientalis [J]. J Asian Nat Prod Res, 8 (8): 677-682.
SU WC, FANG JM, CHENG YS, 1994. Labdanes from Cryptomeria japonica [J]. Phytochemistry, 37 (4): 1109-1114.
WANG L, WANG SY, WU XD, et al, 2013. Study on chemical compositions of Calocedrus macrolepis [J]. J Kumming Med Univ, 34 (7): 8-11. [王蕾, 王双燕, 吴兴德, 等, 2013. 翠柏的化学成分研究 [J]. 昆明醫科大学学报, 34 (7): 8-11.]
WU XD, HE J, LI XY, et al, 2013. Diterpenoids from the twigs and leaves of Fokienia hodginsii [J]. J Nat Prod, 76(6): 1032-1038.
WU XD, WANG SY, WANG L, et al, 2013. Labdane diterpenoids and lignans from Calocedrus macrolepis [J]. Fitoterapia, 85(1): 154-160.
YANG XL, LIU D, BIAN K, et al, 2013. Study on in vitro antiinflammatory activity of total flavonoids from Glycyrrhizae radix et Rhizoma and its ingredients [J]. Chin J Chin Mat Med, 38(1): 99-104. [杨晓露, 刘朵, 卞卡, 等, 2013. 甘草总黄酮及其成分体外抗炎活性及机制研究 [J]. 中国中药杂志, 38(1): 99-104.]

