1株结皮真菌胞外多糖的初步研究
邓振山, 崔 凡, 李 军 , 汪 飞, 金 沐, 顾丽莎
(1.延安大学 生命科学学院,陕西 延安 716000;2.延安市微生物研究所,陕西 延安 716000)
1株结皮真菌胞外多糖的初步研究
邓振山1, 崔 凡1, 李 军2, 汪 飞2, 金 沐1, 顾丽莎1
(1.延安大学 生命科学学院,陕西 延安 716000;2.延安市微生物研究所,陕西 延安 716000)
探究一株真菌胞外多糖最佳生产时间及其组成成分。通过对其发酵液胞外多糖含量及上清液黏度的测定,确定其最佳产糖时间,并用此条件提取胞外多糖粗品,用蒽酮-比色法测得提取的胞外多糖粗品的糖含量,薄层色谱法对所得的胞外多糖进行组分分析。当发酵至第5天时该株真菌的生物量、胞外多糖产量及发酵液的黏度均达到最高峰,分别为0.606 4 g/60 mL、20.22 μg/mL和4.74 mPa/s,并且胞外多糖含量与发酵上清液黏度在一定程度上呈正相关。用蒽酮-比色法测得提取的胞外多糖粗品的糖含量为19.58 μg/mL,并用4 mol/L的硫酸完全水解,硅胶G薄层层析,甲醇-氯仿(1∶1,体积比)展层,苯胺-二苯胺-磷酸显色,表明其组成成分可能为D-甘露糖、D-半乳糖和D-葡萄糖。该菌株所产的胞外多糖具有提高结皮能力和防沙保水作用,为利用微生物治沙提供参考和种质资源。
结皮真菌;胞外多糖;黏度;多糖含量;组分分析
微生物胞外多糖(Extracellular Polysaccharide, EPS)是指微生物在生长代谢过程中分泌到细胞壁外的水溶性多糖,属于微生物多糖的一种。包括胞内多糖、胞壁多糖和胞外多糖。微生物胞外多糖是一种长链的大分子聚合物,具有独特的物理性质、流变学特性以及较好的安全性,在食品工业领域倍受青睐,在石油、日化、纺织、医药等领域的应用潜能日益引起人们的关注[1],它除具有大多数植物多糖和合成的高分子聚合物所特有的性质外,还具有低浓度下呈高黏度、假塑性、热稳定性,可与多种盐类配伍及形成有用的膜,同时具有生产周期短,不受气候和地理环境条件的限制,易于提取和应用面广等特性,在石油工业生产与生活的许多领域具有广阔的发展前景[2-3]。为了不断开发微生物多糖的潜能,需要筛选、分离新的多糖产生菌,了解多糖的生物合成,研究其结构、物理化学特性,进一步拓展其应用领域。沙漠化已经成为当今世界极其重要的环境和社会经济问题,威胁着人类的生存与发展[4],而我国则是受沙漠化危害最严重的国家之一。已有研究表明,一些低营养细菌,如枯草芽胞杆菌具有黏性夹膜或厚的果胶质外壁,能分泌大量的黏液,这些具有黏性附属物的菌体和黏液能将矿物细粒粘结,形成球状表面团聚物[5]。由于微生物可产生胞外代谢物,如多糖、脂类和蛋白质,起到胶结作用以稳定团聚体[6-8],而产多糖的真菌比产多糖的细菌的胶结作用更强,不仅因为真菌的细胞比细菌的大,其产生的胞外代谢产物较多,而且真菌还可以通过菌丝体产生物理胶结作用。邓振山等[9]从陕北地区寡营养环境分离得到一株大量黏性胞外多糖的真菌,并对胞外多糖的结皮能力和防沙保水作用进行了初步研究,证明该菌具有良好的保水、固沙作用。但是,该菌株所产的胞外多糖的具体条件尚不明确。本文在前期研究的基础上,优化了该菌株的产糖条件,为该菌株能尽快地实际应用于生物结皮和防蚀固土方面奠定了基础。
1 材料与方法
1.1 材料
1.1.1 供试菌种 真菌(葡萄孢属Botrytis)[9],由延安大学生命科学学院微生物实验室提供。
1.1.2 培养基 ①保藏培养基:PDA固体培养基,马铃薯200 g,葡萄糖20 g,水1 000 mL,琼脂5%,115 ℃ 灭菌25 min,pH 7.2;②种子培养基:PDA液体培养基,马铃薯200 g,葡萄糖20 g,水1 000 mL, 115 ℃灭菌25 min,pH 7.0~7.2;③发酵培养基:蔗糖20 g,葡萄糖10 g,蛋白胨10 g,酵母膏10 g, MgSO4·7H2O 0.75 g,KH2PO45 g,水1 000 mL,115 ℃灭菌25 min,pH 7.2。
1.2 方法
1.2.1 菌种活化 配制保藏培养基,分装试管,115 ℃灭菌20 min放置斜面,接种试验真菌,30 ℃培养,待菌丝长满斜面后置于4 ℃保藏,备用。
1.2.2 供试溶液的配制 ①蒽酮-硫酸溶液:称取1 g蒽酮,溶解于1 000 mL稀硫酸(将760 mL相对密度为1.84的浓硫酸用蒸馏水稀释成1 000 mL)[10];②碘-碘化钾溶液:碘片1 g,碘化钾2 g,蒸馏水300 mL,先将碘化钾溶解在少量的水中,再将碘片溶解在碘化钾溶液中,待碘全部溶解后,补足水分即可[2];③苯胺-二苯胺-磷酸试剂:1 g二苯胺溶于1 mL苯胺,5 mL 85%磷酸和50 mL丙酮,水浴微热至溶解[11];④考马斯亮蓝试剂:考马斯亮兰G-250 100 g溶于50 mL 95%乙醇中,加入100 mL 85%磷酸,用蒸馏水稀释至1 000 mL(最终试剂中含0.1 g/L考马斯亮蓝G-250,体积分数为4.7%乙醇和 8.5%磷酸)[12]。
1.2.3 葡萄糖标准曲线的建立 ①最大吸收波长的确定:配制80 μg/mL葡萄糖标准溶液,80 μg/mL多糖粗品溶液,蒽酮-比色法[13-14]显色,在波长550~700 nm范围内测定吸光值,得吸光值曲线[15]。吸光值曲线的最大吸收值对应波长作为标准曲线的吸收波长;②标准曲线的建立:将葡萄糖干燥至恒重,精密称取该葡萄糖1.0 g,定容于100 mL容量瓶中,摇匀后取1 mL定容于100 mL容量瓶,即100 μg/mL葡萄糖标准溶液。取20 mL带塞试管,编号,按表1配制系列浓度的葡萄糖标准液,然后分别向每支试管中加入10 mL事先已配好的蒽酮硫酸溶液(冰水浴),混匀,盖上塞子,在沸水浴中煮沸10 min(水浴重沸后计时),取出,立即用水冷却至室温,以第1管为空白对照,调零,在①的最大吸收波长下,分别测量各管的吸光值。以葡萄糖含量为横坐标,对应的吸光值为纵坐标,建立葡萄糖标准曲线。

表1 绘制标准曲线的试剂量
1.2.4 菌株最佳产糖时间的确定 用接种环将已活化的保藏菌种接到平板固体种子培养基上,待菌种长满平板,用直径为6 mm的打孔器打孔,将相同数量的菌饼(5%)接种到装有发酵培养基的三角瓶中,于30 ℃、180 r/min下培养5~9 d,从培养第1天开始,每1天测一次菌株的生物量(干重)、胞外多糖和发酵液的黏度。①菌株生物量测定:发酵液以六层滤纸抽滤发酵液,所得滤渣(即菌丝体)先用水洗涤2~3次,置于60 ℃干燥箱中干燥至恒重,分析天平称重[16]。以培养时间为横坐标,对应菌株的平均生物量(菌丝体干重)为纵坐标,建立培养时间与平均生物量的曲线。②菌株胞外多糖测定:取发酵液5 mL,加入4倍体积的无水乙醇,提取发酵液中的胞外多糖,静置过夜,弃滤液后,加水50 mL,室温搅拌30 min,使胞外多糖充分溶解,再次过滤得到滤液,滤渣水洗5次,合并滤液,定容至125 mL。多糖测定采用蒽酮-比色法。以培养时间为横坐标,对应的胞外多糖平均含量为纵坐标,建立培养时间与胞外多糖平均含量的曲线。 ③菌株发酵液黏度测定:用DV-Ⅲ+黏度计测定每1天发酵上清液的黏度[17]。以培养时间为横坐标,对应的发酵液黏度为纵坐标,建立培养时间与发酵液黏度的曲线。
1.2.5 发酵液中胞外多糖的提取(水提醇沉法) ①发酵液制取:选择最适产糖发酵条件,进行发酵培养,取其发酵液,布氏漏斗6层滤纸抽滤,5 g/100 mL活性炭吸附5 min[18],过滤,取其滤液用旋转蒸发器浓缩至1/4体积。②Sevag法去蛋白:加入0.2倍体积的氯仿和0.04倍体积的正丁醇混合振荡0.5 h进行分离,直至氯仿和水的界面无沉淀为止,重复2~3次,有效除去多糖中的蛋白质[19]。③粗多糖的提取(乙醇沉淀法): 在浓缩的多糖溶液中加入3倍体积的95%乙醇,静置12 h,取其沉淀,于105 ℃烘干即为粗多糖。
1.2.6 糖含量的测定 酸解法:精密称取100.0 mg样品,定容于1 000 mL容量瓶中,混匀后量取此样品液2.0 mL,然后分别加入10 mL事先已配好的蒽酮-硫酸溶液,摇匀,沸水浴加热10 min。分别以葡萄糖标准曲线的第1管为空白对照,3次重复,调零,于 1.2.3 的最大吸收波长处测量吸光值。由标准曲线查出提取胞外多糖粗品中的糖含量[20]。
1.2.7 多糖的组成成分测定 ①酸解法:精密称取粗多糖100.0 mg,加10 mL、4 mol/L硫酸溶液,使其溶解,待完全溶解后灌入玻璃管中,封口。于沸水浴中水解10 h。冷却,用乙酸乙酯萃取,向溶液中加适量固体碳酸钡直到溶液为中性(pH 约7~8),然后转移至离心管,4 000 r/min离心5 min除去硫酸钡沉淀,取其上清液,则为10 mg/mL的多糖酸解样品溶液。②薄层层析:a. 硅胶板的准备:取3 g硅胶G放在小研钵中,加入9 mL 0.5%(质量分数)的羧甲基纤维素(CMC)溶液(起黏合作用),加入4~5滴95%乙醇(消除泡沫),研磨,将研好的浆液倒在干燥的薄层层析玻璃板上,将浆液分布均匀,待表面水分干燥后,置于105 ℃烘箱中活化30 min,冷却后取出。薄层的厚度约为0.5 mm。b. 点样:取D-葡萄糖、D-半乳糖、D-甘露糖、L-阿拉伯糖、D-木糖、L-鼠李糖各100 mg,分别加入10 mL水,配成10 mg/mL的标准单糖溶液。标准糖用毛细管点样5 μL左右,样品糖适当加大浓度和点样量,点扩散后的直径不超过5 mm,点样后自然晾干,或者用吹风机吹干。c. 展层:用新配制的展开剂:V(甲醇)∶V(氯仿) =1∶1,采用倾斜上行法,将薄层板的下端浸在展开剂中0.3~0.5 cm,至展开剂距薄层板的上端约1 cm取出,放置通风处自然干燥。d. 显色:用苯胺-二苯胺-磷酸显色剂喷雾,放入85 ℃烘箱显色,根据Rf值和所显颜色的一致性作出判断[21-22]。
1.2.8 多糖的其他理化性质 ①多糖的溶解试验:试验多糖在丙酮、95%乙醇、乙醚、冷水中的溶解性。②试验多糖与碘-碘化钾溶液的显色反应。③糖的还原性试验:多糖与斐林试剂反应。④蛋白质成分的检验[23]:与考马斯亮蓝G-250反应;与茚三酮的显色反应;与双缩脲的显色反应。
1.2.9 红外光谱测定 分别称取2 mg EPS和瓜尔胶标准品,KBr 压片,使用Nexus470红外光谱仪测定。
1.2.10 数据处理 试验数据采用Excel 2007进行统计学分析。
2 结果与分析
2.1 蒽酮-比色法制得葡萄糖的标准曲线
2.1.1 最大吸收波长 葡萄糖溶液与多糖溶液经蒽酮-硫酸显色后的吸光值曲线表明,葡萄糖溶液与多糖溶液均在625 nm处有最大吸收值,故将625 nm作为其测量波长。
2.1.2 葡萄糖标准曲线 经蒽酮-硫酸溶液显色后测葡萄糖标准溶液各管的吸光值,以葡萄糖标准液的浓度为横坐标,对应的吸光值为纵坐标绘制标准曲线(见图1)。由图1可知,糖浓度在0~1.8 mg/L时,糖浓度和吸光度呈线性关系。
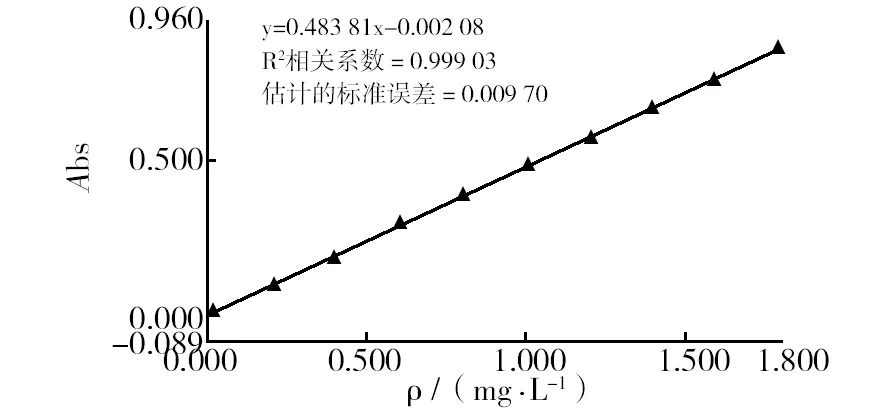
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 菌株产胞外多糖的最佳时间
2.2.1 菌株的最佳产糖时间 在液体深层发酵培养基中接种,对其进行培养,每天对培养的菌种进行生物量、胞外多糖产量和发酵上清液黏度测定。从图2、图3和图4可以看出,当菌种培养至第5天时,其生物量和胞外多糖产量以及发酵上清液的黏度均达到最高峰,因此,第5天是供试真菌的最佳产糖时间。
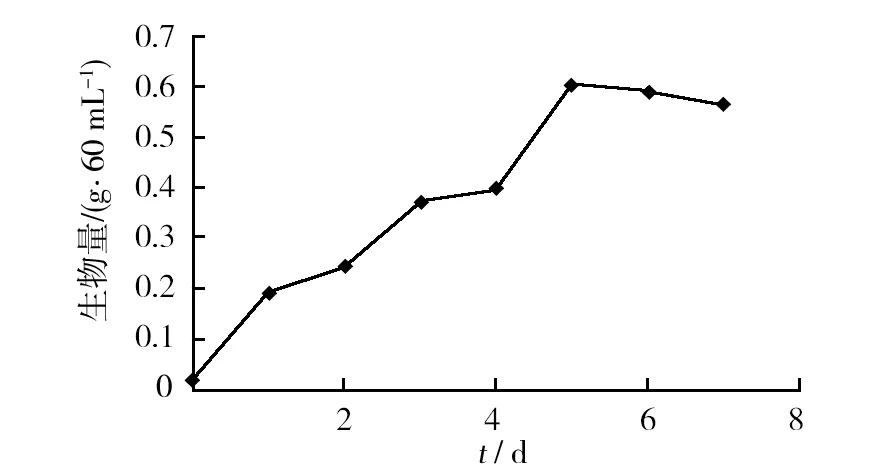
图2 培养时间与平均生物量的关系Fig.2 Relationship of culture time and average biomass

图3 培养时间与胞外多糖平均含量的关系Fig.3 Relationship of culture time and EPS average content

图4 培养时间与发酵上清液黏度的关系Fig.4 Relationship of culture time and fermentation liquid viscosity
2.2.2 菌株胞外多糖含量与发酵上清液黏度的关系模型 由图5可知,胞外多糖的含量和发酵上清液黏度变化趋势基本一致,均为发酵第5天达到最高峰。因此,有可能在两者之间建立某种数学关系。5 d内的胞外多糖含量与发酵上清液黏度的关系见图6。

图5 发酵液黏度和胞外多糖含量与培养时间的关系Fig.5 Relationship of fermentation liquid viscosity and content of EPS with culture time
图6表明,胞外多糖含量与发酵上清液黏度之间的模型方程:y = 0.001 1x2- 0.003 8x + 4.326 2,R2= 0.978 9。式中,x为胞外多糖含量,y为发酵上清液黏度,R为回归系数。发酵上清液的黏度随着胞外多糖含量的增加而增加,说明胞外多糖含量与发酵上清液黏度在一定程度上存在极为显著的线性正相关性。

图6 胞外多糖含量与发酵上清液黏度的关系Fig.6 Relationship of EPS content and fermentation liquid viscosity
2.3 粗多糖含量的测定结果
用紫外可见分光光度计UV-2550 测得的多糖含量见表2,表2中3组样品的平均浓度为19.58 μg/mL,所提取的粗多糖中糖含量为19.58 μg/mL,提取率(质量分数)为19.58%。

表2 样品糖含量测定结果
2.4 多糖成分的测定

图7 TLC结果Fig.7 The results of TLC 1:待测样品(灰黄色); 2: D-木糖(灰绿色); 3: D-半乳糖(灰黄色); 4: L-阿拉伯糖(灰绿色);5: D-甘露糖(灰黄色); 6: D-葡萄糖(灰黄色); 7: L-鼠李糖(淡黄色)1: Test sample; 2: D-xylose; 3: D-galactose; 4: L-arabinose; 5: D-mannose; 6: D-glucose; 7: L-rhamnose
多糖酸解后,薄层层析分析结果见图7。由图7计算得出各个样品的Rf值见表3。
图7与表3结果表明,待测样品的颜色与3号、5号、6号较为接近,并且其Rf值也与3号、5号、6号比较接近,说明组成多糖的单糖可能含有D-甘露糖、D-半乳糖和D-葡萄糖。

表3 样品的Rf值
2.5 多糖的其他理化性质
本研究所提取的寡营养菌的胞外多糖为棕色晶体,无气味,不溶于95%乙醇、丙酮、乙醚等有机溶剂,溶于冷水;碘-碘化钾反应为阴性,说明该多糖为非淀粉类和纤维素类物质;多糖与斐林试剂反应为阳性,有砖红色沉淀生成,说明其中含有还原性糖;与考马斯亮蓝G-250反应为阴性、与茚三酮反应阴性、双缩脲反应阴性,证明其中不含有蛋白质成分。
2.6 胞外多糖红外光谱分析
胞外多糖红外光谱分析如图8所示。结果表明:在3 421/cm处的吸收峰是羟基伸缩振动的特征峰,说明多糖中含有羟基基团。在2 920/cm处存在一个中强吸收峰,在2 154/cm处存在一个弱峰,归属于多糖中的-CH2基团的C-H伸缩振动,为多糖的特征性吸收峰。在1 649/cm处存在一个强吸收峰,与多糖环状结构中的C=O伸缩振动有关。在1 417/cm处存在一个中强的宽吸收峰,与C=C伸缩振动有关。在1 155/cm和1 022/cm处各存在一个弱吸收峰,与多糖环状结构中的C-OH和C-O-C伸缩振动有关,在782/cm处的弱吸收峰存在对称环的伸缩振动。

图8 胞外多糖和瓜尔胶标准品的Fourier变换红外光谱图Fig.8 FT-IR spectra of EPS
3 讨 论
微生物多糖是生物大分子物质,在其发酵过程中随着胞外多糖含量的增加,发酵上清液的黏度也在变化[16]。本研究结果表明胞外多糖含量与发酵上清液黏度在一定程度上具有相关性,与韩洁等[17]的结果一致,并且测量黏度方法简单方便,可以通过测定其上清液的黏度反应其发酵液的多糖含量,对生产实践具有一定的指导意义。
孟玲等[13]对桦褐孔菌菌丝体发酵液提取的粗多糖糖含量作了测定,其用蒽酮-硫酸法测得桦褐孔菌粗多糖质量百分比含量可高达62.25%,本研究所得的粗多糖质量百分比含量仅为19.58%,两者相差较大。桦褐孔菌是一种药用木腐菌,可产生子实体,与本研究的真菌(葡萄孢属)[9]种类有差别,并且使得两者的发酵条件有差异。本研究的供试真菌是利用寡营养菌的筛选方法分离纯化得到的,故其能在寡营养条件下生长,具有很大的应用前景。
本研究通过对一株寡营养菌生物量、发酵液胞外多糖含量及上清液黏度的测定,确定发酵第5 天是该株寡营养菌的最佳产糖时间,此时其生物量、胞外多糖产量以及发酵上清液黏度均达到最大值,之后逐渐衰退,因此发酵时间选择5 d 为宜,表明稳定期是产糖积累的最佳时间。并且随着多糖含量的提高,发酵上清液的黏性也随之增加。建立了多糖含量与发酵上清液上清液黏度的关系模型,结果显示胞外多糖含量与发酵上清液黏度在一定程度上呈正相关性。并以此最佳产糖时间发酵,取其发酵上清液,利用活性炭吸附,旋转蒸发器浓缩,Sevag法去蛋白,乙醇沉淀,最终获得胞外多糖粗品。用蒽酮-比色法测得提取的胞外多糖粗品的糖含量为19.58%,并用4 mol/L的硫酸酸解10 h,使其完全水解,硅胶G薄层层析,V(甲醇)∶V(氯仿)=1∶1展层,苯胺-二苯胺-磷酸显色和红外光谱图结果,证明其组成成分可能为D-甘露糖、D-半乳糖和D-葡萄糖。结果表明本研究分离的一株具有产胞外多糖能力的真菌,可为利用微生物治沙提供参考和种质资源。
[1] 贾薇, 郑志永, 刘汝冰, 等. 一种新型微生物多糖流变学初探[J]. 食品科学, 2009, 30(1): 135-138.
[2] 魏培莲. 微生物胞外多糖研究进展[J]. 油田化学, 2004, 21(1): 91-96.
[3] 胡承钰, 王三英. 细菌胞外多糖复合应用的免疫增强作用[J]. 厦门大学学报(自然科学版), 2001, 40(5): 32-35.
[4] 聂浩刚, 岳乐平, 杨文, 等. 呼伦贝尔草原沙漠化现状、发展态势与成因分析[J].中国沙漠, 2005, 25(6): 635-639.
[5] 周德庆. 微生物实验教程[M]. 北京: 高等教育出版社, 2006: 372.
[6] Gupta V S R, Germida J. Distribution of microbial biomass and its activity in soil aggregate size classes as affected by cultivation[J]. Soil Biochem, 1988, 20: 777-786.
[7] Lynch J M. Interactions between biological processes, cultivation and soil structure[J].Plant Soil, 1984, 76:307-318.
[8] Lynch J M, Bragg E. Microorganisms and soil aggregate stability[J].Advances in Soil Science, 1985, (2):133-171.
[9] 邓振山, 赵佳福, 雷超, 等. 一株葡萄孢属(Botrytis)真菌结皮效果的研究[J]. 干旱地区农业研究, 2012, 30(5): 200-204.
[10]张志良, 瞿伟菁, 李晓芳, 等. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2009: 103.
[11]赵玉萍, 纪丽莲, 朱晓庆. 真菌多糖提纯, 组分分析及结构初步鉴定[J]. 食品科学, 2005, 26(9):127-129.
[12]魏群, 李森, 井健, 等. 基础生物化学实验[M]. 北京: 高等教育出版社, 2009: 130.
[13]孟玲, 王兰英, 梁大勇, 等. 桦褐孔菌多糖测定方法的比较[J]. 食品研究与开发, 2010, 31(4): 108-110.
[14]陈俊辉, 陶力, 李俊, 等. 生物化学实验[M]. 北京: 科学出版社, 2003, 4: 13-16.
[15]徐锡莲, 姚善泾, 童微星. 盐藻胞外多糖的分离与结构研究[D]. 杭州:浙江大学, 2007.
[16]刘成荣, 万飞云. 药用真菌桑黄液体深层培养条件和胞外多糖积累规律研究[J]. 江西农业学报, 2007, 19(12): 77-79.
[17]韩洁, 谢和, 赵杰宏. 枯草芽孢杆菌胞外多糖的快速测定与发酵条件优化[J]. 食品科技, 2007, 6: 210-213.
[18]肖建辉, 陈代雄, 刘金伟, 等. 江西虫草发酵液脱色及其多糖提取分离的优化工艺[J]. 微生物学通报, 2006, 33(3): 24-30.
[19]郑岚, 马耀宏. 液体发酵制备真菌多糖及多糖水解特性研究[D]. 济南:山东轻工业学院, 2011.
[20]张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社,2004, 11: 91-96, 408.
[21]黄纯, 高向东, 陈慧君, 等. 简易方法分析多糖的单糖组成[J]. 齐鲁药事, 2005, 24(10): 607-609.
[22]张龙翔, 张庭芳, 李令媛, 等. 生化实验方法与技术[M]. 北京: 高等教育出版社, 1997: 5-6.
[23]谭周进, 谢达平, 王征, 等. 蜜环菌多糖分离纯化及性质的研究[J]. 食品科学, 2002, 23(9): 49-53.
·写作常识·
英文摘要
GB7713-87规定,为了国际交流,科学技术报告、学位论文和学术论文应附有外文(多用英文)题名和摘要。
英文题名以短语为主要形式,尤以名词短语(noun phrase)最常见,即题名基本上由1个或几个名词加上其前置和(或)后置定语构成。实词首字母大写,虚词小写(也有4个或5个字母以上的虚词首字母大写)。一般而言,英文摘要应是中文摘要的转译,所以只要简洁、准确地将中文意译出即可,字数不宜超过250个实词为宜。英文摘要时态的运用也以简练为佳,常用一般现在时、一般过去时,少用现在完成时、过去完成时,进行时态和其他复合时态基本不用。采用何种语态,既要考虑摘要的特点,又要满足表达的需要。一篇摘要很短,尽量不要混用,更不要在一个句子里混用,应采用更简洁的被动语态或原形动词开头。
编写时应避免一些常见的错误:①冠词。主要是定冠词the易被漏用。The用于表示整个群体、分类、时间、地名以外的独一无二的事物、形容词最高级等较易掌握,用于特指时常被漏用。这里有个原则,即当我们用the时,听者或读者确知我们所指的是什么;②数词。避免用阿拉伯数字作首词;③单复数。一些名词单复数形式不易辨认,从而造成谓语形式出错;④尽量使用短句,因为长句容易造成语义不清;但要避免单调和重复。
Initial Study on Extracellular Polysaccharide (EPS) of a Crust Fungal Strain
DENG Zhen-shan1, CUI Fan1, LI Jun2, WANG Fei2, JIN Mu1, GU Li-sha1
(1.Coll.ofLifeSci.,Yan’anUni.,Yan’an716000;2.Yan’anInstituteofMicrobio.,Yan’an716000)
The optimal extracellular polysaccharide (EPS) producing time and its composition of a fungal strain were studied through determining the content of EPS in the fermented broth and the viscosity of supernatant, to confirm the optimal sugar producing time, and adopted this condition to extract crude EPS. The content of extracted crude EPS was determined with anthrone chromometry, its components were analyzed with thin layer chromatography. The results showed that when the fermentation was at day 5 the fungal biomass and EPS production and the broth viscosity reached to the peak, respectively at 0.606 4 g/60 mL, 20.22 μg/mL and 4.74 mPa/s, and the EPS content and the fermentation broth viscosity assumed to be positive reciprocity to a certain degree. The content of the extracted crude EPS was 19.58 μg/mL by anthrone chromometry. After the completely hydrolyzed by 4 mol/L sulfuric acid, the hydrolysate was analyzed with silica gel G thin-layer chromatography, while dispersed with methanol∶chloroform (1∶1) developed with aniline-diphenylamine, indicated that its components probably were D-mannose, D-galactose and D-glucose.The EPS, which confirmed to have improve crust and the prevention and water retention ability, can provides theoretical basis and neoplasm resources for their further use.
fungi of crust; extracellular polysaccharide (EPS); viscosity; polysaccharides content; component analysis
陕西省科技统筹创新工程项目(2012KTZB03-02-03,2012CGX7,2016TTC-N-3-1); 陕西省教育厅服务地方专项计划项目(16JF029); 陕西省大学生创新创业训练计划基金项目(2015SXTS34); 延安大学“陕北微生物资源与利用研究中心”科研机构专项基金
邓振山 男,博士,副教授。主要从事微生物资源与利用和环境微生物研究。 E-mail: zhenshandeng214@163.com
2016-03-30;
2016-07-03
Q936;S154.3
A
1005-7021(2017)02-0062-07
10.3969/j.issn.1005-7021.2017.02.010

