抗旱水稻种子转基因成分检测技术研究
邓汉超 刘玉琛 邓国标,4 刘 晋 陈惠芳 杨启鹏 周向阳
(1深圳市农业科技促进中心,深圳 518040;2农业部农作物种子质量监督检验测试中心(深圳),广东深圳 518040;3深圳市作物分子育种研究院,深圳 518107;4广东省龙门县卫生和计划生育局,惠州 516800)
抗旱水稻种子转基因成分检测技术研究
邓汉超1,2刘玉琛3邓国标3,4刘 晋1,2陈惠芳1,2杨启鹏1,2周向阳1,2
(1深圳市农业科技促进中心,深圳 518040;2农业部农作物种子质量监督检验测试中心(深圳),广东深圳 518040;3深圳市作物分子育种研究院,深圳 518107;4广东省龙门县卫生和计划生育局,惠州 516800)
利用组织研磨仪快速处理水稻种子样品,采用高通量的磁珠纯化系统提取样本DNA,提取的核酸通过紫外吸收检测其纯度,应用普通PCR检测方法和实时荧光PCR方法对水稻内源基因SPS、靶基因ATAF1进行检测。结果表明,普通PCR方法和实时荧光PCR方法均表现快速、准确、特异性高的特点。
普通PCR;实时荧光PCR;转基因
转基因作物的大量种植和推广同时对转基因生物的检测技术提出要求,发达国家的转基因及相关检测技术远远超过发展中的国家。美国、加拿大等国已有近百种转基因食品上市,并且他们的目标是把大量的转基因食品出口到发展中国家[1-3]。在这些正式获批进行生产和贸易的产品之外,更有数目众多的品种处于试验阶段或未经正常手续进入市场,我国已经加入WTO,正在面临着转基因产品贸易和安全监测的挑战。同时随着商品化转基因生物的种类不断增加,转基因生物本身的安全性以及它们对人类健康和生态环境的潜在威胁成为国际社会和广大民众广泛关注的热点问题之一[4-6];包括我国在内的越来越多的国家制定并实施了转基因食品的强制标识制度。因此,转基因产品的科学管理和应用需要得到转基因产品及其成分检测技术的支持。追踪转基因生物研发动态,研发相适应的检测技术,制定相应的检测标准,是转基因生物安全监管的重要措施。本文以转抗旱基因ATAF1水稻种子为材料,初步建立外源基因的普通PCR和实时荧光PCR检测方法。
1 材料与方法
1.1 材料 本实验室获得的转ATAF1基因水稻70株,种子保存于本实验室种子低温低湿储藏库中备用。
主要仪器和试剂:MP组织研磨仪(24样)、Themo磁珠核酸自动提取纯化仪(96样)、Omega核酸提取试剂盒、Premix Ex Taq酶、Neno1000紫外分光光度计、BIO-RAD iCycler PCR扩增仪、ABI7500实时荧光PCR扩增仪、RAININ edp3 plus排枪(12通道)等。
1.2 方法
1.2.1 样品处理 水稻种子取5粒,置于2mL离心管中,放入1粒陶瓷珠,加入500μ L Buffer SLX Minus裂解液(Omega 核酸提取试剂盒)或500μL 2% CTAB 裂解液,浸泡数小时后采用MP组织研磨仪设置震荡速度4.0 M/s、震荡时间30s,震荡粉碎5~6次,备用。
1.2.2 DNA的提取 磁珠自动提取法:粉碎样品在65℃水浴1h,其间上下颠倒2~3次。12000r/min离心10min。取上清200μ L于深孔96平板、800μL Buffer PHB于深孔96平板、800深孔96平板、100深孔96平板、一个Tip按照表1依次加入Omega 核酸提取试剂盒中的试剂。启动Themo磁珠核酸自动提取纯化系统,根据系统提示依次放入上述试剂板。当DNA提取完毕,取出5号板,将DNA保存在-20℃下备用。

表1 磁珠核酸自动提取纯化系统物品
1.2.3 核酸浓度及纯度测定 采用Neno1000紫外分光光度法测定所提取的核酸的纯度和浓度。
1.2.4 引物设计 水稻内源基因SPS基因引物设计分别参考文献[7]。F:5′-ttgcgcctgaacggatat-3′,R:5′-ggagaagcactggacgagg-3′,产物大小277bp;ATAF1引物F:5′-TAGCCCTGCCTTCATACGCT-3′,R:5′-CGGCAGAGAACCCAATCATC-3′,产物大小580bp。特异性引物由宝生物工程(大连)有限公司合成。
1.2.5 PCR扩增检测 普通PCR反应体系:20μ L反应液中含有10μ L Primex Ex Taq,0.4μ L Forward primer(10μmol/L),0.4μ L Reverse primer(10μ mol/L),2μ L模板DNA(10~50 ng/μ L),补ddH2O至20μ L。反应条件:95℃预变性2min;95℃ 30s,58℃ 30s,72℃ 40s,40个循环;72℃延伸 2min;15℃ 2min。取PCR产物5μ L加1μ L点样液混合后点入上样孔,于90V电压电泳30~40min。电泳结束后,采用自动凝胶成像分析系统检测。
实时荧光PCR反应体系:20μ L反应液中含有10μ L BIO-RAD Supermix with low ROX,0.4μ L Forward primer(10μ mol/L),0.4μ L Reverse primer(10μ mol/L),2μ L模板DNA(10~50ng/μ L),补ddH2O至20μ L。反应条件:95℃ 10s;95℃ 5s,60℃ 34s,40个循环;15℃ 2min。
2 结果与分析
2.1 核酸质量检测
2.1.1 紫外吸收检测 提取的水稻种子DNA通过Neno1000紫外分光光度计测定浓度,均有明显的OD260检测峰,OD260/OD280均在1.8~2.1之间,浓度在10~100ng/μ L之间,提取核酸能满足PCR需求。
2.1.2 内源基因PCR电泳检测 以水稻内源基因SPS为参照基因对样品DNA进行扩增,结果如图1所示,70个样品均能扩增出明显的277bp大小条带,并且阴性对照和阳性对照均正常。
2.1.3 内源基因实时荧光PCR检测 随机挑取部分水稻种子样品对内源基因进行实时荧光PCR检测,各样品检测阈值和Tm值见表2,从结果可知,所有检测样品在实时荧光检测中均有抬头,检测阈值在24~30之间,样品溶解曲线均在同一个位置有高峰,样品Tm值为88.8。
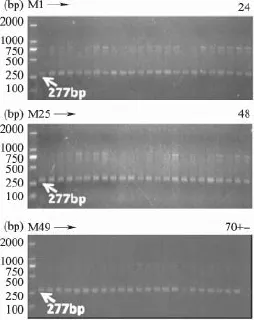
图1 样品SPS基因扩增凝胶电泳分析结果
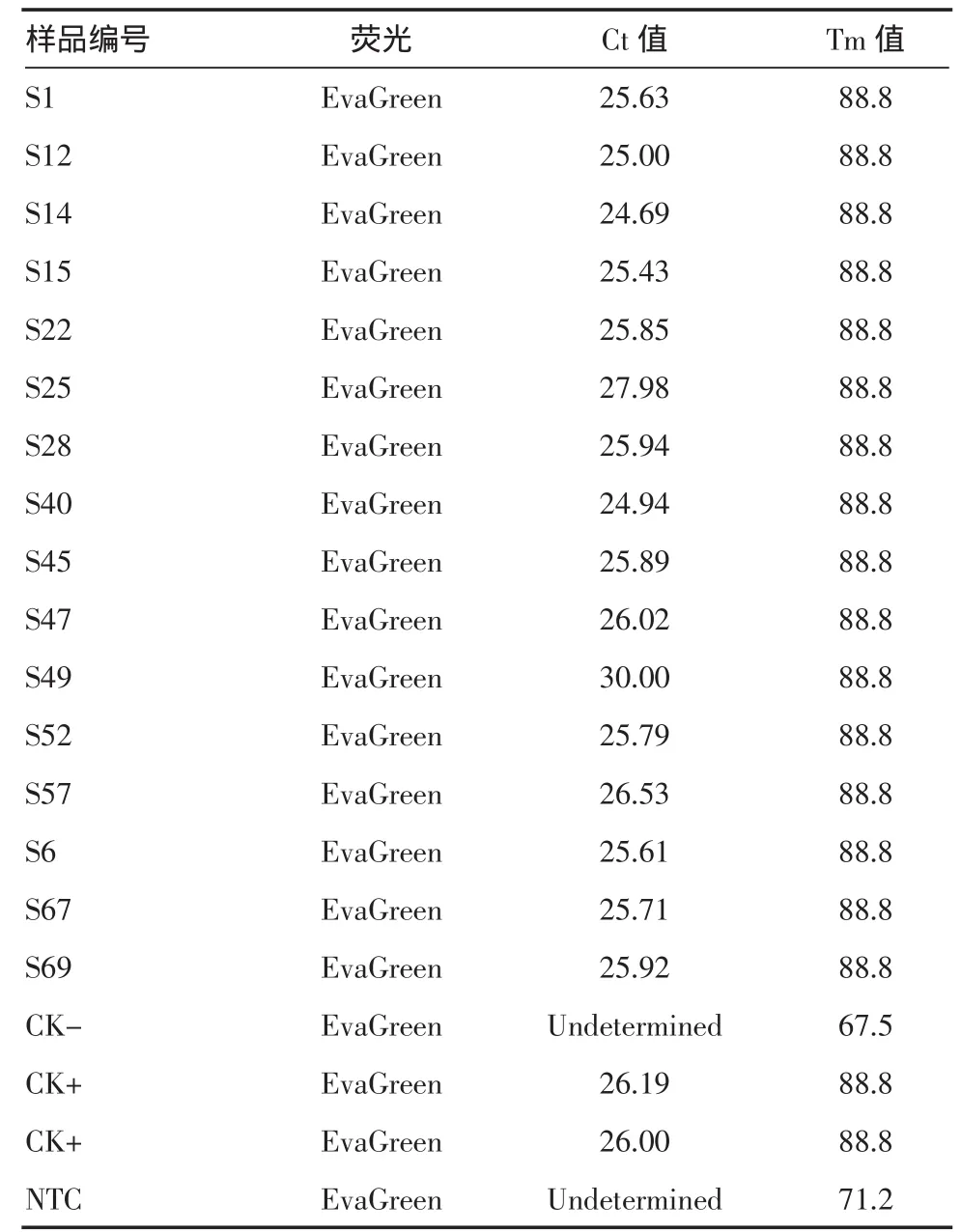
表2 部分样品SPS基因EvaGreen荧光检测阈值和Tm值
2.2 目的基因ATAF1检测
2.2.1 ATAF1基因PCR电泳检测 以外源ATAF1基因对样品DNA进行扩增检测,结果如图2所示,70个样品部分样品能检测到明显的580bp大小条带,并且阴性对照和阳性对照均正常。
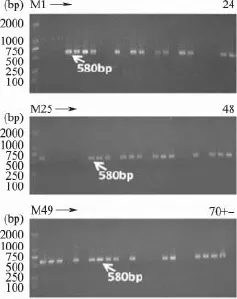
图2 样品ATAF1基因扩增凝胶电泳分析结果
2.2.2 ATAF1基因实时荧光PCR检测 对随机挑取的部分水稻种子样品同时进行ATAF1基因实时荧光PCR检测,从结果可知,所有检测样品在实时荧光检测中均有抬头,其中部分检测阈值在16~22之间,部分大于34(表3),样品溶解曲线均在同一个位置有高峰,样品Tm值为85.2/84.8。
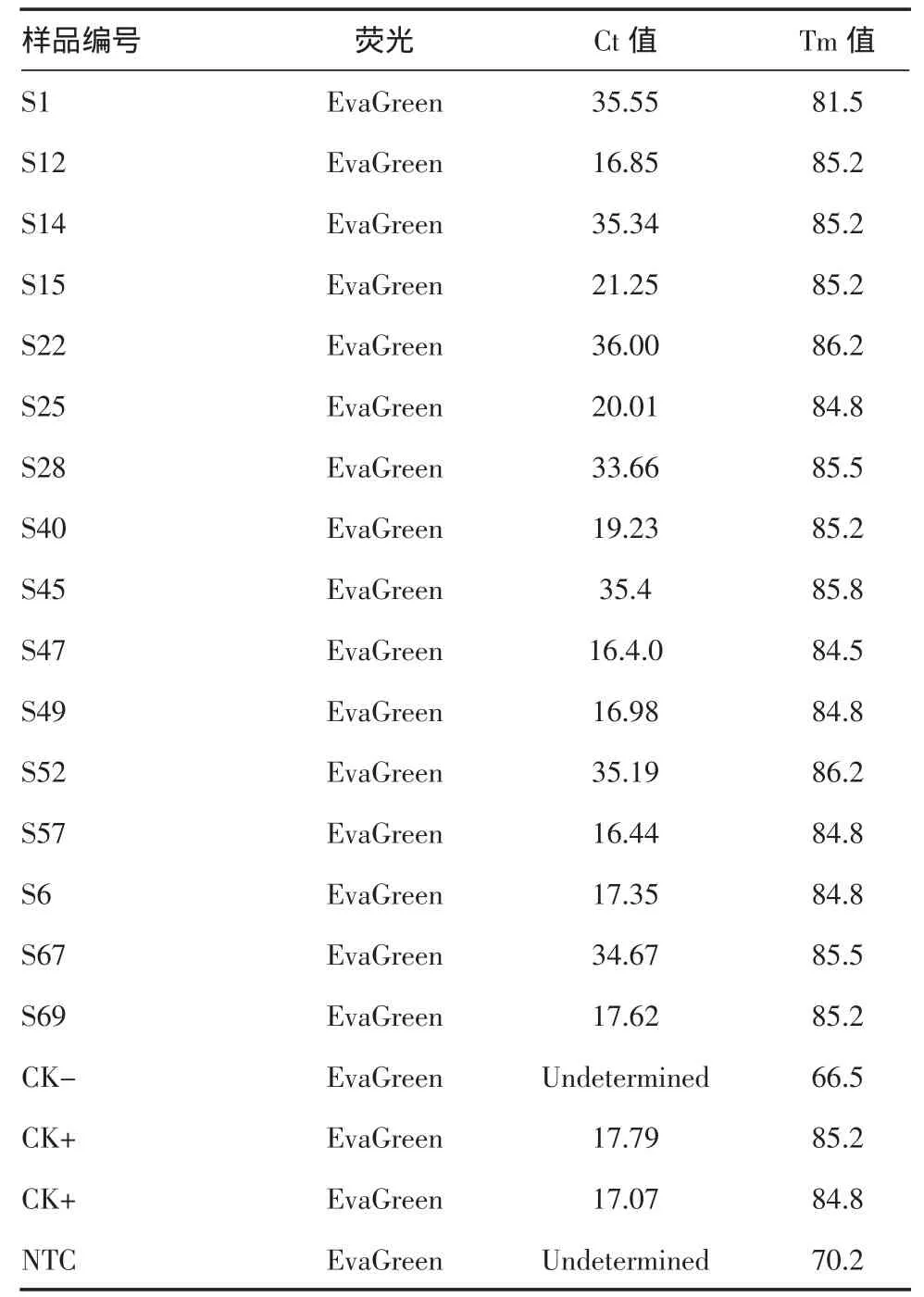
表3 部分样品ATAF1基因EvaGreen荧光检测阈值和Tm值
3 结论与讨论
本研究采用磁珠自动提取法大规模地提取水稻种子的DNA,利用紫外分光光度计检测提取DNA的质量,结果表明大部分提取的DNA浓度(大于10ng/μL)和纯度(OD260/OD280在1.8~2.1之间)均满足一般要求,而部分样品的浓度和纯度未落在上述范围内,浓度仅有2~3ng/μL,OD260/OD280有的小于1或大于2.5。同时利用内源基因检测方法检测提取DNA质量时,这部分样品DNA均能非常清晰地检测到内源条带。因此在PCR扩增检测中,评价提取DNA的质量不单单仅考虑紫外吸收检测的结果,同时结合内源基因检测信息,更好地保证PCR扩增所需DNA的质量。
通过设计外源ATAF1基因引物对研发中的转基因水稻种子进行普通PCR扩增,琼脂糖凝胶电泳检测,初步建立普通PCR筛选检测转基因成分的方法。同时挑选部分样品初步研究实时荧光PCR检测方法,以EvaGreen作为荧光染料,对内源基因和外源基因进行实时扩增,结果与普通PCR检测基本一致,在外源基因检测上,实时荧光PCR具有更高的灵敏度,如表2中Ct值>34的样品在实时荧光检测中能看到扩增曲线有抬头,但是在普通PCR电泳检测方法上未能见到条带,说明这些样品的转基因成分含量很低,普通PCR未能检测到,而用实时荧光PCR方法能检测较为微量的成分。
[1] 邓汉超.转基因植物DNA成分检测技术研究进展[J].中国种业,2016(11):19-21
[2] 侯大军,李洪军.转基因食品的发展历史与未来趋势[J].四川食品与发酵,2007(5):24-27
[3] 杨铭铎,张春梅,华庆,等.转基因食品快速检测技术的研究进展[J].食品科学,2004,25(11):424-427
[4] 叶兴国.从转基因技术角度谈转基因植物的安全性[J].中国种业,2016(9):12-13
[5] 陈飞,刘阳,邢福国.转基因食品的免疫安全性评价[J].食品科学,2012,33(9):296-300
[6] 祁潇哲,黄昆仑.转基因食品安全评价研究进展[J].中国农业科技导报,2013,15(4):14-19
[7] Jiang L X,Yang L T,Zhang H B,et al.International Collaborative Study of the Endogenous Reference Gene,Sucrose Phosphate Synthase(SPS),Used for Qualitative and Quantitative Analysis of Genetically Modified Rice[J].J Agric Food Chem,2009,57:3525-3532
2017-02-21)
转基因新品种培育重大专项(2009ZX08001-023B);深圳市技术创新项目(CXZZ20120614165508810)
刘晋

