塞来昔布下调Apaf-1蛋白表达促进大鼠颅脑损伤后学习记忆功能恢复的研究*
张 涛,国建飞,邢琳琳,张金玲,张宇新
(1.河北医科大学附属邢台人民医院,河北邢台 054031;2.邢台医学高等专科学校,河北邢台 054001;3.华北理工大学医学院,河北唐山 063000)
·论 著·
塞来昔布下调Apaf-1蛋白表达促进大鼠颅脑损伤后学习记忆功能恢复的研究*
张 涛1,国建飞1,邢琳琳1,张金玲2,张宇新3
(1.河北医科大学附属邢台人民医院,河北邢台 054031;2.邢台医学高等专科学校,河北邢台 054001;3.华北理工大学医学院,河北唐山 063000)
目的 探讨塞来昔布对大鼠创伤性脑损伤后学习记忆功能和环氧化酶(COX-2)及凋亡蛋白酶活化因子-1(Apaf-1)蛋白表达的影响。方法 将72只成年雄性Wistar大鼠等量分为对照组、假手术组、损伤组和治疗组,术后72 h灌注取脑,应用免疫组化法和Western blot法分别检测 COX-2 及Apaf-1蛋白表达变化;术前5 d和术后72 h采用Morris水迷宫实验观察大鼠学习记忆功能。结果 损伤组COX-2和Apaf-1蛋白表达明显高于其他组,治疗组与损伤组比较蛋白表达均下降(P<0.05),但仍高于假手术组和对照组(P<0.05);Morris水迷宫实验中,损伤组逃避潜伏期时间延长为4组之最(P<0.05),治疗组较损伤组时间有所缩短(P<0.05)。结论 COX-2抑制剂塞来昔布可下调COX-2和Apaf-1蛋白表达,抑制炎性反应、细胞凋亡,改善脑损伤后的学习、记忆障碍。
脑损伤;环氧化酶-2;凋亡蛋白酶活化因子-1;学习;记忆
众多的研究表明,炎症因子所激发的一系列炎性反应,是加重继发性脑损伤的重要原因之一[1],因此临床上迅速减少炎性反应所带来的继发性损伤尤为重要。环氧化酶-2(cyclooxygenase-2,COX-2)是花生四烯酸代谢的限速酶,后者产生的前列腺素及血栓素是脑创伤后炎症级联反应的重要介质,与继发性脑损伤关系密切[2]。凋亡蛋白酶活化因子-1(antipernicious anemia factor,Apaf-1)作为线粒体凋亡途径中一个重要促凋亡因子,能促进凋亡小体的形成,激活通路下游的一系列Caspases成员[3],切割特定的凋亡底物,最终导致细胞凋亡[4]。本实验以大鼠颅脑损伤为模型,通过塞来昔布对COX-2蛋白的超选择性抑制,调节凋亡因子Apaf-1蛋白的表达,抑制颅脑损伤后炎性反应和减少神经细胞凋亡,为脑损伤的临床治疗提供新的途径。
1 材料与方法
1.1 实验动物 Wistar大鼠72只,雄性,体质量(280±20)g,SPF级,由北京维通利华实验动物技术有限公司提供[许可证号:SCXX(京)2007-0008],自由进食饮水,室温(25±2)℃,自然光照。
1.2 药品与试剂 塞来昔布购自北京辉瑞制药有限公司(国药准字J20120063,规格200 mg,批号C1420006862);总蛋白提取试剂盒(北京普利莱基因技术有限公司);BCA蛋白浓度测定试剂盒(南京碧云天生物技术研究所);增强型ECL化学发光检测试剂盒(美国Biologycal Industries公司);DAB显色试剂盒(北京中杉金桥生物有限公司);兔抗COX-2及Apaf-1多克隆一抗(美国Santa Cruz公司);兔抗GAPDH多克隆一抗、辣根过氧化物酶标记羊抗兔二抗(美国Abcam公司);JEM-1230投射电子显微镜(日本Jeol公司);分子生物学凝胶电泳仪及化学发光凝胶成像系统(美国Bio-Rad公司);LEICA-Rm2145型半自动轮转切片机(德国Leica公司)。
1.3 方法
1.3.1 动物分组 将72只SPF级雄性Wistar大鼠分为对照组、开颅即缝合的假手术组、改良Foda[5]自由落体法建立的损伤组和损伤组基础上腹腔注射塞来昔布的治疗组(250 mg/kg/6 h),前3组相同条件下注入等量生理盐水,每组18只大鼠,各组均在造模前5 d随机选取6只大鼠进行Morris水迷宫训练,其余各组剩余12只大鼠直至术后72 h常规灌注取材。
1.3.2 颅脑损伤模型制备 参照文献[5]大鼠重型颅脑损伤模型构建方法加以改良,制备损伤组模型。术前禁食8 h并在术前0.5 h时,腹腔注射阿托品(30 mg/kg),无不良反应后,以10%水合氯醛(350 mg/kg)腹腔注射麻醉,颅顶除毛,75%乙醇消毒术区。将大鼠取俯卧位固定于脑立体定向仪上,沿正中矢状线切口开颅,在冠状缝及人字缝交汇处暴露骨膜并固定打击片,将450 g打击锤以1.2 m高度自由落体后,迅速保护大鼠,防止二次损伤。明胶海绵止血并人工辅助呼吸及伤口清创缝合,术后常规饲养。
1.3.3 标本制备 术后72 h将各组大鼠以10%水合氯醛(350 mg/kg)经腹腔麻醉,沿胸腹腔正中线暴露心尖,用生理盐水及4%多聚甲醛先后灌注,充分固定后断头取脑。脑组织行后固定经常规梯度乙醇脱水、透明、浸蜡、包埋后石蜡横切片(厚5 μm),烘干后待染色。
1.3.4 COX-2和Apaf-1免疫组织化学及结果判断 术后72 h,采用Envision二步法对组织切片进行SP染色,分别加入兔抗COX-2、Apaf-1多克隆一抗(1∶50),用盐酸盐缓冲液(PBS)取代一抗作为阴性对照,各组图片均使用200倍光镜从左上、左下、右上、右下及中间5个视角摄取结果。结果判定:以细胞颜色呈棕褐(黄)色颗粒且强度高于背景非特异性着色则视为阳性结果。评分要求:一个视野内细胞数大于75%、51%~74%、11%~50%、<10%时分别对应分值为4、3、2、1分,阴性为0分;染色强度评分依次为棕褐色3分、棕黄色2分、淡黄色1分,无色0分;两项得分相乘为阳性表达“+、++、+++”分别代表3、4、5分,“-”为0~2分属阴性表达。
1.3.5 Western blot法检测COX-2、Apaf-1蛋白表达变化 术后72 h,迅速剥离各组大鼠顶叶皮层下方海马区域脑组织,按蛋白提取试剂盒说明提取各组总蛋白。依照BCA蛋白浓度测定试剂盒说明测定总蛋白浓度,各组摄取统一浓度样品行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)跑胶、聚偏氟乙烯(PVDF) 转膜、5%脱脂奶粉室温封闭2 h后行一抗反应(COX-2、Apaf-1一抗1∶200和GAPDF一抗1∶400),4 ℃孵育过夜,次日行二抗反应1∶500,室温孵育2 h,ECL试剂盒显影后使用Bio-Rad摄片,运用Quantity One系统分析各组目的蛋白/GAPDH的相对表达量。
1.3.6 学习记忆能力测试 造模前5 d从各组选取6只大鼠,进行全天各4次,每次60 s,持续5 d的Morris水迷宫方法定位航行试验及空间探索训练[6]。将大鼠从左上、左下、右上、右下方向随机放入浑浊水中,从入水到爬上隐藏平台所需时间即逃避潜伏期(escape latency,EL),记录每只大鼠每天的EL平均值就是平均逃避潜伏期(average escape latency,AEL),如超过120 s未能登陆隐藏平台则引导其登陆,并记录搜索平台线路轨迹,此时EL记为120 s,用于观察学习认知能力;移除水下平台,记录大鼠120 s内穿过原始平台所在的位置次数(停留2 s以上),考察其记忆能力。
2 结 果
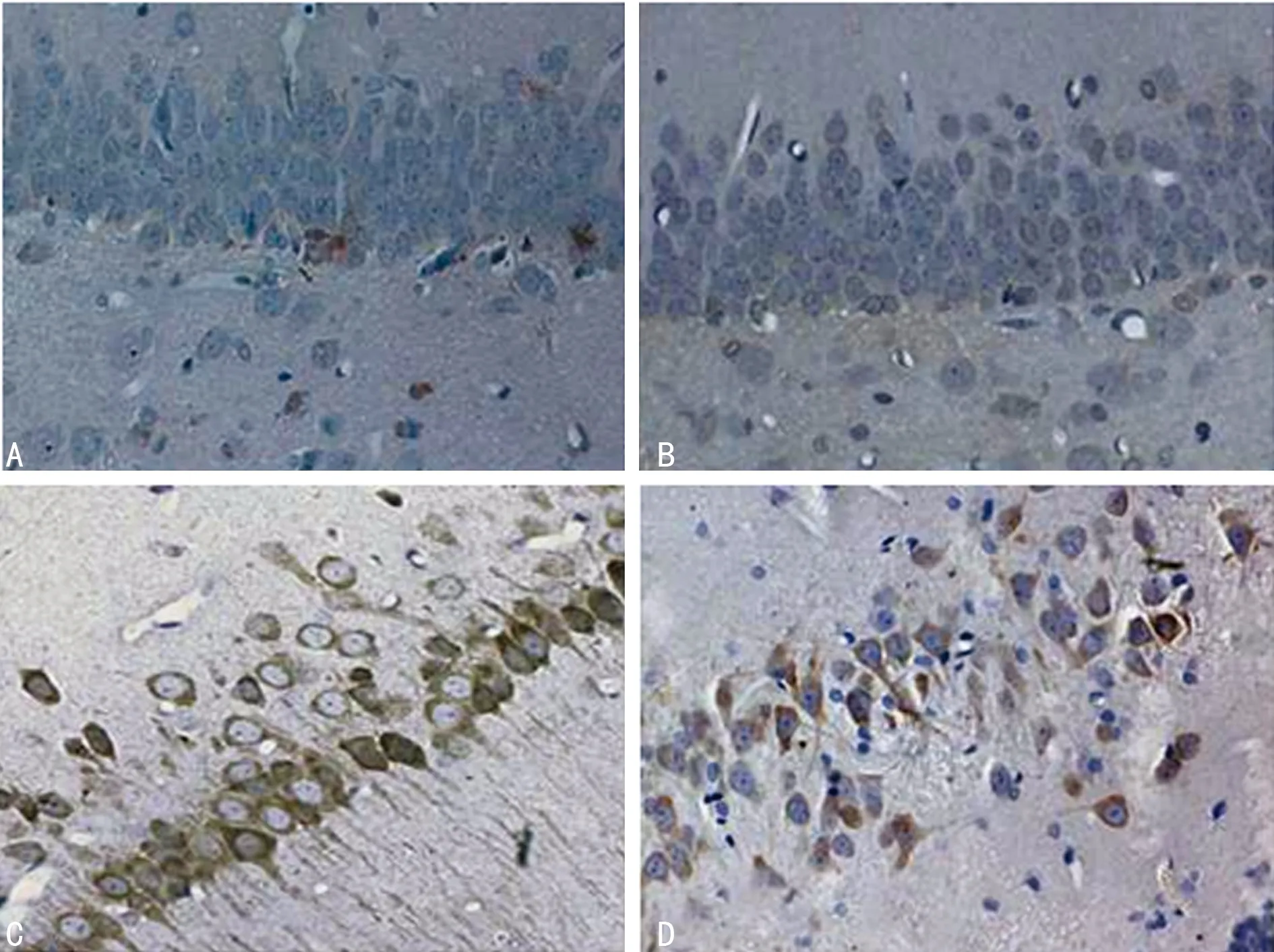
2.1 COX-2和Apaf-1免疫组织化学结果 脑组织海马区域中运用免疫组织化学法分别检测4组模型COX-2和Apaf-1表达变化,阳性表达主要位于细胞质中呈棕褐或黄色,结果发现对照组及假手术组均呈阴性表达(图1A、B;图2A、B),两组比较差异无统计学意义(P<0.05),见表1;损伤组呈棕褐色且数量较多(图1C、图2C),加入塞来昔布后的治疗组呈棕黄色表现(图1D、图2D),与损伤组比较COX-2、Apaf-2均有所减少但仍高于其他两组(P<0.05),见表1。

A:对照组;B:假手术组;C:损伤组;D:治疗组。
图1 脑组织海马区域中的COX-2表达(SP,×200)
A:对照组;B:假手术组;C:损伤组;D:治疗组。
图2 脑组织海马区域中的Apaf-1表达(SP,×200)
2.2 Western blot检测COX-2 和 Apaf-1在各组中蛋白表达变化 COX-2和Apaf-1各组目的条带分别在72×103和130×103处显示,与其相对分子质量相符(图3)。蛋白定量分析结果显示,COX-2和Apaf-1假手术组与对照组比较差异无统计学意义(P>0.05),损伤组与其他各组比较差异均有统计学意义(P<0.05),治疗组与损伤组比较均有所降低,但数值仍高于对照组及假手术组(P<0.05),见表2。

表1 免疫组织化学检测各组COX-2和Apaf-1的阳性表达情况

图3 Western blot检测COX-2和Apaf-1在各组中的蛋白表达变化

组别COX-2/GAPDHApaf-1/GAPDH对照组0.46±0.090.57±0.05假手术组0.57±0.140.42±0.09损伤组2.79±0.482.41±0.33治疗组1.64±0.361.24±0.12F16.44838.514
2.3 Morris水迷宫测试结果 术后1周对各组大鼠进行连续4 d Morris水迷宫测试,其中AEL和探索次数可有效反映大鼠认知功能,而大鼠游泳轨迹分为4种:随机型、边缘型、直线型及趋向型,其中直线型和趋向型则最能反映大鼠记忆功能。通过对比各组大鼠行为学测试发现,对照组和假手术组无论AEL、探索次数还是游泳轨迹均较为接近,差异无统计学意义(P>0.05)。损伤组与其他3组比较AEL时间均明显延长,探索次数也均显著降低,认知功能显著下降(P<0.05),通过对游泳轨迹发现,直线型和趋向型次数均属组别最低,记忆能力严重受损(P<0.05)。治疗组与创伤组比较AEL时间、探索次数以及直线型和趋向型游泳轨迹次数均有所改善,差异有统计学意义(P<0.05)。
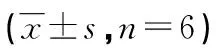
表3 各组大鼠Morris水迷宫AEL和探索次数
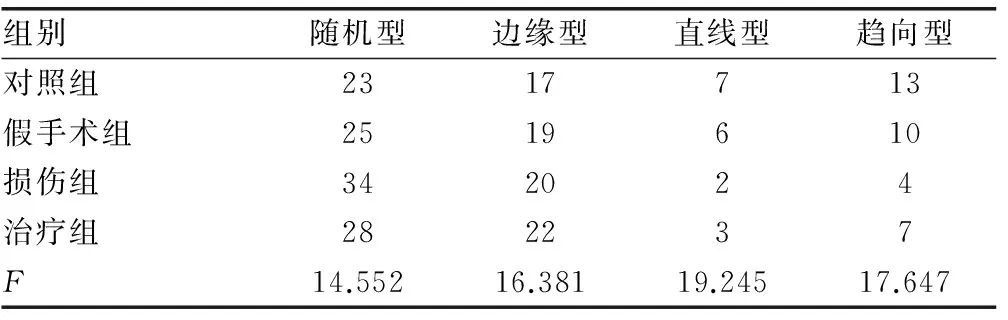
表4 Morris水迷宫大鼠游泳轨迹检测(次)
3 讨 论
脑损伤后寻找有效的神经保护药物,对于患者的学习记忆及运动功能障碍的恢复尤为重要。炎性反应是导致神经元继发性损伤进行性加重的重要原因,而COX-2 是介导炎性反应的关键酶,因此在继发性脑损伤中如何抑制COX-2介导的炎性反应有着重大意义。COX-2是花生四烯酸(AA)代谢的限速酶,产生的前列腺素及血栓素是脑创伤后炎症级联反应的重要介质。炎症介质前列腺素E2(Prostaglandin,PGE2)生物合成的限速酶[7-9],其代谢产物可导致白细胞介素(IL)-1、一氧化氮(NO)及肿瘤坏死因子-α(TNF-α)增多[7]。Apaf-1 是一个具有多功能结构域的蛋白,JNK 途径中是线粒体依赖的关键蛋白酶,由3个结构域组成,其氨基末端有一个半胱氨酸蛋白酶募集域(caspase recruitment domain,CARD) ,CED24 同源域内包含一个保守P环,羧基末端则由12 个 WD240 重复片段组成。另外,Apaf-1在细胞凋亡过程中,起着“扳机点”的作用,活化的 Apaf-1通过 N 端的 CARD 结构域与 Pro-Caspase-9 分子中的 CARD 结构域形成寡聚化,活化的Caspase-9 可激活下游其他 Caspases 成员,导致细胞发生不可逆的凋亡[10-13]。
Caspases-3在凋亡过程中处于蛋白级联反应的核心位置,一旦被活化将使蛋白酶级联反应放大,促使细胞发生不可逆的凋亡[14]。笔者在既往的实验中发现,塞来昔布能够减少颅脑损伤后大鼠海马区域Caspases-3 蛋白的表达,并且与COX-2蛋白表达呈正相关[15]。有研究报道COX-2/NF-κB信号通路与Apaf-1/caspase凋亡通路紧密相关,通过抑制COX-2表达可明显降低Apaf-1表达,从而抑制细胞凋亡[16]。本研究通过免疫组织化学及Western blot结果均证实损伤组COX-2、Apaf-1的蛋白表达较假手术组均明显增高,治疗组表达量均明显低于损伤组,提示COX-2抑制剂塞来昔布可有效抑制或减少细胞凋亡;海马作为脑损伤后易损区,损伤后出现神经细胞延迟性死亡,可导致长期学习记忆功能障碍[1]。Morris水迷宫检测方法是检测动物学习记忆功能的经典方法,实验结果显示通过塞来昔布治疗后AEL时间、探索原始平台以及游泳轨迹较损伤组均有明显改善,且差异均有统计学意义,这表明塞来昔布能够显著提高颅脑损伤后对大鼠的认知能力和记忆能力。
另外COX-2作用下产生PG类产物可以通过诱导bcl-2和Bax 基因突变,抑制Bcl-2蛋白表达,并能逆向降低Bax蛋白的表达,进一步促进了细胞凋亡[16],而且增多的Bax蛋白还可以通过以下原因加速细胞的凋亡:(1)线粒体渗透性转换、氧化磷酸化和三磷酸腺苷的合成功能被破坏;(2)细胞氧化还原作用改变;(3)促进线粒体中的凋亡相关分子Apaf-1释放,与细胞色素C相互作用,激活Caspase信号转导途径[11]。
COX-2 在炎症组织中可被IL-1、TNF-α等多种炎性因子所诱导,表达水平迅速升高,引起炎症部位的PGE、PGI的快速增加,加剧炎性反应和组织损伤。颅脑损伤后脑胶质细胞以及神经元中均有TNF-α、IL-1、IL-6和NO的表达增加,临床检验也证实,患者的脑脊液及血浆中上述炎症因子检测值远远高于正常值水平,而上述炎症因进一步通过诱导COX-2表达,加速了由其介导的炎性反应[17]。推断COX-2可能通过以下途径加重继发性脑损伤:(1)打破PGI2和TXA2保持动态平衡,导致TXA2增多,引发了血管的收缩以及微血栓的形成,导致脑缺血的发生;(2)使血-脑屏障通透性增加,加速了炎症因子进入脑组织,引发了神经元的损伤;(3)COX-2增强兴奋性氨基酸的毒性作用,特别是增加了N甲基-D天冬氨酸介导的神经毒性作用,引发神经元直接损伤。上述诸多因素均导致神经细胞凋亡坏死,引发相应的神经功能障碍[18]。
学习记忆功能是大脑最重要的高级神经功能之一,同时也是中枢神经系统功能的整合。创伤后遗留的记忆障碍严重影响患者的康复,探寻创伤后改善学习记忆障碍的药物具有极其重要的意义。塞来昔布作为经典的COX-2高选择性特异性抑制剂,已广泛应用于临床的镇痛治疗,笔者研究发现该药能显著改善伤后大鼠的认知功能障碍。本实验证实,颅脑损伤后塞来昔布能通过抑制由COX-2介导的一系列炎性反应,来减少由Apaf-1 作为“扳机点”引发的神经元的凋亡,既减少由炎性反应带来的继发性脑损伤,能减少神经元的凋亡,为改善颅脑损伤后学习记忆功能障碍提供了新的思路。
[1]Samal BB,Waites CK,Almeida-Suhett C,et al.Acute response of the hppocampal transcriptome following mild traumatic brain injury after controlled cortical impact in the rat[J].J Mol Neurosci,2015,57(2):282-303.
[2]Das P,De T,Chakraborti T.Leishmania donovani secretory serine protease alters macrophage inflammatory response via COX-2 mediated PGE-2 production[J].Indian J Biochem Biophys,2014,51(6):542-551.
[3]Wen X,Lin ZQ,Liu B,et al.Caspase-mediated programmed cell death pathways as potential therapeutic targets in cancer[J].Cell Prolif,2012,45(3):217-224.
[4]Tanase C,Albulescu R,Codrici E,et al.Decreased expression of APAF-1 and increased expression of cathepsin B in invasive pituitary adenoma[J].Onco Targ Ther,2015,8(1):81-90.
[5]Reinert M,Schaller B,Widmer HR,et al.Influence of oxygen therapy on glucose-lactate metabolism after diffuse brain injury[J].J Neurosurg,2004,101(2):323-329.
[6]Daniels BP,Sestito SR,Rouse ST.An expanded task battery in the morris water maze reveals effects of toxoplasma gondii infection on learning and memory in rats[J].Parasitol Int,2015,64(1):5-12.
[7]Gunther M,Plantman S,Davidsson J,et al.COX-2 regulation and TUNEL-positive cell death differ between genders in the secondary inflammatory response following experimental penetrating focal brain injury in rats[J].Acta Neurochir(Wien),2015,157(4):649-659.
[8]Kawahara K,Hohjoh H,Inazumi T,et al.Prostaglandin E2-induced inflammation:Relevance of prostaglandin E receptors[J].Biochim Biophys Acta,2015,1851(4):414-421.
[9]Saini S,Liu T,Yoo J.TNF-alpha stimulates colonic myofibroblast migration via COX-2 and Hsp27[J].J Surg Res,2016,204(1):145-152.
[10]Feng R,Han J,Ziegler J,et al.Apaf-1 deficiency confers resistance to ultraviolet-induced apoptosis in mouse embryonic fibroblasts by disrupting reactive oxygen species amplification production and mitochondrial pathway[J].Free Radic Biol Med,2012,52(5):889-897.
[11]Kawamoto Y,Ayaki T,Urushitani M,et al.Activated caspase-9 immunoreactivity in glial and neuronal cytoplasmic inclusions in multiple system atrophy[J].Neurosci Lett,2016(628):207-212.
[12]Zhou M,Li Y,Hu Q,et al.Atomic structure of the apoptosome:mechanism of cytochromec and dATP-mediated activation of Apaf-1[J].Genes Dev,2015,29(22):2349-2361.
[13]Lau A,Arundine M,Sun HS,et al.Inhibition of caspase-mediated apoptosis by peroxynitrite in traumatic brain injury[J].J Neurosci,2006,26(45):11540-11553.
[14]Gao Y,Liang W,Hu X,et al.Neuroprotection against hypoxic-ischemic brain injury by inhibiting the apoptotic protease activating factor-1 pathway[J].Stroke,2010,41(1):166-172.
[15]张涛.塞来昔布对颅脑创伤后学习记忆功能及Caspase-3蛋白表达的影响[J].天津医药,2012,40(6):590-593.
[16]Wang J,Xiao X,Zhang Y,et al.Simultaneous modulation of COX-2,p300,Akt,and Apaf-1 signaling by melatonin to inhibit proliferation and induce apoptosis in breast cancer cells[J].J Pineal Res,2012,53(1):77-90.
[17]Checinska A,Giaccone G,Rodriguez JA,et al.Comparative proteomics analysis of caspase-9-protein complexes in untreated and cytochrome c/dATP stimulated lysates of NSCLC cells[J].J Proteomics,2009,72(4):575-585.
[18]Pan W,Lin L,Zhang N,et al.Neuroprotective effects of dexmedetomidine against hypoxia-induced nervous system injury are related to inhibition of NF-kappaB/COX-2 pathways[J].Cell Mol Neurobiol,2016,36(7):1179-1188.
Celecoxib down-regulates Apaf-1 protein expression for promoting learning and mem craniocerebral traumaory function recovery after in rats*
Zhang Tao1,Guo Jianfei1,Xing Linlin1,Zhang Jinling2,Zhang Yuxin3
(1.Hebei Medical University Afficiated Xingtai People′s Hospital,Xingtai,Hebei 054031,China;2.Xingtai Medical College,Xingtai,hebei 054001,China;3.Medical College,North China Institute of Technology,Tangshan,Hebei 063000,China)
[Abstract] Objective To study the effect of celecoxib on learning and memory function,cyclooxygenase(COX-2) and the apoptotic protease-activating factor -1(Apaf-1) protein expression after traumatic brain injury in rat.Methods A total of 72 adult male Wistar rats were equally and randomly divided into the normal control group,sham operation group,trauma group and Celecoxib treatment group.Postoperative 72 h-reperfusion was performed for taking brain specimens.The immunohistochemical method and Western blot were used to respectively detect COX-2 and Apaf-1 protein expression change;the Morris water maze test was adopted to detect the learning and memory function on preoperative 5 d and at postoperative 72 h.Results The COX-2 and Apaf-1 protein expression in the trauma group was significantly higher than that in other groups (P<0.05),and the protein expression in the treatment group and trauma group was decreased,but still higher than that in the sham operation group and normal group(P<0.05);in the Morris water maze test,the prolongation of escape latency time in the trauma group was maximal among 4 groups (P<0.05),but the treatment group had a shorter time compared with the trauma group (P<0.05).Conclusion Craniocerebral trauma can cause different degrees of learning and memory dysfunction,and COX-2 inhibitor celecoxib can downregulate the expression of COX-2 and Apaf-1 protein,inhibit inflammation reaction and cellular apoptosis,and improve the learning and memory dysfunction after traumatic brain injury.
brain injuries;cyclooxygenase-2;apoptotic protease-activating factor-1;learning;memory
10.3969/j.issn.1671-8348.2017.13.002
河北省自然科学基金资助项目(C2004000689);河北省博士基金资助项目(05547008D-4);河北省科学技术与社会发展计划项目(04276135)。 作者简介:张涛(1980-),硕士,副主任医师,主要从事颅脑损伤治疗研究。
R651.1+5
A
1671-8348(2017)13-1732-04
2016-11-19
2017-01-07)

