Elongator复合物在低浓度氨基酸条件下对TORC1活性的影响
何 格,滕昕辰
Elongator复合物在低浓度氨基酸条件下对TORC1活性的影响
何 格,滕昕辰
(苏州大学药学院,苏州,215000)
目的:研究Elongator复合物在低浓度氨基酸条件下对TORC1活性的影响。方法:通过生长实验来观察Elongator突变体在低浓度氨基酸和低浓度亮氨酸条件下的生长程度;通过免疫印迹法检测核糖体蛋白S6的磷酸化水平来检测TORC1的活性;将GFP-ATG8质粒转入到Elongator突变体及野生型酵母菌株WT里,并通过免疫印迹法检测游离的GFP蛋白的水平来检测体内自噬。结果:生长实验显示Elongator突变体在低浓度氨基酸条件下显示过度生长的特性,并且这种过度生长可被TORC1抑制剂雷帕霉素所抑制;免疫印迹检测TORC1活性的实验以及检测体内自噬实验显示Elongator突变体在低浓度氨基酸条件下TORC1活性上升,而自噬进程被抑制;进一步实验证明Elongator 突变体可特异性忽略低浓度亮氨酸而激活TORC1,抑制自噬,从而持续生长。结论:Elongator复合物在氨基酸信号下可抑制TORC1的活性,同时促进体内自噬进程。推测Elongator复合物可通过抑制TORC1信号通路确保细胞内蛋白翻译的准确性。
Elongator复合物;TORC1活性;氨基酸信号
引言
真核生物里的Elongator复合物最早是由Otero等从酵母中分离出来的[1],它能够与RNA聚合酶Ⅱ(RNAPII)紧密结合。因为这种蛋白质复合物与RNAPII的稳定结合依赖于RNAPII的C末端结构域(CTD)的高度磷酸化[2],而这种磷酸化是转录延伸的标记,所以将这种复合物命名为延伸(Elongator)复合物。自其被发现以来,Elongator复合物被报道参与一系列细胞活动,诸如组蛋白乙酰化染色质的修饰﹑DNA去甲基化﹑参与维持基因的稳定性等。Elongator复合物含有六个亚基,通常形成两个三亚基复合物,其中较大的核心复合物是由Elp1﹑Elp2和Elp3亚基组成[1],另一个较小的复合物是由Elp4﹑Elp5和Elp6组成[3,4]。Elongator复合物的组成亚基在酵母和人之间是高度保守的[5,6]。令人惊奇的是[7,8],在酒酿酵母[1,3,9]﹑拟南芥[10]以及黑腹果蝇等生物体内缺失任何一个Elongator亚基都会显示出相似的表型,说明这六个亚基中的任意一个对维持Elongator复合物的结构完整性及酶活性来说都是必须的。
之前我们实验室通过文库筛选发现敲除酵母内Elongator复合物的任一亚基均会导致该突变菌株产生在低浓度氨基酸条件下过度生长的表型。氨基酸不仅是蛋白质合成的重要前体,还作为信号分子被细胞内的感应器所感应从而参与细胞内信号转导过程[11-13]。雷帕霉素靶点蛋白复合物1(target of rapamycin complex1, TORC1)是细胞内感受氨基酸信号并调控细胞生长的重要机制[14]。当氨基酸富足时,TORC1活性上升,并进一步激活下游靶标分子,提高转录翻译水平,抑制自噬,促进细胞生长[15]。当氨基酸缺乏时,TORC1活性下降,转录翻译被抑制,自噬进程被激活,细胞生长停滞[16,17]。TORC1信号通路的失调会导致环境营养水平和细胞生长的脱节,是许多疾病的成因[18-20]。虽然有研究显示Elongator复合物在果蝇细胞内可通过胰岛素激活TORC1的信号通路发挥作用,但目前并没有Elongator复合物与氨基酸信号通路有直接联系的相关报道。本文将会研究探索Elongator突变体在氨基酸缺乏条件下对TORC1活性的影响,将为完善Elongator复合物的生理功能提供帮助以及因Elongator功能缺失导致的疾病的治疗提供分子基础。也有利于我们进一步丰富以及完善TORC1信号通路,并为研发以该信号通路为靶点的药物做出贡献。
1 实验材料与方法
1.1 实验材料
1.1.1 酵母菌株
所用酵母菌株及其基因型名称见表1
1.1.2 质粒
酵母表达所用质粒见表2
1.1.3 培养基
酵母常用液体培养基CSH含0.17%酵母氮基(无氨基酸和硫酸铵)(生工,S505),0.5%硫酸铵(生工,A0191),0.2% CSH氨基酸混合物;ME含0.17%酵母氮基(无氨基酸和硫酸铵),0.5%硫酸铵,0.124% ME氨基酸混合物。实验过程中所使用的CSH及ME氨基酸混合物组分见表3。在液体培养基中添加2%琼脂即得固体培养基。
1.1.4 化学试剂
化学发光HPR底物及PVDF膜购于MILLIPORE公司;玻璃珠(酸洗过的),蛋白酶抑制剂及磷酸酶抑制剂购于Sigma公司;蛋白Marker购于Thremo公司;PGK1抗体(22C5D8)购于Abcam公司;GFP 抗体(B-2)购于Santa Cruz公司;Phospho-S6(Ser235/236)抗体,HRP-linked Anti-mouse IgG及HPR-linked Anti-rabbit IgG购于CST公司。

表1 酵母菌株
1.2 方法
1.2.1 检测酵母TORC1的活性
挑酵母单克隆到3 mL CSH液体培养基中并放在15 mL的无菌培养管在30℃恒温培养箱中摇过夜。使用紫外可见分光光度计测量过夜酵母菌液的OD值(吸光度)。用1.5 mL离心管离心6 OD酵母(13000 rpm/min室温离心1 min),去除上清,然后用6 mL富足培养基CSH使之重悬在15 mL无菌培养管中,于30℃摇床里培养1 h。测量OD值,离心3管2 OD酵母,去上清。其中一管把沉淀存放于-20℃作为0点的样本。另外两管分别用1 mL ddH2O洗一次,用2 mL ME 培养基重悬,在30℃摇床中培养3 h和6 h,并在指定的每一个时间点离心2 OD酵母,沉淀存放于-20℃。其中每管2 OD酵母,加200 μL SDS裂解液,在处理时按1:1000分别现加蛋白酶抑制剂和磷酸酶抑制剂。加大约100 μL无菌玻璃珠,在漩涡混匀仪高速震荡45 s × 4,每次在冰上间隔30 s。干式恒温器100℃煮5 min。进行蛋白免疫印记(WB)。用12% SDS-PAGE 胶,每孔上样15 μL。用p-S6抗体(TORC1活性指示蛋白,1:1000, 二抗兔),PGK抗体(参照蛋白, 1:1000,二抗鼠) 标记。
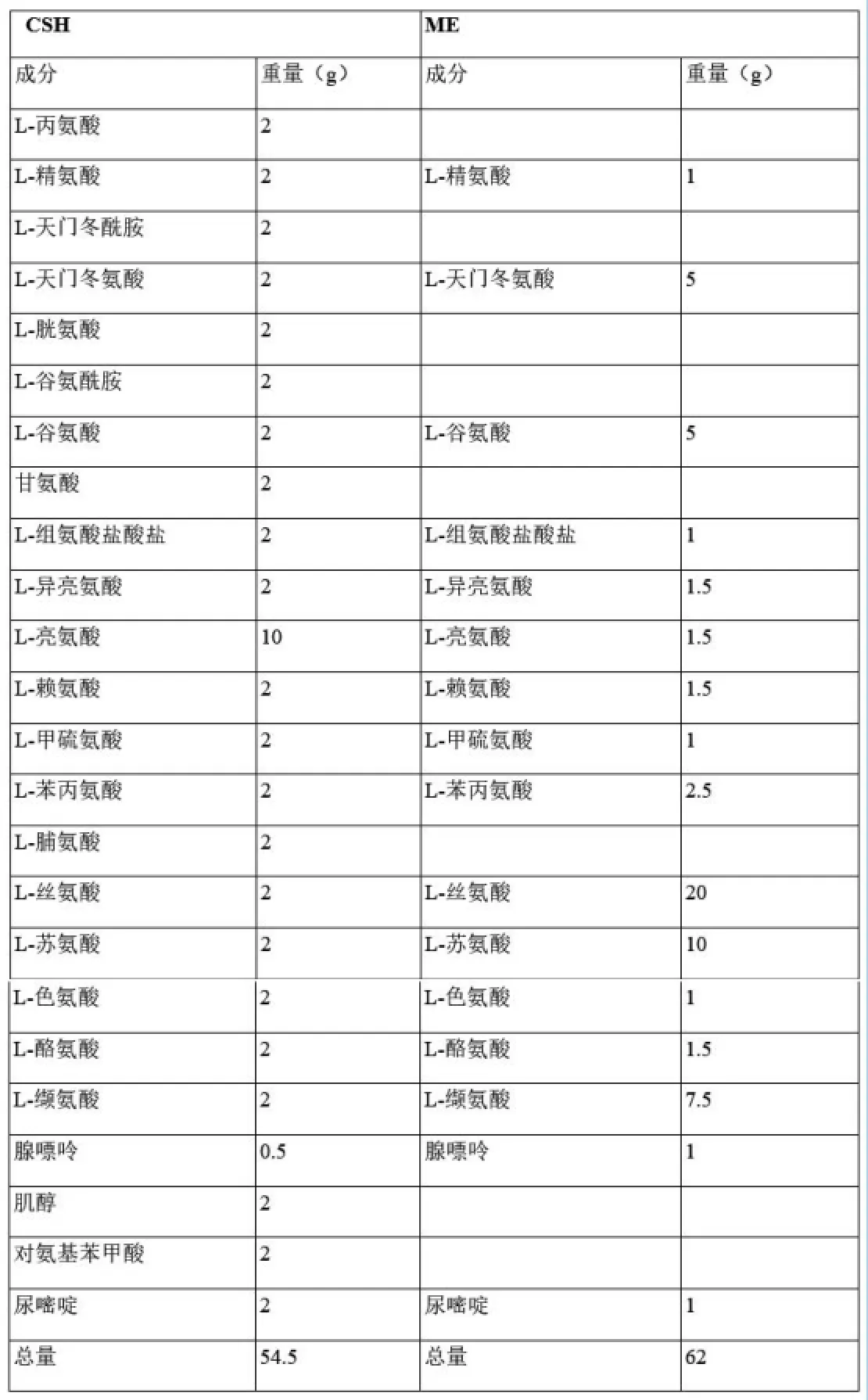
表3 CSH及ME培养基中氨基酸组分列表
1.2.2 酵母质粒转染
划出酵母菌到 YPD 琼脂板上,放在 30℃恒温培养箱长两天后取出琼脂板。挑单克隆到2 mL YPD液体培养基中,在 30℃摇过夜。测定过夜菌液的OD值,并把浓度稀释到OD600 = 0.25。摇大约4 h左右,使菌液OD600大约等于0.8,测定OD值。将每个转染用1.5 mL离心管离心(13000 rpm/ min,1 min)1 mL酵母菌液,并去除上清,将沉淀用1 mL 0.1 M醋酸锂重悬,离心13000 rpm/min,1 min,去除上清。随后将沉淀再用100 μL 0.1 M醋酸锂重悬,这时得到的就是感受态酵母。取变性蛙鱼精子DNA(其中每个转染需加入5 μL),在100℃金属加热器煮5 min并立刻放在冰上。随后在先前制备好的100 μL感受态酵母中按顺序加入0.5 μg质粒DNA,5 μL蛙鱼精子DNA,350 mL PLATE Mix。间歇震荡直到完全混匀。在30℃摇床中孵育30 min。然后在42℃水浴中加热10 min。离心并去除上清。用100 μL ddH2O重悬酵母沉淀,并涂到选择性培养板上。
1.2.3 酵母菌株生长实验
首先准备好无菌的平底96孔板,先在每个孔中加入200 μL符合实验要求的培养基,按照顺序挑单克隆溶在做好标记的孔中,在30℃恒温培养箱中培养48 h。准备一次性无菌96孔板,用排枪吸取80 μL灭菌水依次放到96孔板中,6列。随后按照1:5梯度稀释:用排枪先混匀已经培养了48 h的酵母菌,然后吸取20 μL到第一排,混匀一下然后吸取20 μL到第二排,依次进行到第6排。这是五倍浓度梯度稀释菌液。接下来点板,事先准备好将要用的培养板,从梯度稀释浓度最低的那一排开始,用排枪依次吸取5 μL菌液点到培养板上。然后把培养板放回培养箱,在30℃培养2~3天。最后在成像仪上拍照。
1.2.4 酵母蛋白的蛋白质印记
将用于检测TORC1活性所制备的样品裂解后(见1.2.1),用12% SDS-PAGE电泳并转移到 PVDF 膜上,用 5%牛奶在试问中封闭 0.5 h,一抗(用1%的牛奶按1:1000稀释)放置在 4oC下孵育过夜,用 PBST 洗膜4次,每次10分钟。再用二抗(用1%牛奶按1:20000稀释)封闭并在室温下孵育1 h,用 PBST 洗膜5次,每次5分钟。洗膜完毕之后用化学发光液均匀地浸湿膜,大约1-2分钟,随后放在在成像仪里成像适当的时间,最后处理图像。
1.2.5 统计学处理
所有的数据最后都用Mean ± SEM即平均值±标准差表示。统计分析用 GraphPad Prism 5 软件来进行并制作图表。两组数据之间的统计采用t检验,多组数据之间的运用 One-way ANOVA进行比较,并认为p < 0.05 时具有统计学意义。
2 结果
2.1 Elongator突变体在低浓度氨基酸条件下显示过度生长特性,并且这种过度生长可以被雷帕霉素抑制
我们从酵母全基因组缺失库里选取了Elongator复合物的突变体菌株来进行实验,不同亚基缺失相对应的突变体分别是Δelp1﹑Δelp2﹑Δelp3﹑Δelp4﹑Δelp5和Δelp6。我们以野生型酵母菌株WT作为阴性对照,分别在氨基酸富足的培养基CSH﹑低浓度氨基酸培养基ME上进行生长实验。我们发现,在CSH上WT与Elongator突变体都可以生长良好,但是在ME培养基上,WT菌株的生长受到了抑制,这是因为细胞能够感知低浓度氨基酸从而停止生长。与WT菌株不同,Elongator突变体似乎可以忽略低浓度氨基酸信号,仍然持续生长,表现出了过度生长的表型。由于TORC1复合物是细胞中感知氨基酸信号并调控细胞生长的重要机制,为了鉴定这种过度生长是否和TORC1信 号通路相关,我们考察了TORC1抑制剂雷帕霉素对这种过度生长的影响。当我们在低浓度氨基酸培养基ME中加入雷帕霉素后,我们发现Elongator突变体的这种过度生长可以被抑制。这个实验结果暗示Elongator突变体的过度生长与TORC1信号通路相关。

图1 Elongator突变体在低浓度氨基酸条件下显示过度生长的特性,并且这种过度生长可以被雷帕霉素抑制
WT和Elongator突变体在营养富足(CSH)培养基,低浓度氨基酸(ME)培养基和含5 μg/L 雷帕霉素的ME培养基上的生长实验,其中菌液分别被五倍浓度梯度稀释后点在上述三种培养板上。
2.2 Elongator突变体在低浓度氨基酸条件下通过激活TORC1的活性导致过度生长
从上述实验结果中我们发现雷帕霉素可以抑制Elongator突变体的过度生长。由于雷帕霉素是TORC1的特异性抑制剂,我们认为野生型Elongator复合物可能具有抑制TORC1活性的功能。所以当Elongator复合物的亚基缺失导致突变时,就解除了对TORC1活性的抑制,从而导致TORC1活性升高,细胞过度生长。为了验证这个猜想,我们需要检测Elongator突变体中TORC1的活性。TORC1可以通过磷酸化激活其下游靶标分子——核糖体蛋白S6。当TORC1活性增强时,其下游S6蛋白的磷酸化水平也会提高,所以可以根据S6蛋白的磷酸化水平来检测TORC1的活性。我们采用免疫印迹检测了不同Elongator亚基缺失菌株在低浓度氨基酸条件下S6蛋白的磷酸化水平。图2显示ELP1﹑ELP2﹑ELP3﹑ELP4﹑ELP5﹑ELP6基因缺失菌株在低浓度氨基酸条件下,TORC1的活性都要高于WT酵母菌株。统计学分析表明,Δelp1﹑Δelp2﹑Δelp3﹑Δelp4﹑Δelp5和Δel6的实验组与WT相比是有统计学意义的。以上结果说明,与WT菌株不同,Elongator突变体在低浓度氨基酸的条件下仍能保持较高的TORC1活性,从而导致细胞过度生长。

图2 Elongator突变体在低浓度氨基酸条件下仍保持较高的TORC1活性
(A)在低浓度氨基酸条件下检测WT菌株与ELP1和ELP2基因缺失菌株的TORC1的活性。Δelp1和Δelp2实验组(低浓度氨基酸处理3h)与WT对照组(低浓度氨基酸处理3h)相比较,0.001<**P<0.01,***P<0.001有显著性差异,Δelp1和Δelp2实验组(低浓度氨基酸处理6h)与WT对照组(低浓度氨基酸处理6h)相比较,0.001<##P<0.01有显著性差异。(B)在低浓度氨基酸条件下检测WT菌株与ELP3和ELP5基因缺失菌株的TORC1活性,Δelp3和Δelp5实验组(低浓度氨基酸处理3h)与WT对照组(低浓度氨基酸处理3h)相比较,*P<0.05有统计学意义,Δelp3和Δelp5实验组(低浓度氨基酸处理6h)与WT对照组(低浓度氨基酸处理6h)相比较,0.001<##P<0.01,###P<0.001有显著性差异。(C)低浓度氨基酸条件下检测WT菌株与ELP4和ELP6基因缺失菌株的TORC1活性。Δelp4和Δelp6实验组(低浓度氨基酸处理3h)与WT对照组(低浓度氨基酸处理3h)相比较,0.001<**P<0.01,***P<0.001有显著性差异,Δelp4和Δelp6实验组(低浓度氨基酸处理6h)与WT对照组(低浓度氨基酸处理6h)相比较,0.001<##P<0.01,###P<0.001有显著性差异。作图及方差分析均用GraphPad Prism5软件完成,数据来源于3次实验结果,误差线为标准方差。
2.3 在低浓度氨基酸条件下Elongator突变体体内的自噬可以被抑制
由于TORC1活性的变化可以影响体内的自噬过程,所以,我们设计实验来观察Elongator突变体体内的自噬通路在低浓度氨基酸条件下是否有所改变。我们利用一个自噬检测体系——一个由ATG8启动子驱动的GFP-ATG8表达质粒。当自噬被诱导时,GFP-ATG8表达;当自噬进一步进行时,ATG8蛋白被降解,产生自由的GFP蛋白(图3A)。
我们分别在Δelp1﹑Δelp2﹑Δelp3﹑Δelp4﹑Δelp5﹑Δelp6这六种突变菌株和WT中转入GFP-ATG8质粒,并通过检测突变体及WT酵母菌株细胞内游离GFP蛋白的表达量来观察自噬水平的变化。将WT菌株在6h的GFP蛋白的表达量设定为1,其他时间点的GFP蛋白的表达量与WT菌株6h的GFP蛋白的表达量的比值即为%Free GFP的值。由WB结果(图3B/3C/3D)可知在低浓度氨基酸条件下,Elongator突变体内的游离GFP蛋白的表达量是明显低于WT菌株的。这说明在低浓度氨基酸条件下, Elongator突变体体内的自噬进程被抑制了。这和Elongator突变体中的高TORC1活性是吻合的。
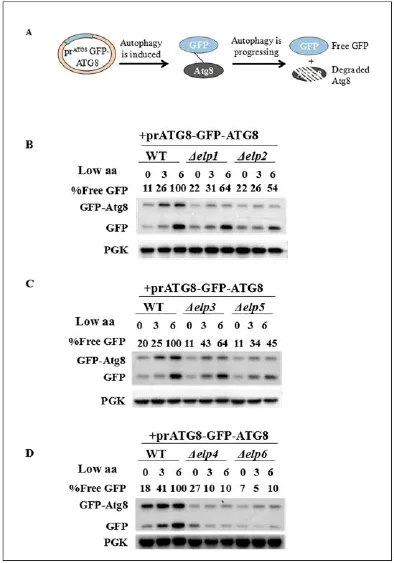
图3.在低浓度氨基酸条件下Elongator突变体体内的自噬可以被抑制
(A)在低浓度氨基酸条件下处理3h和6h之后检测WT菌株与ELP1和ELP2基因缺失菌株的自噬水平。(B)在低浓度氨基酸条件下处理3h和6h之后检测WT菌株与ELP3和ELP5基因缺失菌株的游离GFP蛋白的表达水平。(C)在低浓度氨基酸条件下处理3h和6h之后检测WT菌株与ELP4和ELP6基因缺失菌株的游离GFP蛋白的表达水平。
2.4 Elongator突变体可以特异性忽略低浓度亮氨酸从而导致过度生长
目前已有研究报道显示,TORC1并不是对所有氨基酸的敏感程度都一样,亮氨酸对它的激活格外重要。通过比较CSH和ME培养基的氨基酸成分,我们发现亮氨酸在CSH中的浓度是ME中的10倍以上。因此,我们想进一步考察Elongator突变体是否能特异性感应低浓度亮氨酸。我们在不改变其他氨基酸浓度的情况下将CSH培养基里亮氨酸含量降低为原来的10%,发现和野生型酵母菌株相比,Elongator突变体仍然呈现出过度生长的特性,并且这种过度生长也可以被雷帕霉素所抑制。与低浓度氨基酸条件下十分 相似。所以,我们可以初步得到结论,Elongator突变体可以特异性忽略低浓度亮氨酸从而导致过度生长。

图4.Elongator突变体可以特异性忽略低浓度亮氨酸从而导致过度生长,并且这种过度生长可被雷帕霉素抑制
WT和Elongator突变体在营养富足(CSH)培养基,低浓度亮氨酸培养基(10%LEU)和含5 μg/L 雷帕霉素的低浓度亮氨酸培养基上的生长实验,其中菌液分别被五倍浓度梯度稀释后点在上述三种培养板上。
2.5 Elongator突变体可以通过特异性忽略低浓度亮氨酸来激活TORC1的活性
从上述实验结果中我们发现雷帕霉素可以抑制Elongator突变体在低浓度亮氨酸条件下导致的过度生长。根据上述已有实验结果,我们认为野生型Elongator复合物可能具有特异性感受低浓度亮氨酸从而抑制TORC1活性的功能。所以当Elongator复合物缺失导致突变时,就不能感应细胞内亮氨酸浓度,从而解除了对TORC1活性的抑制。我们同样对低浓度亮氨酸处理之后的酵母菌株进行免疫印迹分析。实验结果图5显示,在低浓度亮氨酸条件下处理3h和6h之后,Elongator突变体的磷酸化S6蛋白的表达量均高于WT菌株,并通过统计学分析表明,具有统计学意义。这说明,在低浓度亮氨酸条件下,Elongator突变体的TORC1活性也是升高的。以上结果说明,Elongator突变体可以通过特异性忽略低浓度亮氨酸从而激活TORC1的活性,导致细胞过度生长。
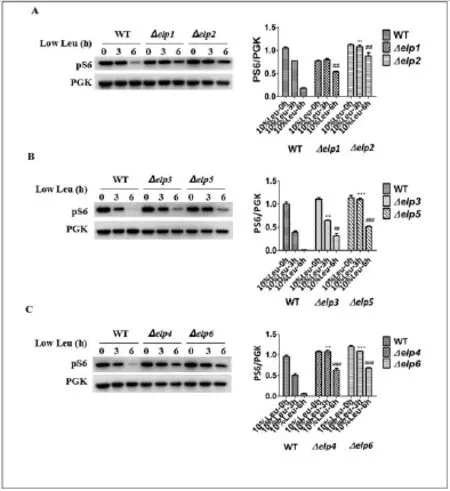
图5.Elongator突变体可通过特异性感受低浓度亮氨酸来激活TORC1的活性
(A)在低浓度亮氨酸条件下检测WT菌株与ELP1和ELP2基因缺失菌株的TORC1的活性。Δelp1和Δelp2实验组(低浓度亮氨酸处理3h)与WT对照组(低浓度亮氨酸处理3h)相比较,0.001<**P<0.01有显著性差异,Δep1和Δelp2实验组(低浓度亮氨酸处理6h)与WT对照组(低浓度亮氨酸处理6h)相比较,0.001<##P<0.01有显著性差异。(B)在低浓度亮氨酸条件下检测WT菌株与Elp3和Elp5基因缺失菌株的TORC1活性。Δelp3和Δelp5实验组(低浓度亮氨酸处理3h)与WT对照组(低浓度亮氨酸处理3h)相比较,0.001<**P<0.01,***P<0.001有统计学意义,Δelp3和Δelp5实验组(低浓度亮氨酸处理6h)与WT对照组(低浓度亮氨酸处理6h)相比较,0.001<##P<0.01,###P<0.001有显著性差异。(C)低浓度亮氨酸条件下检测WT菌株与ELP4和ELP6基因缺失菌株的TORC1活性,Δelp4和Δelp6实验组(低浓度亮氨酸处理3h)与WT对照组(低浓度亮氨酸处理3h)相比较,0.001<**P<0.01,***P<0.001有显著性差异,Δelp4和Δelp6实验组(低浓度亮氨酸处理6h)与WT对照组(低浓度亮氨酸处理6h)相比较, ###P<0.001有显著性差异。作图及方差分析均用GraphPad Prism5软件完成,数据来源于3次实验结果,误差线为标准方差。
2.6 Elongator突变体可以特异性忽略低浓度亮氨酸从而抑制体内的自噬
我们接下来来考察低浓度亮氨酸会不会影响Elongator突变体内的自噬。选用上述所说的已转入GFP-ATG8质粒的WT菌株和Elongator突变体来进行实验,并通过检测细胞内游离GFP蛋白的表达量来观察自噬水平的变化。同样的将WT菌株在6h的GFP蛋白的表达量设定为1,其他时间点的GFP蛋白的表达量与WT菌株6h的GFP蛋白的表达量的比值为%Free GFP的值。由WB结果(图6A/6B/6C)可知在低浓度亮氨酸条件下,Elongator突变体内的游离GFP蛋白的表达量是明显低于WT菌株的。这说明Elongator突变体可以通过特异性忽略低浓度亮氨酸来抑制体内自噬进程。这与上述实验结果Elongator突变体可特异性忽略低浓度亮氨酸从而导致高TORC1活性是相吻合的。
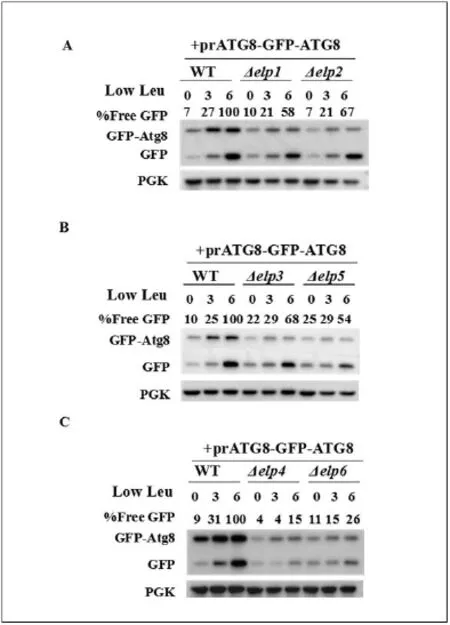
图6.Elongator突变体可通过特异性感受低浓度亮氨酸来抑制体内自噬过程
(A)在低浓度亮氨酸条件下处理3h和6h之后检测WT菌株与ELP1和ELP2基因缺失菌株的游离GFP蛋白的表达水平。(B)在低浓度亮氨酸条件下处理3h和6h之后检测WT菌株与ELP3和ELP5基因缺失菌株的游离GFP蛋白的表达水平。(C)在低浓度亮氨酸条件下处理3h和6h之后检测WT菌株与ELP4和ELP6基因缺失菌株的游离GFP蛋白的表达水平。
3 讨论
包含6个亚基(Elp1-6)的Elongator复合物被报道在许多细胞生理活动中都发挥作用,包括转录﹑蛋白乙酰基化﹑DNA的去甲基化﹑包外分泌以及tRNA修饰。然而近年来,越来越多的证据显示,Elongator复合物主要是通过调节tRNA的修饰从而来维持翻译的高保真性[7]。已有数个研究显示Elongator复合物参与tRNA摆动位置处尿嘧啶的早期修饰过程。tRNA的第34位核苷酸位于tRNA反密码子的第一位摆动点,此处的核苷酸修饰往往会影响tRNA对密码子的识别。在酿酒酵母中,11个tRNA反密码环的第34位尿苷酸被修饰成5-甲氧羧甲基尿苷(mcm5U),5-氨基酰胺甲基尿苷(ncm5U)以及二硫-5-甲氧羧甲基尿苷(mcm5s2U)。而有研究表明mcm5U 和 ncm5U会提高尿苷酸与腺苷酸或鸟苷酸配对的效率。
Elongator复合物亚基的突变会导致神经退行性疾病,比如家族性自主神经异常(FD)[21]﹑肌萎缩侧索硬化症(ALS)[22]以及罗兰多癫痫[23]。尽管我们认为Elongator复合物在神经退行性疾病中的角色与它调控着许多细胞进程有关,但是关于此复合物究竟是直接调控多种细胞进程还是通过调控一个进程从而导致不同的下游效应仍然不清楚。有报道显示,提高细胞内tRNALysUUU和 tRNAGluUUc 这两种被修饰的tRNA水平可绕过转录和胞外分泌过程中对Elongator复合物的需求。而且最近在秀丽隐杆线虫中的研究发现Elongator并不是一个直接的微管蛋白乙酰转移酶,而是通过提高AAA密码子的数量并进行tRNA修饰在翻译水平上调节微管蛋白乙酰转移酶的表达水平。一般认为依赖Elongator复合物进行tRNA修饰的过程出错会通过两种不同的方式来扰乱转录,一种是因为赖氨酸丰富蛋白如核糖体蛋白的翻译减少而导致整体蛋白质的合成减少,另一种是导致翻译的不精确以及蛋白质的错误折叠。Elongator参与的一些其他细胞生理过程也可能与它对翻译的调控有关。
在我们的研究中发现,酵母菌株的Elongator复合物中任意一个亚基发生缺失突变都会导致在氨基酸缺乏条件下TORC1活性的增加以及自噬的降低。这说明Elongator复合物与氨基酸介导的TORC1信号通路存在着一定的联系。TORC1信号通路在酵母和哺乳动物细胞里是高度保守的,其中哺乳动物细胞里的RagA/B蛋白相对应的酵母里的同源蛋白是Gtr1p,RagC/D相对应的酵母里的同源蛋白是Gtr2p,并且RagA/B和RagC/D以及Gtr1p和Gtr2p都是以异二聚体的形式存在[20]。当环境中的氨基酸含量充足时,TORC1的活性就会被Rag/Gtr复合物激活,从而激活下游的一些信号通路比如翻译来促进细胞的生长。当环境中的氨基酸受到限制时,GATOR1/SEACIT复合物作为RagA/Gtr1的GTPase活化蛋白(GTPase-activing protein,GAP)会使RagA/Gtr1处于非活化状态[19],从而来抑制TORC1的活性并诱导自噬。我们的实验结果显示,Elongator发生缺失突变的酵母菌株不能通过感应低浓度氨基酸信号来降低TORC1的活性。所以我们认为Elongator对于细胞感应氨基酸信号分子并作出相应的应答是必不可少的。目前普遍认为能够感应氨基酸水平对于维持细胞的正常生长是至关重要的[17]。而且越来越多的证据显示氨基酸介导的信号通路失调将会造成细胞生长和营养因子信号脱节,导致许多疾病的产生,包括癌症﹑糖尿病﹑组织肥大﹑神经退化以及加速老化等。因为Elongator在维持翻译的准确性里扮演着必不可少的角色,所以Elongator很有可能通过抑制TORC1的活性来防止因过度翻译而产生错误折叠的蛋白。尽管关于Elongator复合物是通过怎样的分子机制来调节氨基酸介导的TORC1信号通路仍然不是很清楚,但是我们发现了一个有趣的现象,Elongator发生缺失突变的酵母菌株在只缺乏亮氨酸的条件下也显示出较高的TORC1活性。目前已有相关报道表明单一亮氨酸足便以激活TORC1。在哺乳动物细胞里亮氨酰-tRNA合成酶(leucyl-tRNA synthetase,LRS)可作为细胞内亮氨酸的感应器[24],通过与RagD相互作用来激活mTORC1。在酒酿酵母中,Elongator可以修饰亮氨酸转运体反密码子环的第34位核苷酸形成tRNALeuncm5UmAA,而亮氨酸转运体很有可能是作为一个中间分子调节调细胞内亮氨酸水平和TORC1活性两者之间的关系,当然这还需要更多的实验去证明。
4 结论
本课题运用生物化学及遗传基因学等方法探讨Elongator复合物在低浓度氨基酸条件下对TORC1活性的影响。我们发现Elongator突变体在低浓度氨基酸条件下显示过度生长的特性,并且这种过度生长可被TORC1抑制剂雷帕霉素(Rapmycine)所抑制。免疫印迹结果显示Elongator突变体在低浓度氨基酸条件下TORC1活性上升,而自噬进程被抑制。进一步实验显示Elongator 突变体可特异性忽略低浓度亮氨酸而激活TORC1,抑制自噬,从而持续生长。我们认为野生型Elongator复合物有抑制TORC1活性的功能,从而防止因TORC1活性过高导致过度翻译而产生错误折叠的蛋白。
[1] Otero G, Fellows J, LI Y, et al.Elongator, a multisubunit component of a novel RNA polymerase II holoenzyme for transcriptional elongation [J].Mol Cell, 1999, 3(1): 109-118.
[2] Dahmus M E.Reversible phosphorylation of the C-terminal domain of RNA polymerase II [J].J Bio Chem, 1996, 271(32): 19009-19012.
[3] Winkler G S, Petrakis T G, Ethelberg S, et al.RNA polymerase II elongator holoenzyme is composed of two discrete subcomplexes [J].J Bio Chem, 2001, 276(35): 32743-32749.
[4] LI Y, Takagi Y, Jiang Y W, et al.A multiprotein complex that interacts with RNA polymerase II elongator [J].J Bio Chem, 2001, 276(32): 29628-29631.
[5] Hawkes N A, Otero G, Winkler G S, et al.Purification and characterization of the human Elongator complex [J].J Bio Chem, 2002, 277(4): 3047-3052.
[6] Solinger J A, Paolinelli R, Kloss H, et al.The Caenorhabditis elegans Elongator Complex Regulates Neuronal alpha-tubulinAcetylation [J].Plos Genet, 2010, 6(1): e1000820.
[7] Frohloff F, Jablonowski D, Fichtner L, et al.Subunit communications crucial for the functional integrity of the yeast RNA polymerase II elongator (gamma-toxin target (TOT)) complex [J].J Bio Chem, 2003, 278(2): 956-961.
[8] Ruan G X, Kazlauskas A.Focus on Molecules: Akt (PKB) [J].Exp Eye Res, 2011, 93(5): 570-571.
[9] Krogan N J, Greenblatt J F.Characterization of a six-subunit holo-elongator complex required for the regulated expression of a group of genes in Saccharomyces cerevisiae [J].Mol Cell Biol, 2001, 21(23): 8203-8212.
[10] Versees W, De G S, Van Lijsebettens M.Elongator, a conserved multitasking complex? [J].Mol Microbiol, 2010, 76(5): 1065-1069.[11] Shimobayashi M, Hall M N.Multiple amino acid sensing inputs to mTORC1[J].Cell Res, 2016, 26(1): 7-20.
[12] Conrad M, Schothorst J, Kankipati H N, et al.Nutrient sensing and signaling in the yeast Saccharomyces cerevisiae [J].FEMS microbiol Rev, 2014, 38(2): 254-299.
[13] Efeyan A, Comb W C, Sabatini D M.Nutrient-sensing mechanisms and pathways [J].Nature, 2015, 517(7534): 302-310.[14] Yerlikaya S, Meusburger M, Kumari R, et al.TORC1 and TORC2 work together to regulate ribosomal protein S6 phosphorylation in Saccharomyces cerevisiae[J].Mol Biol Cell , 2016, 27(2): 397-409.
[15] Bond P.Regulation of mTORC1 by growth factors, energy status, amino acids and mechanical stimuli at a glance [J].J Int Soc Sport Nutr, 2016, 13(1): 8.
[16] Jin M Y, Klionsky D J.The amino acid transporter SLC38A9 regulates MTORC1 and autophagy [J].Autophagy, 2015, 11(10): 1709-1710.
[17] Meijer A J, Lorin S, Blommaart E F, et al.Regulation of autophagy by amino acids and MTOR-dependent signal transduction [J].Amino acids, 2015, 47(10): 2037-2763.
[18] Kim J, Kim E.Rag GTPase in amino acid signaling [J].Amino acids, 2016, 48(4): 915-928.
[19] Peli G M P, Sardu A, Panchaud N, et al.Amino Acids Stimulate TORC1 through Lst4-Lst7, a GTPase-Activating Protein Complex for the Rag Family GTPase Gtr2 [J].Cell Rep, 2015, 13(1): 1-7.
[20] Sekiguchi T, Kamada Y, Furuno N, et al.Amino acid residues required for Gtr1p-Gtr2p complex formation and its interactions with the Ego1p-Ego3p complex and TORC1 components in yeast [J].Genes Cells, 2014, 19(6): 449-463.
[21] Anderson S L, Coli R, Daly I W, et al.Familial dysautonomia is caused by mutations of the IKAP gene [J].Am J Hum Genet, 2001, 68(3): 753-758.
[22] Simpson C L, Lemmens R, Miskiewicz K, et al.Variants of the elongator protein 3 (ELP3) gene are associated with motor neuron degeneration [J].Hum Mol Genet, 2009, 18(3): 472-481.
[23] Strug L J, Clarke T, Chiang T, et al.Centrotemporal sharp wave EEG trait in rolandic epilepsy maps to Elongator Protein Complex 4 (ELP4) [J].Eur J Hum Genet, 2009, 17(9): 1171-1181.
[24] Bonfils G, Jaquenoud M, Bontron S, et al.Leucyl-tRNA Synthetase Controls TORC1 via the EGO Complex [J].Mol Cell, 2012, 46(1): 105-110.
The Ef f ec of Elongator Complex on TORC1 in Condition with Low Concentration Amino Acid
He Ge, Teng Xinchen
(College of Pharmaceutical Sciences, Soochow University, 215000)
Aim: To investigate the effect of Elongator complex on TORC1 activity in response to low amino acids.Methods: Determine the growth level of Elongator mutant yeast in low amino acids and low leucine by growth assays; Determine TORC1 activity by immunoblotting phosphorylated ribosomal protein S6; Transform GFP-ATG8 plasmid in Elongator mutant and the wild type yeast cells, and determine the autophagy flux by quantifying the free GFP.Results: Elongator mutant yeast show overgrowth phenotype in low amino acids and such overgrowth phenotype can be abolished by TORC1 inhibitor rapamycin; Elongator mutant cells show elevated TORC1 activity and decreased autophagy flux; Further experiments show that the Elongator mutant cells specifically ignore low leucine signal to maintain high TORC1 activity and inhibit autophagy, thus keep growing.Conclusion: Elongator complex can inhibit TORC1 activity and promote autophagy in response to amino acid signal.It is hypothesized that Elongator complex may inhibit TORC1 signaling pathway to ensure translational fidelity.
Elongator complex; TORC1 activity; amino acid-sensing
R341 [Document Code] A
10.11967/2017150207
R341
A DOI: 10.11967/2017150207
江苏省青年基金(BK2014318)
何格(1992-),女,硕士研究生,肿瘤药理学。
滕昕辰(1980-),女,特聘副教授,肿瘤药理学。E-mail:xcteng@suda.edu.cn

