海芋石油醚部位对肝癌H22荷瘤小鼠的抑制及诱导凋亡作用研究
丁韩洁 朱燕 刘祖望 许梦捷 黄真 程汝滨 钟晓明
浙江中医药大学药学院 杭州 310053
海芋石油醚部位对肝癌H22荷瘤小鼠的抑制及诱导凋亡作用研究
丁韩洁 朱燕 刘祖望 许梦捷 黄真 程汝滨 钟晓明
浙江中医药大学药学院 杭州 310053
[目的]探讨海芋石油醚部位对肝癌H22荷瘤小鼠的抑制及诱导凋亡作用。[方法]建立小鼠肝癌H22移植瘤模型,随机分为模型组,顺铂组和海芋石油醚部位0.8 g·kg-1、0.4 g·kg-1、0.2 g·kg-1剂量组。观察小鼠肿瘤生长情况,测定抑瘤率、胸腺指数、脾脏指数,H&E染色法观察肿瘤病理形态,流式细胞术检测H22肿瘤细胞凋亡情况,Western blot检测凋亡蛋白pro-caspase-8、pro-caspase-3、Bcl-2和Bax表达情况。[结果]海芋石油醚部位0.8 g·kg-1剂量组抑瘤率达31.41%;H&E染色法结果表明,海芋石油醚部位能使H22肿瘤细胞出现明显的凋亡形态改变;流式细胞术实验结果表明,随海芋石油醚部位给药剂量的增加,H22肿瘤细胞凋亡率也增加;Western blot结果显示,海芋石油醚部位能下调pro-caspase-8和procaspase-3,增加Bax/Bcl-2的比例。[结论]海芋石油醚部位能抑制H22荷瘤小鼠肿瘤的生长,其机制与诱导肿瘤细胞凋亡有关。
海芋石油醚部位;肝癌;H22;pro-caspase-8;pro-caspase-3;Bcl-2家族蛋白;细胞凋亡
目前,肝癌是全世界最常见的恶性肿瘤之一,发病率逐年上升,其死亡率已逐渐接近发病率[1]。在我国肝癌的发病率和死亡率也常年居高不下,发病人数和死亡人数已占据全世界的50%[2]。肝癌的潜伏期较长,不易被察觉,一旦发病进展十分迅速,因此大多数患者被确诊时,已进入肝癌晚期,常伴有恶性腹水,严重影响患者的生活质量[3-5]。海芋[Alocasia macrorrhiza (L.)Schott]为天南星科海芋属植物海芋的干燥根茎[6],本课题组前期研究发现,海芋石油醚部位对人源肝癌细胞HepG-2、Bel-7402有较好的抑制作用,且呈剂量依赖性,作用48h的IC50分别为347.0μg·mL-1、353.0μg·mL-1。故本研究对海芋石油醚部位体内抗肝癌H22的药效及其初步机制作进一步探讨。
1 材料
1.1 实验药材 海芋原植物从重庆、贵州地区自采,经浙江中医药大学中药资源研究所陈孔荣副教授鉴定为天南星科海芋属植物海芋[Alocasia macrorrhiza (L.)Schott]。
1.2 实验动物 SPF级ICR雄性小鼠,体质量(25±2) g,由浙江中医药大学实验动物中心提供,动物许可证号:SCXK(沪)2013-2016。独立隔离饲养,环境温度为22℃~25℃,相对湿度45%~70%,昼夜明暗交替时间12h,自由进食饮水。
1.3 细胞株 小鼠肝癌H22细胞株由中科院上海药物研究所提供,浙江中医药大学动物实验中心培养并保存。
1.4 主要仪器设备 BX51正置显微镜、DP72显微镜摄影仪(奥林巴斯有限公司);KD-BM生物组织包埋机、KD-BL包埋机冷冻台(浙江金华市科迪仪器设备有限公司);HM430滑动切片机(赛默飞世尔科技有限公司);DZKW-4电热恒温水浴锅(余姚市上通温控仪表厂);BS124S型电子分析天平(赛多利斯科学仪器北京有限公司);TD4台式低速离心机(盐城市凯特实验仪器有限公司);细胞超净工作台 (苏州净化设备厂);IC1000细胞计数仪 (上海睿钰生物科技有限公司);BECKMAN流式细胞仪(美国贝克曼库尔特有限公司);Odyssey双色红外激光成像系统 (美国LICOR公司)。
1.5 主要试剂 生理盐水(浙江莎普爱思药业股份有限公司,批号:120715-3);苏木精(上海顺强化学试剂有限公司,批号:20120220);伊红(上海三爱思试剂有限公司,批号:20111026);甲醛(衢州巨化试剂有限公司,批号:20130901);95%乙醇(杭州长征化学试剂有限公司,批号:20110617);二甲苯(杭州化学试剂有限公司,批号:20120116);中性树胶(中国上海标本模型厂,批号:20090610);高效切片石蜡(上海华灵康复器械厂,批号:20110107);台盼蓝(吉诺生物技术发展有限公司,批号:20140901);顺铂(齐鲁制药有限公司,批号:1WA2A1405032B);FITC偶联Annexin-V凋亡检测试剂盒(BD BIOSCIENCES PHARMINGEN,批号:6033840);凯基全蛋白提取试剂盒(江苏凯基生物技术股份有限公司,批号:20161021);BCA蛋白定量检测试剂盒 (北京康为生物科技有限公司,批号:10121);5×蛋白上样缓冲液 (杭州诺森德生物技术有限公司,批号:LMYG 15502);预染蛋白Marker(美国赛默飞世尔科技有限公司,批号:00135995);β-actin鼠抗单克隆抗体 (美国Abcam公司,批号:ab13575、ab32516、ab76122、ab8226);caspase-8兔抗人多克隆抗体(美国Abcam公司,批号:ab25901);Bax兔抗人单克隆抗体(美国Abcam公司,批号:ab32503);Bcl-2兔抗人单克隆抗体(美国Abcam公司,批号:ab182858);caspase-3兔抗人单克隆抗体 (美国CST公司,批号:49662S、5174P);山羊抗兔荧光二抗、山羊抗鼠荧光二抗 (美国LI-COR公司,批号:C50113、C50331)。
2 方法
2.1 海芋的提取方法 原植物海芋根茎,洗净,切薄片,平铺于烘箱中,60℃烘干。取干燥海芋根茎薄片6kg,加10倍量75%乙醇,浸泡2h,85℃回流提取3次,每次3h,滤过,合并3次滤液,减压浓缩,回收乙醇至无醇味,石油醚(v:v=1:1)萃取3次,减压浓缩回收石油醚。干燥至恒重,备用。
2.2 ICR小鼠H22肿瘤模型的建立 参考相关文献[7],将H22肿瘤细胞接种于ICR小鼠腹腔内,待小鼠长出腹水(约8~9d左右),用1mL注射器腹腔穿刺抽取H22腹水瘤,加入适量生理盐水,配制成细胞悬液,细胞计数并测定细胞活力,活细胞率达95%以上。调整细胞数为1×107/mL以备用。75%乙醇消毒小鼠的左腋,皮下接种H22肿瘤细胞悬液0.2mL/只。小鼠接种当天记为第0d。
2.3 分组及处理 小鼠接种24h后,随机分为5组,每组10只,即模型组、顺铂组(2mg·kg-1)、海芋石油醚部位0.8g·kg-1剂量组、海芋石油醚部位0.4g·kg-1剂量组和海芋石油醚部位0.2g·kg-1剂量组。顺铂组于H22肿瘤接种后第5d开始腹腔注射给药,其余各组于接种后第1d开始灌胃给药,0.1mL·10g-1,模型组给予等体积生理盐水灌胃处理,1次/d,连续12d。每天观察小鼠的一般状况,记录体重,并用游标卡尺测瘤体的最长径(a)和最短径(b),按公式(1)计算肿瘤体积。于末次给药后禁食12h,称取体重,取出肿瘤、胸腺、脾脏,生理盐水洗涤后滤纸吸干,分别称重,按公式(2~4)分别计算抑瘤率、胸腺指数和脾脏指数。
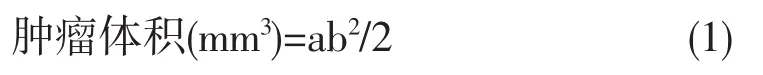
肿瘤抑制率(%)=(模型组平均肿瘤重量-给药组平均

2.4 H&E染色法观察肿瘤组织病理形态 取肿瘤组织于4%多聚甲醛中固定,常规石蜡包埋,切片(4μm/片),H&E染色[8]具体操作步骤如下:二甲苯脱蜡10min,2次;无水乙醇、95%乙醇、70%乙醇依次浸泡2min,然后蒸馏水洗 2min;Gill苏木素染液浸染10min;蒸馏水水洗数秒;0.5%盐酸乙醇分化;流水浸洗;温水蓝化2~3min;95%乙醇1min;0.5%伊红乙醇染液1min;80%乙醇适当分化1min;95%乙醇脱水3min,2次;无水乙醇脱水3min,2次;二甲苯透明5min,2次,用中性树胶以盖片封片,贴标签[8-9],于显微镜下(400×)观察肿瘤形态学的变化。
2.5 流式细胞术检测细胞凋亡率 取肿瘤组织,轻微研磨,加入少量PBS润洗,过200目筛网,2000rpm离心5~10min,洗涤细胞,按照BD公司FITC偶联Annexin-V凋亡检测试剂盒说明书操作,将细胞重悬于300 μL Binding Buffer中,加入5μL Annexin VFITC,混匀后,避光,室温孵育15min,上机前5min再加入5μL的PI染色和200μL的1×Binding Buffer,使用BECKMAN流式细胞仪检测细胞凋亡率。
2.6 Western blot法检测肿瘤细胞凋亡蛋白 取肿瘤组织,按全蛋白提取试剂盒说明书制备蛋白提取液。按BCA蛋白定量试剂盒说明书定量蛋白并用dH2O调整蛋白浓度一致,加入5×上样缓冲液后100℃变性10min,室温冷却后,-20℃保存。取40μg蛋白进行SDS-PAGE电泳100 min,电泳结束后电转100min,将PVDF膜用5%的脱脂奶粉于室温封闭2h,用TBST洗3次,每次5min,封闭一抗,4℃过夜,再用TBST洗3次,每次5 min,封闭二抗,在室温下避光孵育2h,TBST洗3次,每次10 min,应用Odyssey荧光扫描成像系统对蛋白条带的灰度值进行分析,将β-actin作为内参,用目的条带与β-actin条带灰度值的比值作为目的蛋白的相对表达量。
2.7 统计学方法 应用SPSS 17.0软件进行数据分析,数据以平均数±标准差±s)和百分数表示,多组间均数比较采用方差分析,进一步两两比较采用LSD-t检验。P<0.05时认为差异有统计学意义。

图1 海芋石油醚部位对荷H22小鼠体重(A)、肿瘤体积(B)的影响Fig.1 Effects of petroleum ether layer of Alocasia macrorrhiza on body weights(A)and tumor volumes(B)of H22-bearing mice
3 结果
3.1 海芋石油醚部位对小鼠一般状况的影响 分组前荷H22小鼠身形匀称 (瘤体隆起处除外),动作敏捷,反应灵活,皮毛光滑,进食饮水正常。分组后给药起,随着实验时间的延长,顺铂组小鼠最先出现精神萎靡、饮食活动减少、聚集一团、皮毛失去光泽、尿液变黄等现象。模型组瘤体最大,活动减少,体热,嗜睡。海芋石油醚部位各剂量组小鼠的精神状态较顺铂组和模型组有所改善。
3.2 海芋石油醚部位对荷H22小鼠体重与肿瘤体积的影响 由图1A可见,接种后,模型组小鼠体重随肿瘤迅速生长而增长,海芋石油醚部位各剂量组则从第6d起出现体重增长放缓的趋势,顺铂组自第5d给药起即对小鼠体重增长起显著的抑制作用。第13d,顺铂组和海芋石油醚部位各剂量组小鼠体重均低于模型组,其中,顺铂组小鼠体重显著低于模型组,差异具有统计学意义(P<0.01)。由图1B可见,自第4d起,各组小鼠肿瘤体积迅速增长,模型组第8d开始肿瘤体积趋于平稳,海芋石油醚部位各剂量组小鼠肿瘤体第6d开始肿瘤体积相对增长较缓,第13d,顺铂组和海芋石油醚部位0.4g·kg-1、0.8g·kg-1剂量组肿瘤体积均小于模型组,差异具有统计学意义 (P<0.05,P< 0.01)。由图2肿瘤实物图可见,第13d顺铂组和海芋石油醚部位0.4g·kg-1、0.8g·kg-1剂量组肿瘤体积均小于模型组。
3.3 海芋石油醚部位对荷H22小鼠脏器指数的影响由表1可知,与模型组相比,顺铂组的脾脏指数、胸腺指数均显著降低,差异有统计学意义(P<0.01),海芋石油醚部位各剂量组小鼠脾脏指数、胸腺指数与模型组相比无统计学差异(P>0.05);与顺铂组相比,海芋石油醚部位各剂量组小鼠脾脏指数、胸腺指数均显著升高,差异有统计学意义(P<0.05)。
3.4 海芋石油醚部位对荷H22小鼠抑瘤率的影响
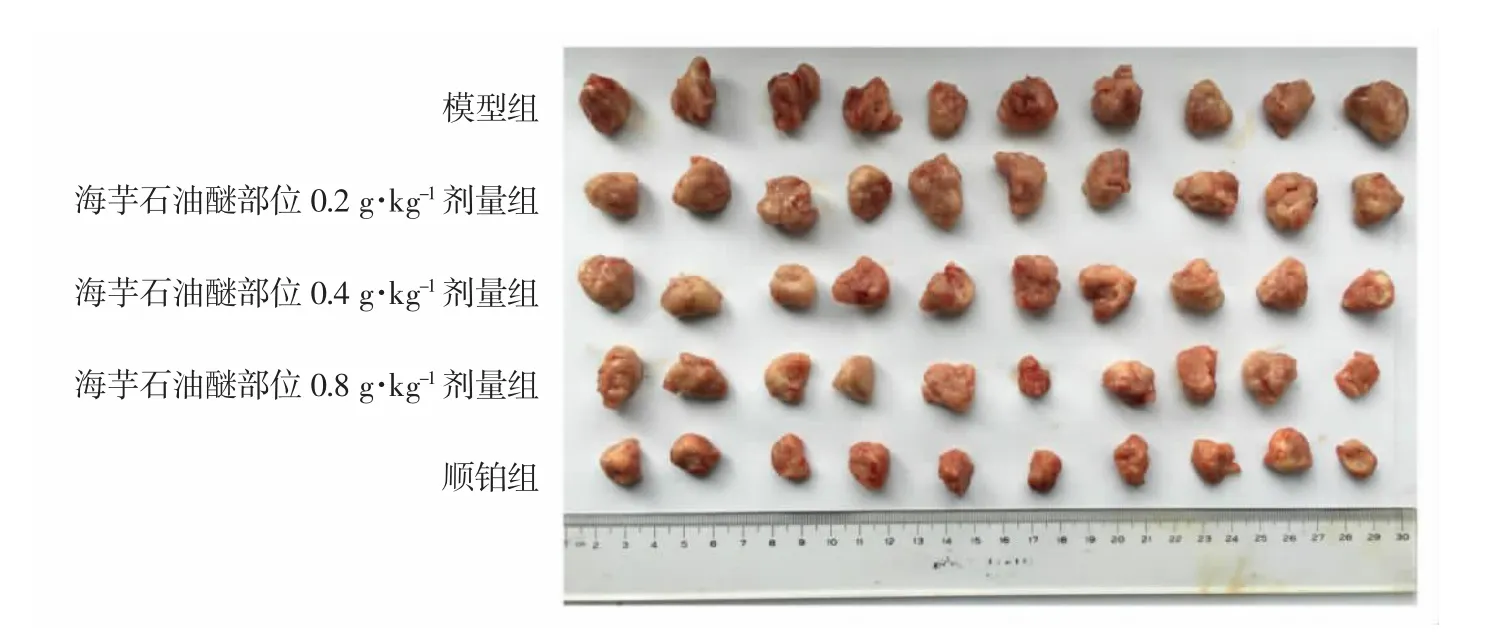
图2 第13d各组小鼠H22肿瘤实物图Fig.2 The tumor tissue photographs of H22-bearing mice in each group on the 13th day
表1 海芋石油醚部位对荷H22小鼠脏器指数的影响(±s,n=10)Tab.1 Effect of petroleum ether layer of Alocasia macrorrhiza on visceral index of H22-bearing mice(±s,n=10)

表1 海芋石油醚部位对荷H22小鼠脏器指数的影响(±s,n=10)Tab.1 Effect of petroleum ether layer of Alocasia macrorrhiza on visceral index of H22-bearing mice(±s,n=10)
注:与模型组比较,**P<0.01;与顺铂组比较,#P<0.05。Note:Compared with model group,**P<0.01;Compared with cisplatin group,#P<0.05.
组别 剂量(g·kg-1) 脾脏指数(mg·g-1) 胸腺指数(mg·g-1)模型组顺铂组-海芋石油醚部位组0.002 0.2 0.4 0.8 11.07±2.29 2.50±0.43**11.01±1.81#10.32±2.59#10.03±2.80#1.09±0.32 0.37±0.12**1.13±0.33#1.19±0.33#1.42±0.43#
由表2可见,与模型组相比,各给药组肿瘤重量均低于模型组,其中,海芋石油醚部位0.4g·kg-1剂量组、海芋石油醚部位0.8g·kg-1剂量组和顺铂组的小鼠瘤重显著降低,差异有统计学意义(P<0.05,P<0.01),抑瘤率分别为19.71%、31.41%和45.70%。
表2 海芋石油醚部位对荷H22小鼠抑瘤率的影响(±s,n=10)Tab.2 Effect of tumor inhibition rate of H22-bearing mice after treated by petroleum ether layer of Alocasia macrorrhiza (±s,n=10)
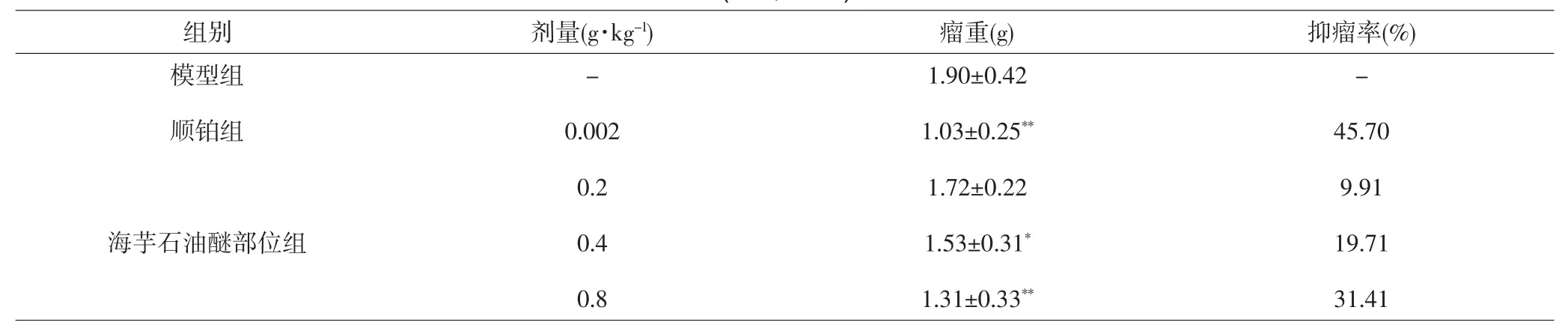
表2 海芋石油醚部位对荷H22小鼠抑瘤率的影响(±s,n=10)Tab.2 Effect of tumor inhibition rate of H22-bearing mice after treated by petroleum ether layer of Alocasia macrorrhiza (±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01。Note:Compared with model group,*P<0.05,**P<0.01.
组别 剂量(g·kg-1) 瘤重(g) 抑瘤率(%)模型组顺铂组--海芋石油醚部位组0.002 0.2 0.4 0.8 1.90±0.42 1.03±0.25**1.72±0.22 1.53±0.31*1.31±0.33**45.70 9.91 19.71 31.41
3.5 海芋石油醚部位对荷H22小鼠实体瘤形态病理学的影响 由图3肿瘤组织H&E染色切片可知,模型组小鼠肿瘤细胞生长旺盛,细胞核大、深染且大小不一,总体上细胞生长分布均匀且紧密,呈现典型的肿瘤细胞基本特征[10]。海芋石油醚部位各剂量组均有明显肿瘤坏死区,细胞排列疏松,细胞质固缩,核质比减小,肿瘤细胞染色整体较浅,肿瘤坏死区随药物剂量的增加而明显增多。
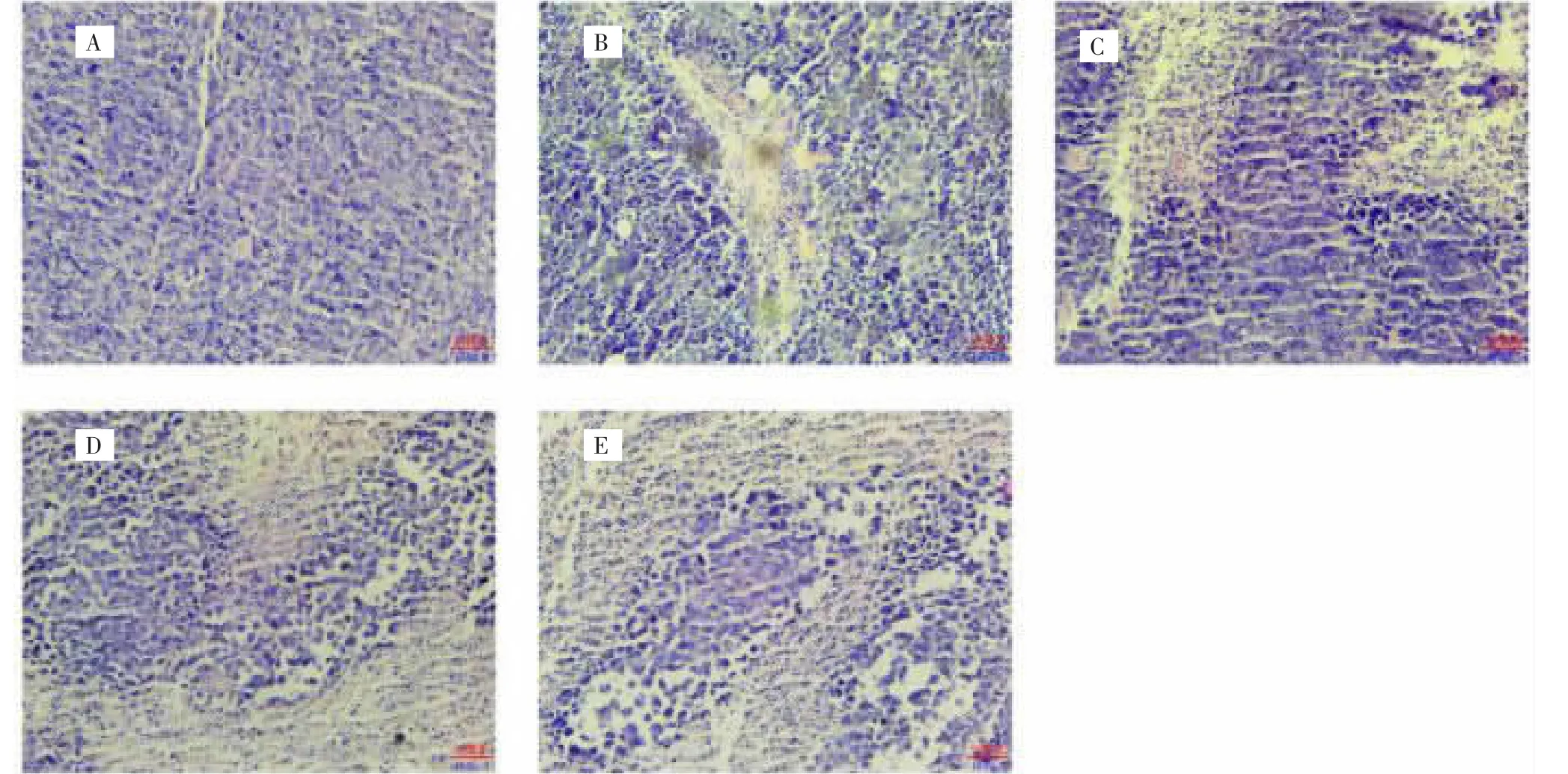
图3 H&E染色法观察海芋石油醚部位对荷H22小鼠肿瘤组织形态学的影响(400×)Fig.3 Effect of Tumor histomorphology of H22-bearing mice after petroleum ether layer of Alocasia macrorrhiza observed by H&E staining method(400×)
3.6 海芋石油醚部位对荷H22小鼠肿瘤细胞凋亡的影响 由图4和图5可知,海芋石油醚部位各剂量组、顺铂组和模型组小鼠H22肿瘤细胞凋亡率分别为19.64%、26.62%、33.80%、34.10%和14.13%,其中海芋石油醚部位0.4g·kg-1、0.8g·kg-1剂量组和顺铂组肿瘤细胞凋亡率均高于模型组,差异均有统计学意义(P<0.05)。
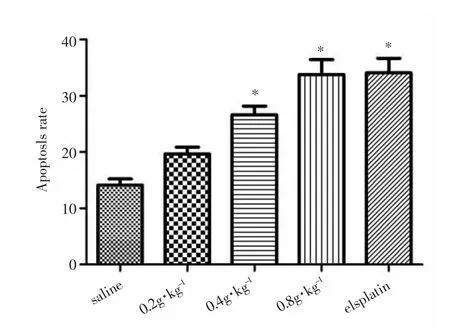
图4 海芋石油醚部位对荷H22小鼠肿瘤细胞凋亡率的影响Fig.4 Effect of tumor cell apoptosis rate of H22-bearing mice after petroleum ether layer of Alocasia macrorrhiza
3.7 海芋石油醚部位对荷H22小鼠肿瘤细胞凋亡蛋白的影响 如图6所示,海芋石油醚部位作用于荷H22小鼠后,与模型组相比,海芋石油醚部位0.4g·kg-1剂量组、海芋石油醚部位0.8g·kg-1剂量组和顺铂组pro-caspase-8(57kDa)、pro-caspase-3(35kDa)蛋白表达均呈明显下调,差异有统计学意义(P<0.05,P<0.01);海芋石油醚部位0.4g·kg-1、0.8g·kg-1剂量组和顺铂组caspase-8出现裂解产物(18kDa),差异有统计学意义(P<0.05,P<0.01);海芋石油醚部位0.4g·kg-1剂量组、海芋石油醚部位0.8g·kg-1剂量组和顺铂组促凋亡蛋白Bax(21kDa)的表达明显增加,差异有统计学意义(P<0.05,P<0.01);顺铂组抗凋亡蛋白Bcl-2(26kDa)的表达明显下降,差异有统计学意义(P<0.05)。
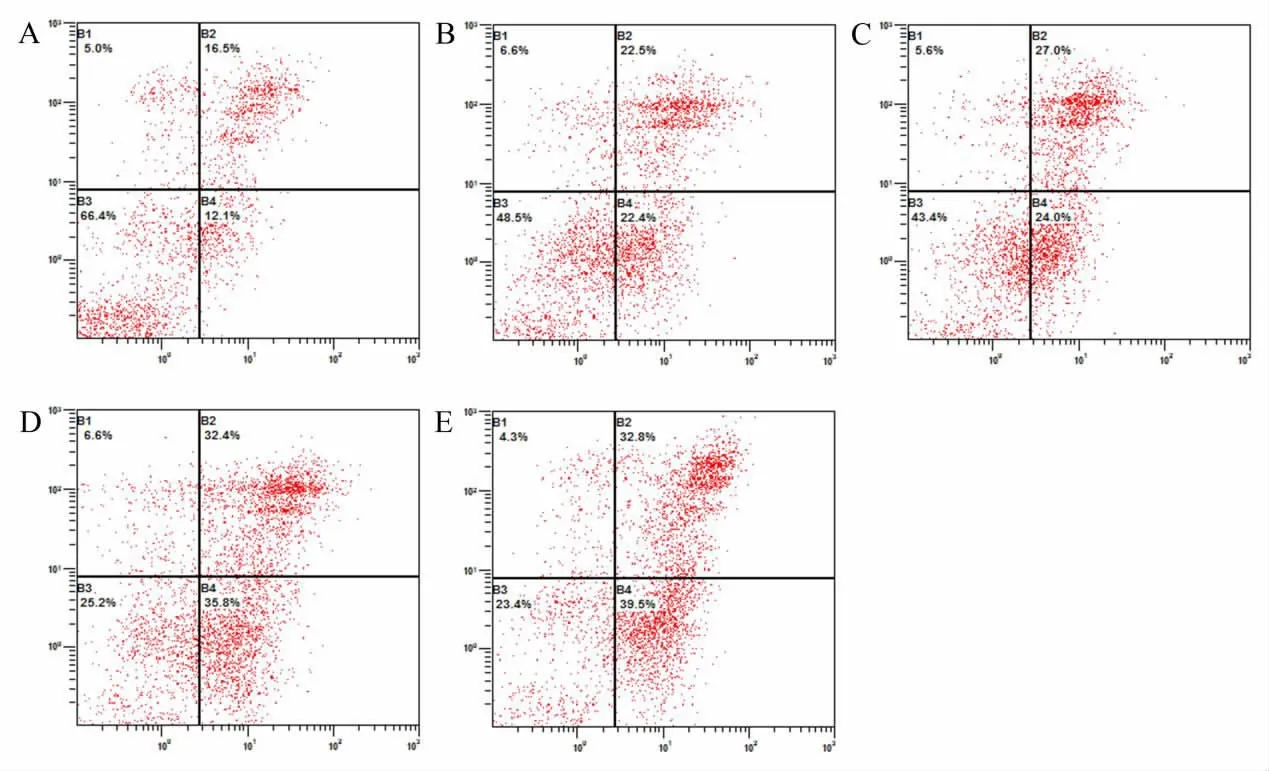
图5 流式细胞术检测海芋石油醚部位对荷H22小鼠肿瘤细胞凋亡的影响Fig.5 Effect of tumor cell apoptosis of H22-bearing mice after petroleum ether layer of Alocasia macrorrhiza detected by flow cytometry
4 讨论
4.1 海芋石油醚部位对荷H22小鼠的抗肿瘤作用小鼠肝癌H22肿瘤模型是抗肿瘤药物研究中常用的动物移植性肿瘤模型[11-12]。本实验利用此模型观察了海芋石油醚部位的体内抑瘤作用。研究发现,海芋石油醚部位可有效改善荷H22小鼠的生活质量、减慢小鼠肿瘤体积的增长速度;通过观察肿瘤病理形态变化及肿瘤细胞凋亡率进一步探讨了海芋石油醚部位体内抗肿瘤的实际疗效。实验结果显示,海芋石油醚部位0.8g·kg-1剂量组抑瘤率达30%以上;组织病理形态学观察发现,海芋石油醚部位各剂量组肿瘤细胞质固缩,核质比减小,能增加肿瘤组织中的肿瘤坏死区,有明显的肿瘤细胞凋亡现象;流式细胞术结果显示,除海芋石油醚部位0.2g·kg-1剂量组外,其余各给药组肿瘤细胞凋亡率均显著高于模型组 (P<0.05),表明海芋石油醚部位对荷H22小鼠具有显著的抗肿瘤作用。
4.2 海芋石油醚部位对荷H22小鼠的毒副作用 衡量机体免疫功能的初步观察指标为免疫器官指数,脾脏和胸腺是机体重要的免疫器官[13]。实验结果显示,与模型组相比,海芋石油醚部位作用后荷H22小鼠的胸腺指数和脾脏指数无明显变化,顺铂组荷H22小鼠的胸腺指数和脾脏指数极显著降低 (P<0.01),表明海芋石油醚部位对荷H22小鼠的免疫功能无明显损伤,顺铂对荷H22小鼠的免疫功能损伤明显;与顺铂组相比,海芋石油醚部位各剂量组能显著提高荷瘤小鼠的胸腺指数和脾脏指数(P<0.05),表明海芋石油醚部位对胸腺和脾脏的毒副作用小于顺铂。
4.3 海芋石油醚部位对荷H22小鼠肿瘤细胞凋亡蛋白的影响 近年来研究表明,凋亡对肿瘤的抑制起到重要的作用[14]。当细胞通过外源性途径发生凋亡作用时,死亡信号通过细胞表面的信号分子传递到caspase-8形成二聚体并自身激活,即pro-casepase-8在D216、D374和D384通过自切割形成具有活性的异源四聚体caspase-8,从而激活caspase-3,最终启动外源性调亡途径[15]。Bcl-2和 Bax是Bcl-2家族中已知的重要凋亡调控蛋白,前者是抗凋亡蛋白,后者是促凋亡蛋白,Bcl-2蛋白存在于线粒体膜、内质网膜以及外核膜上,但主要定位于线粒体外膜,具有拮抗促凋亡蛋白的功能,而Bax则主要定位于细胞质[16]。caspase-8可诱导Bcl-2、Bax向线粒体转位,通过寡聚化在线粒体外膜形成跨膜通道,或者开启线粒体的PT孔,从而导致线粒体中的凋亡因子释放,启动内源凋亡途径,激活caspase-3,导致细胞凋亡[17-18]。有研究表明,在细胞凋亡调节中,不仅取决于 Bcl-2和Bax自身表达的高低,还与二者的比值有关[19]。Western blot结果显示,海芋石油醚部位作用后能下调pro-caspase-8和pro-caspase-3蛋白的表达,促进pro-caspase-8自切割为cleaved-caspase-8;上调促凋亡蛋白 Bax的表达,下调抗凋亡蛋白 Bcl-2的表达,增加Bax/Bcl-2的比例,从而调节线粒体膜通道,增加凋亡因子释放,进一步激活caspaset-3,导致细胞启动凋亡途径,产生细胞凋亡。
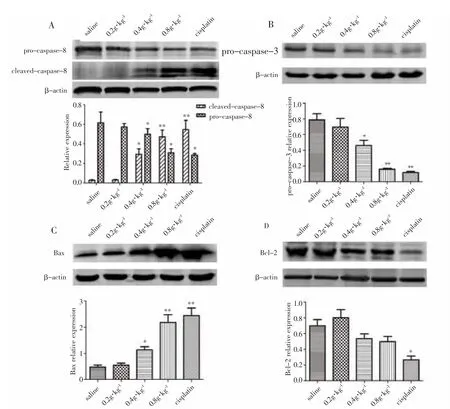
图6 Western blot检测海芋石油醚部位对荷H22小鼠肿瘤细胞凋亡蛋白的影响Fig.6 Effect of cell apoptosis protein of H22-bearing mice after petroleum ether layer of Alocasia macrorrhiza detected by Western blot
综上可得,本文通过建立荷H22小鼠肿瘤模型,研究海芋石油醚部位对体内肝癌细胞的抑制作用,海芋石油醚部位对荷H22小鼠肿瘤具有明显的抑制作用,推测海芋石油醚部位是通过上调caspase-8或作用于Bcl-2家族蛋白而诱导小鼠肝癌H22移植性肿瘤细胞发生的凋亡,海芋可以作为一个潜在抗肝癌药物,对其作用机制做进一步的研究。且海芋石油醚部位各剂量组较模型组未见明显的毒副作用,对进一步开发该提取物具有一定的意义。
References:
[1]Forner A,Llovet JM,Bruix J.Hepatocellular carcinoma [J].The Lancet,2012,379(9822):1245-1255.
[2]EI-Serag HB,Rudolph KL.Hepatocellular Carcinoma:epidemiology and molecular carcinogenesis[J].Grastroenterology,2007,132(7):2557-2576.
[3]Ren XF,Chen YX,Xie WF.The countermeasure and treatment of malignant ascites[J].Chin J Dig,2006,28(8): 573-576.
[4]Thomas M.Molecular targeted therapy for hepatocellular carcinoma[J].J Gastroenterol,2009,44(19):136-141.
[5]汪彬彬,王小虎,刘凯,等.黄芪超滤物对H22腹水瘤小鼠重离子放疗的增敏作用及机制探讨[J].药学学报,2015, 50(12):1596-1602. WANG Binbin,WANG Xiaohu,LIU Kai,et al.Enhanced radiosensitivity of H22 ascitic tumor to12C6+ions radiation in ultra-filtration extract mixture from Astragalus mongholicus-treated mice[J].Acta Pharmaceutica Sinica,2015,50(12):1596-1602.
[6]李恒.天南星科的生态地理和起源[J].云南植物研究,1986, 8(4):363-381. LI Heng.Ecological geography and origin of the araceae [J].Acta Botanica Yunnanica,1986,8(4):363-381.
[7]高越颖,冯磊,邱丽颖.王不留行提取物对H22荷瘤小鼠的抗肿瘤作用研究[J].中药材,2015,38(1):150-152. GAO Yueying,FENG Lei,QIU Liying.Anti-tumor effect of water extract from stem of Vaccaria segetalis(Neek.) Gareke in mice[J].Journal of Chinese Medicinal Materials,2015,38(1):150-152.
[8]周庚寅.组织病理学技术[M].北京:北京大学医学出版社, 2010:1-13. ZHOU Gengyin.Histopathological technique[M].Beijing: Peking University Medical Press,2010:1-13.
[9]张敏.HE染色在临床病理诊断中的应用[J].齐齐哈尔医学院学报,2011,32(4):552-553. ZHANG Ming.HE staining in the application of the clinical pathological diagnosis[J].Journal of Qiqihar University of Medicine,2011,32(4):552-553.
[10]陈丹丹,宋扬,代海华.刺参酸性黏多糖联合氟尿嘧啶对H22荷瘤小鼠肿瘤细胞的抑制作用[J].卫生研究,2014,43 (4):598-602. CHEN Dandan,SONG Yang,DAI Haihua.Antitumor effectofStichopusjaponicusacidic mucopolysaccharide combined with fluorouracil in mice bearing neoplasia of H22 hepatoma cells[J].Journal of Hygiene Research,2014, 43(4):598-602.
[11]高进.动物肿瘤模型的建立及其标准研讨[J].中国肿瘤生物治疗杂志,1995,2(1):76-79. GAO Jin.Discussion on the Establishment of Animal Tumor Models and Their Standards[J].Chin J Cancer Biother,1995,2(1):76-79.
[12]孙维凯,朱伟宏.大鼠Walker-256小鼠H22肿瘤模型建立及应用[J].同济大学学报(医学版),2009,30(5):15-18. SUN Weikai,ZHU Weihong.Establishment of transplantation tumor models for Walker-256 rats and H22 mice and discussion on their applications[J].Journal of Tongji University(Medical Science),2009,30(5):15-18.
[13]刘亚丽,杨小明,李月英,等.银杏酚对顺铂化疗Heps肝癌小鼠血清干扰素-γ、白介素-2和肿瘤坏死因子-α水平的影响[J].江苏大学学报(医学版),2016,26(2):98-101. LIU Ya1i,YANG Xiaoming,LI Yueying,et al.Effect of ginkgol on the serum levels of IFN-γ,IL-2 and TNF-α in cisplatin chemotherapied Heps hepatocarcinoma xenografts[J].Journal of Jiangsu University(Medicine Edition),2016,26(3):98-101.
[14]Lowe S W,Lin A W.Apoptosis in cancer[J].Carcinogenesis,2000,21(3):485-495.
[15]张潇月,孔庆宏,王冠林,等.Procaspase-8/Caspase-8非凋亡作用的研究进展[J].生命的化学,2016,36(5):704-709. ZHANG Xiaoyue,KONG Qinghong,WANG Guanlin,et al.Research progress on the non-apoptosis function of Procaspase-8/Caspase-8[J].Chemistry of Life,2016,36(5): 704-709.
[16]Chipuk J E,Green D R.How do Bcl-2 proteins induce mitochondrial outer membrane permeabikization[J].Trends in Cell Biology,2008,18(4):157-164.
[17]Landes T,Martinou JC.Mitochondrial outer membrane permeabilization during apoptosis:the roleofmitochondrial fission[J].Biochim Biophys Acta,2011,1813(4):540 -545.
[18]Nagaraja NS,Anilakumar KR,Singh OV.Diallyl disulfide causes caspase-dependent apoptosis in human cancer cells through a Bax-triggered mitochondrial pathway [J].J Nutr Biochem,2010,21(5):405-412.
[19]Danial NN.Bcl-2 family proteins:critical checkpoints of apoptotic cell death[J].Clin Cancer Res,2007,13(24):7254-7263.
Petroleum Ether Layer of Alocasia Macrorrhiza Research on the Inhibition of Liver Cancer H22 Tumor-bearing Mice and Apoptotic Effect
DING Hanjie,ZHU Yan,LIU Zuwang,et al
College of Pharmaceutical Science,Zhejiang Chinese Medical University,Hangzhou(310053)
[Objective]The purpose of this paper is to investigate the antitumor and apoptotic effect of petroleum ether layer of Alocasia macrorrhiza on H22 tumor-bearing mice.[Methods]H22 tumor model was established and randomly divided into the model group,cisplatin group,petroleum ether layer of Alocasia macrorrhiza 0.8 g·kg-1,0.4 g·kg-1and 0.2 g·kg-1dose groups.The tumor volumes were monitored.The inhibition rates as well as indexes of spleen and thymus were calculated during the study.Then,we observed pathologic morphology of the tumor tissues after treatment through H&E staining method and applied flow cytometry to evaluate the cell apoptosis of H22 tumor cells.Caspase-3,caspase-8 and Bcl-2,Bax protein expressions were measured by Western blot.[Results]The petroleum ether layer of Alocasia macrorrhiza 0.8 g·kg-1dose group had tumor growth inhibition rate of 31.41%.The results of H&E staining method showed that petroleum ether layer of Alocasia macrorrhiza could make H22 tumor cells appear obvious morphological changes of apoptosis;The exprimental results of flow cytometry showed that with petroleum ether layer of Alocasia macrorrhiza to the increase of the dose,apoptosis rate increased;The results of Western blot showed petroleum ether layer of Alocasia macrorrhiza could down-regulate pro-caspase-8 and pro-caspase-3 protein, increase the proportion of Bax/Bcl-2.[Conclusion]Petroleum ether layer of Alocasia macrorrhiza could inhibit the growth of H22 tumor in mice and its mechanism relate to apoptosis of tumor cell.
petroleum ether layer of Alocasia macrorrhiza;liver cancer;H22;pro-caspase-8;pro-caspase-3;Bcl-2 family protein;apoptosis
R331
:A
:1005-5509(2017)05-0362-08
10.16466/j.issn1005-5509.2017.05.003
2017-01-17)
浙江省自然科学基金(LY17H290010)
Fund project:Zhejiang Provincial Natural Science Foundation(LY17H290010)
钟晓明,E-mail:K6-zxm@sina.com

