TFDG对IL-1β体外诱导大鼠软骨细胞炎性损伤的保护作用研究
周盈,黄倩,张甜,陈萍*
1. 浙江大学茶学系,浙江 杭州 310058;2. 浙江大学基础医学院,浙江 杭州 310058
TFDG对IL-1β体外诱导大鼠软骨细胞炎性损伤的保护作用研究
周盈1,黄倩2,张甜1,陈萍1*
1. 浙江大学茶学系,浙江 杭州 310058;2. 浙江大学基础医学院,浙江 杭州 310058
体外分离培养SD雄性大鼠膝关节软骨细胞,经甲苯胺蓝及II型胶原(Col II)免疫荧光染色鉴定后,加入白介素-1β(IL-1β)诱导建立骨关节炎(OA)细胞模型,探讨茶黄素双没食子酸酯(TFDG)对OA软骨细胞的保护作用。细胞形态观察发现TFDG能明显改善OA软骨细胞形态。实时荧光定量PCR(Real-time PCR)结果显示,TFDG不仅可以上调软骨细胞分子标志物Col II mRNA的表达,还可以下调炎症因子IL-1β、IL-6 mRNA的表达。酶联免疫吸附实验(ELISA)检测结果进一步表明TFDG可明显降低炎症因子的分泌。免疫印迹(Western blot)检测结果证明,TFDG预干扰可降低炎症诱导酶环氧化酶COX-2蛋白表达量。这些结果说明TFDG通过减弱炎症反应,从而对IL-1β体外诱导大鼠软骨细胞炎性损伤起到保护作用。
茶黄素双没食子酸酯;骨关节炎;软骨细胞;炎症
骨关节炎(Osteoarthritis, OA)是最常见的慢性关节疾病,随着年龄的增长,其发病率会逐渐上升,严重危害中老年人的健康[1-3]。关节软骨损伤是骨关节炎最主要的生理病变之一,增龄、肥胖、劳损、创伤、关节先天性异常等诸多因素均可引起关节磨损损伤,最终导致关节软骨退行性变和继发性骨质增生[4-5]。软骨细胞作为关节软骨中唯一一种细胞,调节胞外基质(Extracellular matrix, ECM)的合成和降解,维持软骨基质稳态[6-7]。软骨细胞形态及功能的异常是OA病变的主要因素[8-9]。现阶段骨关节炎的体外研究主要集中在动物关节软骨细胞的培养及白介素-1β(Interleukin-1β, IL-1β)体外诱导成模,该模型现已被广泛应用和认可[10-11]。
茶黄素是红茶的主要功能成分,由儿茶素和没食子酸等酚类物质氧化形成,其最主要的单体有4种:茶黄素(Theaflavin, TF)、茶黄素-3-没食子酸酯(Theaflavin-3-monogallate, TF-3-G)、茶黄素-3′-没食子酸酯(Theaflavin-3′-monogallate, TF-3′-G)及茶黄素双没食子酸酯(Theaflavin-3, 3′-digallate, TFDG)。现已发现,茶黄素具有抗氧化、调节炎性反应、预防心血管疾病、抗肿瘤等药理功能[12]。刘伟等研究认为[13],茶黄素分子活性主要来源于没食子酰基等基团所含的酚羟基,随着茶黄素没食子酸酯化程度的提高,其生理活性明显增强。在茶黄素的4种主要单体中,TFDG单体的酚羟基最多,可能具有较强的生理活性。已有研究发现[14-16],以EGCG为主的绿茶多酚对骨关节炎的防治作用,是通过促进软骨细胞增殖和软骨细胞胞外基质合成,并减少炎症因子的分泌实现的,但目前对茶黄素的相关研究鲜有报道。因此,本实验用IL-1β对体外分离培养的大鼠软骨细胞进行诱导,建立OA细胞模型,初步探讨TFDG对OA软骨细胞的保护作用。
1 材料与方法
1.1 材料、试剂和实验动物
TFDG标准品(纯度≥98%,上海源叶生物有限公司),用无菌磷酸盐缓冲液(Phosphate buffered saline, PBS)溶解稀释,-20℃避光保存备用。
胎牛血清(Fetal bovine serum, FBS)、DEME/F12培养液、双抗溶液(青霉素/链霉素)、PBS、胰酶、混合胶原酶(均购自美国Gibco公司);牛血清白蛋白(Bovine serum albumin, BSA)(美国Sigma公司);重组大鼠IL-1β(英国Peorotech公司);抗荧光淬灭封片液、DAPI(均购自上海碧云天公司);II型胶原抗体(美国Santa Cruz公司);COX-2抗体、GAPDH抗体、辣根过氧化物酶标记的抗兔、抗小鼠IgG抗体(均购自美国CST公司);山羊抗兔Dylight 488荧光二抗(美国Abcam公司);Trizol试剂(美国Invitrogen公司);SYBR® Green Supermix试剂盒(美国Bio-Rad公司);ReverTra Ace®(日本ToYoBo公司);实时荧光定量PCR引物(中国上海生物工程技术有限公司);大鼠IL-1β、IL-6酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)试剂盒(深圳欣博盛生物科技有限公司)。
实验动物采用清洁级雄性SD(Sprague-Dawley)大鼠,体质量120~150 g,约40只,来源于浙江省实验动物中心。所有动物实验的操作均经过浙江大学动物中心伦理委员会批准。
1.2 主要仪器
JB-CJ-1FX超净工作台(苏州佳宝净化工程设备有限公司)、Galaxy系列二氧化碳培养箱(英国RS Biotech公司)、Nikon倒置相差显微镜(日本Nikon公司)、Western blot电泳转膜装置(美国Bio-Rad公司)、NanoDrop蛋白核酸定量仪(美国NanoDrop公司)、480 II荧光定量PCR仪(美国Roche公司)、G:BOX化学发光成像仪(英国Syngene公司)。
1.3 软骨细胞分离培养
用10%水合氯醛将SD大鼠麻醉致死后,用75%酒精浸泡10 min。无菌条件下打开膝关节,分离关节软骨面,转移至超净工作台做如下操作:灭菌手术刀削下关节软骨碎片,剪成1 mm×1 mm大小的组织块,加入2 mL 0.2%混合胶原酶,37℃消化30 min,转移到含3 mL完全培养基(含10% FBS和1%双抗)的6 cm培养皿中培养。24 h后,将组织悬液转移至15 mL离心管,12 000 r·min-1离心5 min,弃上清,加入1 mL完全培养基重悬细胞后,转移至原6 cm培养皿,37℃、5% CO2培养箱进行常规培养。待贴壁细胞长满80%左右进行传代,期间每隔2 d进行细胞换液。
1.4 实验分组及处理
待大鼠第一代软骨细胞长满约80%时,经胰酶消化后形成细胞悬液,并以每孔1×106个接种到六孔板中,置于37℃、5% CO2培养箱中进行常规培养。按照说明书用0.1% BSA溶解IL-1β。实验分3个处理组:空白对照组、IL-1β诱导组及TFDG组。待细胞长满80%~90%时,更换无血清培养基饥饿处理细胞12 h,使细胞同步于增殖相。干预组加入不同浓度的TFDG(25、50、75、100 μmol·L-1)预处理2 h后,再加入终质量浓度为10 ng·mL-1的IL-1β,模型组仅加入同浓度IL-1β和PBS,对照组加入相同体积PBS,各组细胞培养基总体积一致,细胞培养24 h后,观察并记录3个处理组细胞形态特征。
1.5 软骨细胞爬片和培养
待大鼠第一代软骨细胞长满约80%时,经胰酶消化后形成细胞悬液,并以每孔2×104个接种到铺有多聚赖氨酸盖玻片的24孔板中,置于37℃、5% CO2培养箱中爬片培养24 h。待细胞贴壁完成后,取出爬片,用于软骨细胞染色鉴定。
1.6 甲苯胺蓝染色
取出制备好的第二代细胞爬片,95%乙醇4℃固定30 min,PBS清洗2次,用体积分数为1%的甲苯胺蓝乙醇液染色20 min,PBS清洗2次,无水乙醇漂洗,空气中干燥,中性树胶封片,倒置荧光显微镜下观察并拍照。
1.7 II型胶原免疫荧光染色
将制备好的第二代细胞爬片用PBS-BSA(用PBS配制1% BSA)孵育细胞15 min,PBS清洗2次,4%多聚甲醛固定20 min。弃多聚甲醛,PBS清洗3次,0.2% Triton-X-100通透细胞10 min。PBS清洗2次,PBS-BSA封闭15 min。PBS清洗2次,加入II型胶原抗体4℃孵育过夜,翌日PBS清洗3次后,加入山羊抗兔Dylight 488荧光二抗室温避光孵育1 h。PBST清洗3次后,DAPI染核30 min。滴入防淬灭剂,封片,倒置荧光显微镜下观察并拍照。
1.8 ELISA检测
软骨细胞以每孔1×106个接种于六孔板中,待细胞长满80%~90%时,更换无血清的培养基孵育12 h,使细胞同步于增殖相,按不同组别进行相应处理,培养24 h后,以无菌管收集细胞培养基上清。严格按照试剂盒说明书步骤操作,绘制出标准曲线,测定细胞培养基中IL-1β和IL-6的含量。实验重复4次,每次各组设3个复孔。
1.9 Western blot检测
第二代大鼠软骨细胞培养于六孔板内,按不同组别进行相应处理。24 h后,弃培养基,PBS清洗2次,用RIPA裂解液冰上裂解细胞30 min,刮下细胞后将其转移至1.5 mL离心管中,4℃ 13 000 r·min-1离心10 min后取上清,BCA法测定蛋白浓度。以含40 µg蛋白质的上样量,经由8%十二烷基磺酸钠-聚丙烯酰胺凝胶(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)恒压100 V进行电泳。恒流250 mA PVDF膜转膜2 h,5%~10%脱脂奶粉封闭1 h。洗膜后加入COX-2、GAPDH抗体4℃孵育过夜。翌日再用辣根过氧化物酶标记的二抗室温孵育1 h,洗膜后加Immobilon显色液,G:BOX化学发光成像仪曝光显示目的蛋白,并拍照记录。用ImageJ软件对图像进行数据转化处理,以目的条带和内参条带的灰度值比值作为结果,实验重复3次。
1.10 Real-time PCR检测
用trizol收集各组细胞,采用trizol法提取各组软骨细胞总RNA,NanoDrop蛋白核酸定量仪测RNA浓度。取1 μg总RNA采用ReverTra Ace®逆转录试剂盒制备cDNA模板。参考Bio-Rad公司Real-time PCR试剂盒构建10 µL反应体系,反应条件如下:95℃变性10 s,95℃退火5 s,60℃延伸30 s,共40个循环。每次Real-time PCR至少为3个不同样本。选用大鼠管家基因GAPDH作为内参,将所得样本的Ct值按公式2–ΔΔCT计算IL-1β、IL-6和Col II相对表达量,实验重复3~4次,每次各处理组设3个复孔。本实验Real-time PCR所用引物通过查阅相关文献获得(表1)。
1.11 统计学方法
统计分析采用Graphpad prism 5软件处理,实验数据均以平均数±标准差(Mean±SD)表示,采用Student t test进行分析,P<0.05表示有统计学意义。

表1 本实验中使用的Real-time PCR引物序列Table 1 Real-time PCR primers used in this experiment
2 结果与分析
2.1 软骨细胞的鉴定
蛋白聚糖和II型胶原的合成和分泌是软骨细胞维持其分化表型的特征性指标,可用于软骨细胞鉴定。实验结果如图1所示。软骨细胞贴壁固定后,经甲苯胺蓝染色,可见胞内蓝紫色异染颗粒,细胞核染成蓝紫色,细胞质呈蓝色。软骨细胞核经DAPI染色后呈蓝色,细胞质经Dylight 488染色后呈绿色。由此可见,本实验提取得到了纯净的软骨细胞,特征性II型胶原主要分布在胞浆和细胞膜上。

图1 软骨细胞鉴定Fig. 1 Identification of chondrocytes
2.2 TFDG对软骨细胞形态的影响
软骨细胞以每孔1×106个的细胞密度培养在六孔板中,待细胞在皿底铺至80%~90%时,分组做相应处理。24 h后,镜下观察结果如图2所示,空白对照组软骨细胞外观多为圆形或多角形,汇合成片呈现“铺路石”状。IL-1β诱导组的软骨细胞大多呈现为长梭形,圆形或多角形细胞数量减少。50 μmol·L-1TFDG组软骨细胞形态较IL-1β诱导组明显得到改善,长梭形细胞减少。
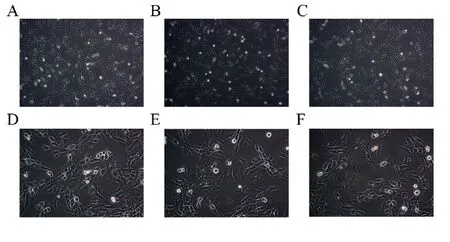
图2 软骨细胞形态观察Fig. 2 Morphological observation of chondrocytes
2.3 TFDG对IL-1β诱导的大鼠软骨细胞Col II mRNA表达的影响
II型胶原(Type II collage, Col II)为软骨胞外基质ECM胶原成分的主要类型,参与软骨细胞合成代谢,对维持关节软骨合成与分解代谢稳态起重要作用[17]。Real-time PCR结果如图3所示。与空白对照组相比,IL-1β诱导组中II型胶原表达降低(P<0.05);而与IL-1β诱导组相比,TFDG能有效抑制IL-1β引起的Col II表达的降低(P<0.05),且抑制效果呈浓度依赖性,说明TFDG具有通过上调ECM中Col II的水平,促进骨关节炎中受损软骨细胞的修复。
2.4 TFDG对IL-1β诱导的大鼠软骨细胞IL-1β和IL-6 mRNA表达的影响
提取软骨细胞总RNA进行Real-time PCR分析,检测TFDG对OA软骨细胞中炎症因子活性的影响。如图4所示,正常大鼠软骨细胞经IL-1β诱导24 h后,IL-1β和IL-6的表达均显著增加(P<0.001或P<0.01)。与IL-1β诱导组相比,软骨细胞预孵不同浓度的TFDG 2 h再加入IL-1β共培养24 h后,IL-1β和IL-6的表达均受到显著抑制,且抑制效果呈现出浓度依赖关系。结果表明,TFDG通过抑制IL-1β诱导的大鼠软骨细胞IL-1β和IL-6表达,表现出明显的抗炎活性。
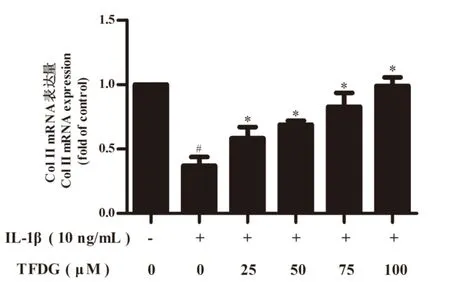
图3 TFDG对IL-1β诱导的大鼠软骨细胞Col II mRNA表达的影响Fig. 3 Effect of TFDG on IL-1β-induced Col II mRNA expression in rat chondrocytes

图4 TFDG对IL-1β诱导的大鼠软骨细胞IL-1β和IL-6 mRNA表达的影响Fig. 4 Effect of TFDG on IL-1β-induced IL-1β and IL-6 mRNA expression in rat chondrocytes
2.5 TFDG对IL-1β诱导的大鼠软骨细胞IL-1β和IL-6蛋白表达的影响
软骨细胞分组做相应处理后,收集细胞培养液,离心取上清液,测定细胞炎症因子IL-1β和IL-6的分泌量,结果见图5。在空白对照组中,体外培养的正常大鼠软骨细胞中IL-1β和IL-6的含量很少。IL-1β处理大鼠软骨细胞24 h后,炎症因子的蛋白表达量显著增加(P<0.001)。软骨细胞经不同浓度的TFDG预处理2 h,再加入IL-1β共培养24 h后,发现IL-1β和IL-6的蛋白含量均呈浓度依赖性的显著降低。提示TFDG可抑制IL-1β诱导的大鼠软骨细胞中IL-1β和IL-6的分泌量,进一步表现抗炎活性。

图5 TFDG对IL-1β诱导的大鼠软骨细胞IL-1β和IL-6蛋白表达的影响Fig. 5 Effect of TFDG on IL-1β-induced the protein level of IL-1β and IL-6 expression in rat chondrocytes
2.6 TFDG对IL-1β诱导的大鼠软骨细胞COX-2蛋白表达的影响
IL-1β作用于软骨细胞后,可上调环氧合酶2(Cyclooxygenase-2, COX-2)的表达,刺激炎性介质如前列腺素E2(Prostaglandin E2, PGE2)的释放,加速OA发生发展[18]。实验采用Western blot方法检测了TFDG对IL-1β诱导的大鼠软骨细胞COX-2表达的影响。结果由图6-A可知,在TFDG预处理组中,大鼠软骨细胞COX-2的蛋白丰度相较于IL-1β刺激组明显降低。用ImageJ软件对图像进行数据处理,结果(图6-B)显示,大鼠软骨细胞经IL-1β诱导后COX-2表达量显著增加(P<0.01)。预孵TFDG 2 h后经IL-1β诱导培养24 h,发现COX-2表达量呈浓度依赖性显著降低。说明TFDG能够明显下调IL-1β诱导的大鼠软骨细胞COX-2表达。

图6 TFDG对IL-1β诱导的大鼠软骨细胞COX-2蛋白表达的影响Fig. 6 Effect of TFDG on IL-1β-induced the protein level of COX-2 expression in rat chondrocytes
3 讨论
TFDG是一种存在于红茶中的天然化合物,其分子结构中含有没食子酰基及多个酚羟基,在炎症调节方面表现出良好的生理活性[19-21]。有研究指出TFDG可抑制软骨细胞基质金属蛋白酶(Matrix metalloproteinases, MMPs)活性而起到预防风湿性关节炎的作用[21]。本实验证实分离培养的细胞是软骨细胞。细胞形态学观察结果显示,软骨细胞经IL-1β诱导后细胞形态发生改变,由椭圆形变成长梭形。TFDG预干扰后,长梭形细胞比例降低,细胞形态得到明显改善。
骨关节炎是一种随年龄增长、发病率明显增加的退行性关节疾病,驱动OA进程的主要因素是慢性炎症和关节软骨胞外基质结构的改变[22-23]。炎症因子IL-1β通过恶化软骨细胞生存的微环境,干扰软骨细胞正常功能,引起关节软骨退变,加速骨关节炎病理进展。由此可见,控制软骨细胞的炎症反应有利于控制或延缓骨关节炎进展,并可能成为治疗OA的关键环节。Leong D J等[24]在小鼠骨关节炎体内实验中发现,绿茶多酚通过抑制炎症因子IL-1β和TNF-α mRNA的表达而减缓疼痛。袁昊等[25]认为,白藜芦醇也可以通过降低软骨细胞中炎症因子TNF-α、IL-1β的表达,延缓软骨细胞退变。本实验结果显示,TFDG可有效阻断IL-1β诱导的软骨细胞中炎症因子IL-1β、IL-6的表达及分泌,表现出明显的抗炎活性,且抑制效果具有浓度依赖性。
Huang H等[14]的研究结果显示,IL-1β可抑制软骨细胞Col II的表达。本研究结果与之一致,且发现TFDG还通过上调OA软骨细胞中Col II mRNA表达,改善细胞外基质降解现象。童敏等[26]认为,白藜芦醇可通过下调COX-2在关节软骨中的表达达到调控骨关节炎的作用。本研究结果显示,COX-2在正常软骨细胞中表达量极低,IL-1β刺激能明显上调其蛋白表达量。而TFDG预干扰能有效降低OA软骨细胞中COX-2蛋白表达量,进而减轻炎症反应。
本研究首次探讨TFDG对IL-1β体外诱导大鼠软骨细胞炎性损伤的保护作用。TFDG预干扰明显改善OA软骨细胞形态,有利于软骨细胞维持良好的生物学特征;上调软骨细胞分子标志物Col II基因表达,促进OA软骨细胞的修复;下调促炎细胞因子IL-1β和IL-6 mRNA的表达及分泌,表现出明显的抗炎活性;抑制COX-2蛋白量表达,减少炎性介质产物的合成。综上所述,TFDG对受损的OA软骨细胞具有一定的保护作用,可以有效调控骨关节炎,促进关节软骨修复,在炎症相关慢性关节疾病的研究、预防及治疗中具有科研前景。
[1] Loeser R F, Goldring S R, Scanzello C R, et al. Osteoarthritis: a disease of the joint as an organ [J]. Arthritis Rheum, 2012, 64(6): 1697-1707.
[2] Hunter D J. Osteoarthritis [J]. Best Practice and Research in Clinical Rheumatology, 2011, 25(6): 801-814.
[3] Blagojevic M, Jinks C, Jeffery A, et al. Risk factors for onset of osteoarthritis of the knee in older adults: a systematic review and meta-analysis [J]. Osteoarthritis Cartilage, 2010, 18(1): 24-33.
[4] Troeberg L, Nagase H. Proteases involved in cartilage matrix degradation in osteoarthritis [J]. Biochim Biophys Acta, 2012, 1824(1): 133-145.
[5] Goldring M B, Marcu K B. Cartilage homeostasis in health and rheumatic diseases [J]. Arthritis Res Ther, 2009, 11(3): 224.
[6] Poole A R, Kojima T, Yasuda T, et al. Composition and structure of articular cartilage: a template for tissue repair [J]. Clin Orthop Relat Res, 2001, 391(Suppl): S26-S33.
[7] Kim H, Kang D, Cho Y, et al. Epigenetic regulation of chondrocyte catabolism and anabolism in osteoarthritis [J]. Molecules and Cells, 2015, 38(8): 677-684.
[8] 陈后煌, 邵翔, 马玉环, 等. 电针调节骨关节炎软骨细胞功能的机制探讨[J]. 风湿病与关节炎, 2015, 4(6): 37-41.
[9] Holyoak D T, Tian Y F, van der Meulen M C, et al. Osteoarthritis: pathology, mouse models, and nanoparticle injectable systems for targeted treatment [J]. Annals of Biomedical Engineering, 2016, 44(6): 2062-2075.
[10] 冷薇, 冯文周. 骨性关节炎(OA)临床研究进展及药物治疗[J]. 中国实用医药, 2010, 22(5): 246-249.
[11] 郑洁, 王瑞辉, 寇久社. 炎性反应在骨关节炎软骨退变中的作用[J]. 基础医学与临床, 2014, 34(8): 1146-1149.
[12] 周降生, 吴远双, 吕世懂, 等. 茶黄素药理作用及其作用机制研究进展[J]. 食品工业科技, 2014, 35(18): 373-377.
[13] 刘伟, 周洁, 龚正礼. 茶黄素的功能活性研究进展[J]. 食品科学, 2013, 34(11): 386-391.
[14] Huang H, Liu Q, Liu L, et al. Effect of epigallocatechin-3-gallate on proliferation and phenotype maintenance in rabbit articular chondrocytesin vitro[J]. Exp Ther Med, 2015, 9(1): 213-218.
[15] Singh R, Akhtar N, Haqqi T M. Green tea polyphenol epigallocatechin-3-gallate: Inflammation and arthritis [J]. Life Sciences, 2010, 86(25/26): 907-918.
[16] Shen C L, Samathanam C, Tatum O L, et al. Green tea polyphenols avert chronic inflammation-induced myocardial fibrosis of female rats [J]. Inflammation Research, 2011, 60(7): 665-672.
[17] Shinomural T, Ito K, Höök M, et al. A newly identified enhancer element responsible for type II collagen gene expression [J]. J Biochem, 2012, 152(6): 565-575.
[18] Amin A R, Dave M, Attur M, et al. COX-2, NO, and cartilage damage and repair [J]. Curr Rheumatol Rep, 2000, 2(6): 447-453.
[19] Ukil A, Maity S, Das P K. Protection from experimental colitis by theaflavin-3,3'-digallate correlates with inhibition of IKK and NF-kB activation [J]. Br J Pharmacol, 2006, 149(1): 121-131.
[20] Chen H D, Parks T A, Chen X X, et al. Structural identification of mouse fecal metabolites of theaflavin-3,3'-digallate using liquid chromatography tandem mass spectrometry [J]. Journal of Chromatography A, 2011, 1218(41): 7297-7306.
[21] Oka Y, Iwai S, Amano H, et al. Tea polyphenols inhibit rat osteoclast formation and differentiation [J]. J Pharmacol Sci, 2012, 118(1): 55-64.
[22] Zhao H, Zhang T, Xia C, et al. Berberine ameliorates cartilage degeneration in interleukin-1β-stimulated rat chondrocytes and in a rat model of osteoarthritis via Akt signaling [J]. J Cell Mol Med, 2014, 18(2): 283-292.
[23] 魏丽杰. 降钙素对IL-1β诱导的大鼠软骨细胞炎性反应的影响[D]. 唐山:河北联合大学, 2014: 35-39.
[24] Leong D J, Choudhury M, Hanstein R, et al. Green tea polyphenol treatment is chondroprotective, anti-inflammatory and palliative in a mouse post-traumatic osteoarthritis model [J]. Arthritis Res Ther, 2014, 16(6): 508.
[25] 袁昊, 曾晖, 肖德明, 等. 白藜芦醇通过NF-kB信号通路抑制软骨细胞炎症因子的表达[J]. 中华骨与关节外科杂志, 2016, 9(1): 75-79.
[26] 童敏, 高戈, 高洁生, 等. 白藜芦醇对兔骨关节炎模型关节软骨中COX-2表达的影响[J]. 江西医学院学报, 2008, 48(3): 24-26.
Research on the Protective Effects of TFDG on IL-1β-induced Inflammatory Injury in Rat Chondrocytes in Vitro
ZHOU Ying1, HUANG Qian2, ZHANG Tian1, CHEN Ping1*
1. Department of Tea Science, Zhejiang University, Hangzhou 310058, China; 2. School of Basic Medical Sciences, Zhejiang University, Hangzhou 310058, China
The chondrocytes were isolated and harvested from knee articular surface of male Sprague-Dawley rats, which were identified by toluidine blue and type II collagen immunofluorescence staining. To investigate potential protective effects of theaflavin-3,3′-digallate (TFDG) on IL-1β-induced inflammatory injury in rat chondrocytesin vitro, a model of osteoarthritis was established through stimulating rat chondrocytes with IL-1β. Inverted phase contrast microscopy showed TFDG treatment significantly improved osteoarthritis chondrocytes morphology. Real-time PCR results showed that TFDG treatment not only up-regulated chondrocyte marker Col II mRNA expression, but also down-regulated pro-inflammatory cytokines IL-1β and IL-6 mRNA expression. ELISA analysis further confirmed TFDG treatment significantly decreased the secretion of inflammatory factors. Western blot results showed that TFDG treatment significantly inhibited the inflammation-related enzyme COX-2 expression. Taken together, these results indicate that TFDG has a preventive effect on IL-1β-induced inflammatory injury in rat chondrocytesin vitroby reducing inflammatory reaction.
TFDG, osteoarthritis, chondrocytes, inflammation
Q946.84+1;R681.3
A
1000-369X(2017)03-290-09
2016-10-12
2017-01-05
国家茶叶产业体系(CARS-23)、国家自然科学基金(31200521)、高等学校博士学科点专项科研基金(20120101120112)
周盈,女,硕士研究生,主要从事茶叶药理功能和茶叶品质鉴定研究,vaelailai@zju.edu.cn。*通讯作者:pingchen@zju.edu.cn

