冠状静脉系统起源室性心律失常的心电图特征和导管消融
郑志涛 刘兴鹏
冠状静脉系统起源室性心律失常的心电图特征和导管消融
郑志涛 刘兴鹏
起源于冠状静脉系统的室性心律失常并不少见,但是,该部位的解剖及毗邻结构复杂,导管消融困难,成功率较低。本文拟对冠状静脉系统的解剖及毗邻结构、心电图特征及导管消融进行综述,旨在提高该部位起源的室性心律失常导管消融成功率。
冠状静脉系统;室性心律失常;心电图特征;导管消融
特发性室性心律失常(idiopathic ventricular arrhythmias,IVAs)最常见的起源部位是右室流出道心内膜,也可起源于肺动脉瓣上、主动脉窦、左室尖峰部等部位。当IVAs起源于冠状静脉系统(coronary venous system,CVS)时,可以在心大静脉、前室间静脉或其毗邻部位消融成功。既往观点认为该部位起源的IVAs少见,近年的研究则表明在IVAs中CVS心外膜起源的比例为9%~15%[1-2],消融成功率为50%~70%[2-3]。在CVS内消融是一项富有挑战性的工作,本文拟对CVS的解剖及毗邻结构、心电图特征及导管消融进行综述,旨在提高该部位起源的IVAs的导管消融成功率。
1 冠状静脉系统的解剖及毗邻结构
CVS走形迂曲、分支较多,根据其开口部位、血管粗细及其回流心室血液的部位分为:冠状静脉窦、心大静脉、心中静脉、心小静脉、前室间静脉、左室后静脉、左室侧静脉(图1,引自文献[2])。CVS起始为冠状静脉窦,是导管进入CVS的开口位置。与冠状静脉窦连接的心大静脉走形最长、直径最大,是常规放置冠状静脉窦电极的部位,也是消融导管在CVS内常规标测部位,其远端连接前室间静脉。前室间静脉以近称为心大静脉近端,以远称为心大静脉远端。前室间静脉走形在前室间沟内,由于与心大静脉成角陡直,消融导管常常难以到达。心中静脉开口在冠状静脉窦近端,走形于后室间沟内,其远端可绕过心尖,接近前室间静脉远端。CVS存在变异的情况常见,但几乎100%存在心大静脉、心中静脉,99%存在前室间静脉。单独存在左室侧静脉和左室后静脉的比例分别是82%、55%;二者中有一支存在的比例为99%;但是左室侧静脉和左室后静脉的变异最多见,可以单独存在,也可以二者并存,二者之间也可以存在多支血管,形成血管网[4]。
CVS位于心外膜,其毗邻结构复杂,对IVAs的标测和消融造成困难。其主要毗邻结构包括:前降支、回旋支、对角支等冠状动脉,左冠窦,左室尖峰部,主动脉瓣-二尖瓣连接部,心外膜脂肪垫[5](图2,引自文献[5])。由于心大静脉或前室间静脉的某些部位紧邻冠状动脉,是消融损伤冠状动脉的解剖基础,所以在心大静脉或前室间静脉消融前一定要进行冠脉造影,确定安全消融距离,避免出现冠状动脉损伤。有研究测量过可以在CVS内成功消融的心外膜IVAs最早激动点与毗邻结构的距离,距离CVS 约(2.1±1.5)mm,距离心包约(9.7±3.7) mm,距离左室心内膜约(7.7±2.7) mm[6],可见在局部狭小的空间内各结构非常接近。所以,当CVS内到达困难或消融能量不足时,可以在左冠窦、左室尖峰部等部位消融成功,60%的患者需要在CVS和主动脉窦、左室心内膜等毗邻部位联合消融[6]。
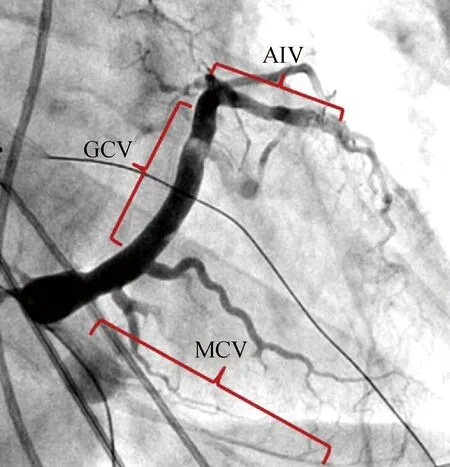
右前斜位逆行冠状静脉造影,显示冠状静脉系统
2 冠状静脉系统起源室性心律失常的心电图特点
心外膜起源IVAs的心电图判断标准多样,包括:类本位曲折时间、最大偏转指数等参数。但是,这些参数计算复杂,临床应用不便,并且不同的研究结果也不尽一致。例如Daniels等[7]认为最大偏转指数可鉴别心外膜起源和主动脉窦起源,最大偏转指数>0.55提示心外膜起源。而Yamada等[8]认为由于优势传导通路和心肌内部激动等原因,最大偏转指数鉴别心大静脉、前室间静脉起源的心外膜IVAs的可信度低。由于CVS走形较长,其不同部位的心电图特点存在差异。本文旨在根据不同的起源部位对心外膜起源IVAs的心电图一般特点进行判断、分析。
心大静脉起源时,起源点位于房室沟内、心室较高的位置,Ⅱ、Ⅲ、aVF导联呈高大的R波。由于起源部位偏左侧,除极向量更多地指向Ⅲ导联,所以Ⅲ导联振幅>Ⅱ导联;Ⅰ导联一般呈rS或S型;aVL和aVR导联呈QS型,研究表明aVL/aVR>1.1提示心大静脉或前室间静脉起源[9]。当起源点位于心大静脉近端时,该部位靠近左室的基底部侧壁,除极的初始向量指向V1导联,在V1导联可见R波,呈右束支阻滞形态,胸前导联移行
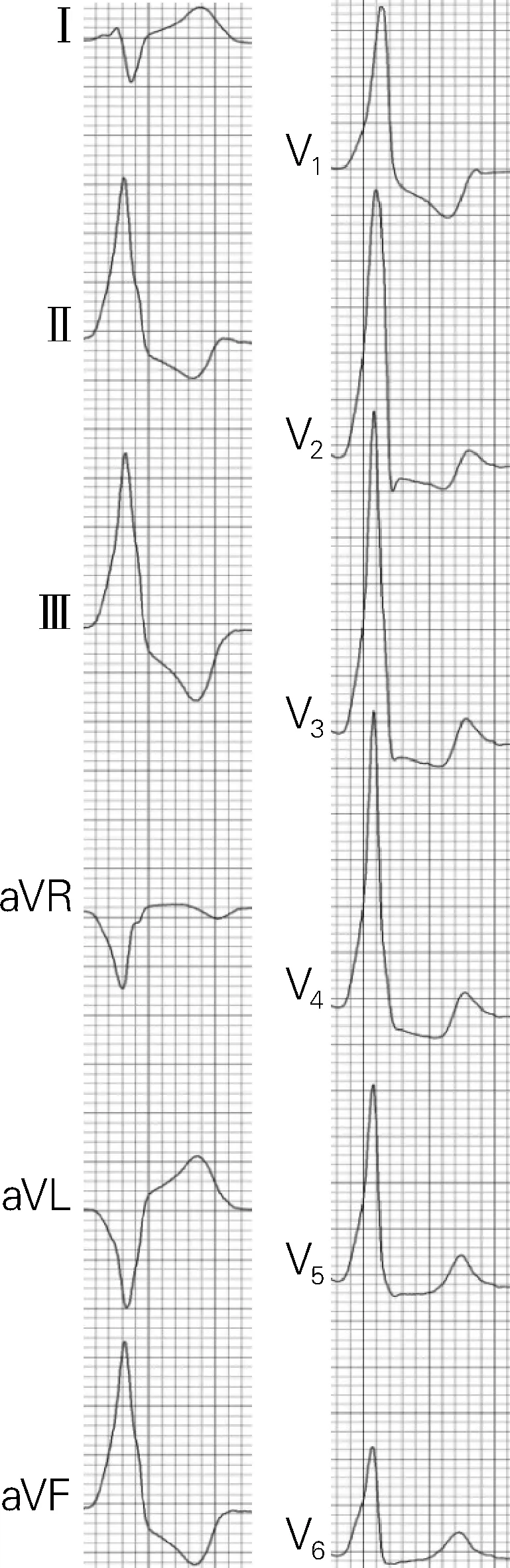
图3 心大静脉起源室早心电图特点
而当起源点位于心大静脉远端时,位置相对偏右,Ⅰ 导联呈R型,下壁导联虽然仍呈R型,但 Ⅱ 导联振幅>Ⅲ导联,aVL、aVR导联与心大静脉近端起源类似。由于该部位接近左室前间壁,除极的初始向量背离V1导联,所以V1导联呈QS形或仅可见窄r波,呈左束支阻滞形态,胸前导联移行在V2~V3导联。
前室间静脉起源时,下壁导联呈R型,Ⅲ导联振幅>Ⅱ导联,Ⅰ导联呈qr或rS型,aVL、aVR导联呈QS型,aVL/aVR>1.1[10],V5、V6导联有或无s波(图4)。由于该部位走形在前室间沟内,距离V2导联更近,所以V2导联的R波振幅最小,其典型特点是V1导联R波振幅>V2导联。胸前导联移行在V2~V3导联。
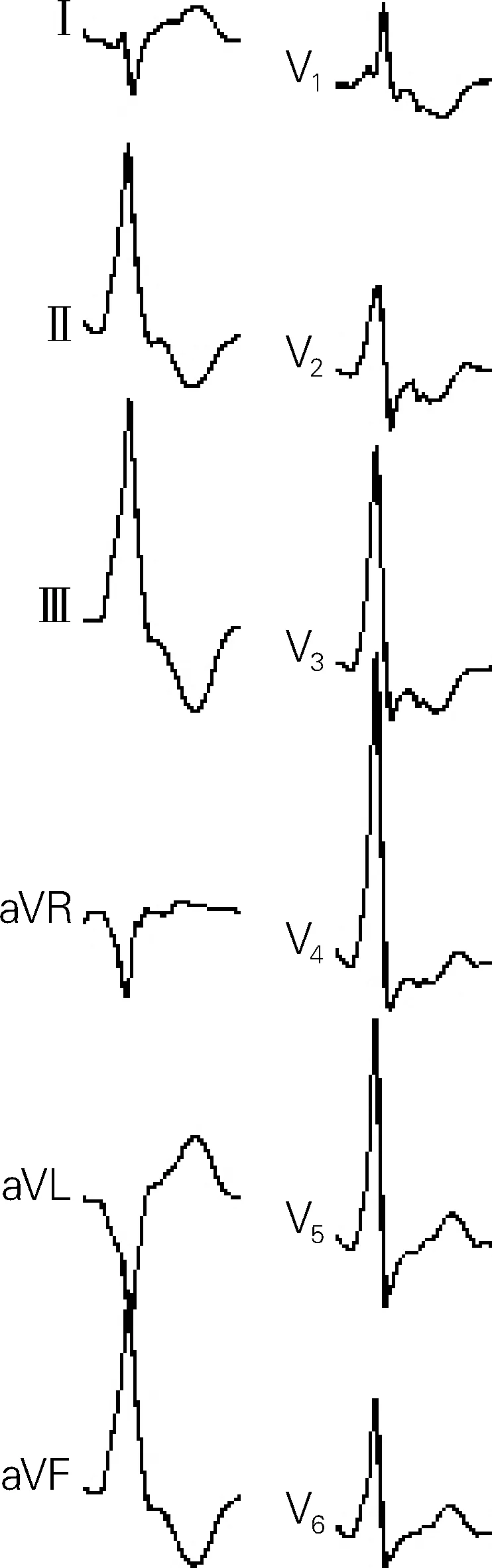
图4 前室间静脉起源室早心电图特点
当起源点为心中静脉或冠状静脉窦近端时,由于该部位位于心底部,位置较低,下壁导联呈S波;位置相对偏右,除极向量背离Ⅲ导联更多,所以Ⅲ导联S波深度>Ⅱ导联。Ⅰ、aVL导联呈R型或Rs型。胸前导联呈左束支阻滞形态,移行早于V2导联。
利用联律间期变异度也可鉴别主动脉窦起源和心大静脉起源。联律间期变异度的计算简便,为最大联律间期与最小联律间期之差。联律间期变异度>60 ms的敏感性89%、特异性100%、阳性预测值100%、阴性预测值94%[10]。
3 冠状静脉系统起源室性心律失常的导管消融
3.1 标测
起源于CVS的IVAs中53%起源于心大静脉,40%起源于前室间静脉,7%起源于心中静脉[2]。标测方法包括激动顺序标测和起搏标测。
虽然CVS的室性心律失常有其特殊的心电图特点,依据心电图可以判断左室或心外膜起源,但是北京朝阳医院心脏中心遵从心腔标测顺序:右室流出道—主动脉窦—左室心内膜—冠状静脉系统。我们认为按照该顺序进行标测能够建立整个心腔激动顺序的时间关系,判断消融靶点毗邻部位的时间先后顺序,避免无效放电或消融无效后室性心律失常出口改变带来的标测困难。尽管这会耗费一定时间,但是在遇到复杂病例时反而事半功倍。
我中心采用“先粗标后细标”的热点标测法,即先在单心腔内进行激动顺序标测,各部位均匀采点,初步判断最早激动部位,即热点;然后在热点部位密集采点,精细标测最早激动点,观察消融导管领先的激动时间及单极电图形态,同时辅以起搏标测。各研究报道的消融导管领先QRS波起始的时间不一,最近的一项研究显示最早激动点领先QRS波起始(39±18)ms[2]。我们的经验是,由于CVS位于心外膜,局部激动后需要传导至邻近心肌,电激动的传导时间较长,一般领先QRS波起始25 ms以上。单极电图要求呈QS型。起搏标测要求至少11个导联的QRS波与自发QRS波形态一致,另外一个导联可以存在细微差异。此外,消融导管头端可能记录到一些领先的、低幅高频的心室前电位,这些电位也提示潜在的消融靶点。图5显示我们成功消融心大静脉内起源室早一例,在心大静脉内标测到最早激动点,其距离心内膜最早激动部位13.1 mm,局部电图领先体表心电图QRS波起始58 ms,起搏标测相似度98%,放电2.3 s后室早消失。
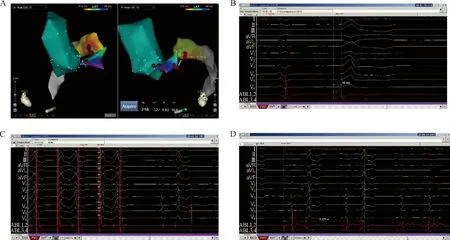
A:CRATO下激动顺序标测,在心大静脉内标测到最早激动点,其距离心内膜最早激动部位13.1 mm;B:最早激动点局部电图领先体表心电图QRS波58 ms(走速200 mm/s);C:在最早激动点起搏标测,相似度98% (走速
3.2 消融
在CVS内消融前要求常规进行冠状动脉造影,以了解消融部位与冠状动脉的位置关系。尤其当消融导管位于心大静脉和前室间静脉的交界部位时,该部位作为“左室尖峰部不可到达区”三角形的底边,与前降支、回旋支和对角支均有交集,如果盲目放电可能损伤冠状动脉而带来严重后果。造影体位常规采用左前斜和右前斜位,当消融导管贴近左主干尾部分叉处时,可加做蜘蛛位造影。目前认为消融导管距离冠状动脉的安全距离为10 mm,10 mm以上时可以放电,小于10 mm时不能放电。
CVS内消融常规使用冷盐水灌注消融导管。采用温控模式,设定功率20~25 W,温度45℃,盐水灌注速度17 mL/h。消融15 s并观察消融效果,如果IVAs消失,或者放电后出现短暂的频率加速或室早成串出现的现象也是有效消融的表现。单点消融60 s,逐步提高消融功率,最高功率35 W。放电有效的标志为放电后阻抗下降10~15 Ω。由于CVS内空间狭小,局部阻抗会明显升高,难以放电,或者采用温控模式放电后快速达到预设温度,而功率不再升高,难以达到额定功率。此时,可以将盐水灌注速度提高到30 mL/h,以增强局部血流冲刷的降温作用,或者采用功率模式,消融功率设定为15~20 W。
CVS内消融不成功的最常见原因是消融靶点接近冠状动脉,占55%。其次,是由于CVS细小,消融导管难以到达最早激动点,占9%。4%的消融失败是由于放电时难以达到设定的额定功率[2]。
前室间静脉是标测和消融最困难的部位,原因包括以下几点:① 由于前室间静脉与心大静脉成角,导管操作困难,难以到达前室间静脉所在的前室间沟;可以使用长鞘管,送至冠状静脉窦口或心大静脉内,增强导管支撑力和操作性;② 在前室间沟内接近80%的前室间静脉与前降支走形邻近,而心大静脉与冠状动脉走形邻近的情况只占40%,使得在前室间静脉内不能安全消融;③ 由于前室间静脉更为细小,所以消融时容易发生阻抗高、消融功率不足的情况,此时可以调高盐水灌注速度。
CVS内消融需要面对以上所述的各种困难,并且左室开口部解剖结构复杂,有时需要在心内膜对应的部位联合消融才能损伤中层心肌,所以在毗邻部位的联合消融是重要的消融策略。研究显示,34% CVS起源的IVAs可在CVS外毗邻部位消融成功[2]。在邻近部位联合消融时需要更长的消融时间以达到足够的消融深度。常见的联合消融部位是左室心内膜、左冠窦、主动脉瓣-二尖瓣连接部,少见的联合消融部位是右室流出道。
心大静脉远端和前室间静脉近端起源的IVAs可以在左冠窦、左室心内膜连接处、主动脉瓣-二尖瓣连接部消融成功。联合消融成功的预测指标包括:Ⅰ导联起始部存在r波[11]、QaVL/QaVR<1.45[3]、CVS内最早激动点到毗邻消融部位的距离<13.5 mm[3]、CVS内最早激动点到毗邻消融部位的激动间期≤7 ms[11]。
当右室流出道非常偏前、偏左时,右室流出道覆盖在心大静脉远端向右走形部分或前室间静脉的前方,所以能够在右室流出道间隔偏后的部位消融成功[2]。
经冠状静脉系统逆行或心内膜联合消融失败后,可以选择心包穿刺后经心外膜途径消融。但是,经心包途径消融的成功率低,仅为8%~14%[2,11]。影响成功率的因素包括:① 左心耳覆盖在心大静脉表面;② 右室流出道覆盖在心大静脉远端和前室间静脉表面;③ 心外膜脂肪垫具有隔热作用,覆盖在左室尖峰部,当厚度>7 mm时消融难以成功[12];④ 干性心包穿刺及心包内导管操作困难,存在一定风险,消融容易损伤冠状动脉。此外,当起源点位于CVS与心肌的连接侧时,心外膜消融难以到达。
对于消融困难的病例,有报道称外科医生采用胸腔镜技术将消融导管送入心包内,从而可以在直视下进行标测并成功消融[13]。
4 总结
CVS的解剖和毗邻结构复杂,可通过CVS进行消融的室性心律失常主要起源于心大静脉。心电图对该部位IVAs的判断有一定的提示作用。消融前要进行冠脉造影,采用功率滴定消融,对于导管操作困难者可使用长鞘支撑。经CVS无法消融成功者可在左冠窦、左室心内膜连接处、主动脉瓣-二尖瓣连接部等毗邻结构消融或二者联合消融,或者采用经胸腔镜途径直视下消融。
[1] Baman TS,Ilg KJ, Gupta SK,et al. Mapping and ablation of epicardial idiopathic ventricular arrhythmias from within the coronary venous system [J]. Circ Arrhythm Electrophysiol, 2010, 3(3):274-279.
[2] Mountantonakis SE,Frankel DS,Tschabrunn CM. et al. Ventricular arrhythmias from the coronary venous system: prevalence, mapping, and ablation [J]. Heart Rhythm, 2015, 12(6):1145-1153.
[3] Jauregui Abularach ME, Campos B, Park KM, et al. Ablation of ventricular arrhythmias arising near the anterior epicardial veins from the left sinus of Valsalva region: ECG features, anatomic distance, and outcome[J]. Heart Rhythm, 2012, 9(6):865-873.
[4] Meisel E,Pfeiffer D,Engelmann L,et al. Investigation of coronary venous anatomy by retrograde venography in patients with malignant ventricular tachycardia [J]. Circulation, 2001, 104(4):442-447.
[5] Atienza F, Arenal, Prez-David E, et al. New diagnostic and therapeutic approaches to treat ventricular tachycardiasoriginating at the summit of the left ventricle:role of merged hemodynamic-MRI and alternative ablation sources [J]. Circ Arrhythm Electrophysiol, 2013, 6(6):e80-e84.
[6] Carrigan TP, Patel S, Yokokawa M, et al. Anatomic relationships between the coronary venous system, surrounding structures, and the site of origin of epicardial ventricular arrhythmias [J]. J Cardiovasc Electrophysiol, 2014, 25(12): 1336-1342.
[7] Daniels DV, Lu YY, Morton JB, et al. Idiopathic epicardial left ventricular tachycardia originating remote from the sinus of Valsalva: electrophysiological characteristics, catheter ablation, and identification from the 12-lead electrocardiogram[J]. Circulation, 2006, 113(13):1659-1666.
[8] Yamada T, McElderry HT, Okada T, et al. Idiopathic left ventricular arrhythmias originating adjacent to the left aortic sinus of valsalva: electrophysiological rationale for the surface electrocardiogram[J]. J Cardiovasc Electrophysiol, 2010, 21(2):170-176.
[9] Yamada T, McElderry T, Doppalapudi H, et al. Idiopathic ventricular arrhythmias originating from the left ventricular summit: anatomic concepts relevant to ablation [J]. Circ Arrhythm Electrophysiol, 2010, 3(6):616-623.
[10] Bradfield JS, Homsi M, Shivkumar K, et al. Coupling interval variability differentiates ventricular ectopic complexes arising in the aortic sinus of valsalva and great cardiac vein from other sources[J]. J Am Coll Cardiol, 2014, 63(20):2151-2158.
[11] Nagashima K, Choi EK, Lin KY, et al. Ventricular arrhythmias near the distal great cardiac vein challenging arrhythmia for ablation[J]. Circ Arrhythm Electrophysiol, 2014, 7(5):906-912.
[12] Van Huls van Taxis CF, Wijnmaalen AP, Piers SR, et al. Real-time integration of MDCT-derived coronary anatomy and epicardial fat: impact on epicardial electroanatomic mapping and ablation for ventricular arrhythmias[J]. JACC Cardiovasc Imaging, 2013, 6(1):42-52.
[13] Aziz Z, Moss JD, Jabbarzadeh M, et al. Totally endoscopic robotic epicardial ablation of refractory left ventricular summit arrhythmia: first-in-man [J]. Heart Rhythm, 2017, 14(1): 135-138.
(本文编辑:郭欣)
ECG features and catheter ablation of ventricular arrhythmias originating from the coronary venous system
Zheng Zhi-tao1, Liu Xing-peng2
(Heart Center, 1. Beijing Luhe Hospital Affiliated to Capital Medical University, Beijing 101100; 2. Beijing Chaoyang Hospital Affiliated to Capital Medical University, Beijing 100020, China)
Ventricular arrhythmia originating from the coronary venous system(CVS) is not rare in clinical practice. However, the success rate of catheter ablation is low due to the complicated anatomical structure of CVS and its adjacent tissue. This paper reviews on the anatomical structure of CVS and its adjacent tissue, and the ECG features and catheter ablation of ventricular arrhythmia, aiming to elevate the success rate of catheter ablation of ventricular arrhythmia originating from this site.
coronary venous system; ventricular arrhythmia; electrocardiographic characteristics; catheter ablation
国家自然科学基金资助项目(81370293, 81470023)
101100 北京,首都医科大学附属北京潞河医院心脏中心(郑志涛);100020 北京,首都医科大学附属北京朝阳医院心脏中心(刘兴鹏)
郑志涛,副主任医师,主要从事心脏电生理和起搏的研究。
刘兴鹏,E-mail:liuxingpeng@medmail.com.cn
10.13308/j.issn.2095-9354.2017.03.003
2017-03-28)
R541.7
A
2095-9354(2017)03-0161-06

