阳江红树林内生真菌Aspergillus sp. 5Y次级代谢产物及其活性的研究*
李海斌,蓝雄,刘婷,郭俊熙,黄华容,张焜
(广东工业大学轻工化工学院,广东 广州510006)
阳江红树林内生真菌Aspergillus sp. 5Y次级代谢产物及其活性的研究*
李海斌,蓝雄,刘婷,郭俊熙,黄华容,张焜
(广东工业大学轻工化工学院,广东 广州510006)
对阳江红树林内生真菌Aspergillussp.5Y的次级代谢产物进行研究。本文采用硅胶柱层析、LH-20凝胶柱层析、ODS-C18反相硅胶柱层析及HPLC等色谱技术,应用红外、紫外、质谱、核磁等现代波谱技术手段。通过对阳江红树林内生真菌Aspergillussp.5Y进行次级代谢产物的研究,获得5个单体化合物,分别为6-epi-ophiobolin P(1)、strobilactone A(2)、penicisochroman E(3)、asperterpenol B(4)和(E,E)-6-(6′,7′-dihydroxy-2′,4′-octadienoyl)-strobilactone A(5)。在α-葡萄糖苷酶抑制实验中,化合物1,4对α-葡萄糖苷酶有显著的活性,IC50分别为(676.09±10.3) μmol/L和(9.57±0.2) μmol/L,为口服降糖药物的研发提供一定的理论数据。
红树林;内生真菌;次级代谢产物
生长在热带、亚热带的海岸潮间带的红树林,由于其处在高压、少光照、寡营养的海洋环境,生活在其中的微生物就容易产生结构新颖、活性特异的物质[1-2]。曲霉属真菌在红树林微生物里比较常见,且代谢产物种类繁多、药用活性特异,因此成为海洋天然产物研究员的研究热点[3]。曲霉属真菌次级代谢产物的主要类型包括生物碱、萜类、甾体、黄酮等[4-6],具有抗菌、抗肿瘤、抗氧化等方面具有较强的生物活性[7-8],是获得新天然产物的重要来源之一。笔者对红树林曲霉属真菌5Y的次级代谢产物进行研究,采用硅胶柱层析、反相硅胶柱层析、LH-20凝胶柱层析以及HPLC等方法分离纯化得到了5个单体化合物(如图1)。运用红外、紫外、质谱、核磁等现代波谱技术鉴定其结构分别为:6-epi-ophiobolin P(1)、strobilactone A(2)、penicisochroman E(3)、asperterpenol B(4)和(E,E)-6-(6′,7′-dihydroxy-2′,4′-octadienoyl)-strobilactone A(5)。在α-葡萄糖苷酶抑制实验中,化合物1,4对α-葡萄糖苷酶有显著的活性,IC50分别为(676.09±10.3)μmol/L和(9.57±0.2)μmol/L。
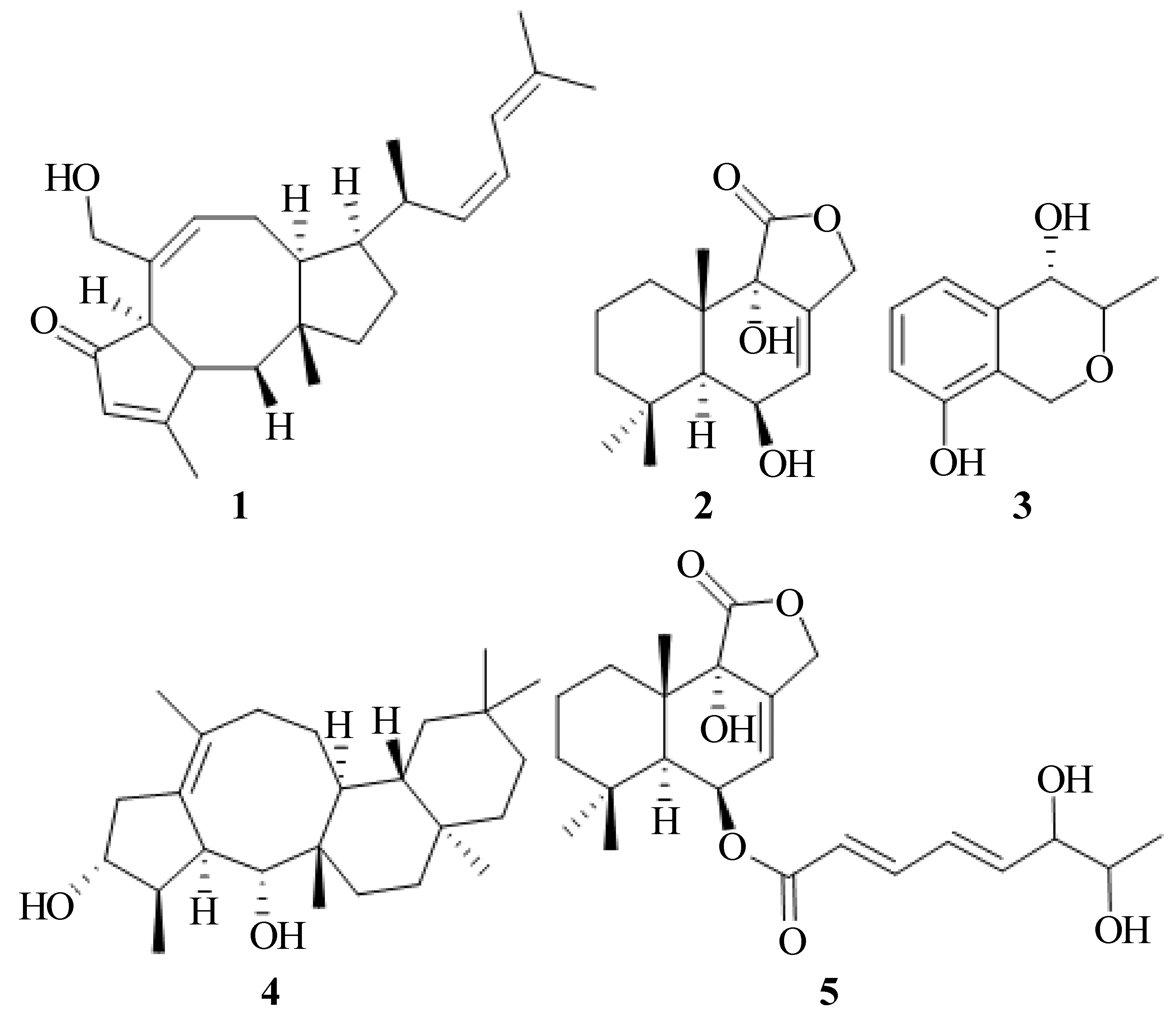
图1 化合物1,2,3,4,5的结构式Fig.1 Structures of compounds 1,2,3,4,5
1 实验部分
1.1 仪器与材料
Bruker AVANCE 400 核磁共振仪(瑞士Bruker公司),LC-6AD半制备高效液相色谱(日本岛津公司),DSQ电子轰击电离质谱仪-低分辨(美国Thermo公司),Nicolet 6700研究型红外光谱仪(美国Thermofisher公司),Perkin Elmer Lambda 25紫外可见分光光度计(美国珀金埃尔默公司),SPX-250B-Z生化培养箱(上海博迅公司),Infinite F200多功能酶标仪(奥地利TECAN公司)。
薄层层析板(GF254)和柱层析硅胶(300~400目)购自青岛海洋化工厂;C18反相硅胶(40~63 μm),为德国Merck公司产品;凝胶Sephadex LH-20(18~110 μm),为美国Pharmacia公司产品;α-Glucosidase(α-葡萄糖苷酶)购自Sigma公司;4-Nitrphtnyl α-D-glucopyranoside(4-硝基苯-α-D-吡喃葡萄糖苷)(PNPG)和Acarbose(阿卡波糖) 均购自阿拉丁公司;其他试剂均为国产分析纯。
1.2 菌种及菌种培养
红树林内生真菌5Y采自广东阳江海陵岛桐花树叶,利用ITS序列分析技术鉴定为曲霉属真菌为Aspergillussp.(KT715696),保藏号为CGMCC 3.15554。PDA液体培养基进行发酵培养,共接种100 L。28 ℃室温条件下静置培养30 d。
1.3 提取与分离
菌液用纱布过滤,45 ℃减压浓缩至3 L,乙酸乙酯萃取3次;菌丝晒干后用甲醇浸泡3次。将萃取物和浸提物混合后采用硅胶(300~400目)柱色谱分离,以石油醚-乙酸乙酯-甲醇梯度洗脱,收集各极性组分,再经过反复硅胶柱层析、反相硅胶柱层析、凝胶和HPLC等分离方法,得到化合物1(28.8 mg),化合物2(31.9 mg),化合物3(9.6 mg),化合物4(50.7 mg),化合物5(9.4 mg)。
1.4 α-葡萄糖苷酶抑制活性测试
采用96孔板法。样品初始浓度为50 000 μmol/L,二倍稀释法,使样品浓度变为50 000、25 000、12 500、6 250、3 125、1 562.5、781.25、390.63、195.31、97.66、48.83 μmol/L。药物反应孔加入10 μL药液和40 μL α-葡萄糖苷酶(0.1 U/mL),阳性反应孔加入10 μL阿卡波糖(0.1 U/mL)和40 μL α-葡萄糖苷酶,空白反应孔加入10 μL DMSO和40 μL α-葡萄糖苷酶,药物对照孔加入10 μL药液和40 μL磷酸缓冲液,阳性对照孔加入10 μL阿卡波糖和40 μL磷酸缓冲液,空白对照孔加入10 μL DMSO和40 μL磷酸缓冲液。微型振荡器上震荡30 s,置于恒温37 ℃水浴中孵育10 min后,每孔加50 μL底物(1 mmol/L的PNPG)后,在微型振荡器上震荡30 s,在恒温水浴锅中37 ℃孵育30 min。最后每孔加入100 μL Na2CO3(1 mol/L)终止反应。在酶标仪405 nm处测定吸光度值[9]。
2 结 果
2.1 结构鉴定



2.2 α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶抑制实验中,当化合物1的最终浓度分别为2 500、1 250、625、312.5、156.25 μmol/L时,以及当化合物4的最终浓度分别为156.25、78.13、39.07、19.54、9.76和4.88 μmol/L时,计算各浓度的抑制率。用Origin算出半数抑制浓度,得出,化合物1的IC50为(676.09±10.3) μmol/L,化合物4的IC50为(9.57±0.2) μmol/L,阳性对照阿卡波糖的IC50为(1 075.53±11.94)μmol/L。
3 讨 论
本文对红树植物曲霉属真菌5Y的次级代谢产物进行了详细的研究,PDA液体培养基对5Y进行发酵培养。通过硅胶柱色谱、反向硅胶、凝胶LH-20以及制备型高效液相等各种色谱手段,从曲霉属内生真菌5Y分离得到了5个单体化合物:6-epi-ophiobolin P(1),strobilactone A(2),penicisochroman E(3),asperterpenolB(4),(E,E)-6-(6′,7′-dihydroxy-2′,4′-octadienoyl)-strobilactone A(5)。在α-葡萄糖苷酶抑制实验中,化合物1,4对α-葡萄糖苷酶有显著的活性,IC50分别为(676.09±10.3) μmol/L和(9.57±0.2) μmol/L。这为开发α-葡萄糖苷酶抑制剂提供一定的理论依据。另外,已有文献报道,化合物4对乙酰胆碱酯酶具有强的抑制作用,其IC50为(3.0±0.1) μmol/L[13]。
[1] 王艳磊,蓝雄,黄华容,等.南海红树林内生真菌Aspergillussp.9H次级代谢产物的研究[J].中山大学学报(自然科学版),2015,54(4):99-101. WANG Y L, LAN X,HUANG H R,et al.Secondary metabolites of mangrove endophytic fungusAspergillussp. 9H in the South China Sea[J]. Acta Scientiarum Naturalium Universitis Sunyatseni,2015,54(4):99-101.
[2] 李春远,龚兵,黄素萍,等. 红树林内生真菌K38和E33共培养代谢产物研究[J]. 中山大学学报(自然科学版),2013,53(2):66-69. LI C Y, GONG B,HUANG S P,et al. Studys on the metabolites from the co-culture broth ofmangrove endophytic fungi K38 and E33[J]. Acta Scientiarum Naturalium Universitis Sunyatseni, 2013,53(2):66-69.
[3] 申毅.海洋微生物土曲霉的代谢产物及雪莲中石油醚部分的化学成分研究[D].哈尔滨:黑龙江中医药大学,2010. SHENG Y. Study on the chemical constituents from metabolites of marine microorganismAspergillusterreusand petroleum ether fractions ofSaussureainvolucrate[D]. Harbin: Heilongjiang University of Traditional Chinese Medicine,2010.
[4] 李春艳,郭顺星,王春兰.抑制肿瘤细胞活性的红树林植物内生真菌代谢产物研究进展[J].安徽农业科学,2012,40(2):702-705. LI C Y,GUO S X,WANG C L.Research progress on inhibiting tumor cell activity metabolites by mangrove endophytic fungus[J]. Journal of Anhui Agri Sci, 2012,40(2):702-705.
[5] 何仁发,李明月,王娟,等.木榄根际土壤来源的曲霉属真菌F5及其抗菌活性代谢产物[J].菌物学报,2010,29(5):732-738. HE R F, LI M Y,WANG J, et al.Aspergillussp. F5 from the rhizospheric soil of Bruguieragymnorrhiza and its antibacterial metabolites[J]. Mycosystema,2010,29(5):732-738.
[6] 徐基伟,车茜,朱天骄,等.曲霉属真菌AspergillussclerotiorumXJW-56中抗肿瘤活性次级代谢产物研究[J].中国海洋药物,2014,33(2):13-18. XU J W,CHE Q,ZHU T J,et al.The cytotoxic secondarymetabolites fromthe South China Sea derivedfungusAspergillussclerotiorumXJW-56[J]. Chinese Journal of Marine Drugs,2014,33(2):13-18.
[7] 李端,郭利伟,郭伟云,等.抗肿瘤药用植物及其内生菌活性代谢产物的研究[J].安徽农业科学,2009,37(16):7508-7509. LI D,GUO L W,GUO W Y, et al. Study on active metabolitic ingredients from antineoplastic plants and it’s endophytes[J]. Journal of Anhui Agri Sci, 2009,37(16):7508-7509.
[8] 李莹,李进军,王辂,等. 海洋曲霉属真菌菌株F5抑菌活性代谢产物的分离与鉴定[J].中国抗生素杂志,2013,38(3):191-194. LI Y,LI J J,WANG L,et al.Isolation and structural elucidation of the antibacterial metabolites produced by marine-derivedAspergillusstrain F5[J].Chinese Journal of Antibiotics,2013,38(3):191-194.
[9] 李玉萍,白冰,叶军,等.α-葡萄糖苷酶抑制剂的制备和活性研究进展[J].食品科学,2008,29(9):617-620. LI Y P, BAI B,YE J, et al. Reviews on preparation and determination of α-glucosidase inhibitor[J].Food Science, 2008,29(9):617-620.
[10] LIU H B, EDRADA-EBEL R A, EBEL R, et al. Ophiobolin sesterterpenoids and pyrrolidine alkaloids from the sponge derived fungusAspergillusustus[J]. Helvetica Chimica Acta,2011,94(4):623-631.
[11] SHIONO Y, HIRAMATSU F, MURAYAMA T, et al. Two drimane-type sesquiterpenes, strobilactones A and B, from the liquid culture of the edible mushroom strobilurus ohshimae[J].Cheminform,2008,39(12):1585-1589.
[12] TRISUWAN K, RUKACHAISIRIKUL V, SUKPONDMA Y, et al. Furo[3, 2-h]isochroman, furo[3,2-h] isoquinoline, isochroman, phenol, pyranone,and pyrone derivatives from the sea fan-derived fungusPenicilliumsp.PSU-F40[J].Tetrahedron, 2010,66(25):4484-4489.
[13] XIA Z E,HUANG H R,SHAO C L, et al. Asperterpenols A and B, new sesterterpenoids isolated from a mangrove endophytic fungusAspergillussp.085242[J].Organic Letters,2013,15(10):2522-2525.
[14] LIU X H, MIAO F P,QIAO M F, et al. Terretonin,ophiobolin,and drimane terpenes with absolute configuration from an algicolousAspergillusustus[J].Rsc Advances,2013,3(2):588-595.
The secondary metabolites and bioactivities of mangrove endophytic fungusAspergillussp. 5Y in Yangjiang
LIHaibin,LANXiong,LIUTing,GUOJunxin,HUANGHuarong,ZHANGKun
(School of Chemical Engineering and Light Industry,Guangdong University of Technology,Guangzhou 510006,China)
The secondary metabolites of mangrove endophytic fungusAspergillussp.5Y was studied in this work.The chemical constituents were isolated and purified through silical gel,Sephadex LH-20,ODS-C18columnchromatography and HPLC and identified through IR,UV, mass anylysis and NMR specctroscopy. Five compounds were isolated from secondary metabolites of mangrove endophytic fungusAspergillussp.5Y and their structures were identified as 6-epi-ophiobolin P(1),strobilactone A(2),penicisochroman E(3),asperterpenol B(4),and (E,E)-6-(6′, 7′-dihydroxy-2′,4′-octadienoyl)-strobilactone A(5).Compound 1,4 have a good inhibition on α-glucosidase,IC50values of (600.13±10.3) μmol/L,(9.57±0.2) μmol/L respectively, which provides a certain theoretical data for researching and developing oral hypoglycemic drugs.
mangrove;endophytic fungus;secondary metabolites
10.13471/j.cnki.acta.snus.2017.03.015
2017-03-13 基金项目:国家自然科学基金(211102020)
李海斌(1990年生),男;研究方向:天然产物化学;E-mail:964841823@qq.com
黄华容(1978年生),女;研究方向:天然产物化学;E-mail:hrhuang@gdut.edu.cn
O629
A
0529-6579(2017)03-0100-05

