银纳米粒子生物催化合成的研究进展
张闻韵, 童 燕, 余建云, 陈鑫鑫, 王安明
(杭州师范大学 材料与化学化工学院,浙江 杭州 310036)
·综合评述·
银纳米粒子生物催化合成的研究进展
张闻韵, 童 燕, 余建云, 陈鑫鑫, 王安明
(杭州师范大学 材料与化学化工学院,浙江 杭州 310036)
综述了银纳米粒子生物催化合成的研究进展,重点阐述了以微生物(细菌、真菌、酵母和链霉菌)、植物浸取液(多酚类化合物和植物蛋白质)和酶(硝酸还原酶、辣根过氧化物酶和磷酸酶)等为催化剂或还原剂合成纳米银生物的方法,并对其未来发展进行了展望。参考文献51篇。
银纳米粒子; 生物合成; 酵母菌; 酶; 植物浸取物; 交联酶聚集体; 综述
银纳米粒子同其他纳米材料相同,处在原子簇和宏观物体交界的过渡区域,具有表面效应、小尺寸效应和宏观量子隧道效应,近年来在多个领域的应用日益受到人们的重视。(1)抗菌应用方面,银离子和含银化合物可以杀死或抑制细菌、病毒、藻类和真菌,有对抗疾病的效果,又被称为亲生物金属。当银的粒径达到纳米级时,由于呈现出表面效应和量子效应,其抗菌性能将增大数千倍。因此纳米银在医学领域的应用已经成为研究的热点。(2)环保应用方面,贵金属纳米颗粒由于表面等离基元共振[1],能有效地吸收可见光,被广泛运用于室内污染控制。(3)纳米银粒子可以应用于表面增强拉曼散射技术(SERS)。(4)银纳米粒子在生物催化领域也有应用,本课题组[2]曾将纳米银粒子与酶蛋白共同组装在二氧化硅载体表面,借助银与蛋白质所含氨基酸中氨基之间的作用,并用红外光谱验证了银纳米粒子对酶蛋白的结构的稳定,同时,实验结果证实银的介入有效富集了酶催化的底物,增强了酶的催化活性。
传统的纳米银合成方法主要包括物理法和化学法[3]。物理法原理比较简单,是将大块的单质银变成纳米级的银粒子。常用的制备方法有物理粉碎法、蒸发冷凝法、溅射法、雾化法、机械球磨法等[4]。物理法制备的纳米银质量好、杂质少,但所得纳米银粉末粒径较大,分布不均匀。因此,物理法一般只适用于尺寸、形状及性能要求不是太高的生产和制备[5]。除此之外,物理法对仪器和设备的要求较高,所用的设备昂贵,生产成本高且条件不易控制。化学制备纳米银的原理主要是使用还原剂将Ag1+还原为纳米银颗粒[6-7]。主要有液相化学还原法、光化学还原法[8]、电化学还原法、溶胶-凝胶法、微波辅助法[9]、微乳法[10]等。以鲁志强等[11]报道的液相化学还原法为例,以聚乙烯醇(PVA)作分散剂,硼氢化钠为还原剂,硝酸银为前驱体,制得平均粒径120 nm的纳米粉。此外,随着科技的发展,纳米材料的化学制备方法也在不断改进。江桂斌课题组[12]发现稳定存在的纳米硫化银(Ag2S-NPs)在环境浓度Fe3+作用下,明显地转化为AgNPs。光照下,Ag2S-NPs通过Fe3+还原为Fe2+时水溶液中生成的羟基自由基的氧化作用,释放大量银离子;而释放的银离子由于Fe2+的还原性,又逐渐转化为AgNPs,引起银离子浓度持续下降。这种在Fe3+作用下生成AgNPs的方式,为AgNPs的合成开辟了新的解决途径,但是这种新型的AgNPs制备方法效率不高,纳米银粒子的分散效果也无进一步的优化,因此该成果仅处于起步阶段,现在依然使用传统的化学方法合成纳米银粒子。然而想要用化学方法合成粒径较小、性能较好的纳米颗粒,很难避免以下缺陷:(a)使用有毒溶剂;(b)较多有害的副产物;(c)使用过量的溶解度较小的金属前驱体;(d)为了得到稳定的纳米银粒子需要加入稳定剂、保护剂[5],例如,硼氢化钠等毒性较大的还原剂或覆盖剂,限制了它在生物医学中的应用,且不符合绿色化学的发展理念[13-15]。
随着纳米银的应用被逐渐推广,如何回收重新制备、如何更加低能高效地合成纳米银并将其投入工业生产是目前纳米银行业的重要研究问题。由于物理方法和化学方法存在耗能高或产生对环境有一定危害的副产物等大量弊端,与可持续发展理念相违背,因此生物合成方法应运而生[15-16]。生物合成法是采用生物材料或生物体天然合成纳米微粒,无需高压、高能耗、高温或有毒化学品[18]。该方法简单、容易控制、成本低、不污染环境[19-20],且与化学还原法制得的纳米银相比,生物合成的纳米颗粒更加稳定,且方法更为安全、低毒,越来越受到研究者的青睐,成为近几年的研究焦点[21-22]。
生物合成纳米银的方法有两种: 细胞内合成法和细胞外合成法。细胞内生物合成法,主要原理是细胞内有一些酶可以引起金属离子的还原,其机制尚未明确。主要涉及两个过程,生物合成纳米粒子以及纳米粒子的纯化。该合成方法纯化过程极为复杂且成本较高。细胞外生物合成法是将细菌细胞从培养基中分离出来,使用上层清液来合成纳米粒子。虽然胞外生物合成法的回收提取过程简单廉价,但对于纳米粒子的大限形状有一定的限制,一般为10 nm~6 μm,该限制对纳米银粒子的制备和纯化并不会有太大影响。
1 微生物介导催化合成纳米银
1.1 细菌介导催化合成纳米银
细菌是首次被报道可以合成纳米银的微生物体系。细菌拥有易处理和遗传操作等优良的特点,被认为是最有效的环保型纳米工厂[18]。截止目前,大肠杆菌、阴沟肠杆菌、肺炎克雷伯菌、嗜酸乳杆菌、金黄色葡萄球菌、假单胞菌属、节细菌属、芽孢杆菌和不动杆菌等原核生物制备纳米银的合成方法已被报道[23]。
然而金属银自古以来就有广泛的抗菌作用,对细菌有较大的毒性,如何保证细菌在高浓度银离子的环境中良好的存活下来成为细菌合成纳米银的一大难题。研究发现,Azospirillum固氮螺菌,在高浓度的金属离子中能较好的存活,并能较好的生物还原金属离子。在此基础上其原理得以证实,Azospirillum固氮螺菌能促使金属离子的络合失活,再加上其细胞壁的抗渗性及生物还原性,外排系统的耐药性等一系列作用,减弱了环境的毒性,进而增强细菌对银离子毒性的抵抗能力,在高浓度的金属离子环境中依然保证还原的效率,这为细菌合成纳米银粒子提供了重要的突破口。针对这一特性, Kupryashina等[24]使用Azospirillum固氮螺菌作为还原剂,得到10~80 nm的银微粒。为进一步证实其真正作用于银离子还原过程的物质为Mn-过氧化物酶,通过进一步实验,提取纯化Azospirillum固氮螺菌中的Mn-过氧化物酶,将其加入实验中,于室温反应12 h,成功合成粒径为9~40 nm的较为稳定的纳米银粒子(图1),经表征发现,在纯化的酶参与后制得的纳米银其稳定性大大增强,在10 d内不发生聚集或絮凝。Mn-过氧化物酶含有氧化还原酶血红素,能催化许多芳香族、杂环化合物和有机物质进行氧化分解。Mn-过氧化酶的催化活性主要取决于酶中的Mn2+, Mn2+能在底物上独立作用, Mn-过氧化酶作为一个经典的过氧化酶,在反应中会形成过氧化氢,因此Kupryashina等猜测纳米银的还原与过氧化氢有较为密切的关系。

图1 Azospirillum固氮螺菌内Mn-过氧化物酶 催化合成银纳米粒子的TEM图Figure 1 TEM of silver nanoparticles synthesized by Mn-dependent peroxidase from Azospirillum
表皮葡萄球菌能在细胞内生物合成纳米银,且合成的纳米银在反应完成后,能够均匀地分布在整个细胞质和细胞壁外表面,大大简化了纳米银粒子的纯化步骤,并且促进了细胞组分的回收利用。葡萄菌是通过“排毒”的途径合成纳米银粒子。这种途径巧妙地避开了金属粒子的毒性,并捕获它们,通过微生物中的硝酸还原酶及糖在细胞质和细胞壁的部位进行银离子的还原,经研究证实,硝酸还原酶对金属离子的还原是有效的,生化试验表明,表皮葡萄球菌(ATCC 12228)在硝酸还原酶试验中显示为弱阳性。
Amin等[25]尝试了以AgNO3溶液为银源,在细胞内成功合成纳米银离子,将其较为均匀地分散于细胞的整个细胞质和细胞壁的外表面(图2),使用凝胶电泳技术分离出纳米银粒子,所得的纳米粒子大小均匀,平均分布在40 nm以下。表征后发现用生物方法合成的纳米银粒子在表面有一层天然的保护层,与化学合成的纳米银粒子相比,具有更好的抗强光性、抗聚集性和低毒性,性能更为优越,应用空间也更为广泛。

图2 在表皮葡萄球菌的细胞内合成银纳米的TEM图Figure 2 TEM images of intracellular biosynthesis of silver nanoparticles in Staphylococcus epidermidis

图3 产碱菌还原硝酸银合成AgNPs的SEM图Figure 3 FE-TEM images of AgNPs by Variovorax guangxiensis THG-SQL3
Guangxiensis产碱菌THG-SQL3是一种促进植物生长的菌种,易从土壤中分离得到,它还能降解苯丙氨酸、对苯二甲酸二甲酯和多种除草剂等有害物质。Du等[26]使用Guangxiensis产碱菌 THG-SQL3还原Ag+,于28 ℃反应24 h胞外合成纳米银粒子,高速离心分离出纳米银粒子,其径粒在10~40 nm之间且呈不规则的球形(图3)。该纳米银粒子对多种病原体包括黄色葡萄球菌、白色念珠菌、热带念珠菌等都具有非常好的抗菌活性,由于其原料取材方便、绿色,在未来的生物合成纳米银领域具有很好的发展前景。
Mb是由甲烷氧化菌向胞外分泌的与铜结合的小肽,Mb除与铜结合外也能与金、铁、镍、锌、钴、钙和汞等金属结合。Mb能够将Au(III)还原成Au(0)形成纳米金,Mb起到双重作用,既为还原剂又为保护剂。同时,Mb介导合成的纳米金在大小和形态上与其他方法相比有着明显的优势,这种优势同样可以运用于纳米银的合成。范洪臣等[27]以硝酸银为前体物,使用甲烷氧化菌一步制得纳米银,其中甲烷氧化菌素(Mb)为还原剂,将Ag+还原为Ag,得到纳米银粒子(AgNPs),其中Mb吸附在形成的AgNPs表面起到保护剂作用,避免AgNPs聚集沉淀。在此研究成果基础上,该团队提出其反应机制(图4)。
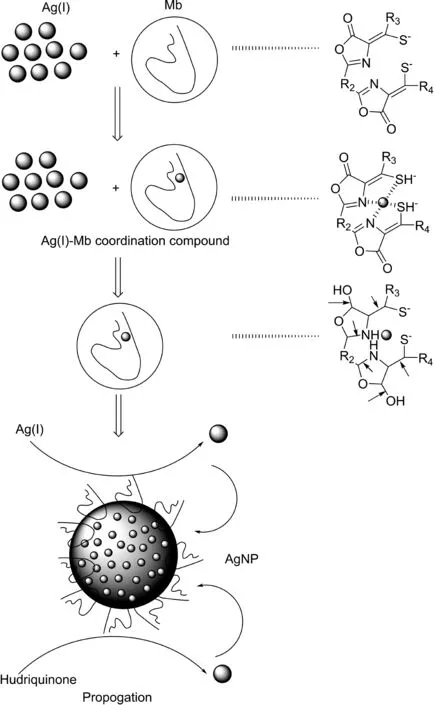
图4 甲烷氧化菌素(Mb)还原Ag+的反应机制Figure 4 Proposed mechanism of the formation of Ag+ by Mb
1.2 真菌介导催化合成纳米银
近年来有不少生物法合成AgNPs的报道,微生物材料是目前最常见的生物还原材料,但是采用细菌合成的纳米材料大多数分布在菌体细胞内部,给纳米颗粒的下游纯化加工带来了一定的困难,从而限制了其应用。真菌具有较高的金属离子耐受性,能高效分泌大量的胞外酶和蛋白质作为还原剂和包覆剂,进行细胞外合成纳米颗粒,使得胞外合成成为可能。同时真菌的扩大培养较为快捷且其下游的分离纯化步骤较为简便[28],因此利用真菌合成纳米银具有广阔的发展前景[29]。
目前,经报道成功合成纳米银粒子的真菌已有酵母菌株MKY3、白色念珠菌、白念珠菌、布拉酵母菌、产朊假丝酵母菌等单细胞真菌[30]。
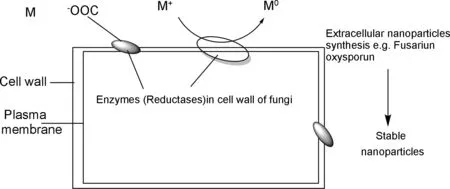
图5 真菌生物合成纳米颗粒的假设模型Figure 5 Hypothetical model of nanoparticles biosynthesis by Fungus

图6 裂褶菌制备纳米银的SEM图Figure 6 SEM images of extra cellular silver nanoparticles produced by S.commune
Dhillon等[18]对目前纳米粒子绿色合成方法的综述中,提出了真菌合成纳米颗粒的假想模型,认为真菌合成纳米银主要分为四步:第一,金属离子与细胞壁中的酶之间的静电相互作用;第二,酶将M+还原到M0状态;第三,细胞内合成纳米粒子;第四,真菌胞外合成纳米颗粒(图5)。裂褶菌(Schizophyllum commune)是一种蘑菇菌(mushroom fungus)菌中分泌的生物酶和蛋白质可作为合成纳米银的还原剂和包覆剂,在氨基酸、多糖和维生素以及其他杂环化合物的辅助下,将银离子还原为银单质后聚合生成纳米银粒子,且其所生成的纳米银粒子均匀地粘附在细胞壁上,通过过滤和离心即可获得较为纯净的纳米银粒子。Arun等[31]使用该种方法,成功合成较高产率的纳米银粒子(图6)。
寄存在寄主植物的组织内,且对寄主的生命并不造成危害的真菌称为内生真菌。Balakumaran等[32]从柑橘叶中分离内生真菌G.mangiferae(图7),使用G.mangiferae合成银纳米粒子,反应12 h即可得到粒径为8~20 nm的球形纳米粒子。该方法具有高度的生物相容性,能广泛适用,在生物、医药和农业等行业具有较大的发展潜力。
植物病原真菌Macrophominaphaseolina(Tassi)Goid是一种较为优良的生物还原试剂。真菌的菌丝垫能承受压力、搅拌或其他生物反应条件,且真菌胞外分泌的还原性蛋白在合成纳米银中能避免不必要的细胞干扰,因此能在纳米银的合成中直接使用。Macrophominaphaseolina(Tassi)Goid能分泌胞外还原酶如萘醌和蒽醌类物质,能将Ag+还原为Ag0。由于能产生大批量相对较纯的还原酶,真菌介导法是特别有利的大规模的合成纳米颗粒的高效生物方法。

图7 内生真菌G.mangiferae还原纳米银粒子的SEM图Figure 7 SEM images of silver nanoparticles synthesized from G.mangiferae
Chowdhury等[33]使用植物病原真菌Macrophominaphaseolina的无细胞滤液合成纳米银粒子。反应24 h通过简单过滤便可得到粒径为5~40 nm的纳米银粒子(图8)。其中85-kDa蛋白质作为覆盖剂并负责合成纳米银。使用该方法合成的纳米银粒子对人体和植物病原菌具有多重耐药的抗菌活性,对微生物的生长具有较好的抑制效果,在生物、医用领域具有较为良好的发展前景。
1.3 酵母介导催化合成纳米银
作为世界上最广泛应用的微生物,酵母菌在食品加工等领域被广泛应用,但合成纳米粒子的报道却鲜有人知。Eugenio等[30]从白蚁肠道中分离出酵母,首次用酵母菌在多种光谱技术的辅助下胞外成功合成纳米银粒子,且是粒径在2~10 nm间的球形的纳米银粒子(图9)。由于该方法制得的纳米粒子具有较大的比表面积,在催化工业具有较为强大的潜在发展。除此之外,他们还对所获得的纳米银粒子进行了抗菌测试,结果表明,该纳米银粒子具有强强的杀菌性能,对金黄色葡萄球菌、肺炎克雷伯菌的抗菌性能良好。可见,使用酵母菌合成的纳米银粒子在工业生物领域,特别是在微生物工业领域具有较好的发展前景。

图8 植物病原真菌M. phaseolina介导还原纳米银 的电子显微照片Figure 8 Electron micrographs of silver nanoparticles with M. phaseolina

图9 酵母菌株体外合成纳米银粒子的HR-TEM图Figure 9 HR-TEM of the nanoparticles biosynthesized by SNPP2
1.4 链霉菌介导催化合成纳米银
链霉菌是一种较为重要的真菌。75%的天然抗生素产自于土壤中链霉菌属,以至于生物能够适应土壤中重金属及酸性的环境。除此之外,链霉菌属的多种次生代谢产物也具有独特的潜在能力,可广泛应用于如抗生素、免疫抑制剂等其他生物活性化合物的制备。开发链霉菌并将其运用于纳米技术近年来广受重视。
Desai等[34]用链霉菌sp. GUT 21的上层清液中的二代代谢产物作为还原剂,在热水中制备纳米银粒子,得到粒径在23~48 nm的球形纳米银粒子(图10)。链霉菌提取物作为覆盖剂和稳定剂在高温高压过程中能够防止纳米银的进一步聚集和团聚,得到分散性良好的纳米银粒子。通过抗菌性测试,发现其对大肠杆菌(MTCC 9537)、克雷白氏杆菌(MTCC109)、绿浓杆菌(MTCC1688)、金黄色酿脓葡萄球菌(MTCC 96)等都具有良好的抗菌作用。

图10 链霉菌sp.GUT 21介导还原纳米 银粒子的AFM图Figure 10 AFM image of biosynthesised AgNPs from Streptomyces sp.GUT 21
2 植物浸取液合成纳米银
作为新兴的制备方法,生物还原法采用的生物源中,植物是非常理想的合成纳米粒子的材料。植物由于其次生代谢物具有强还原电位,且在还原金属离子时可同时作为稳定剂和还原剂[35]。利用植物的浸取液为还原剂还原Ag+溶液得到纳米粒子,既能还原Ag+得到纳米粒子,又能保护环境,成为近几年的研究热点[36]。另外,相对于真菌和细菌,植物对于金属毒性不太敏感,无需培养,解除了无菌条件的限制,是一种新兴的生物合成纳米粒子材料[35]。与物理和化学方法相比,由植物合成纳米粒子的速率更快,且其本身可作为一种覆盖剂,使得所产生的纳米粒子是更稳定[37]。植物中的多种植物化学物质在金属银离子的环境中可作为合成纳米银的还原剂,例如萜类化合物、黄酮类、苯酚衍生物、植物酶(氢化酶、还原酶、醌类)及其衍生物等。由于植物合成纳米金属是在细胞内合成的,而细胞内固有的并发症等原因,使得颗粒的分离变得困难,植物浸取液便很好的解决了这个问题。已发现的用来制备纳米银粒子的植物有很多,金钱草[38]、印楝叶[39]、苍耳子[40]、播娘蒿[41]、丁癸草[42]、绿茶[43]、普洱茶[43]、西瓜[44]、夹竹桃[45]等植物提取液都可制备出纳米银。从植物中寻找高效、廉价、低毒的天然还原剂成为目前抗氧化剂发展的一个必然趋势。
2.1 多酚类化合物还原纳米银粒子
苍耳子属菊科,俗称苍耳,在印度是一种常见的杂草。研究显示,该植物的化学成分多样,如生物碱、黄酮类、萜类、单宁、茶多酚、鞣质、皂苷类、醌类、蛋白质和糖类。Kumar等[40]对苍耳叶提取物进行了研究,发现其有较高含量的单宁等多酚类化合物,具有潜在的快速合成纳米银粒子的功能。该团队采用生物还原法,用苍耳子水提取物为原料,以其中的单宁等多酚类化合物为还原剂,以浸取液中的蛋白质分子为稳定剂,在无任何仪器的支持或外部能源供应(加热和搅拌)的情况下,通过光诱导过程在40 s内快速高效地把Ag+从AgNO3溶液中还原为Ag,得到纳米银粒子。他们在此基础上提出了反应机理(图11)。当反应混合物暴露在阳光下,单宁分子吸收了光子的能量,其中n组参与反应的(R-OH)并且通过释放的O-H中的H+,将Ag+生物还原得到Ag。

图11 苍耳子水提取物还原合成纳米银的机理Figure 11 The schematic representation of synthesis silver nanoparticle using aqueous extract of Xanthium strumarium
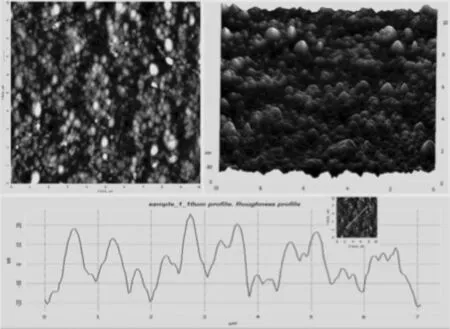
图12 苍耳子水提取物还原合成纳米银的AFM图Figure 12 AFM images of biosynthesized AgNPs using aqueous extract of Xanthium strumarium

图13 绿茶浸取液还原合成纳米银的SEM图Figure 13 TEM of nano silver powder with green tea

图14 夹竹桃叶水提取物还原合成纳米的SEM图Figure 14 SEM images of silver nanoparticles using aqueous leaf extract of Thevetia peruviana Juss
他们对合成工艺进行了优化,得出最佳条件,得到粒径为12~34 nm的球形纳米银(图12)。
绿茶是指釆取茶树新叶,未经发酵,经杀青、揉挣、干燥等工艺制成的茶,冲泡后茶汤较多的保存了鲜茶叶较多的天然物质。绿茶浸泡后,可以用水作溶剂萃取它的活性物质。其主要活性成分为茶多酚,占茶叶干质量的20~35%。茶叶中水溶性有效成分主要是黄焼醇、黄烧双醇、生物碱、粉酸、茶黄素、茶红素和氨基酸等。
由于茶叶中的茶多酚有极强的抗氧化性,以茶叶浸取液中的茶多酚及黄酮类化合物为还原剂,在反应中可同时起还原和分散作用。王迎春等[43]采用绿茶提取液生物合成纳米银,制得球形的纳米银粒子,平均粒径在32.4 nm。制备的最佳条件是AgNO3浓度为0.08 mol·L-1,绿茶与水的配比为1 g/80 mL,不添加任何表面活性剂,于40 ℃反应2 h,快速得到径粒大约为30 nm的纳米银粒子(图13)。
黄花夹竹桃,是一种常绿观赏植物,双子叶的灌木。该植物原产于美国中部和南部,常见于热带和亚热带地区。黄花夹竹桃叶存在酚类、蛋白质、黄酮醇苷。之前使用T.夹竹桃乳胶合成银纳米粒子已被报道。Oluwaniyi等[45]以植物介导法用黄花夹竹桃叶水提取物快速合成纳米银粒子,得到平均粒径在18.1 nm的球形纳米银粒子(图14),确定了夹竹桃作为一个潜在合成纳米银的有效功能,且该纳米银粒子对真菌病原体和细菌具有抑制作用。
他们发现夹竹桃叶中的黄酮苷多酚基团具有较强的还原性能,并对其还原银离子的机理做出了大胆猜测:可能是黄酮苷多酚类物质还原了Ag+从而得到纳米银粒子,糖苷中的羟基和羰基在纳米银的还原中作为还原剂和稳定剂(图15)。

图15 黄酮苷多酚类物质还原Ag+的机理Figure 15 Possible bioreduction mechanism of Ag+reduced by flavanone glucoside

图16 播娘蒿浸取液还原合成纳米银粒子的TEM图Figure 16 TEM images of the synthesized silver nanoparticles in different scales

图17 利用红豆杉愈伤组织合成的纳米银粒子的SEM图Figure 17 TEM image of AgNPs synthesized using callus extracts from T. yunnanensis and AgNO3
播娘蒿索菲亚(播娘蒿)是一年生双子叶植物属十字花科(十字花科),它的种子在民间是常用的药物,用于治疗咽喉疾病。这种植物的种子含有多种次生代谢产物,如强心苷、黄酮类、内酯类、脂类、硫苷、木脂素和香豆素。Khatami等[41]以播娘蒿sophia种子提取液来合成纳米银,得到一种有效的纳米银粒子合成方法。在该种子提取液中,存在各种水溶性代谢产物(如生物碱、酚类化合物、萜类化合物)和辅酶,使得该浸取液具有还原纳米粒子的能力。该团队得到粒径在1~35 nm的球形纳米银粒子,且经表征其均匀度高、稳定性较强(图16)。
纳米技术的进展及其应用已经扩展到不同的生物领域。然而,在使用药物植物及其愈伤组织培养来合成纳米粒子的方法还比较新颖需要进一步研究。据报道,木瓜、海马齿及苜蓿植物愈伤组织已应用于纳米银的绿色合成。
红豆杉愈伤组织提取物中含有次生代谢产物包括紫杉烷类化合物、木脂素、多糖、酚类化合物等。其中植物的多糖和酚类化合物可作还原剂和包覆剂绿色合成纳米银颗粒。Xia等[46]用云南红豆杉愈伤组织进行绿色合成纳米银粒子,得到粒径为6.8~27.2 nm的球形纳米银粒子(图17)。
近年来,各种药用植物材料、微生物、酶、农业废弃物和食品废弃物的综合利用已发生了革命性的发展。西瓜是一种最为丰富的食用水果,西瓜红色的果肉可以食用,但外皮是没有商业价值的废物。然而,西瓜皮是多种生物活性物质,富含纤维素、瓜氨酸、果胶、蛋白质和类胡萝卜素,将西瓜皮作为纳米银的合成方法回收利用,是一种值得推广的方法。
Patra等[44]回收利用农业废弃物——西瓜皮(一种新型的生物性垃圾),利用西瓜皮提取液来合成纳米银粒子,是一种合成纳米粒子的低成本的开发方法。其中西瓜皮中富含黄酮类化合物,酚类化合物、番茄红素、瓜氨酸等,由于具有这些物质,西瓜皮提取液可充当还原剂、稳定剂和覆盖剂用于合成纳米银粒子。所得的纳米银粒子,在光波长为425 nm处有表面等离子体共振,其平均粒径为109.97 nm。
2.2 植物蛋白质还原合成纳米银粒子
大叶山蚂蝗是一种重要的草药的药用植物,属蝶形花科,有较大的医用价值,其中含有丰富的黄酮类、生物碱、有机酸、紫檀碱。Thirunavoukkarasu等[38]通过大叶山蚂蝗的提取物合成纳米银颗粒。以金钱草的水合提取物为原料,还原AgNO3溶液中的Ag+粒子,快速合成多晶结构的纳米银颗粒,其尺寸在18~39 nm,该纳米银粒子稳定性极强,在多个星期后仍然不发生凝聚。在表征过程中,观察到紫外可见光谱中约300 nm处存在一吸收带,并证实这条吸收带是由于在蛋白质中的色氨酸和酪氨酸残基的电子激发产生的。因此推测出可能是大叶山蚂蝗叶中的生物合成产物或还原辅助因子在合成过程中起到了还原纳米银粒子的作用。
与微生物相似,植物能够在受污染的土壤或水源中净化重金属离子,甚至可以将其诱导在植物的相关部位中超累积。而在植物内部的络合金属离子能与一个合适的生物配位体发生氧化还原反应,有一个高价态还原为一个低价态。这就为生物还原纳米银粒子提供了一种新的合成方式。其中,由于植物蛋白质中的羰基化合物具有很强的结合金属能力,因此植物提取液在作为还原剂的同时还可以作为封端剂,保护纳米粒子防止其团聚。
印楝叶是一种在例如印度这种热带国家被广泛使用的植物。印楝叶的主要成分为苦楝素,印楝素,印楝宁,油酸、亚油酸、棕榈酸、硬脂酸、花生酸等。Nazeruddin等[39]使用印楝叶提取液作为还原剂,在不添加任何表面活性剂或者外部能量的条件下,室温反应1~2 h细胞外快速合成纳米银,得到球形、非均匀的分散型纳米粒子,平均粒径为11.5 nm(图18)。经检测,该纳米银粒子结构稳定、生物相容性良好,可用于增强靶向给药治疗效果且副作用最小。
法国蔷薇是一种使用广泛的医用植物,具有抗菌和治疗风湿宁的作用。该植物浸取液中的羰基能够除去芳香族化合物(例如苯)生成纳米粒子,通过纳米银粒子表面有机化合物的检测进一步证实了银离子的还原机制。LuisLópez-Miranda等[47]使用法国蔷薇的植物浸取液作为还原剂和稳定剂,在常温下以硝酸银为银源,能够快速合成纳米银粒子。该纳米银粒子粒径为5~40 nm,呈面心立方体,平均粒径为12 nm(图19),且对大肠杆菌等有较好的抗菌活性。

图18 印楝叶提取液合成的纳米银的TEM图Figure 18 TEM image for silver showing size of nanoparticles using Azadirachta indica leaf extract
3 酶催化合成
体外酶催化反应是目前被广泛认可的替代传统(非生物)的复杂天然产物和有机小分子的合成方法,在银纳米粒子合成中也不例外。使用可溶性形式的纯化酶,不仅产生废物,还限制了酶的再利用。此外,在纯化制得的纳米银中,可溶性酶无可避免成为其中的杂质。固定化酶的使用就恰好避开了这个问题,它不仅可以使酶重复使用,并且可以减少纳米粒子的下游步骤,做到高效的分离,高效的利用。
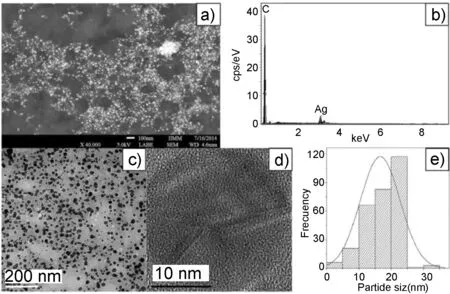
图19 a)法国蔷薇浸取液还原合成的纳米银的SEM图; c)法国蔷薇浸取液还原合成的纳米银的TEM图; d)纳米银晶面的HR-TEM图Figure 19 Analysis of electron microscopy of AgNps synthesized with Tamarix gallica extract: a) SEM image; c) TEM micrograph; d) HR-TEM micrograph showing the crystal planes of silver
3.1 硝酸还原酶
尖孢镰刀菌细胞提取液可以合成纳米银粒子,主要原因是含其有NADH-dependent硝酸还原酶,因此可从尖孢镰刀菌提取物中提取出纯的NADH-dependent硝酸还原酶还原AgNO3溶液中的Ag+来合成纳米银粒子。交联酶聚集体(CLEAs)实质上就是将酶沉积,在可溶的游离酶中加入盐或者有机溶剂,用戊二醛交联形成酶聚集体。由于能进行亚基交联,CLEAs在固定化酶的方式中能形成一种稳定的多聚体酶的四级结构。与载体结合的固定化技术相比,CLEAs具有极高的时空效率,这就很好的避免了固体载体对活性的稀释。
Talekar等[48]使用稳定的CLEAs固定化NADH-dependent硝酸还原酶,使用硫酸铵促进8 mmol·L-1NADH-dependent硝酸还原酶进行交联聚合,反应4 h形成聚集体,该固定化酶具有93%的活性回收率,具有可重用性和热稳定性。且由于CLEAs的粒子的尺寸远大于纳米颗粒,只需要低速离心或者简单过滤就可以简单的将CLEAs粒子从反应混合物中分离离心,整个过程操作简单低耗。最终得到球形的纳米银粒子,其粒径在10~20 nm(图20)。在此基础上还成功地进行了循环四个周期的纳米银粒子批量生产。

图20 使用CLEAs固定化酶合成纳米银的TEM图Figure 20 TEM image of silver nanoparticles synthesized with CLEAs

图21 辣根过氧化酶催化沉积纳米银机理Figure 21 The mechanism of enzyme-catalyzed deposition of silver nanoparticles
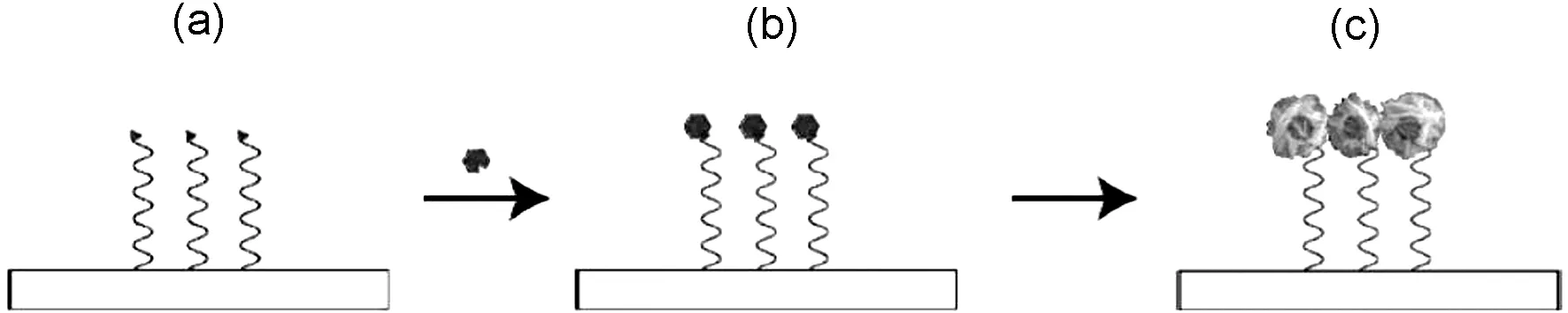
图22 辣根过氧化氢促使酶沉积的生长机制示意图Figure 22 Schematic sketch displaying the growth mechanism of the silver EGNP

图23 用不同起始DNA浓度制备纳米银的SEM图Figure 23 SEM images of silver EGNPs grown from different starting DNA concentrations
3.2 辣根过氧化物酶(HRP)
酶催化银沉积法是常见的酶催化合成纳米银的方法。Conzuelo等[49]使用H2O2溶液为底物,对苯二酚(HQ)为氧化还原介质,硝酸银为银源,在柠檬酸盐缓冲液的缓冲作用下,使用辣根过氧化物酶催化沉积纳米银(图21)。辣根过氧化物酶是由纳米探针所获得的一种专门设计的增强性试剂。诱导银沉积的效率较高,其优点是反应快速及具有高灵敏度。
沙漠玫瑰银纳米粒子由单一的纯银结晶板构成。Schneidewind等[50]以SERS为基底,使用辣根过氧化酶催化沉积纳米银,得到沙漠玫瑰形态的纳米银粒子。具体操作步骤如下,经过初步的基板清洗和准备,第一步,将一个使用氨基修饰的单链DNA绑定到衬底上。第二步,辣根过氧化物酶(HRP)作用并结合到DNA上。第三步,通过酶的催化反应,银沉积被激活,进而促进银的生长(图22)。
在该酶的附近,一个氧原子被从过氧化氢中分离出来,与辣根过氧化物酶的血红素组相连接,从而改变分子内的铁原子的氧化态。在这个过程中,电子给体释放电子以还原生成银粒子。
通过证实,沉积的纳米银无其他杂质,为纯银物质。在反应1~5 min内便可观察到彼此连接、相当致密的银纳米粒子阵列,而在进一步生长的过程中,生成的纳米银粒子可作为种子,在酶催化和纳米银粒子作为“晶种”的共同作用下继续生成纳米银粒子。该沉积制备纳米银的方法快速高效,在DNA浓度为1 μm的条件下,反应不到5 min,便可获得致密的银纳米粒子的薄膜(图23)。
3.3 磷酸酶
碱性磷酸酶(AP)以3-吲哚磷酸盐为底物,将Ag+还原为Ag0的纳米银,并将纳米银从溶液中剥离并沉积,可使用阳极溶出伏安法完成较为灵敏的相应测定。该方法还可作为酶传感器,检测核酸自溶素基因、人类病原体肺炎链球菌的基因组的致病因素等方面。Fanjul-Bolado等[51]以为碱性磷酸酶的电化学底物,成功用碱性磷酸酶催化沉积Ag+还原为纳米银粒子,并提出了该酶促反应的机理(图24)。在碱性磷酸酶的存在下,3-吲哚磷酸盐3-位发生水解,生成一种吲哚中间体。在中间体两两聚合的过程中,Ag+被还原为Ag0。
LimoniaAcidissima是一种落叶直立林木,俗称木苹果或像苹果,原产于印度、巴基斯坦、斯里兰卡和南洋,它具有广泛的生物活性,例如抗糖尿病、保肝活性和抗真菌活性。Pawar等[52]从LimoniaAcidissima分离出紫色酸性磷酸酶作为还原剂和稳定剂,用酶催化法合成银纳米粒子,作为一种新合成银纳米粒子的方法。其中,脱辅基酶蛋白作为还原剂和稳定剂,得到粒径为25~45 nm的纳米银粒子(图25)。

图24 使用3-吲哚磷酸盐碱性磷酸酶还原纳米银的酶促反应机理Figure 24 Enzymatic reaction in the presence of alkaline phosphatase using 3-indoxyl phosphate

图25 酸性磷酸酶催化还原纳米银粒子的SEM图Figure 25 TEM image of silver/silver oxide nanoparticles
纳米材料的生物合成属于交叉学科研究,既追求纳米技术的实用性、前沿性,又融合了生物技术的严谨性、多样性。与传统的物理、化学合成方法相比较,生物合成方法低能耗、无毒环保、可持续发展。本文主要阐述了三种新型的生物合成纳米银的方式。其合成过程主要利用了生物自身的物质,如酶、蛋白质、植物提取液或愈伤组织等,通过氧化还原反应,还原银离子生成相应的纳米银粒子。随着纳米金属粒子的合成和生物技术的紧密结合,纳米材料的生物合成将不仅仅局限于基础的生物提取物的使用,如何高效地提取生物合成有效成分进行新型生物纳米材料的合成将是今后热门的研究要点。随着纳米材料的广泛应用以及可持续发展理念的深入贯彻,纳米材料的生物合成也必将在未来的新型材料制备方面发挥重要的作用。
[1] Wei H Y, Eilers H. From silver nanoparticles to thin films:Evolution of microstructure and electrical conduction on glass substrates[J]. Journal of Physics and Chemistry of Solids,2009,2(70):459-465.
[2] Wang A M, Wang H, Zhou C,etal. Ag-induced efficient immobilization of papain on silica spheres[J].Chinese Journal of Chemical Engineering,2008,4(16):612-619.
[3] Shavel A, Cadavid D, Ibanez M,etal. Continuous production of Cu2ZnSnS4nanocrystals in a flow reactor[J].Journal of the American Chemical Society,2012,3(134):1438-1441.
[4] 郭志睿,柏婷婷,陆鹏,等. 纳米银液相可控制备的研究进展[J].中国材料进展,2016,35(1):1-9.
[5] Mallick K, Witcomb M J, Scurrell M S. Polymer stabilized silver nanoparticles:A photochemical synthesis route[J].Journal of Materials Science,2004,(39):4459-4463.
[6] Yang F J, Yao J, Min J J,etal. Synthesis of high saturation magnetization FeCo nanoparticles bypolyol reduction method[J].Chemical Physics Letters, 2016,14(648):143-146.
[7] He L, Riassetto D, Bouvier P,etal. Controlled growth of silver nanoparticles through a chemically assisted photocatalytic reduction process for SERS substrate applications[J].Journal of Photochemistry and Photobiology a-Chemistry,2014,227(5):1-11.
[8] Maleki N, Safavi A, Farjami E,etal. Palladium,nanoparticle decorated carbon ionic liquid electrode for highly efficient electrocatalytic oxidation and determination of hydrazine[J].Analytica Chimica Acta,2008,2(611):151-155.
[9] Ma Y, Pang Y H, Liu F,etal. Microwave-assisted ultrafast synthesis of silver nanoparticles for detection of Hg2+[J].Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy,2016,(153):206-211.
[10] Li Y H, Qiang Q, Zheng X W,etal. Controllable electrochemical synthesis of Ag nanoparticles in ionic liquid microemulsions[J].Electrochemistry Communications,2015,(58):41-45.
[11] 鲁志强,甘卫平,黎应芬,等. 化学还原法制备微纳米银粉[J].粉末冶金材料科学与工程,2015,(2)200-206.
[12] Wei H, Li J, Wang Y L,etal. Silver nanoparticles coated with adenine:Preparation,self-assembly and application in surface-enhanced Raman scattering[J].Nanotechnology,2007,17(18).
[13] Zhang W, Qiao X, Chen J. Synthesis of silver nanoparticles- effects of concerned parameters in water/oil microemulsion[J].Materials Science and Engineering B-Solid State Materials for Advanced Technology,2007,1(142):1-15.
[14] Rai M, Yadav A, Gade A. Current trends in phytosynthesis of metal nanoparticles[J].Critical Reviews in Biotechnology,2009,1(29):78-78.
[15] Begum N A, Mondal S, Basu S,etal. Biogenic synthesis of Au and Ag nanoparticles using aqueous solutions of black tea leaf extracts[J].Colloids and Surfaces B-Biointerfaces,2009,1(71):113-118.
[16] Albrecht M A, Evans C W, Raston C L. Green chemistry and the health implications of nanoparticles[J].Green Chemistry,2006,5(8):417-432.
[17] Dhillon G S, Brar S K, Kaur S,etal. Green approach for nanoparticle biosynthesis by fungi:Current trends and applications[J].Critical Reviews in Biotechnology,2012,1(32):49-73.
[18] Mittal J, Batra A, Singh A,etal. Phytofabrication of nanoparticles through plant as nanofactories[J].Advances in Natural Sciences-Nanoscience and Nanotechnology,2014,4(5).
[19] Thakkar K N, Mhatre S S, Parikh R Y. Biological synthesis of metallic nanoparticles[J].Nanomedicine-Nanotechnology Biology and Medicine,2010,2(6):257-262.
[20] Ali M, Kim B, Belfield K D,etal. Green synthesis and characterization of silver nanoparticles using Artemisia absinthium aqueous extract-A comprehensive study[J].Materials Science & Engineering C-Materials for Biological Applications,2016,(58):359-365.
[21] Rauwel P, Kuunal S, Ferdov S,etal. A review on the green synthesis of silver nanoparticles and their morphologies studiedviaTEM[J].Advances in Materials Science and Engineering,2015,(2015):1-9.
[22] Kulkarni R R, Shaiwale N S, Deobagkar D N,etal. Synthesis and extracellular accumulation of silver nanoparticles by employing radiation-resistant Deinococcus radiodurans, their characterization, and determination of bioactivity[J].International Journal of Nanomedicine,2015,(10):963-974.
[23] Kupryashina M A, Vetchinkina E P, Nikitina V E. Biosynthesis of silver nanoparticles with the participation of extracellular Mn-dependent peroxidase from azospirillum[J].Applied Biochemistry and Microbiology,2016,4(52):384-388.
[24] Amin Z R, Khashyarmanesh Z, Bazzaz B S F. Different behavior of Staphylococcus epidermidis in intracellular biosynthesis of silver and cadmium sulfide nanoparticles: more stability and lower toxicity of extracted nanoparticles[J].World Journal of Microbiology & Biotechnology,2016,9(32):1-11.
[25] Du J, Yi T H. Biosynthesis of silver nanoparticles by Variovorax guangxiensis THG-SQL3 and their antimicrobial potential[J].Materials Letters,2016,(178):75-78.
[26] 范洪臣,辛嘉英,王艳,等. 甲烷氧化菌素介导一步法合成纳米银[J].分子催化,2016,30(3):276-281.
[27] 刘小莉,胡彦新,彭欢欢,等. 内生真菌绿色生态法合成纳米银的研究[J].现代食品科技,2017,(1):1-9.
[28] 张杰,张映,郭瑞,等. 钩状木霉生物合成纳米银及其杀菌性能[J].微生物学通报,2016,(2):386-393.
[29] Eugenio M, Muller N, Frases S,etal. Yeast-derived biosynthesis of silver/silver chloride nanoparticles and their antiproliferative activity against bacteria[J].Rsc Advances,2016,12(6):9893-9904.
[30] Arun G, Eyini M, Gunasekaran P. Green synthesis of silver nanoparticles using the mushroom fungus Schizophyllum commune and its biomedical applications[J].Biotechnology and Bioprocess Engineering,2014,6(19):1083-1090.
[31] Balakumaran M D, Ramachandran R, Kalaichelvan P T. Exploitation of endophytic fungus,Guignardia mangiferae for extracellular synthesis of silver nanoparticles and theirinvitrobiological activities[J].Microbiological Research,2015,(178):9-17.
[32] Chowdhury S, Basu A, Kundu S. Green synthesis of protein capped silver nanoparticles from phytopathogenic fungus Macrophomina phaseolina (Tassi) Goid with antimicrobial properties against multidrug-resistant bacteria[J].Nanoscale Research Letters,2014,(9):1-11.
[33] Desai P P, Prabhurajeshwar C, Chandrakanth K R. Hydrothermal assisted biosynthesis of silver nanoparticles from Streptomyces sp. GUT 21(KU500633) and its therapeutic antimicrobial activity[J].Journal of Nanostructure in Chemistry,2016,3(6):235-246.
[34] Pandey S, Mewada A, Thakur M,etal. Biogenic gold nanoparticles as fotillas to fire berberine hydrochloride using folic acid as molecular road map[J].Materials Science & Engineering C-Materials for Biological Applications,2013,7(33):3716-3722.
[35] Borase H P, Salunke B K, Salunkhe R B,etal. Plant extract:A promising biomatrix for ecofriendly,controlled synthesis of silver nanoparticles[J].Applied Biochemistry and Biotechnology,2014,1(173):1-29.
[36] Iravani S. Green synthesis of metal nanoparticles using plants[J].Green Chemistry,2011,10(13):2638-2650.
[37] Thirunavoukkarasu M, Balaji U, Behera S,etal. Biosynthesis of silver nanoparticle from leaf extract of Desmodium gangeticum (L.) DC. and its biomedical potential[J].Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy,2013,(116):424-427.
[38] Nazeruddin G M, Prasad N R, Waghmare S R,etal. Extracellular biosynthesis of silver nanoparticle using Azadirachta indica leaf extract and its anti-microbial activity[J].Journal of Alloys and Compounds,2014,(583):272-277.
[39] Kumar V, Gundampati R K, Singh D K,etal. Photo-induced rapid biosynthesis of silver nanoparticle using aqueous extract of Xanthium strumarium and its antibacterial and antileishmanial activity[J].Journal of Industrial and Engineering Chemistry,2016,(37):224-236.
[40] Khatami M, Mehnipor R, Poor M H S,etal. Facile biosynthesis of silver nanoparticles using descurainia sophia and evaluation of their antibacterial and antifungal properties[J].Journal of Cluster Science,2016,5(27):1601-1612.
[41] Govindarajan M, Rajeswary M, Muthukumaran U,etal. Single-step biosynthesis and characterization of silver nanoparticles using Zornia diphylla leaves:A potent eco-friendly tool against malaria and arbovirus vectors[J].Journal of Photochemistry and Photobiology B-Biology,2016,(161):482-489.
[42] 王迎春,陈慧英,蓝蓉. 绿茶提取物制备纳米银[J].环境科学与技术,2013,(12):122-125.
[43] Patra J K, Das G, Baek K H. Phyto-mediated biosynthesis of silver nanoparticles using the rind extract of watermelon (Citrullus lanatus) under photo-catalyzed condition and investigation of its antibacterial, anticandidal and antioxidant efficacy[J].Journal of Photochemistry and Photobiology B-Biology,2016,(161):200-210.
[44] Oluwaniyi O O, Adegoke H I, Adesuji E T,etal. Biosynthesis of silver nanoparticles using aqueous leaf extract of Thevetia peruviana Juss and its antimicrobial activities[J].Applied Nanoscience,2016,6(6):903-912.
[45] Xia Q H, Ma Y J, Wang J W. Biosynthesis of silver nanoparticles using Taxus yunnanensis callus and their antibacterial activity and cytotoxicity in Human Cancer cells[J].Nanomaterials,2016,9(6):1-15.
[46] Lopez-Miranda J L, Vazquez M, Fletes N,etal. Biosynthesis of silver nanoparticles using a Tamarix gallica leaf extract and their antibacterial activity[J].Materials Letters,2016,(176):285-289.
[47] Talekar S, Joshi G, Chougle R,etal. Preparation of stable cross-linked enzyme aggregates (CLEAs) of NADH-dependent nitrate reductase and its use for silver nanoparticle synthesis from silver nitrate[J].Catalysis Communications,2014,(53):62-66.
[48] Conzuelo F, Grutzke S, Stratmann L,etal. Interrogation of immunoassay platforms by SERS and SECM after enzyme-catalyzed deposition of silver nanoparticles[J].Microchimica Acta,2016,1(183):281-287.
[49] Schneidewind H, Schuler T, Strelau K K,etal. The morphology of silver nanoparticles prepared by enzyme-induced reduction[J].Beilstein Journal of Nanotechnology,2012,(3):404-414.
[50] Fanjul-Bolado P, Hernandez-Santos D, Gonzalez-Garcia M B,etal. Alkaline phosphatase-catalyzed silver deposition for electrochemical detection[J].Analytical Chemistry,2007,14(79):5272-5277.
[51] Pawar O, Deshpande N, Dagade S,etal. Green synthesis of silver nanoparticles from purple acid phosphatase apoenzyme isolated from a new source Limonia acidissima[J].Journal of Experimental Nanoscience,2016,1(11):28-37.
《合成化学》约稿函
尊敬的各位专家学者:
《合成化学》自1993年创刊以来,在各位专家学者的支持下得到了快速发展。于2008年和2011年两次入选"中文核心期刊要目总览(化学类)"。2003年以来被连续收录为"中国科技论文统计源期刊"(中国科技核心期刊)。2003年度在"CA收录千种表"中名列第710名(中国入选科技期刊的第39名)。1999年至今被"中国科学文献计量评价研究中心"认证为《中国科学引文数据库》来源期刊(CSCD)。2014年入选《中国学术期刊影响因子年报》统计源期刊。
为了进一步提升《合成化学》的学术质量和影响力,特向各位专家学者约稿。编辑部将采取以下鼓励性措施:
1、对于学术质量较高的研究论文进行网络优先出版,并全额免除版面费。
2、对于排队出版的快递论文、研究简报、制药技术及综合评述类文章,版面费统一降低为:1000元/篇(即超出4页的部分不再收取费用)。
3、以上措施适用于2016年6月1日起所投稿件,未尽事宜,可来电来函咨询。
本次约稿是《合成化学》建刊以来的首次大胆尝试,在实际操作过程中可能会存在欠妥之处,请各位专家学者谅解并不吝赐教!诚盼各位专家学者踊跃投稿!
投稿网址: http://hchxcioc.com, Tel. 028-85255007, E-mail: hchx@cioc.ac.cn
《合成化学》编辑部
Research Progress in Biocatalytic Synthesis of Ag Nanoparticles
ZHANG Wen-yun, TONG Yan, YU Jian-yun, CHEN Xin-xin, WANG An-ming*
(College of Materials, Chemistry and Chemical Engineering, Hangzhou Normal University, Hangzhou 310036, China)
The research progress on the synthesis of silver nanoparticles was reviewed with 51 references. The biosynthesis of silver nanoparticles using microorganisms(Bacteria, Fungi, Yeast and Streptomyces), plant extracts(Polyphenols and Plant Proteins) and enzymes(Nitrate reductase, horseradish peroxidase and phosphatase) as catalysts or reducing agents were described in detail. Its future development is prospected.
silver nanoparticle; biosynthesis; yeast; enzyme; plant extract; cross-linked enzyme aggregate; review
2016-12-21;
2017-03-28
国家自然基金资助项目(21576062); 教育部长江学者和创新团队发展计划资助(IRT1231); 浙江省自然科学基金资助项目(Y13B060058); 杭州市农业科研攻关专项(20120232B13); 杭州师范大学“本科生创新能力提升工程”项目(cx2016094); 杭州师范大学教学2016年改革项目
张闻韵(1996-),女,汉族,浙江台州人,本科生,主要从事金属纳米粒子生物合成的研究。
王安明,副研究员,硕士生导师, E-mail: waming@hznu.edu.cn
Q814.9; O614.122
A
10.15952/j.cnki.cjsc.1005-1511.2017.06.16317

