1,3-DG猪脂肪微胶囊的制备及其特性分析
洪莹,王志耕,2,3*,梅林,2,3,薛秀恒,2,3
1(安徽农业大学 茶与食品科技学院,安徽 合肥,230036) 2(安徽农产品加工工程实验室,安徽 合肥,230036) 3(合肥市农产品加工研究院, 安徽 合肥,230036)
1,3-DG猪脂肪微胶囊的制备及其特性分析
洪莹1,王志耕1,2,3*,梅林1,2,3,薛秀恒1,2,3
1(安徽农业大学 茶与食品科技学院,安徽 合肥,230036) 2(安徽农产品加工工程实验室,安徽 合肥,230036) 3(合肥市农产品加工研究院, 安徽 合肥,230036)
为减少1,3-甘油二酯(1,3-DG)猪脂肪的氧化,延长产品的货架期。以海藻酸钠为壁材,1,3-DG猪脂肪为芯材,蔗糖酯为乳化剂,通过微胶囊造粒仪制备1,3-DG猪脂肪微胶囊,并以包埋率为指标,采用单因素试验和响应面分析法对1,3-DG猪脂肪微胶囊的制备工艺进行优化;对其基本理化指标、形态特征、氧化稳定性和贮藏稳定性进行测定分析。结果表明:微胶囊造粒仪最佳工作条件为,凝结剂CaCl2浓度为100 mmol/L,造粒仪频率为1 000 Hz,压力为0.06 MPa;微胶囊化最佳配方为:壁材浓度1.4%,芯壁质量比为1∶1.9,乳化剂的添加量为2.8%。在此条件下,微胶囊包埋率为85.2%,其水分活度为0.227、灰分为1.98%、粒度分布在280 μm左右。
1,3-DG猪脂肪;造粒仪;工艺参数;微胶囊
猪脂肪是我国传统食用油脂,产量世界第一,资源十分丰富。现代营养学认为,长期大量食用动物源油脂,易导致血脂升高、引发肥胖、脂肪肝、心血管疾病等“富贵病”。改性后的1,3-甘油二酯(1,3-DG)具有降血脂、减少内脏脂肪、抑制体重增长等营养代谢调节功能[1-2]。为此,本实验室创制了富含1,3-DG(44%)的新型猪脂肪。但富含1,3-DG的新型猪脂肪产品存在易氧化、流动性差等问题,制约了其在食品工业中的应用[3]。
运用微胶囊技术原理,研究新型1,3-DG猪脂肪的微胶囊化工艺技术及微胶囊化对1,3-DG猪脂肪特征、特性的影响[4-5],对延长新型1,3-DG猪脂肪的贮存期和拓展其在食品工业中的应用具有重要意义。
本文运用微胶囊造粒仪装备,研究建立了富含1,3-DG(44%)猪脂肪的微胶囊制备工艺技术参数,并对微胶囊化1,3-DG猪脂肪的基本特性进行了分析。
1 材料与方法
1.1 材料和仪器
1,3-DG猪脂肪(密度为0.84 mg/mL),安徽农业大学畜产品加工实验室提供;海藻酸钠(食品级),山东洁晶集团股份有限公司;CaCl2(食品级),北京鹏彩精细化工有限公司;蔗糖酯(食品级),维氏实业(上海)有限公司;正己烷(分析纯),国药集团化学试剂有限公司。
B-390微胶囊造粒仪,瑞士步琦有限公司;Lambda 35紫外分光光度计,美国Perkin Elmer公司;Christ L-1真空冷冻干燥机,德国Martin-Christ公司;KQ3200DE型数控超声波清洗器,昆山市超声仪器有限公司;智能恒温恒湿培养箱,上海三发科学仪器有限公司;CP224C电子天平,奥豪斯仪有限公司。
1.2 实验方法
1.2.1 标准曲线的绘制
分别吸取1,3-DG猪脂肪1.0、0.8、0.6、0.4、0.2、0.1、0 mL于100 mL容量瓶中,用正己烷定容,混匀,制备浓度为8.40、6.72、5.04、3.36、1.68、0.84、0 mg/mL的1,3-DG猪脂肪正己烷标准溶液,在269 nm波长处测定其吸光度,以标准溶液浓度为横坐标,吸光度为纵坐标绘制1,3-DG猪脂肪正己烷溶液的标准曲线。
1.2.2 1,3-DG猪脂肪微胶囊包埋率的测定
1.2.2.1 微胶囊表面油的测定
称取0.5 g样品于20 mL离心管中[6],加入10 mL正己烷,轻微振荡1 min,然后3 000 r/min下离心1 min,倾出正己烷相,再向沉淀中加入10 mL正己烷,合并正己烷相,经0.22 μm有机滤膜过滤后在269 nm处测定吸光度;根据标准曲线计算微胶囊表面油含量。
微胶囊表面油含量/g=C1×V1/1 000
(1)
式中:C1,正己烷相中油的浓度,mg/mL,由其吸光度和1,3-DG猪油的正己烷溶液标准曲线得出;V1:正己烷相的体积,mL。
1.2.2.2 微胶囊总油的测定
称取0.5g样品于20 mL离心管中[7],加入10 mL正己烷,50 ℃、90 W超声提取30 min,3 000 r/min下离心1 min,倾出正己烷相,再向沉淀中加入10 mL正己烷,合并正己烷相,经0.22 μm的有机滤膜过滤后在269 nm处测其吸光度;根据标准曲线计算微胶囊中1,3-DG猪油总量。
微胶囊中总油含量/g=C2×V2/1 000
(2)
式中:C2,正己烷相中1,3-DG猪脂肪的浓度,mg/mL,由其吸光度和1,3-DG猪脂肪正己烷溶液标准曲线得出;V2,正己烷相的体积,mL。
1.2.2.3 微胶囊包埋率的计算
包埋率/%=[1-(微胶囊表面油含量/微胶囊总油含量)]×100[8]
保留率/%=[(A1-B1)/(A-B)]×100
(3)
式中:A,1,3-DG猪脂肪微胶囊总油含量,g;B,1,3-DG猪脂肪微胶囊表面油含量,g;A1,贮藏一段时间后1,3-DG猪脂肪微胶囊总油含量,g;B1,贮藏一段时间后1,3-DG猪脂肪微胶囊表面油含量,g。
1.2.4 1,3-DG猪脂肪微胶囊的制备
本试验采用B-390微胶囊造粒仪制备1,3-DG猪脂肪微胶囊,选取直径120 μm喷嘴,振动频率600~1 400 Hz以及气压0.04~0.08 MPa,利用海藻酸钠与Ca2+接触可迅速发生离子交换,生成凝胶的原理,以50~250 mmol/ L CaCl2溶液作为凝结液,辅以磁性搅拌器,使微胶囊均匀散开,防止形成的微胶囊粘结。通过调节振动频率以及气压使乳化液分离,形成单液滴。将微胶囊置于直径150 mmol/L的培养皿中,于-20 ℃预冷冻4 h,再经真空冷冻干燥30 h得到1,3-DG猪脂肪微胶囊粉末。
1.2.5 1,3-DG猪脂肪微胶囊工艺参数优化
1.2.5.1 微胶囊制备单因素试验
以1,3-DG猪脂肪微胶囊包埋率为评定指标,考察1,3-DG猪脂肪微胶囊化的最佳配方和造粒仪的最佳条件。微胶囊化的配方包括芯壁比(1,3-DG猪脂肪与海藻酸钠的质量比1∶4、1∶3、1∶2、1∶1、2∶1)、蔗糖酯添加量(1%、2%、3%、4%、5%)、壁材浓度(0.5%、1.0%、1.5%、2.0%、2.5%)。造粒仪条件包括CaCl2浓度(50、100、150、200、250 mmol/ L)、振动频率(600、800、1 000、1 200、1 400 Hz)、气压(0.04、0.05、0.06、0.07、0.08 MPa)。
1.2.5.2 响应面法优化微胶囊配方
采用Box-Behnken设计,选取壁材浓度(A)、芯壁比(B)、乳化剂添加量(C)为因素,以包埋率为响应值,因素水平编码参见表1。
问题就在于目前在全球范围内没有找到一个能克服在如此高速的状况下,能够平稳运行的车头模型。就连目前位于世界上商业运营速度最快、科技含量最高、系统匹配最优的动车组的车头也是从当初20个模型中,去掉性能不好,与外形不美观的经过层层筛选最终成为CRH380A的车头模型。而在所有车型中CRH380A的车型采用完全光滑的车体表面,加长型的头部设计,改变最大纵剖面轮廓线与水平轮廓线,从而降低头车的气动阻力,从而达到提高列车时速的效果。

表1 响应面实验因素水平编码表
1.2.6 1,3-DG猪脂肪微胶囊的成分与特性分析
1.2.6.1 水分活度分析
1,3-DG猪脂肪微胶囊的水分活度采用H-3A型水分活度仪进行测定,测定温度18℃,测定时间10 min。
1.2.6.2 灰分含量的测定
根据国标GB/T5009.4—2010测定1,3-DG猪脂肪微胶囊中的灰分含量。
1.2.6.3 密度的测定
将一定质量1,3-DG猪脂肪微胶囊粉末置于量筒中,计算单位体积1,3-DG猪脂肪微胶囊的质量[9]。
1.2.6.4 粒径分析与形态的检测
采用Mastersizer 2000激光粒度仪测定1,3-DG猪脂肪微胶囊的粒径分布。并取1,3-DG猪脂肪微胶囊悬浮液20 mL,过滤出1,3-DG猪脂肪微胶囊,显微镜下观察微胶囊的形态。
1.2.6.5 吸湿能力的测定
将一定质量1,3-DG猪脂肪微胶囊粉末置于称量皿中,在恒温恒湿培养箱中放置60 h(温度为25 ℃、湿度为80%),每隔6 h称重,根据下式计算吸湿率:
Ra/%=[(m1-m0)/m0]×100
(4)
式中,m1和m0分别是放入培养箱前和放入培养箱后的质量,g。
1.2.6.6 氧化稳定性测定
对1,3-DG猪脂肪微胶囊产品使用油脂氧化分析仪进行分析,在压力为0.6 MPa、温度为90 ℃时,观察1,3-DG猪脂肪和1,3-DG猪脂肪微胶囊氧化稳定性。
1.2.6.7 贮藏特性的测定
将制得的1,3-DG猪脂肪微胶囊密封包装后在25 ℃温度下贮藏,然后分别在贮藏1、2、3、4、5、6、7、8、9、10周后测定1,3-DG猪脂肪微胶囊的含量,计算微胶囊中1,3-DG猪脂肪的保留率。
1.2.7 数据统计分析
所有试验均设3次重复,将得到的试验结果利用 Microsoft Excel进行处理分析。
2 结果与分析
2.1 标准曲线的绘制
1,3-DG猪油正己烷溶液的标准曲线如图1所示。图1表明,当1,3-DG猪脂肪的正己烷溶液和正己烷溶液浓度在0~8.40 mg/mL时,浓度和吸光度之间均呈现良好的线性关系,其线性方程分别为y=0.055 8x-0.025 1 (R2=0.999 4)。

图1 标准曲线Fig.1 The standard curve
2.2 微胶囊造粒仪工作参数单因素试验
2.2.1 CaCl2浓度对微胶囊化效果的影响
由图2可知,在微胶囊造粒仪频率1 000 Hz,气压0.05 MPa时,CaCl2浓度低于100 mmol/L时,随着浓度的增大包埋率升高,但浓度超过100 mmol/L时,随着浓度的增大包埋率差异不显著(P>0.05)。表明,CaCl2浓度100 mmol/L时微胶囊化效果最佳,此时的包埋率达(82.3±1.15)%。

图2 CaCl2浓度对包埋率的影响Fig.2 Effect of the concentrations of CaCl2 on the microencapsulation efficiency
2.2.2 振动频率对微胶囊化效果的影响
由图3可知,凝结剂CaCl2浓度在100 mmol/L,微胶囊造粒仪气压0.05 MPa时,微胶囊造粒仪的振动频率与形成的液珠链均匀性有关,进而影响到包埋效果。结果表明,振动频率在600~1 400 Hz范围内,1,3-DG猪脂肪的包埋率呈先上升后下降的趋势。频率过高或过低均可导致珠链不易分开或不稳定,引起包埋率降低。在振动频率为1 000 Hz时具有最大包埋率,达(82.1±0.2)%。

图3 振动频率对包埋率的影响Fig.3 Effect of the ratio between vibration frequency on the microencapsulation efficiency
2.2.3 气压对包埋率的影响
气压也是微胶囊造粒仪的一个重要参数,直接影响到包埋率。结果表明,凝结剂CaCl2浓度在100 mmol/L、微胶囊造粒仪频率1 000 Hz时,气压在0.04~0.08 MPa内,1,3-DG猪脂肪的包埋率呈先上升后下降的趋势(图4),在压力0.06 MPa时, 1,3-DG猪脂肪微胶囊化效果最佳。

图4 气压对包埋率的影响Fig.4 Effect of the pressure on the microencapsulation efficiency
2.3 微胶囊化配方的单因素试验
2.3.1 壁材浓度对包埋率的影响
如图5所示,壁材浓度对微胶囊化有一定影响。壁材浓度低于1.5%时,随着浓度的增加包埋率提高,这可能是由于壁材浓度过低时,乳状液稳定性较差;而壁材浓度增加,提高其体系的稳定性,致使包埋率提高。但当壁材浓度过高,黏度过大,导致造粒过程中喷嘴堵塞,降低造粒效率,并且产品粒径大小不均,包埋率亦降低。本研究表明,壁材海藻酸钠浓度1.5%时,1,3-DG猪脂肪微胶囊化效果最佳。

图5 壁材浓度对包埋率的影响Fig.5 Effect of the ratio between solids concentration on the microencapsulation efficiency
2.3.2 芯壁比对微胶囊化的影响
芯壁比对微胶囊化的影响也较明显,由图6可知,随着芯壁比的增大,1,3-DG猪脂肪包埋率先增加后减小,在芯壁质量比为1∶2时达到最高。当壁材含量较高时,单位体积包埋1,3-DG猪脂肪量较少,导致包埋率较低;而芯材含量较高时,可能由于微胶囊壁太薄,不够致密,易出现裂纹,而且也会降低其乳化稳定性,致使包埋率降低。本研究芯壁比为1∶2时微胶囊化效果最佳[10]。

图6 芯壁比对包埋率的影响Fig.6 Effect of the ratio betweencoer and wall on the microencapsulation efficiency
2.3.3 乳化剂添加量对微胶囊化的影响
由图7可知,乳化剂添加量在1%~5%范围内,包埋率呈先上升后下降的趋势,乳化剂添加量3%时,包埋率最大,达(82.67±0.67)%。随乳化剂用量增大,明显降低芯材与壁材两相间的自由能,并通过静电斥力或立体位阻防止分散粒子之间聚集,提高乳化液的稳定性,从而使得包埋率快速增加;但当乳化剂的用量过多时,微胶囊的粒径过小,会造成乳化液粘度增大,甚至出现絮凝现象[9]。本研究乳化剂用量为3%时,体系稳定性好,微胶囊化效果最佳。

图7 乳化剂用量对包埋率的影响Fig.7 Effect of the emulsifier concentration on the microencapsulation efficiency
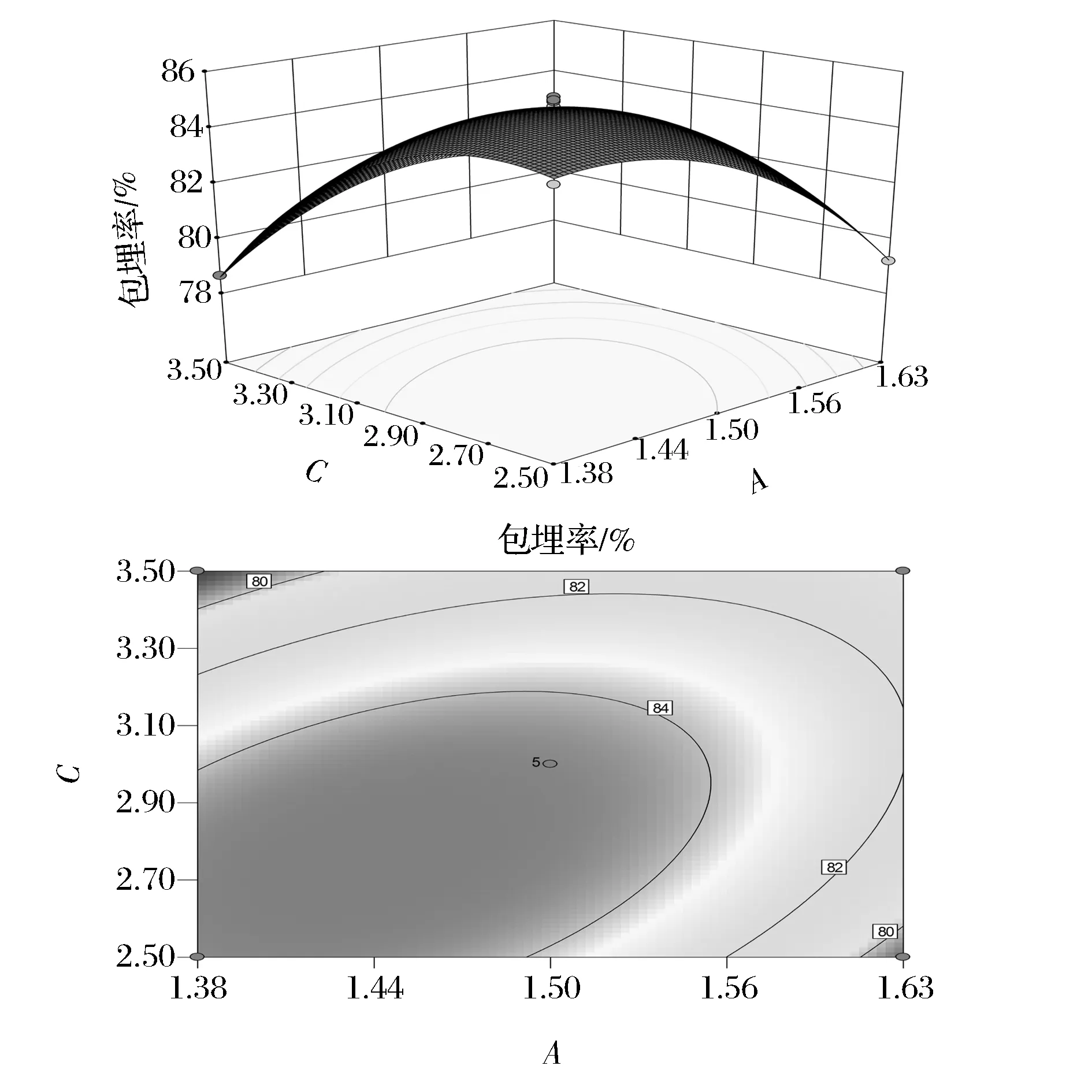
2.4 响应面试验
2.4.1 响应面试验结果
根据Box-Behnken design试验设计原理,试验方案及结果见表2。

表2 响应面实验设计及结果
采用Design Expert 8.0.5软件对试验数据进行回归分析。得到壁材浓度,芯壁比,乳化剂用量与包埋率之间的二次多项回归方程如下:
Y=84.78-0.94A-0.40B-1.26C-0.56AB+1.81AC-0.58BC-1.81A2-1.50B2-2.22C2
(5)
对上述回归模型进行方差分析,表3结果表明,所建立的二次回归方程具有高度显著性(P<0.000 1),失拟项0.843 2>P0.05,不显著,模型的拟合度R2为98.99%,调整后R2为97.68%,说明模型的拟合较好,实验数据误差小。因此,可以用此模型对1,3-DG猪脂肪微胶囊工艺进行分析和预测。

表3 回归方程方差分析表
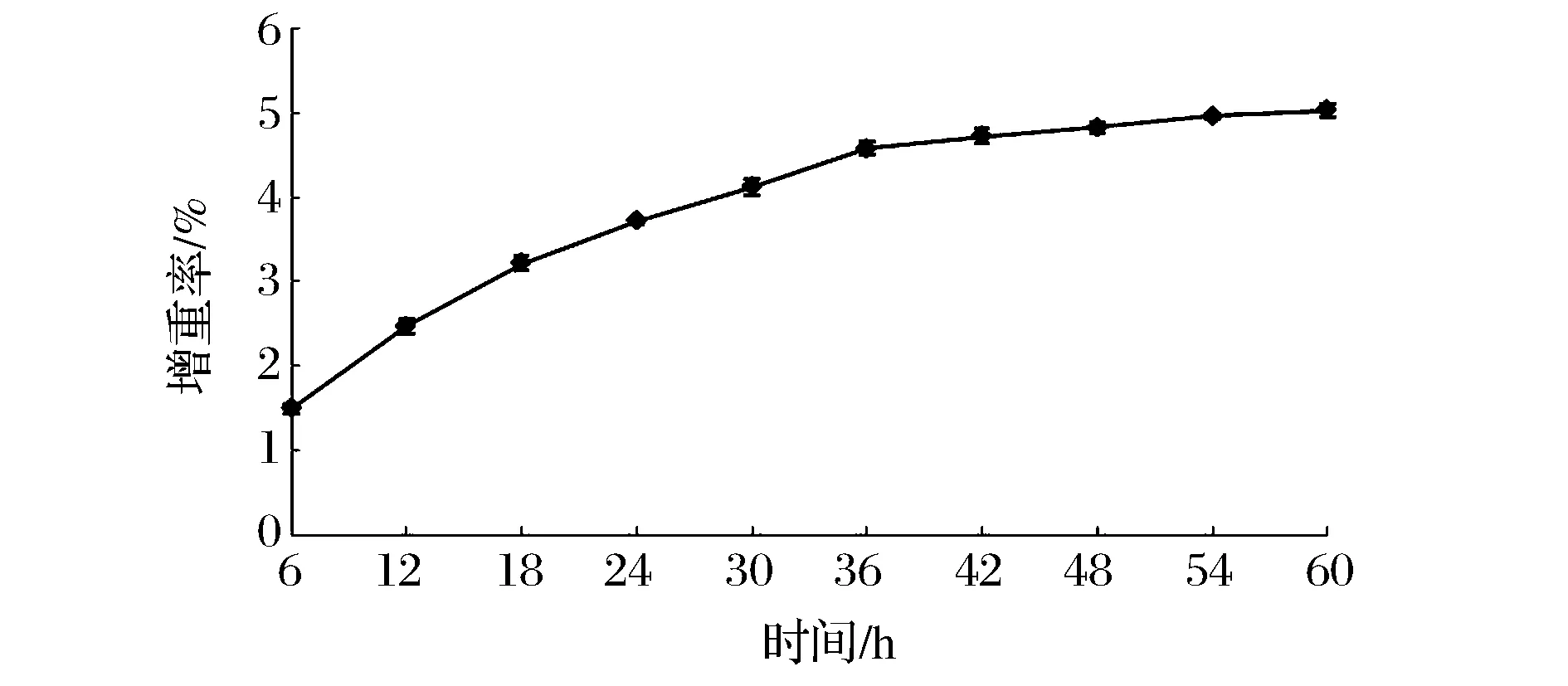
注:**表示极显著(P<0.01);*表示显著(0.01 从该模型看,B(芯壁比)对包埋率的影响显著(P<0.05),A(壁材浓度)C(乳化剂添加量)对包埋率的影响极显著(P<0.01);乳化剂添加量和壁材浓度交互项交互作用极显著(P<0.01),芯壁比与壁材浓度、乳化剂添加量互作效应显著(P<0.05);方程二次项均达到极显著水平(P<0.01)。由F值还可以得出各因素对包埋率影响大小排列分别为乳化剂添加量>壁材浓度>芯壁比。 2.4.2 响应面及等高线分析 由图8可知,乳化剂添加量与芯壁比交互作用极显著。 图8 芯壁比与乳化剂添加量对包埋率影响的响应面及等高线图Fig.8 The response surface and contour plots of the embedding rate in ratio of core and material and emulsifier dosage 芯壁比一定,提高乳化剂添加量,包埋率呈现先提高后缓慢降低的趋势。这可能是由于作为乳化剂蔗糖酯含量较少时,在油-水界面吸附较少,界面膜强度较差,而随着蔗糖酯添加量的增加,提高了乳状液在造粒过程中的稳定性,包埋率随之相应地增加。但当蔗糖酯添加量过多时,体系黏度较高,从而导致包埋率有所下降。乳化剂添加量一定,随着芯壁比的增加,包埋率提高,随后逐渐降低。这是由于乳化液体系中芯材含量越高,单位体积1,3-DG猪脂肪包埋量增加。但芯壁比过大,则芯材过量,壁材含量不足,包埋率降低。等高线呈椭圆形,说明乳化剂添加量与芯壁比交互作用显著。等高线沿乳化剂添加量方向变化比沿芯壁比方向密集,说明乳化剂添加量对1,3-DG猪脂肪微胶囊包埋率的影响比芯壁比大。 由图9 可知,响应面的坡度较陡,壁材浓度与乳化剂添加量交互作用极显著。 图9 壁材浓度与乳化剂添加量对包埋率影响的响应面及等高线图Fig.9 The response surface and contour plots of the embedding rate in ratio of wall material concentration and emulsifier dosage 壁材浓度一定,提高乳化剂添加量,包埋率显著提高,随后缓慢降低。当乳化剂添加量过高时,产生絮凝现象,从而影响造粒的效果。乳化剂添加量一定,包埋率随壁材浓度呈下降的趋势。一定浓度的壁材海藻酸钠能够提高乳化体系的稳定性,使得包埋率增加。但海藻酸钠浓度过大,引起乳状液黏度较大,导致造粒仪喷嘴易堵塞,并且微胶囊形态改变,严重影响微胶囊的质量和效果。等高线图呈椭圆形,说明交互作用显著。等高线沿乳化剂添加量方向变化比沿壁材浓度方向密集,说明乳化剂添加量对1,3-DG猪脂肪微胶囊包埋率的影响比壁材浓度大。 由图10可知,芯壁比与壁材浓度交互作用显著。 图10 芯壁比与壁材浓度对包埋率影响的响应面及等高线图Fig.10 The response surface and contour plots of the embedding rate in ratio of wall material concentration and emulsifier dosage 壁材浓度一定,芯材1,3-DG猪脂肪比率增加,包埋率显著升高,随后缓慢降低。这可能由于乳化液体系中芯材含量越高,单位体积包埋量增加,包埋率提高,但芯材比率过大,壁材含量不足以包裹芯材,或形成较薄表面外膜易破裂,导致包埋率降低。芯壁比一定,包埋率随壁材浓度呈先上升后下降的趋势。壁材海藻酸钠在一定浓度范围内,随着浓度的增加,乳化体系的稳定性提高,包埋率增加。但浓度过大,引起乳状液过于黏稠,严重影响微胶囊的质量和效果,降低包埋率。等高线沿壁材浓度方向变化比芯壁比方向密集,说明壁材浓度对1,3-DG猪脂肪微胶囊包埋率的影响比芯壁比大。 2.4.3 验证试验 根据该模型得到的微胶囊最佳配方为壁材浓度1.44%,芯壁质量比为1∶1.85,乳化剂的添加量为2.75%,其包埋率可达85.33%。考虑到实际生产操作情况,将最优配方修正为壁材浓度1.4%,芯壁质量比为1∶1.9,乳化剂的添加量为2.8%。在此条件下,对预测值进行3次验证试验,得到平均包埋率85.2%,与预测值接近。 2.5 微胶囊成分与特性分析 2.5.1 基本理化指标 制备的微胶囊颗粒具有猪脂肪原有的风味,其理化指标参见表4。由表4可知,微胶囊水分活度为(0.227±0.003),该微胶囊具有良好的储藏性[11-12]。 表4 1,3-DG微胶囊基本理化指标测定结果 2.5.2 粒径分析及形态分析 由图11可知,制备的微胶囊颗粒粒径呈偏正态分布,粒径主要分布在200~350 μm,平均粒径为280 μm。图12为采用倒置显微镜拍照的图像,此微胶囊外壁形状规则,内外表面光滑,形态完整为规则圆球形,同时其稳定性好。 图11 微胶囊粒径分布曲线Fig.11 The curve of particle size of the in the microcapsules water 图12 微胶囊微观图Fig.12 Microgram of microcapsule 2.5.3 吸湿能力分析 贮藏试验中微胶囊水分含量变化如图13所示。在初始阶段,微胶囊快速吸水,增重较快,呈线性变化规律,可能是因为微胶囊壁材为海藻酸钠,吸湿性较好[13];但放置36 h后,微胶囊吸水速率趋于平缓。所以该微胶囊应置于干燥的环境中贮藏。 图13 微胶囊抗潮吸湿试验结果Fig.13 Experimental results of micro capsules on moisture resistance 2.5.4 氧化稳定性分析 图14为OXITEST油脂氧化仪加速氧化1,3-DG猪脂肪和1,3-DG猪脂肪微胶囊过程的曲线,诱导期越长,氧化稳定性越高。由图14可看出,1,3-DG猪脂肪的氧化诱导期为58 min,在前58 min内氧压略微发生变化,仅下降了0.02 MPa ,但从58 min开始急剧下降,9 h左右氧压降至并稳定在0.15 MPa左右, 1,3-DG猪脂肪基本氧化完全。1,3-DG猪脂肪微胶囊的氧化基本呈线性变化,氧压均匀缓慢的下降。1,3-DG猪脂肪微胶囊的氧化诱导期为20.5 h,氧化速率远低于非微胶囊化的脂肪,氧化稳定性显著较高。 图14 1,3-DG猪脂肪和1,3-DG猪脂肪微胶囊的氧化曲线Fig.14 The curve of 1,3-DG and 1,3-DG microcapsules with oxidation 2.5.5 贮藏特性的分析 贮藏过程中微胶囊1,3-DG猪脂肪的保留率如图15所示。随着贮藏时间的增加,1,3-DG猪脂肪保留率下降速率越大,当贮藏时间达到8周后,1,3-DG猪脂肪的保留率趋于稳定,在第10周时,1,3-DG猪脂肪的保留率为 (84.23±0.12)%。说明1,3-DG猪脂肪微胶囊可以长期贮藏。 图15 1,3-DG猪脂肪微胶囊的释放规律Fig.15 The release of 1,3-DG microcapsules 1,3-DG猪脂肪微胶囊造粒仪的最佳工艺参数为: 凝结剂CaCl2浓度为100 mmol/L,造粒仪频率为1 000 Hz,压力为0.06 MPa。1,3-DG猪脂肪微胶囊化最佳配方为: 壁材浓度1.4%,芯壁质量比为1∶1.9,乳化剂的添加量为2.8%。在最佳工艺及配方条件下,1,3-DG猪脂肪的微胶囊包埋率在 85%以上。1,3-DG猪脂肪微胶囊粒径主要分布在200~350 μm,平均粒径为280 μm,微胶囊粒外表面光滑、分散性好,形态完整,且具有良好抗氧化稳定性和贮藏特性。 [1] MAKI K C, DAVIDSON M H, YSUSHIMA R, et al. Consμmption of diacylglycerol oil as part of a reduced-energy diet enhances loss of body weight and fat in comparison with consμmption of a triacylglycerol control oil[J]. American Journal of Clinical Nutrition, 2002, 76(6): 1 230-1 236. [2] COREY E S.Betapol Structured lipid-A close match to mother,s milk for a healthy start to life[J]. Wellness Foods Europes, 2009(5): 30-35. [3] 韩海纳, 王宝维, 葛文华, 等. 鹅油甘油二酯微胶囊化工艺的研究[J]. 中国粮油学报, 2014, 29(9): 46-51. [4] JANG H A, YOUNG P K, SEO E M, et al. Oxidative effect of natural plant extracts on the microencapsulated high oleic sunflower oil[J]. Journal of Food Engineering, 2008,84(2): 327-334. [5] 朱明. 食品工业分离技术[M]. 北京: 化学工业出版社, 2009: 37-39. [6] WANG J, CAO Y P, SUN B G, et al. Physicochemical and release characterisation of garlic oil-b-cyclodextrin inclusion complexes[J]. Food Chemistry, 2011, 127: 1 680-1 685. [7] 朱艳巧, 田耀旗, 徐学明, 等. 超声波协助处理制备淀粉-肉桂醛微胶囊研究[J]. 食品工业科技, 2012, 33(2) : 232-235. [8] 陈欣, 王志耕, 梅林, 等. 乳脂微胶囊的制备[J]. 食品与发酵工业, 2015, 41(6): 143-148. [9] 赵巍,王军,段长青, 等.喷雾干燥法制备微胶囊化山葡萄籽油粉末油脂[J].中国粮油学报,2009,24(12):77-83. [10] 魏巍, 李敏, 李春, 等. 1,3-二油酸-2-棕榈酸结构油脂微胶囊的研制[J]. 食品工业科技, 2013, 34(20): 294-301. [11] CORCORAN B M, ROSS R P, FITZGERALD G F, et al. Comparative survival of probiotic lactobacilli spray-dried in the presence of prebiotic substances[J]. Journal of Applied Microbiology, 2004, 96(5): 1 024-1 039. [12] 阚建全. 食品化学[M]. 北京: 中国农业大学出版社, 2008: 23-36. [13] 王秀娟, 张坤生, 任云霞, 等. 海藻酸钠凝胶特性的研究[J]. 食品工业科技, 2008(2): 259-262. The preparation of 1, 3-DG pig fat microcapsule and its characteristic analysis HONG Ying1, WANG Zhi-geng1, 2, 3*, MEI Lin1,2,3, XUE Xiu-heng1,2,3 1( School of Tea and Food Science & Technology, Anhui Agriculture University, Hefei 230036, China) 2 (Anhui Engineering Laboratory of Agricultural Products Processing, Hefei 230036, China) 3 (Heifei Agricultural Product Processing Research Institute, Hefei 230036, China) This study was to reduce oxidation of 1,3-DG pig fat and extend its shelf life. The fat microcapsule was made by sodium alginate as the wall material and 1,3-DG pig fat as the core material, and sucrose ester as the emulsifier. According to single factor experiment and response surface methodology, embedding fat rate was selected as the main index, the optimal microcapsules formula and its morphological characteristics, oxidation stability and storage stability were studied. The results showed that the best encapsulator conditions were: 100 mmol/L CaCl2as condensation agent, 1 000 Hz frequency and 0.06 MPa pressure; the optimum formula of microencapsulation was: the wall material concentration 1.4%, mass ratio of core to wall 1∶1.9 and emulsifier dosage 2.8%. Under these conditions, the microencapsulation of 1,3-DG pig fat exhibited good oxidation stability, storage resistance and other properties, 85.2% embedding rate, 0.227 water activity, 1.98% ash content, and about 280 μm particle size. 1,3-DG pig fat; encapsulator; processing parameters; microcapsule 10.13995/j.cnki.11-1802/ts.201704029 硕士研究生(王志耕教授为通讯作者,E-mail:wzhg@ahau.edu.cn)。 安徽省试验区和试点省专项(12Z0102032) 2016-06-03,改回日期:2016-08-24






3 结论

