一种精密恒温环境微量燃烧-溶解-反应多用量热计的设计及应用
李 旭 李强国,* 蒋建宏 谷惠文 李传华肖圣雄 李 霞
(1湘南学院化学生物与环境工程学院,湖南 郴州 423034;2长江大学化学与环境工程学院,湖北 荆州 434023)
一种精密恒温环境微量燃烧-溶解-反应多用量热计的设计及应用
李 旭1李强国1,*蒋建宏1谷惠文2,*李传华1肖圣雄1李 霞1
(1湘南学院化学生物与环境工程学院,湖南 郴州 423034;2长江大学化学与环境工程学院,湖北 荆州 434023)
将SRC-100型溶解-反应量热计改进成了一种精密恒温环境微量燃烧-溶解-反应多用量热计。采用电能法标定了量热计的能当量,其值为Ccalor= (987.63 ± 0.61) J·K-1。用该量热计分别测定了苯甲酸和丁二酸的标准质量燃烧热,分别为ΔcUθm,B(cr, T = 298.15 K) = -(26425.99 ± 10.70) J·g-1和ΔcUθ
m,S(cr, T = 298.15 K) = -(12621.97 ± 5.30) J·g-1。测量的不确定度小于0.04%,精度高于0.05%。
微量燃烧-溶解-反应量热计;标准质量燃烧热;苯甲酸;丁二酸
1 引 言
弹式量热计和溶解量热计是获取物质基础热化学性质(物质的标准生成焓)的两个主要量热技术载体。弹式量热计是通过精确测定元素、有机化合物、金属有机化合物等物质在氧气中的恒容燃烧热,并根据热化学原理计算得到物质的标准燃烧焓和标准生成焓;溶解量热计是通过精确测定无机化合物和配合物在特定溶剂中的溶解热,然后根据热化学原理计算得到物质的标准溶解焓和标准生成焓。物质的热化学数据在工业、国防和科学研究领域起着重要作用,如在工业生产中,许多化学反应的平衡常数的确定,产率的计算、国防导弹武器燃料推进剂的生产利用、药物和新材料的合成、废弃物的焚烧处理等等。21世纪以来,随着化学、生命科学、新能源和新材料等交叉学科飞速发展,对热化学数据的需求与日俱增,对先进量热技术更加需求1,对新型综合量热计的研发越来越得到普遍重视2,3。由于许多新材料化合物难以制备和纯化,产量很少,如果采用传统的燃烧量热技术来获得他们的热力学数据,每次燃烧热测定实验需要约0.5-1 g物质,为了进行统计分析需要约10次实验,即需要5-10 g高纯度(w >0.999)化合物,要获得这个数量的样品,成本将十分昂贵, 有时是不可能的。因此,弹式量热计的微型化势在必行。近十几年来,已报道了许多可靠的能够测量几毫克到几十毫克样品燃烧热的微型燃烧量热计4-15。溶解量热计发展也非常迅速,已报道了许多高精度多功能溶解量热计16-18。另一方面,由于精密的弹式量热计和溶解量热计比较昂贵,难以购买,就是购买了利用率也很低。能否把微型弹式量热计和溶解量热计集成到同一仪器中呢?如果能,便可大大提高仪器的利用率,从而降低教学、科研实验成本。况且高等院校现有物理化学实验中的燃烧热测定和溶解热测定存在许多不足,不适宜用来做毕业论文,也不利于培养学生严谨的科研素养。为了与科研接轨和降低教学成本,对高校教学用的燃烧热测定仪和溶解热测定仪进行改进,推出第四代物理化学实验教学仪器势在必行。
为此,笔者尝试在SRC-100型恒温环境的溶解-反应量热计的基础上,自行设计、搭建了一台“精密恒温环境微量燃烧-溶解-反应量热计”,该量热计是集燃烧热、溶解热和反应热测定于一体的多功能量热仪,具有如下特点:温度测量精度达到±0.0001 K;温度的控制精度达到±0.001 K;样品用量少,约5-20 mg。并通过测定苯甲酸和丁二酸的标准质量燃烧热进行验证,达到了预期效果。
2 实验部分
2.1 试剂与仪器
苯甲酸[(NIST SRM 39j) (美国国家标准与技术研究所(NIST),标准参考材料(SRM))]购于中国标准物质采购中心;丁二酸(AR,w ≥ 0.995)购于上海迈瑞尔化学技术有限公司;高纯氧气(φ ≥0.99999)购于长沙方罡气体有限公司;棉线由郴州棉纺厂提供。
具有恒温环境的溶解-反应量热计(SRC-100型,武汉大学化学与分子科学学院热化学实验室);百万分之一天平(Sartorius CPA225D,赛多利斯科学仪器(北京)有限公司);电子天平(YP30002,上海越平科学仪器有限公司);差热-热重分析仪(DTG-60,日本岛津公司制作所);元素分析仪(Perkin-Elmer 2400 CHN,美国珀金埃尔默公司)。
2.2 仪器的改进
精密恒温环境微量燃烧-溶解-反应量热计是在SRC-100型溶解-反应量热计基础上进行改进而成的,所以基本上保留了SRC-100型溶解-反应量热计的结构16。恒温环境微量燃烧-溶解-反应量热计主要由恒温控温系统、量热系统和数据采集与计算机控制处理系统等三个模块组成,是一种半绝热式量热计。该仪器主要作了如下几点改进:一是为了研制燃烧热、溶解热测量一体化,就必须保持溶解量热所用的杜瓦瓶,而使用杜瓦瓶就必须解决自身的热漏问题。实验证明19外部配有真空夹套,夹套内壁镀银,夹套内的真空度达到0.001 Pa的杜瓦瓶可以有效减小对流引起的热漏,热传导引起的热漏,以及热辐射引起的热漏。实验还证明广口杜瓦瓶的热辐射作用主要是在瓶口的顶部,占85%-95%之多,在杜瓦瓶中加挡板会有明显的改善作用20。所以,首先必须将溶解量热计的普通杜瓦瓶改进为带盖、镀银、瓶内衬有铝泊挡板的特制的杜瓦瓶。二是为了保障良好的密闭性能,防止热漏。将量热单元中玻璃棒搅拌改为潜水式磁力搅拌。三是为了减小环境的干扰,在控温系统中增加了致冷系统(即低温恒温槽)。四是为了保证弹体水平、垂直360°旋转时,实现数据信号及动力的精密传递,增加了24路金触点集电环和无极调速电机构成的转动系统。五是自制了一个独具特色的微型燃烧弹,其结构剖面示意图如图1所示。所用材料均为耐高温高压特种不锈钢材料制成。弹体的有效容积约8.5 cm3,内部所有表面均衬有0.1 mm金属铂层。电标定加热电阻直接安装在微型弹体中,这样其热量的传递与样品燃烧后热量的传递可以保持基本一致。六是增加了一个由精密恒流源和精密时控装置构成的点火系统,能准确控制点火能量,并保障点火铂丝不被烧断,这样可以避免因铂丝质量损失而增大测量误差。
该仪器由26个部件组成,结构示意图如图2所示。图中红色虚线框表示用于不同功能(燃烧热或溶解热)时的更换部件。
2.3 燃烧热的测定
2.3.1 热敏电阻电势与温度的关系的测定
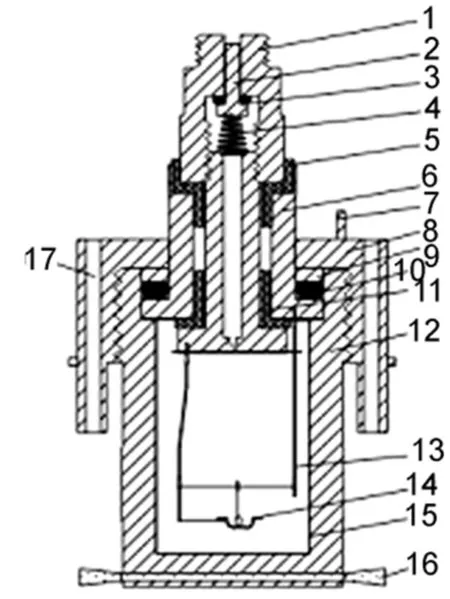
图1 微型燃烧弹剖面Fig.1 Transversal view of the microcombustion bomb

图2 量热计(燃烧热测定)示意图Fig.2 Diagram of calorimeter for measurement of heat of combustion
由于微量弹式量热计所用样品量小,系统温度变化范围小,所以选择298.350、298.250、298.150、298.050和297.950 K等5个测温点。首先将恒温槽温度调整到297.950 K;待温度完全恒定后,调节热敏电阻电势基线在“0”附近,波动范围控制在±0.03 mV之间,测定该温度下热敏电阻电势(R298.15K≈ 80 kΩ),重复测定10次;然后依次升温,测定其它温度下的电势(注意,此时不再调节基线)。结果列入表1中。
2.3.2 铂丝点火能的测定
点火系统是由直径为0.20 mm的铂丝、高精密恒流源、定时器、继电器等构成。
操作步骤:(1) 用移液枪准确移取30 µL (0.00167 mol)蒸馏水加入到弹体内,迅速拧紧弹盖。用2.8-3.0 MPa的高纯氧排空气10次,然后用3.0 MPa的高纯氧充气10 min (注意充气、排气速度要非常缓慢,以免蒸馏水挥发逸出),记录室内温度;(2) 杜瓦瓶内装蒸馏水(200 ± 0.01) g,放入搅拌子并将其安装到恒温槽中, 把弹体安装到吊杆上并放入杜瓦瓶中,拧紧杜瓦瓶盖;(3) 将测温、电标定和点火插头分别插入主机相应插孔。调整磁力搅拌速率400 r·min-1(顺时针旋转),弹转速24 r·min-1(逆时针旋转),恒温槽温度恒定为(298.150 ± 0.001) K,室温297.5至298 K (用空调调节),冷槽296.5 K;(4) 待系统温度完全恒定后(基线波动范围在±0.03 mV)开始采集基线(初期),采集时间6-8 min。然后迅速以(5.520 ± 0.001) A电流加热,时间3 s,温度随即上升。当温度有下降趋势后再采集8 min (末期);(5) 接着用电流20.40 mA的恒流源进行电标定(电阻R = 1333.96 Ω),电标定时间30 s左右,温度随即上升。当温度有下降趋势后再采集8 min (末期)。测定10次的结果,列入表2。
2.3.3 棉线燃烧热的测定
待测物质的点火方法是通过铂丝放热引燃棉线,再烧着压片的待测物质。
实验所用棉线是用未经化学方法脱脂、漂白的纯棉线,用酒精浸泡,然后在363 K烘干,保存在干燥器中待用。为了保持干燥,在这项研究中棉线一直保存在363 K这个温度下。
实验测定操作步骤:(1) 准确称量铂坩埚,再准确称取1-2 mg纯棉线,并打结绕在铂丝上,再打圈放到铂坩埚中;(2) 用移液枪准确移取30 µL (0.00167 mol)蒸馏水加入到弹体内,迅速拧紧弹盖。用2.8-3.0 MPa的高纯氧排空气10次,然后用3.0 MPa的高纯氧充气10 min;(3) 杜瓦瓶内装蒸馏水(200 ± 0.01) g,放入搅拌子并将其安装到恒温槽中,把弹体安装到吊杆上并放入杜瓦瓶中,拧紧杜瓦瓶盖;(4) 将测温、电标定和点火插头分别插入主机相应插孔。调整磁力搅拌速率400 r·min-1(顺时针旋转),弹转速24 r·min-1(逆时针旋转),恒温槽温度恒定为(298.150 ± 0.001) K,室温297.5 K至298 K (用空调调节),冷槽296.5 K;(5) 待系统温度完全恒定后(基线波动范围在±0.03 mV)开始采集基线(初期),时间6-8 min。然后迅速以(5.520 ± 0.001) A电流点火,时间3 s,温度随即上升;当温度有下降趋势后再采集8 min (末期);(6) 接着用恒流源(I = 20.40 mA,电阻R = 1333.96 Ω)进行电标定,温度随及上升。当温度有下降趋势后再采集8 min (末期)。
实验中所有物质的质量都是用Sartorius CPA225D百万分之一天平称量(蒸馏水除外),并经空气浮力校正。
燃烧产物的检验:气相样品用聚乙烯塑料袋取出经郴州湘南环科检测有限公司检测,没有一氧化碳形成,且坩埚中没有黑色物质残留,说明反应完全。每次实验结束后,把弹体中的气体导入装有蒸馏水的长颈洗气瓶中,使未溶入弹液中的二氧化氮气体溶解到洗气瓶中;然后用25 mL蒸馏水分3次洗涤弹体。最后将洗气液体与弹液体合并,定容后,用0.1 mol·L-1的氢氧化钠溶液进行滴定。测定10次,结果列入表3中。

表1 传感器的电势与温度的关系Table 1 Relationship between temperature and electric potential of sensor

表2 铂丝的点火能及量热计的能当量Table 2 Ignition energy of platinum wire and the energy equivalent of the calorimeter
2.3.4 苯甲酸燃烧热的测定
所购苯甲酸未经进一步纯化,置于363 K烘箱中烘干4 h,称取10 mg左右苯甲酸, 压成直径约5 mm药片,放入装有P2O5的真空干燥箱中干燥。为了保持干燥,在这项研究中将苯甲酸片和棉线一直保存在363 K这个温度下。称量时天平内用烧杯装P2O5干燥除湿。
操作步骤:与2.3.3节的操作步骤基本相似,只有步骤(1)略有不同,即 (1) 准确称量铂坩埚,再准确称取1-2 mg纯棉线,并打结绕在铂丝上,再打圈放置到铂坩埚中。再将已冷却的苯甲酸片放入铝泊斗槽中,准确称量,然后把苯甲酸片倒在铂坩埚中的棉线圈上。测定10次,结果列入表4中。
2.3.5 丁二酸的燃烧热的测定
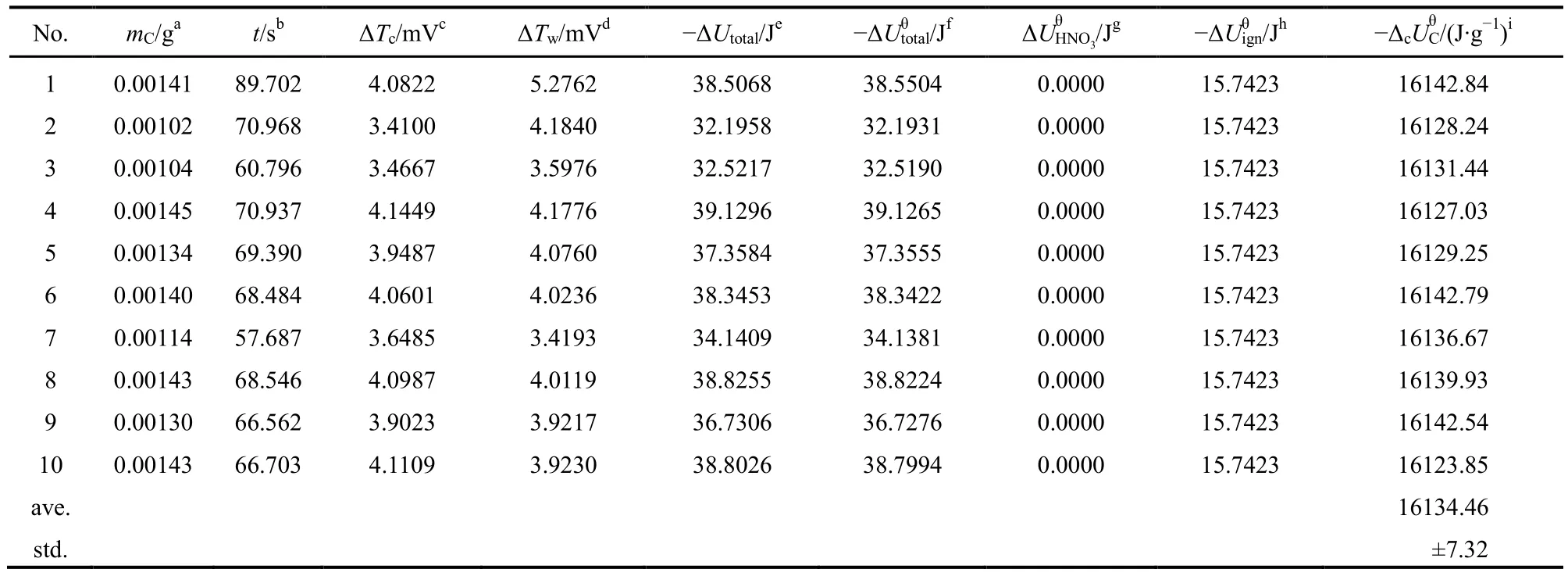
表3 棉线的标准质量燃烧热Table 3 Standard massic energy of combustion of cotton
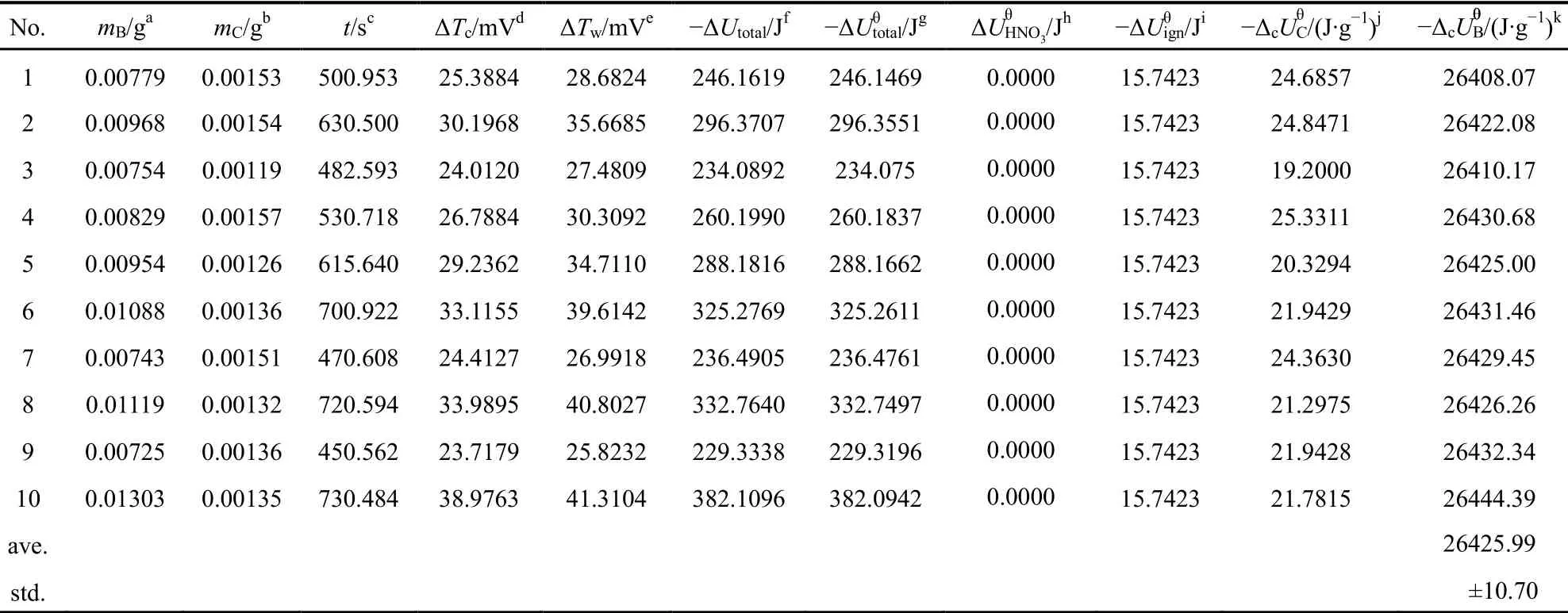
表4 苯甲酸的标准质量燃烧热Table 4 Standard massic energy of combustion of benzoic acid
在真空度为10 Pa、温度为363 K下,将丁二酸经三次缓慢升华提纯,用差热-热重分析仪进行热重测定检查其纯度,从室温升温到熔化温度,未检测到水蒸发失重信号,这表明在样品中几乎不含水。5次实验的结果得到丁二酸的平均摩尔分数x = (0.9994 ± 0.0001)。此外,C、H、N元素的含量用元素分析仪进行分析,也证实了热重分析的结果。经两次测定丁二酸C4H6O4的C和H平均质量分数w(C) 0.4079和w(H) 0.0516,与理论质量分数w(C) 0.4068和w(H) 0.0513非常吻合。
升华提纯后,在363 K下干燥72 h,冷却后称取20 mg左右丁二酸,压成直径约5 mm药片,放入装有P2O5的真空干燥箱中干燥。在这项研究中,为了保持干燥,丁二酸一直被保存在363 K这个温度下。
实验操作步骤与苯甲酸燃烧热的测定相似。测定10次,结果列入表5中。
3 结果与讨论
3.1 燃烧热测定的相关校正
3.1.1 绝热温度变化ΔT的校正
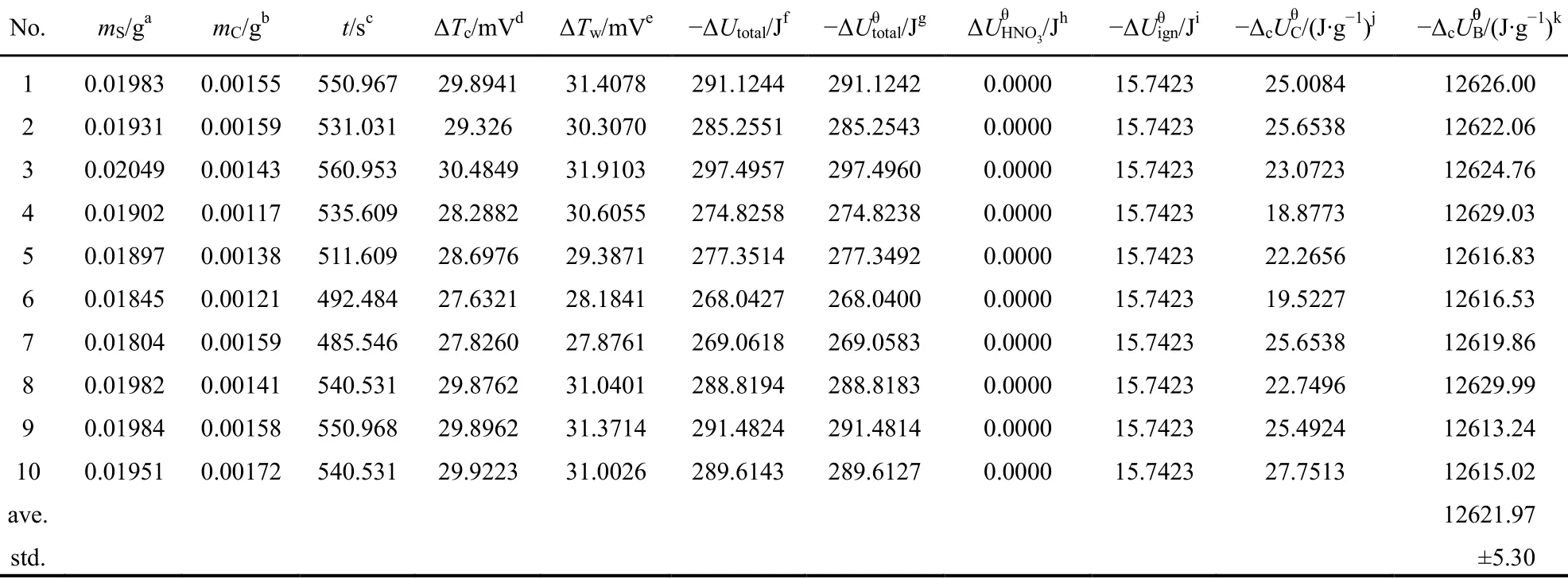
表5 丁二酸的标准质量燃烧热Table 5 Standard massic energy of combustion of succinic acid
具有恒温环境微量燃烧-溶解-反应量热计属于半绝热式量热计,它与环境间存在较小的热交换,同时还不可避免存在蒸发、对流、辐射,此外搅拌也会产生一定的摩擦热,因此需要进行绝热温度变化的校正。常用的绝热温度变化的校正方法有两种:雷诺法和等面积法,前者适合于手工作图的校正,后者适合于计算机编程作图的校正。等面积法的原理如图3所示。
所谓的等面积就是要使图3中F1和F2的面积相等,此时ΔT即为绝热温度变化校正值。图4是实验测定的典型的加热(或燃烧放热)电压-时间曲线图。数据处理时,将图4中加热(或燃烧)阶段及电标定阶段的电压-时间曲线分为两个独立的阶段,分别计算出两个阶段的绝热温度变化(实际为电压变化)。SRC-100溶解量热计编写了此计算程序。
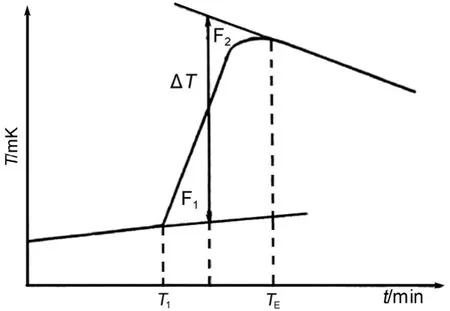
图3 等面积法原理图Fig.3 Principle of equal area method
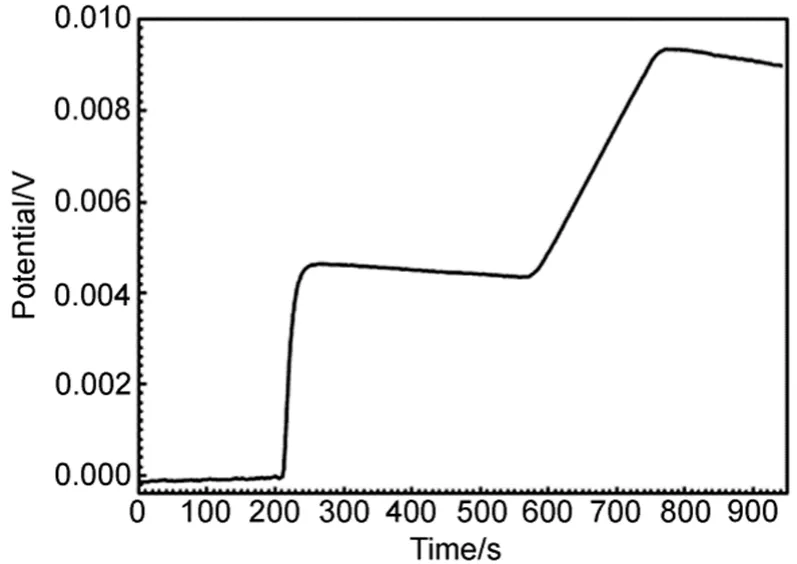
图4 加热(或燃烧放热)电压-时间曲线Fig.4 Voltage-time curve during heating (or burning)
3.1.2 空气浮力的校正
将样品的表观质量校正为真空质量的公式21:
式中:ρ为物质的密度,g·cm-3;纯棉线的密度为1.50 g·cm-322;苯甲酸的密度为1.32 g·cm-323;mVAC为真空质量;mAPP为表观质量,即所称质量。
3.1.3 副反应产生燃烧热的校正
由于空气没有完全排除或者高纯氧的实际纯度不达标,可能有微量氮气存在;或者是含N的化合物燃烧时生成的氮气,均会与氧气进一步反应生成二氧化氮,溶入弹体蒸馏水中反应生成硝酸。必然伴随着硝酸的生成热和溶解热产生,因此必须进行校正。硝酸的生成热和溶解热可按下式计算24:

式中:59.8是相当于由N2(g)、O2(g)和H2O(l)生成0.1 mol·dm-3HNO3(aq)的标准摩尔生成焓(kJ·mol-1);N是氢氧化钠溶液的浓度(mol·dm-3);V是滴定时消耗氢氧化钠溶液的体积(cm3)。
3.1.4 标准态的校正
实验测得的样品(棉线、苯甲酸及丁二酸)恒容燃烧热ΔcUs都是在3.0 MPa的高压下的总热量,必须换算到标准状态下的总热量ΔcUθs。
美国国家标准局对用弹式量热计精确测定燃烧热的标准态校正,推荐使用Washburn提出的近似校正公式25:
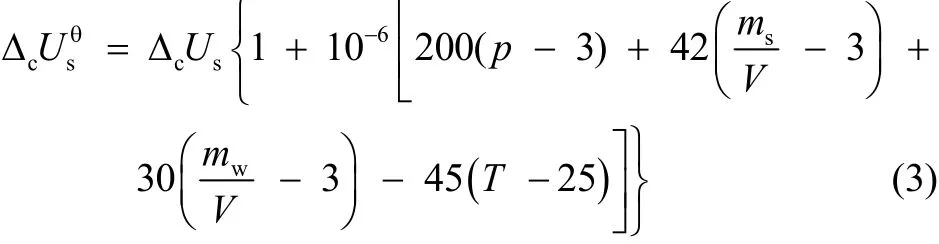
氧弹的有效内容积V = 8.5 cm3= 0.0085 L。假定室温为24.5 °C,弹内充氧气的表压(用pG表示表压) pG= 3.0 MPa,某次测量量热计的终态温度T= 25.4 °C = 298.55 K。
在室温下氧气的绝对压力为:
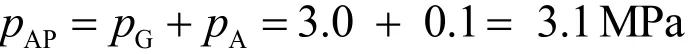
式中:APp表示绝对压力;Ap表示大气压力。在量热计的终态温度T时氧气的初始绝对压力为:

3.2 传感器的电势与温度的关系
根据实验测定的不同温度下传感器的电势数据(见表1),用Origin作图,以温度T为横坐标、电势V为纵坐标,结果如图5所示,并进行直线拟合,得到其电势随温度变化的直线方程(4):


3.3 铂丝的点火能和量热计的能当量
根据热容的定义, 可以得到热容与铂丝的点火能(或燃烧热)的关系式:

式中:Ccalor是系统的热容量(相当于能当量),单位为J·mV-1或J·K-1;ΔUign是点火能,单位为J;ΔUw是用精密恒流源电标定的电能,ΔUw= I2× R × t;ΔTign和ΔTw分别为加热(或燃烧)和电标定阶段的温度变化(校正值)。SRC-100溶解量热计编写了此计算程序。
铂丝点火能和量热计的热容量如表2所示。
3.4 棉线的质量燃烧热
棉线的标准状态质量燃烧热的计算公式为:

实验以及由上述公式计算得到的棉线的质量燃烧热列入表3中。
3.5 苯甲酸的质量燃烧热
苯甲酸的质量燃烧热的计算公式为:
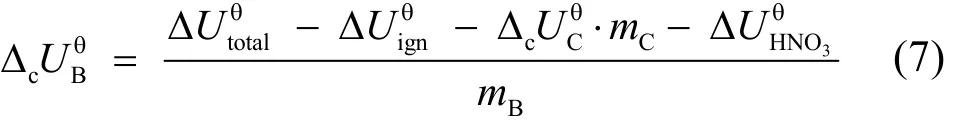
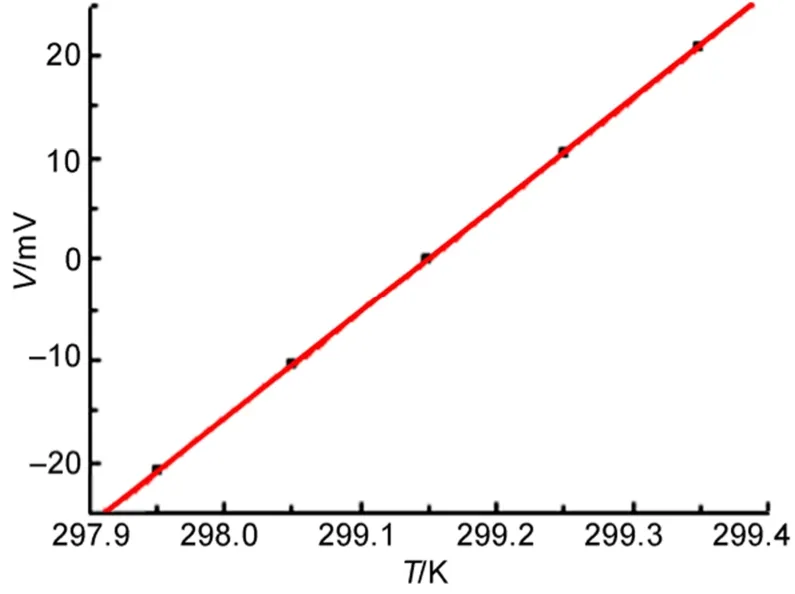
图5 电势与温度的线性关系Fig.5 Linear relationship between electric potential
实验及其由上述公式计算得到的苯甲酸的质量燃烧热列入表4中。
由表4可知苯甲酸的平均标准质量燃烧热及标准偏差:
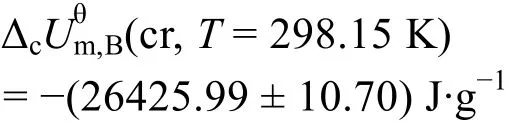
测量的不确定度:
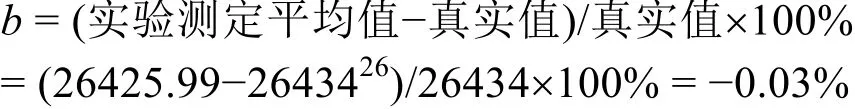
测量的精确度:
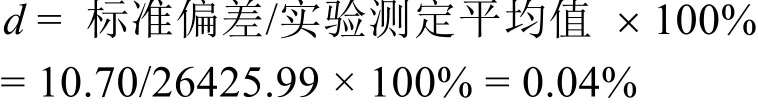
3.6 丁二酸的质量燃烧热
根据实验测定结果,并仿照公式(7)可计算得到丁二酸的质量燃烧热列入表5中。
由表5可知丁二酸的平均标准质量燃烧热及标准偏差:
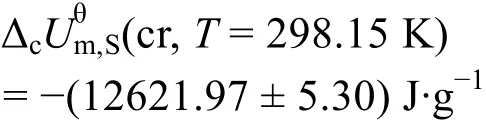
测量的不确定度:
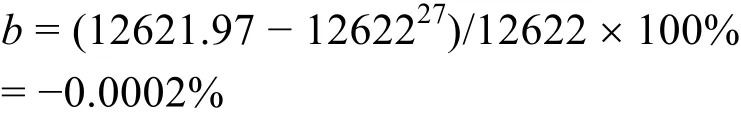
测量的精确度:

4 结 论
用本实验室自行设计搭建的精密恒温环境微量燃烧-溶解-反应多用量热计测定热值基准苯甲酸(NIST 39j)和丁二酸的标准质量燃烧热,分别为5.30) J·g-1,与参考文献26,27的值相比,测量的相对误差在0.03%以内,属于正常的误差范围,说明改进的精密恒温环境微量燃烧-溶解-反应多用量热计既可以用来测量物质的溶解热,也可以用来测量物质的燃烧热。测量数据的不确定度小于0.04%,精度高于0.05%,表明目前搭建的微型转动弹燃烧热测定这部分重现性好,运行稳定,测量结果可靠,基本满足要求。
(1) Randzio, S. L. Annu. Rep. Prog. Chem., Sect. C: Phys. Chem. 2002, 98, 157. doi: 10.1039/B111196P
(2) Tang, H. F.; Huang, Z. Y.; Xiao, M.; Liang M.; Chen, L.Y. Acta Phys. -Chim. Sin. 2016, 32 (12), 2891 [汤焕丰, 黄在银, 肖 明,梁 敏, 陈栎莹. 物理化学学报, 2016, 32 (12), 2891.] doi: 10.3866/PKU.WHXB201609133
(3) Korchagina, E. N. Measurement Techniques 1998, 41 (11), 1057. doi: 10.1007/BF02503874
(4) An, X. W.; He, J. Thermochim. Acta 2000, 352-353, 273. doi: 10.1016/S0040-6031(99)00476-1
(5) An, X. W.; He, J.; Bi, Z. J. Chem. Thermodyn. 1996, 28, 1115. doi: 10.1006/jcht.1996.0097
(6) Parker, W.; Steele, W. V.; Stirling, W.; Watt, I. J. Chem. Thermodyn. 1975, 7, 795. doi: 10.1016/0021-9614(75)90256-6
(7) Metzger, R. M.; Kuo, C. S.; Arafat, E. S. J. Chem. Thermodyn. 1983, 15, 841. doi: 10.1016/0021-9614(83)90090-3
(8) Beckhaus, H. D.; Riichardt, C.; Lagerwall, D. R.; Paquette, L. A.; WahlJ, F.; Prinzbach, H. J. Am. Chem. Soc. 1994, 116, 11775. doi: 10.1021/ja00105a018
(9) Diogo, H. P.; Minas da Piedade, M. E. J. Chem. Thermodyn. 1995, 27, 197. doi: 10.1006/jcht.1995.0016
(10) Sabbah, R.; Aguilar, A.R. J. Chem. Thermodyn. 1995, 27, 685. doi: 10.1006/jcht.1995.0070
(11) Nagano, Y.; Sugimoto, T. J. Therm. Anal. Calorim. 1999, 57, 867. doi: 10.1023/A:1010166813912
(12) Sakiyama, M.; Kiyobayashi, T. J. Chem. Thermodyn. 2000, 32, 269. doi: 10.1006/jcht.1999.0602
(13) Rojas-Aguilar, A. J. Chem. Thermodyn. 2002, 34, 1729. doi: 10.1016/S0021-9614(02)00257-4
(14) Camarillo, E. A.; Flores, H. J. Chem. Thermodyn. 2006, 38, 1269. doi: 10.1016/j.jct.2006.03.001
(15) da Silva, M. A. V. R.; Pilcher, G.; Santos, L. M. N. B. F.; Lima, L. M. S. S. J. Chem. Thermodyn. 2007, 39, 689. doi: 10.1016/j.jct.2006.10.013
(16) Yu, H. G.; Liu, Y.; Tan, Z. C.; Dong, J. X.; Zou, T. J.; Huang, X. M.; Qu, S. S. Thermochim. Acta 2003, 401, 217. doi: 10.1016/S0040-6031(02)00566-X
(17) Juan, Carlos M. P.; Liliana, G. G. Rev. Sci. Instrum. 2007, 78, 046105. doi: 10.1063/1.2727485
(18) Vargas, E. F.; Moreno, J. C.; Forero, J.; Parra, D. F. J. Therm. Anal. Calorim. 2008, 91, 659. doi: 10.1007/s10973-007-7613-y
(19) Mo, K. W. J. Changsha Communications Institute 1995, 11, 34 [莫克威. 长沙交通学院学报, 1995, 11, 34.]
(20) Yan, S. S.; Lu, G.; Xiao, G. C. Acta Physica Temperature Humilis Sinica 1980, 2, 65 [阎守胜, 陆 果, 熊光成. 低温物理, 1980, 2,65.]
(21) Hubbard, W. N.; Scott, D. W.; Waddington, G. Experimental Thermochemistry; Rossini, F. D. Ed. Interscience Publisher: New York, 1956; pp 75-103.
(22) Good, W. D.; Smith, N. K. J. Chem. Eng. Data 1969, 14, 102. doi: 10.1021/je60040a036
(23) Steele, W. V. J. Chem. Thermodyn. 1978, 10, 445. doi: 10.1016/0021-9614(78)90092-7
(24) Chen, J. T.; Di, Y. Y.; Tan, Z. C.; Zhang, H. T.; Sun, L. X. Chem. Pap. 2005, 59, 225.
(25) Jessup, R. S. Precise Measurement of Heat of Combustion with a Bomb Calorimeter. National Bureau of Standards Monograph 7. Issued February 26, 1960; pp 12-13
(26) National Institute of Standard and Technology, Certificate of Analysis, Standard Reference Material 39j, Benzoic Acid Calorimetric Standard, NIST, Standard Reference Material 2007. via the Internet at http://www.nist.gov/srm.
(27) Rojas, A.; Valdés, A. J. Chem. Thermodyn. 2003, 35, 1309. doi:10.1016/S0021-9614(03)00095-8
Design and Application of a Precise Isoperibol Combustion-Solution-Reaction Microcalorimeter
LI Xu1LI Qiang-Guo1,*JIANG Jian-Hong1GU Hui-Wen2,*LI Chuan-Hua1XIAO Sheng-Xiong1LI Xia1
(1College of Chemistry Biology and Environmental Engineering, Xiangnan University, Chenzhou 423043, Hunan Province, P. R. China;2College of Chemistry and Environmental Engineering, Yangtze University, Jingzhou 434023, Hubei Province, P. R. China)
The SRC-100 type solution-reaction calorimeter was improved to a more precise and versatile isoperibol combustion-solution-reaction microcalorimeter. The energy equivalent of the calorimeter was calibrated to be Ccalor= (987.63 ± 0.61) J·K-1by the electric calibration method. The standard massic energy of combustion of benzoic acid and succinic acid were determined by the developed isoperibol combustion-solution-reaction microcalorimeter as-(26425.99 ± 10.70) J·g-1andrespectively. The uncertainty of the measurement was less than 0.04% and the accuracy was higher than 0.05%.
Combustion-solution-reaction microcalorimeter; Standard massic energy of combustion; Benzoic acid; Succinic acid
m=7.9988ρ×mAPP(1)
VAC8ρ - 0.0096
December 26, 2016; Revised: February 20, 2017; Published online: February 21, 2017.
O642
10.3866/PKU.WHXB201702213
*Correspondent authors. Email: LI Qiang-Guo, liqiangguo@163.com. GU Hui-Wen, gugo@yangtzeu.edu.cn; Tel: +86-735-2653353.
The project was supported by the National Natural Science Foundation of China (21273190) and Science and Technology Plan Projects of Hunan Province, China (2014TT2026).
国家自然科学基金(21273190)和湖南省科技厅计划项目(2014TT2026)资助项目
© Editorial office of Acta Physico-Chimica Sinica

