结合型虾青素酶法水解工艺的研究
孙兆远,侯会绒,孔令伟
(1.江苏食品药品职业技术学院,江苏淮安223003;2.淮安快鹿牛奶有限公司,江苏淮安223003)
结合型虾青素酶法水解工艺的研究
孙兆远1,侯会绒1,孔令伟2
(1.江苏食品药品职业技术学院,江苏淮安223003;2.淮安快鹿牛奶有限公司,江苏淮安223003)
利用木瓜蛋白酶将克氏原螯虾虾壳中的结合型虾青素水解,获取游离虾青素。以虾青素提取量为评价指标,考察了蛋白酶添加量、酶解温度、溶液pH值及酶解时间等因素对水解效果的影响。通过单因素和正交试验确定了酶解工艺的最佳条件为:木瓜蛋白酶添加量10%、酶解温度45℃、溶液pH值5.5、酶解时间5 h,在此条件下,虾青素的提取量为97.26μg/g;各因素对虾青素提取量的影响依次为溶液pH值>酶解温度>酶解时间>木瓜蛋白酶添加量。
克氏原螯虾;结合型虾青素;木瓜蛋白酶
虾青素分子中的碳骨架由中央多聚烯链和两侧的芳香环组成,每个芳香环上各有一个羟基及一个酮基[1],中央多聚烯链和不饱和α羟基酮具有比较活泼的电子效应,能吸引自由基或向自由基提供电子[2],因此具有很强的抗氧化能力,可以广泛应用于食品、药品、化妆品、饲料等领域[3]。虾青素为非极性物质,游离的虾青素可利用非极性低沸点有机溶剂将其提取,然后通过蒸发回收溶剂进行分离,该法提取率高、选择性好、溶剂残留少,是较为理想的提取方法[4-5]。但虾壳中大多数虾青素与蛋白质以共价键形成结合型复合物,无法用有机溶剂萃取出来,因此所得提取率较低[6]。酶解法是利用蛋白酶将蛋白质与虾青素结合的共价键水解,将结合型虾青素分解为游离虾青素,然后利用有机溶剂萃取出来。该法得到的虾青素不但包含游离虾青素,还包含结合型虾青素的水解产物,因此提取率较高。另外,酶解法还具有反应条件温和、化学试剂用量少、对虾青素的破坏小、成品安全无毒、操作简便等优点,因此发展前景较高[7-8]。目前研究最多的是利用木瓜蛋白酶进行酶解,因为该酶具有只选择性降解GlcNAc-GleN-糖苷键的优势,有利于虾青素的提取[9]。
本文以克氏原螯虾虾壳为原料,木瓜蛋白酶为催化剂,虾青素提取量为指标,探讨蛋白酶添加量、酶解温度、溶液pH值及酶解时间等因素对结合型虾青素水解效果和虾青素提取量的影响,并通过正交试验对水解条件进行了优化,旨在获得最佳水解工艺,为虾青素的综合利用提供理论依据。
1 材料与仪器
1.1 试验材料
克氏原螯虾:盱眙龙盛龙虾养殖场;虾青素标准品:Sigma公司;木瓜蛋白酶(酶活力2.0×106U/mg):诺维信;其余试剂均为国产分析纯。
1.2 试验仪器
WF180万能粉碎机:上海光学仪器有限公司;TU-1900紫外可见分光光度计:北京普析通用仪器有限责任公司;TDL-40C低速大容量离心机:上海安亭科学仪器厂;RE-2000A旋转蒸发器:上海亚荣生化仪器厂;DX-II恒温磁力搅拌器:常州诺基仪器有限公司;SHZD循环水式真空泵:巩义市予华仪器有限责任公司;SPH-211F恒温振荡器:上海世平实验设备有限公司;PHS-3C酸度计:上海仪电科学仪器股份有限公司;HH-601恒温水浴锅:上海新嘉电子有限公司;JA1003A电子精密天平:上海伦捷机电仪表有限公司。
2 试验方法
2.1 样品处理
新鲜螯虾沸水煮制2 min后自然冷却,剥除虾仁和内脏,流水洗净虾头、尾及壳,避光、密封于-20℃备用。试验前用万能粉碎机粉碎,过80目筛备用。
2.2 酶解工艺
准确称取一定质量粉碎后的虾壳样品,按比例加入一定pH值的缓冲溶液和木瓜蛋白酶(酶活力2.0× 106U/mg),混合均匀,恒温振荡酶解,酶解结束后用冰水浴冷却,离心分离取滤渣,反复水洗去除矿物质,碾碎后加入丙酮过夜,过滤后留上清液,丙酮定容至50 mL[7,10]。
2.3 虾青素提取量的测定
2.3.1 标准曲线的绘制
分别吸取0、0.50、1.00、1.50、2.00、2.50 mL 1.0 mg/mL虾青素标准溶液于比色管中,丙酮定容至50 mL,混合均匀后在478 nm波长下测定吸光度,以吸光度值为纵坐标,虾青素标准溶液浓度为横坐标,绘制标准曲线见图1。

图1 虾青素标准曲线Fig.1 The standard curve of astaxanthin
由图1可知虾青素在0~50 μg/mL范围内线性回归方程y=0.008 6x-0.006 3,相关系数为0.999 3,结果符合朗伯比尔定律,方程可用于虾青素提取量的测定。
2.3.2 样品测定
吸取1.0 mL丙酮溶解液置于50 mL比色管中,按照2.3.1测定吸光度值,根据标准曲线计算虾壳提取液中虾青素含量。
2.4 酶解条件的研究
2.4.1 木瓜蛋白酶添加量对结合型虾青素水解效果的影响
准确称取7份粉碎后的虾壳样品各5.0 g,加入pH值为5.0的缓冲溶液100 mL,再分别加入0.1、0.2、0.3、0.4、0.5、0.6、0.7 g木瓜蛋白酶(加酶量分别为2%、4%、6%、8%、10%、12%、14%),置于40℃的恒温振荡器中酶解4 h,酶解结束后根据2.2进行过滤和定容,并根据2.3在478 nm条件下进行虾青素提取量测定,以虾青素提取量为指标考察木瓜蛋白酶添加量对结合型虾青素水解效果的影响。
2.4.2 酶解温度对结合型虾青素水解效果的影响
准确称取7份粉碎后的虾壳样品各5.0 g,加入pH值为5.0的缓冲溶液100 mL和0.5 g木瓜蛋白酶,分别置于25、30、35、40、45、50、55℃的恒温振荡器中酶解4 h,酶解结束后根据2.2进行过滤和定容,并根据2.3在478 nm条件下进行虾青素提取量测定,以虾青素提取量为指标考察酶解温度对结合型虾青素水解效果的影响。
2.4.3 溶液pH值对结合型虾青素水解效果的影响
准确称取7份粉碎后的虾壳样品各5.0 g,依次加入pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0的缓冲溶液100 mL和0.5 g木瓜蛋白酶,置于45℃的恒温振荡器中酶解4 h,酶解结束后根据2.2进行过滤和定容,并根据2.3在478 nm条件下进行虾青素提取量测定,以虾青素提取量为指标考察溶液pH值对结合型虾青素水解效果的影响。
2.4.4 酶解时间对结合型虾青素水解效果的影响
准确称取7份粉碎后的虾壳样品各5.0 g,加入pH值为5.0的缓冲溶液100 mL和0.5 g木瓜蛋白酶,置于45℃的恒温振荡器中分别酶解1、2、3、4、5、6、7 h,酶解结束后根据2.2进行过滤和定容,并根据2.3在478 nm条件下进行虾青素提取量测定,以虾青素提取量为指标考察酶解时间对结合型虾青素水解效果的影响。
2.4.5 最佳酶解条件的确定
在单因素试验的基础上,以木瓜蛋白酶添加量、酶解温度、溶液pH值和酶解时间为因素,采用L9(43)正交表进行正交试验设计,以虾青素提取量为评价指标,确定酶解最佳工艺条件。因素水平见表1。

表1 正交试验因素水平表Table 1 Factors and levels in orthogonal array design
3 结果与分析
3.1 木瓜蛋白酶添加量对结合型虾青素水解效果的影响
木瓜蛋白酶添加量对结合型虾青素水解效果的影响见图2。

图2 木瓜蛋白酶添加量对结合型虾青素水解效果的影响Fig.2 Effect of papain amount on extraction yield of free astaxanthin
由图2可知,在木瓜蛋白添加量为2%时,虾青素提取量非常低(44.34 μg/g),但随木瓜蛋白酶添加量不断增加,虾青素提取量快速增加。这主要是因为当底物充足而酶不足时,酶与底物结合后迅速分解为目标产物,此时水解速度取决于酶的数量多少,酶越多,反应速度越快。当酶添加量为10%时,虾青素提取量基本达到最大值;当酶添加量大于10%以后,虾青素提取量增加缓慢,这主要是因为当酶添加量增加到一定程度,所有底物都与酶相互结合,再增加多余酶,无底物结合,因此也不会产生水解速度的增加。由试验可知,酶的添加量过少酶解时间延长,添加量过多则造成酶的浪费,考虑到酶制剂的经济成本,选择木瓜蛋白酶添加量在10%左右。
3.2 酶解温度对结合型虾青素水解效果的影响
酶解温度对结合型虾青素水解效果的影响见图3。
由图3可知,在常温条件下(25℃),虾青素提取量很低(41.36 μg/g),这说明低温条件不利于蛋白酶水解糖苷键。随着温度的不断提升,虾青素提取量快速增加,并在温度为45℃时达到最大值(82.74 μg/g)。这主要是因为温度的增加使得蛋白酶和底物分子运动加速,分子碰撞概率增大。同时温度增高会逐渐接近酶的最适温度,酶分子和底物构象最适合酶促反应,因此速度快速增加[11]。但温度大于50℃后,虾青素提取量快速下降,特别是当温度为55℃时虾青素提取量仅为50.48 μg/g,这主要是因为过高的温度使酶分子结构发生可逆或不可逆的改变甚至变性,导致虾青素提取量快速下降[9]。
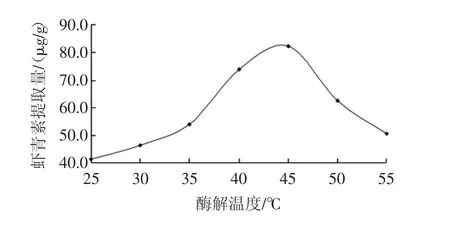
图3 酶解温度对结合型虾青素水解效果的影响Fig.3 Effect of hydrolytic temperature on extraction yield of free astaxanthin
3.3 溶液pH值对结合型虾青素水解效果的影响
溶液pH值对结合型虾青素水解效果的影响见图4。

图4 溶液pH值对结合型虾青素水解效果的影响Fig.4 Effect of hydrolytic pH on extraction yield of free astaxanthin
由图4可知,随着缓冲溶液pH值的增加,虾青素提取量先增加后降低,当pH值接近5.0时为虾青素提取量最大,这主要是因为木瓜蛋白酶为弱酸性酶类,最适pH值为5.0左右,pH值小于4.5或大于5.5时,酶蛋白分子活性中心功能基团的带电状态会发生改变,酶活性降低。
3.4 酶解时间对结合型虾青素水解效果的影响
酶解时间对结合型虾青素水解效果的影响见图5。
由图5可知,当酶解时间为1 h时,虾青素提取量很低(32.51 μg/g),因为这部分虾青素主要由虾壳本身含有的游离虾青素和结合型虾青素水解产物组成,由于游离虾青素和短时间内的水解产物均较低,因此所得提取量较低[12];随着酶解时间的延长,虾青素提取量先快速增加,并在5 h时达到最大值,这主要是因为木瓜蛋白酶为高效蛋白质水解酶,5 h内足以将全部结合型虾青素水解为游离状态;当时间继续延长,虾青素提取量变化缓慢,这主要是因为5 h后底物几乎被全部水解,虾青素不再产生;虾青素缓慢降低的原因可能是因为游离状态的虾青素易受光、氧、热等因素的影响而发生氧化反应[13]。

图5 酶解时间对结合型虾青素水解效果的影响Fig.5 Effect of hydrolytic time on extraction yield of free astaxanthin
3.5 最佳酶解条件的确定
正交试验结果见表2,采用excel 2007对正交试验结果进行极差分析结果见表3。
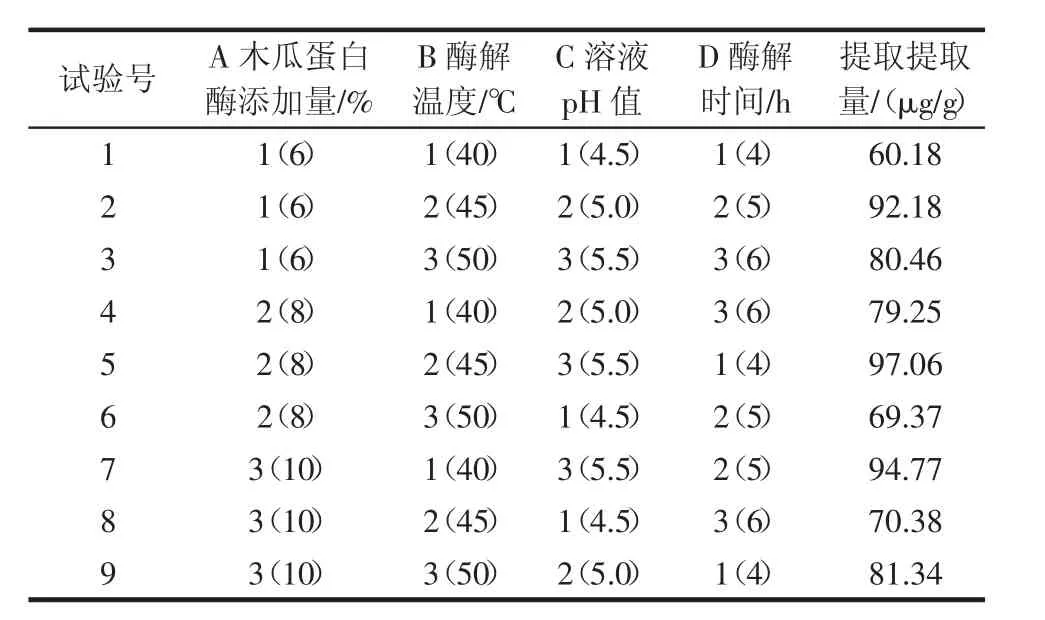
表2 木瓜,蛋白酶水解正交试验结果Table 2 Orthogonal test results of hydrolysis of bound astaxanthin compounds

表3 极差分析表Table 3 Range analysis of orthogonal test results
由表3可知,RC(72.35)>RB(28.45)>RD(26.23)>RA(13.68),这说明四因素对结果的影响次序为:C>B>D>A,即溶液pH值对结合型虾青素水解效果的影响最大,酶解温度次之,木瓜蛋白酶添加量的影响最小。由表中各水平对应的K值可以看出,在A因素下的K3,B因素下的K2,C因素下的K3和D因素下的K2分别在各自因素条件下最大,因此确定本试验的最佳组合A3B2C3D2,即最佳酶解条件为:木瓜蛋白酶添加量10%、酶解温度45℃、溶液pH值5.5、酶解时间5 h。
3.6 验证试验
因为A3B2C3D2的提取条件不在正交试验表中,所以按此条件补做3次平行验证试验,结果见表4。

表4 验证试验结果Table 4 Verification test of optimal hydrolytic conditions
由表4可知,在设定的酶解条件下,虾青素提取量较高(97.26 μg/g)且稳定,平均提取量超过正交试验最大值,具有可行性和实用价值。
4 结论
以克氏原螯虾虾壳为原料,蛋白酶为催化剂水解结合型虾青素制备游离虾青素,通过单因素试验和正交试验,确定了木瓜蛋白酶制备虾青素工艺的最佳参数为:木瓜蛋白酶添加量10%、酶解温度45℃、溶液pH值5.5、酶解时间5 h,在此条件下,虾青素的提取量为97.26 μg/g;各因素对结合型虾青素水解效果的影响依次为溶液pH值>酶解温度>酶解时间>木瓜蛋白酶添加量。
[1]张晓燕,刘楠,周德庆.天然虾青素来源及分离的研究进展[J].食品与机械,2012,28(1):264-267
[2]杨艳.虾青素抗氧化活性机制研究进展[J].国外医学卫生学分册, 2008,35(4):231-234
[3]曹平华,李晓霞,禹学礼,等.雨生红球藻的初步探讨[J].江西饲料, 2004(3):20-22
[4]姜启兴,夏文水.甲壳类加工下脚料中虾青素的提取研究[J].食品科技,2003(12):85-88
[5]张琇,李娜,曹晓虹,等.红酵母虾青素提取工艺的优化[J].食品科技,2011(1):196-199
[6]姜启兴,夏文水.影响酶法回收螯虾加工下脚料中虾青素及蛋白质的因素研究[J].食品工业科技,2004(7):54-56
[7]侯会绒,孙兆远,贡汉坤.超声波提取克氏原螯虾壳中虾青素[J].食品与发酵工业,2015,41(9):209-214
[8]于晓,尚宪明,刘云,等.木瓜蛋白酶酶解南极磷虾壳提取虾青素的研究[J].食品工业科技,2013,34(16):212-217
[9]赵仪,陈兴才.木瓜蛋白酶在虾仁加工废弃物中提取虾青素的应用[J].福州大学学报(自然科学版),2006,34(3):453-457
[10]张晓燕,刘楠,周德庆.正交试验优化南极磷虾壳中虾青素提取工艺研究[J].食品工业,2013,34(4):12-16
[11]蔡丽华,马美湖.4种常用蛋白酶对牛骨蛋白的酶解动力学研究[J].食品科学,2010,31(5):150-154
[12]陈兴才,黄伟光,欧阳琴.雨生红球藻中虾青素酯的皂化及游离虾青素的纯化分离[J].福州大学学报,2005,33(2):264-268
[13]蹇华丽,朱明军,吴振强,等.环状芽孢杆菌胞壁溶解酶用于红发夫酵母虾青素提取的研究[J].高校化学工程学报,2006,20(1):147-151
Optimizing Hydrolysis Techniques of Bound Astaxanthin Compounds by Papain
SUN Zhao-yuan1,HOU Hui-rong1,KONG Ling-wei2
(1.Jiangsu Food&Pharmaceutical Science College,Huai'an 223003,Jiangsu,China;2.Huaian Kuailu Milk Co.,Ltd.,Huai'an 223003,Jiangsu,China)
The bound astaxanthin compounds in Procambarus clarkia shell was hydrolyzed to free astaxanthin with papain.The effects of four reaction parameters,including amount of papain,temperature,pH and time,on the yield of free astaxanthin were explored by the yield of astaxanthin as index.The optimal hydrolyzed conditions was determined by the single factor test and orthogonal array design as follows:addition amounts of papain 10%,temperature 45℃,pH 5.5,hydrolyzed time 5 h.Under these conditions,the yield of astaxanthin was 97.26 μg/g.In addition,pH had the largest impact on the yield of astaxanthin followed by temperature,hydrolyzed time and addition amounts of papain.
Procambarus clarkia;bound astaxanthin compounds;papain
10.3969/j.issn.1005-6521.2017.12.009
2016-09-09
淮安市2013年度科技支撑计划(工业)项目(HAG2013074)
孙兆远(1979—),男(汉),讲师,硕士,主要从事天然产物应用与开发研究。

