牦牛发酵酸奶中耐久肠球菌的筛选鉴定和益生特性
黄 坚,童京京,岳 华,汤 承*
(西南民族大学生命科学与技术学院,四川 成都 610041)
牦牛发酵酸奶中耐久肠球菌的筛选鉴定和益生特性
黄 坚,童京京,岳 华,汤 承*
(西南民族大学生命科学与技术学院,四川 成都 610041)
为从牦牛发酵酸奶中筛选出新的食源性益生菌株,通过培养分离、16S rRNA基因测序分析和生化实验鉴定出4 株耐久肠球菌。这4 株分离株与已报道的8 株耐久肠球菌的同源性高达99.4%~99.9%,并且在系统发育树中单独聚为一支。其中耐久肠球菌SWUN5857的体外抗酸和抗胆盐能力最强,在体外可以有效抑制致病性大肠杆菌(抑菌圈直径(17.0±0.3) mm)和沙门氏菌(抑菌圈直径(18.0±0.2) mm)的生长,对常见的大多数抗生素都敏感,并且可以很好地与小鼠各段肠黏液产生黏附。短期喂服耐久肠球菌SWUN5857可以显著提高小鼠体质量(P<0.01),促进动物脾脏和胸腺的发育,同时还可提升动物体液和细胞免疫水平(P<0.01)以及肠道SIgA的表达水平(P<0.01)。综上所述,分离得到的耐久肠球菌SWUN5857能很好地适应胃肠环境压力,有效提高动物的生长性能和免疫功能,可以作为候选的益生性菌株。
牦牛酸奶;耐久肠球菌;分离鉴定;益生作用
牦牛发酵酸奶是青藏高原地区牧民的传统特色食品,其营养价值出众,包含丰富的乳酸菌资源。不同牧区牦牛发酵乳制品中的乳酸菌群组成各异,包括乳杆菌属、链球菌属、肠球菌属、明串珠菌属和乳球菌属等,并呈现出丰富的生物遗传多样性[1-2]。从多种乳制品和发酵食物中都可分离得到肠球菌,如粪肠球菌、屎肠球菌和耐久肠球菌等,其生物学表型和属性各异[3-5]。虽然从乳制品分离得到的乳酸菌中,肠球菌不是主要的优势菌群,但部分动物源性的肠球菌分离株已显示出了良好的益生属性,对维持肠道正常菌群结构发挥着重要作用,已经用于食品发酵和临床微生物学的研究[6-8]。优良的益生菌能够耐受胃肠道内的环境压力、在肠道内定植、抑制病原菌的生长和提高机体免疫力等属性[4,9],并且易于培养保存和便于生产应用,因此在筛选时需要在这些方面进行考察。
目前,现有对牦牛酸奶中乳酸菌资源的研究仍集中于菌种的筛选以及发酵工艺的优化[2,4],而对其中可能具有益生属性的肠球菌研究较少。不同来源的耐久肠球菌已经被分离得到,其生物学特性和作用也各不相同[10-12],但鲜见有关牦牛酸奶源耐久肠球菌在体内发挥微生物效应的报道,因此值得进一步研究。因此,本研究拟从牦牛发酵酸奶中分离鉴定出耐久肠球菌,研究其遗传特征及益生性能,以期为食源性益生菌的开发提供新的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、疫苗及样本
鸡致病性大肠杆菌CVCC 79301、猪霍乱沙门氏菌CVCC 503 中国微生物菌种保藏中心;鸡新城疫La Sota活毒冻干疫苗 成都生物技术有限公司。
牦牛酸奶样本采集于川西北阿坝州和甘孜州牧区,共采集得到10 份自然发酵牦牛酸奶,在4 ℃条件下转移至实验室,并立即进行乳酸菌的分离培养。
1.1.2 实验动物
昆明种小鼠(清洁级),21 日龄,体质量(20±2)g,雌性,由成都里来生物医学实验中心提供,饲养环境为SPF级实验动物房。
1.1.3 试剂
MRS培养基 杭州微生物有限公司;VETEK 2细菌生化鉴定试剂、药敏片 法国生物梅里埃公司;细菌基因组DNA提取试剂盒 北京天根生化科技有限公司;Taq DNA聚合酶、dNTPs、核酸染料GELVIEW、DNA Marker DL2000、琼脂糖 大连宝生物公司;SIgA检测试剂盒 上海心语生物科技有限公司;改良型RPMI-1640培养液、小鼠外周淋巴细胞分离液、CCK-8试剂盒 日本同仁化学研究所;刀豆蛋白A(concanavalin A,ConA) 美国Sigma公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)试剂盒、Bradford蛋白检测试剂盒 碧云天生物技术研究所。
1.2 仪器与设备
My CyclerTM聚合酶链式反应(polymerase chain reaction,PCR)仪、Ver SaDoc 2000凝胶成像系统、PowerPac UniversalTM核酸电泳仪 美国Bio-Rad公司;DELTA 320PH酸度计 瑞士Mettler Toledo公司;Biophotometer紫外分光光度计 德国Eppendorf公司;全自动细菌生化分析仪HX-21 合肥恒星科技开发有限公司;EX808酶标仪 美国BioTek公司。
1.3 方法
1.3.1 乳酸球菌的分离纯化
将适当稀释后的酸奶溶液均匀涂布于含2% CaCO3乳液的MRS培养基双层培养平板,置于37 ℃恒温箱中连续培养48 h,观察并记录菌落特征,并挑取培养平板上产生溶钙圈的菌落进行革兰氏染色。根据乳酸球菌的圆形或椭圆形菌落特征对革兰氏染色阳性菌株进行纯化培养。将纯化得到的乳酸球菌用含30%甘油的培养基重悬后置于-20 ℃保存备用。
1.3.2 乳酸球菌16S rRNA的PCR扩增和序列测定
按照操作说明提取上述细菌纯化培养物的基因组DNA作为PCR模板。PCR扩增16S rRNA区域上1 505 bp大小的片段,设计以下引物序列。上游引物:5’-CAGGTTCCCCTACGGTTA-3’;下游引物:5’-ATGGCTCAGATTGAACGC-3’,交由上海生物工程股份有限公司合成。PCR反应采用25 μL反应体系:DNA模板1 μL、上下游引物各1 μL(10 pmol)、4×dNTPs(10 mmo l/L)2 μL、Taq聚合酶(5 U/μL)0.125 μL、Mg2+3 μL(10 mmol/L)、10×PCR buffer 2.5 μL,用ddH2O补足至25 μL。PCR设定程序如下:95 ℃预变性5 min,94 ℃变性60 s、52 ℃退火60 s、72 ℃延伸90 s,共36 个循环。以无菌ddH2O设立阴性对照。将获得的PCR产物用1.5%琼脂糖凝胶电泳进行鉴定后,经纯化回收送上海生物工程股份有限公司进行测序。将扩增片段的序列与GenBank上已知的耐久肠球菌序列进行BLAST比对和同源性分析。
1.3.3 耐久肠球菌的生化鉴定
挑取分子鉴定为耐久肠球菌的菌株单菌落,接种于营养琼脂平面,37 ℃培养24 h后无菌蘸取适量菌落制成悬液,按照VETEK 2细菌生化鉴定系统操作要求上机分析并判读结果(四川省兽药监察所)。
1.3.4 16S rRNA基因序列分析及系统发育树构建
将初步抗压筛选得到的耐久肠球菌分离株的16S rRNA基因序列与已报道的耐久肠球菌基因序列进行同源性分析,同时调取GenBank数据库中收录的8 株同源性最高的耐久肠球菌基因序列,用Mega 5.2软件采用邻位相连法1 000 次Bootstrap抽样构建发育进化树。
1.3.5 耐久肠球菌的生长曲线
将充分活化的菌株按照1%的量接入200 mL MRS液体培养基中,37 ℃培养,于不同时间取样。每隔2 h取样,测定样本OD600nm,并记录数据,构建生长曲线。
1.3.6 耐酸和耐胆盐实验
将耐久肠球菌接种于MRS液体培养基,37 ℃培养24 h后,将菌体用培养基浸洗后重悬并调整浓度为3.0×108CFU/mL。将菌液调整pH值为1.0、2.0、3.0或0.3%牛胆酸盐条件,37 ℃恒温培养3 h后,分别进行活菌计数。实验重复3 次,并按公式(1)计算细菌存活率,以存活率表征菌株对酸或者胆盐的耐受性。

1.3.7 体外抑菌实验
取活化的耐久肠球菌接种于MRS液体培养基中增殖培养。在制备好的上层含指示菌的米勒-海顿(Mueller-Hinton,MH)肉汤培养双层平板上,于牛津杯中加入200 μL测试菌液样本,做好标记,并设立阴性对照。37 ℃培养15 h后测定抑菌圈的大小。用游标卡尺测定抑菌圈直径,当抑菌圈直径大于10 mm,即认为检测样品对指示菌有抑菌作用。
1.3.8 抗生素敏感实验
将耐久肠球菌接种于MH培养基,37 ℃培养24 h后用无菌棉签蘸取少许菌落,添加到MH肉汤中,调配成0.5麦氏比浊标准的菌悬液,经MH肉汤1∶1 000(V/V)稀释后备用。将100 µL上述菌液加入96 孔药敏板(阳性肠球菌专用)中,并设立生长和空白对照。用封口膜将96 孔板密封后置于37 ℃恒温培养箱中,孵育20 h后在Vitek Compact 2全自动微生物分析仪上判读结果。
1.3.9 体外肠黏液黏附实验
[20-21]的方法。剖杀昆明小鼠后无菌操作刮取各段肠道的肠黏液,用无菌0.01 mol/L pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS)离心浸洗后,过滤膜除菌。根据Bradford法测定蛋白质量浓度,用0.01 mol/L PBS调整蛋白质量浓度为1 mg/mL后于-20 ℃保存备用。将制备好的肠黏液100 μL加入96 孔培养板中于4 ℃固定过夜。200 μL PBS洗涤2 次,去除未黏附的黏液;加100 μL耐久肠球菌悬液(108CFU/mL);加入50 μL PBS及20 μL MTT(5 mg/mL),30 ℃孵育1 h后,加裂解液(含20%十二烷基硫酸钠及50%二甲基亚砜)振荡30 min。酶标仪于490 nm波长处测定各孔吸光度。以脱脂奶粉作为阴性对照,实验重复3 次。黏附率按公式(2)计算。

式中:A1、A0、A空分别代表实验组、菌悬液、空白对照吸光度。
1.3.10 小鼠体增质量和脏器指数的测定
经1 周的适应性饲喂后,将48 只小鼠随机分为2 组,每组24 只。根据前期饲喂浓度对小鼠体增重影响的结果,确定105CFU/mL为最佳的饲喂浓度。因此,实验组小鼠灌胃饲喂0.5 mL耐久肠球菌液(105CFU/mL),对照组小鼠灌服等量的MRS培养基,每天1 次,连续7 d;对照组和实验组小鼠均自由采食。在灌胃结束后的第1、7、14、21天对各组小鼠进行称质量,并记录结果。同时,剖杀小鼠后摘取脾脏和胸腺称质量,按公式(3)计算脏器指数并记录结果。

1.3.11 肠黏膜SIgA分泌的测定
在灌胃7 d后的第1、7、14、21天各组随机取出6 只小鼠,解剖小鼠空肠和回肠,刮取肠黏膜放于1 mL PBS中,充分搅拌,12 000×g离心15 min,获得上清液于-20 ℃保存。采用双抗夹心ELISA法定量测定其中的SIgA含量。
1.3.12 微量间接血凝抑制实验
在最后一次灌胃后间隔12 h,对所有昆明小鼠肌注鸡新城疫弱毒鸡新城疫La Sota活毒冻干疫苗2 头份/只。在免疫结束后第7、14、21天每组取出6 只小鼠,每只鼠无菌采集得0.3 mL眼球非抗凝血,制备血清并标记编号,置于56 ℃水浴中灭活30 min,然后采用β微量法[24]血凝抑制实验测定小鼠血清中新城疫抗体的效价。血清的血凝抑制HI抗体效价为该血清100%抑制凝集的最大稀释度(X),结果以log2X表示。
1.3.13 淋巴细胞转化实验
参考文献[25]的方法,将无菌采集得到的0.5 mL小鼠眼球血贮存于肝素抗凝管中,用Ficoll密度梯度离心法分离外周血中的淋巴细胞悬液,用PBS重复洗涤3 次后在96 孔细胞培养板中进行淋巴细胞转化增殖实验。采用CCK-8法测定对照孔和刺激孔在450 nm波长处的吸光度。按公式(4)计算对应小鼠样本的刺激指数(stimulating index,SI)。

1.4 数据分析与处理
2 结果与分析
2.1 乳酸球菌的菌落形态及细胞形态特征

图1 乳酸球菌革兰氏染色阳性(×40)Fig.1 Positive Gram staining of Lactococcus lactics (× 40)
用双层MRS选择培养平板从10 份传统发酵牦牛酸奶中分离得到38 株乳酸菌,菌落形态呈圆形,颜色呈乳白色,表面光滑湿润,周围有溶钙圈。由图1可知,显微镜下呈圆形或椭圆形,无芽孢,革兰氏染色呈阳性,符合乳酸球菌的形态特征。
2.2 乳酸球菌16S rRNA序列PCR扩增结果及基因测序同源比对

图2 乳酸球菌16S rRNA基因扩增结果Fig.2 PCR amplification of 16S rRNA gene from Lactococcus lactics
由图2可知,乳酸球菌16S rRNA基因扩增片段大小约为1 500 bp,与预期片段大小相符。经16S rRNA基因测序并与GenBank数据库中已知的耐久肠球菌序列进行比对后发现,分离得到的38 株乳酸球菌中,有4 株分离菌(SWUN5856、SWUN5857、SWUN5858和SWUN5859)与耐久肠球菌的同源性最高,同源性均大于99%,因此初步认定这些分离菌为耐久肠球菌。
2.3 耐久肠球菌16S rRNA的同源性比对和系统进化树的构建
使用M E G A 5.2软件,将本实验分离株SWUN5856~SWUN5859(GenBank登录号:KX687981~KX687984)与16S rRNA序列同源性高于99%的8 株耐久肠球菌进行系统进化分析并建立进化树,结果显示这12 株耐久肠球菌形成2 个分支,本研究的分离株单独聚为一支(图3)。

图3 4 株耐久肠球菌分离株和8 株同源性耐久肠球菌株16S rRNA基因片段的进化树Fig.3 Phylogenic tree of4 strains of Enterococcus durans and8 homologous isolates based on 16S rRNA gene sequences
2.4 耐久肠球菌的生化鉴定结果

表1 耐久肠球菌的生化鉴定分析Table1 Biochemical analysis of Enterococcus durans
使用VITEK2鉴定系统对4 株分离株进行生化特性分析(表1),结果显示这4 株乳酸球菌均为耐久肠球菌。2.5 体外耐酸和抗胆盐能力优势耐久肠球菌的筛选

表2 耐久肠球菌在酸性和胆酸盐条件下的存活率Table2 Survival of Enterococcus durans after exposure to acidic and bile salts %
体外耐酸和抗胆盐实验结果显示,pH 1.0的酸性条件下对各个菌株均有不同程度的抑杀作用,在pH 3.0的条件下SWUN5857的存活率达到84%,在pH 1.0条件下的存活率也要高于其他3 株,说明耐久肠球菌SWUN5857对酸性条件耐受较好。4 株耐久肠球菌在0.3%牛胆酸盐存在条件下培养3 h后,耐久肠球菌SWUN5857对0.3%胆盐的耐受率最高(约为73%),说明其对胆盐的耐受性较好,其次是耐久肠球菌SWUN5858,其他菌株耐胆盐能力一般(表2)。综上结果将SWUN5857选定为候选益生菌株进行下一步研究。
2.6 耐久肠球菌SWUN5857的生长曲线
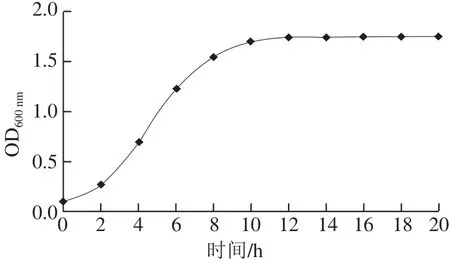
图4 耐久肠球菌SWUN5857的生长曲线Fig.4 Growth curve of Enterococcus durans SWUN5857
由图4可知,菌株SWUN5857在前2 h处于延滞期,没有大的变化,之后进入对数期,大约到11 h达到生长高峰,进入稳定期后和衰亡期后,活菌就会被自身代谢产物所抑制,从该曲线上可以确定该菌体的最佳收获时间是11 h。
2.7 耐久肠球菌SWUN5857对小鼠各肠段肠黏液的体外黏附作用将耐久肠球菌SWUN5857与固定好的肠黏液共孵育结束后的黏附率检测结果见表3。结果显示,该菌与各段肠黏液都能产生黏附,其中菌株对盲肠和结肠段黏液的黏附率要略高于十二指肠、空肠和回肠段,但各组数据间并无显著差异(P>0.05)。

表3 耐久肠球对各肠段肠黏液的黏附率Table3 Adhesion percentages of Enterococcus durans SWUN5857 to intestinal mucus of mice %
2.8 耐久肠球菌SWUN5857对抗生素的敏感性
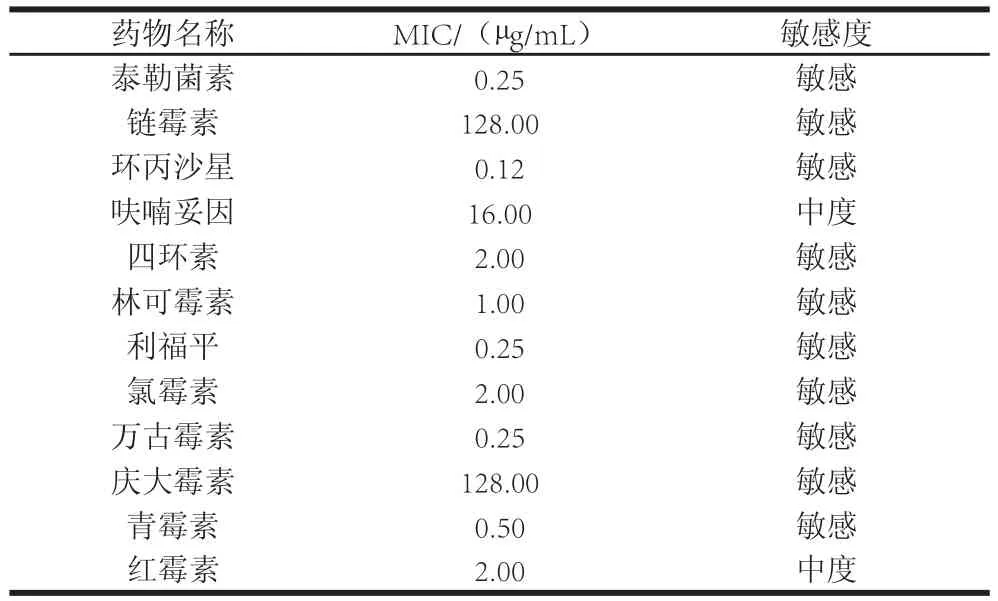
表4 耐久肠球菌SWUN5857对抗生素的敏感性Table4 Antibiotic susceptibilities of Enterococcus durans SWUN5857
最小抑菌浓度(minimum inhibitory concentration,MIC)即为小孔内完全抑制细菌生长的最低药物浓度,本实验生长对照组细菌生长良好,空白对照组无细菌生长,证明了结果的可靠性。根据NCCLS推荐的药物敏感分界点值标准,可以将结果判定为耐药、敏感或中度敏感,结果见表4。
2.9 耐久肠球菌SWUN5857的体外抑菌能力

图5 耐久肠球菌SWUN5857对大肠杆菌和沙门氏菌的生长抑制作用Fig.5 Inhibitory effects of Enterococcus durans SWUN5857 on the growth of Escherichia coli and Salmonella
如图5所示,牦牛酸奶源耐久肠球菌SWUN5857对大肠杆菌的抑菌圈大小平均为(17.0±0.3) mm;对沙门氏菌的抑菌圈大小平均为(18.0±0.2) mm。结果表明,耐久肠球菌SWUN5857对大肠杆菌和沙门氏菌都具有较好的体外抑制效果。
2.10 短期饲喂耐久肠球菌SWUN5857对小鼠体质量的影响

表5 饲喂耐久肠球菌SWUN5857对小鼠体质量的影响Table5 Effects of feeding Enterococcus durans SWUN5857 on mouse body weight g
由表5可知,灌胃结束后的各时间段,105CFU/mL组与对照组相比差异极显著(P<0.01)。结果表明,105CFU/mL耐久肠球菌SWUN5857能够显著提高小鼠的体质量。
2.11 饲喂耐久肠球菌SWUN5857对小鼠脾脏和胸腺指数的影响

表6 饲喂耐久肠球菌SWUN5857对小鼠脾脏和胸腺指数的影响Table6 Effects of feeding Enterococcus durans SWUN5857 on mouse spleen and thymus indexes
饲喂结束后,对照组与饲喂组小鼠在饲喂停止后第7、14、21天的脾脏指数和胸腺指数,仅第7天的脾脏指数存在差异(P<0.05),而其他对比组无统计学差异,但饲喂组的平均器官指数均高于对照组(表6)。
2.12 饲喂耐久肠球菌SWUN5857对小鼠肠黏膜SIgA的影响

表7 饲喂SWUN5857不同时间对小鼠肠黏膜SIgA的影响Table7 Effects of Enterococcus durans on SIgA of mouse intestinal mucosa SIgA ng/mL
由表7可知,饲喂组各时间段小鼠肠黏膜SIgA的含量均高于对照组。在灌胃结束后的第1天,饲喂组与对照组的SIgA含量差异极显著(P<0.01)。结果显示,饲喂耐久肠球菌SWUN5857能够显著提高小鼠肠黏膜SIgA的分泌。
2.13 饲喂耐久肠球菌SWUN5857对小鼠体液免疫的影响

表8 饲喂耐久肠球菌SWUN5857对小鼠血清ND HI抗体效价的影响Table8 Effects of feeding Enterococcus durans SWUN5857 on ND HI antibody titer of mouse serum
由表8可知,饲喂结束后的第7、14天,饲喂组与对照组的抗体效价变化差异极显著(P<0.01),提示饲喂耐久肠球菌SWUN5857能够显著提高小鼠的体液免疫。
2.14 饲喂耐久肠球菌SWUN5857对小鼠细胞免疫水平的影响

表9 饲喂耐久肠球菌SWUN5857对小鼠外周血淋巴细胞刺激增殖指数的影响Table9 Effects of feedingEnterococcus durans rans SWUN5857 on thee stimulation of peripheral blood lymphocyte proliferation index in mice
表9结果显示,饲喂结束后的第7、14天,饲喂组与对照组的指数变化差异极显著(P<0.01),且在第14天时达到最大;第21天差异显著(P<0.05),表明灌胃耐久肠球菌SWUN5857能够显著提高小鼠的细胞免疫水平。
3 讨 论
本研究分离鉴定并筛选出一株具有益生属性的耐久肠球菌SWUN5857,该分离株的对数生长期长,繁殖快,平台期维持时间长,因此十分适于大量发酵生产。该菌株耐酸和耐胆盐能力突出,是其在消化道环境内适应存活的前提,这可能是通过合成酪氨酸来实现的[8,13]。SWUN5857与其他已报道的耐久肠球菌分离株各自聚为一支,并且不同来源的分离株间存在一定的遗传变异,因此在生物学性能上可能会存在一些差别,这也可能与菌株的分离背景和生存环境有关[2,14-15]。
SWUN5857对常见的多种抗生素均表现出敏感性,并且可以有效地抑制病原微生物的生长,显示出了其作为候选益生菌株的潜力。研究报道显示,一些肠球菌属的益生菌株会对某些抗生素具有抗性,这可能与其携带的相关抗性基因有关[16-17],但这些抗性可能是内源性的或者是天然性的,不一定具有转移性。而一些菌株还能表达分泌细菌素,具有很好的抗微生物活性,因此在应用时需要综合考虑它们的表型及基因型特征与益生特性的关系[11,17-19]。此外,自然牧区传统制作的酸奶可以较好地保留这类有益的乳酸菌,而作为食源性菌株也降低了其用作益生菌的安全风险。
益生菌株进入消化道后,需要与肠道黏液中的蛋白受体进行接触附着后才能进行定植和发挥作用,并且可以竞争性抑制病原菌与肠黏液的黏附,保护机体不受侵害[20]。耐久肠球菌SWUN5857与小鼠的各段肠道的肠黏液都可以很好地发生黏附,这与其他报道的乳酸菌黏附作用的研究结果相似[21-22],而耐久肠球菌为兼性厌氧菌,且可以形成生物膜[17,23],这也更利于其在后段肠道内进行快速定植和发挥作用。为此,研究也进一步观察了其在动物体内的生物学作用。
在整个实验饲喂周期内动物未出现任何不良表现,提示合理使用该菌株具有安全性。通过短期饲喂,该菌株显示出了明显的促进生长和免疫器官发育的作用,这可能与菌株能有效促进营养物质的吸收转化、调节肠道内菌群组成、抑制有害菌的生长和增强机体免疫力有关[7,26-28]。而本研究结果也进一步证明了SWUN5857可以显著提高动物肠道的黏膜免疫、细胞免疫和体液免疫的水平,虽然呈现一定的时间依赖性,但对于动物的早期健康发育显示出了积极作用。这一作用可能与菌株本身或细胞壁成份刺激宿主细胞,激活树突状细胞,分泌干扰素-γ的产生实现对机体的免疫调节[26],或者通过合成分泌细菌素、抗氧化活性酶和降胆固醇相关酶来提升动物的抗病能力有关[5,8,29-30]。因此,短期的预防性添加饲喂生物学效果显著。此外,分离株SWUN5857在体内适应性强,因此也更易在机体内发挥有益的生物学作用,而将其作为免疫增强性微生态制剂的应用潜力也值得进一步研究。本研究的相关结果也为SWUN5857耐久肠球菌作为益生性菌株的开发应用提供参考数据。
参考文献:
[1] 丁武蓉. 青藏高原传统发酵牦牛奶中乳酸菌多样性及其益生功能研究[D]. 兰州: 兰州大学, 2014: 41-52.
[2] 田鸿, 蒲彪, 张小平. 川西高原牦牛酸奶子乳酸菌遗传多样性及系统发育研究[J]. 食品科学, 2012, 33(5): 170-176.
[3] 国立东, 王欣, 杜鹏, 等. 传统乳制品中乳酸菌的分离及性能研究[J]. 食品科学, 2006, 27(3): 60-64. DOI:10.3321/ j.issn:1002-6630.2006.03.010.
[4] 吴均, 赵晓娟, 陈佳昕, 等. 西藏、川西青藏高原牧区自然发酵牦牛酸奶中优良乳酸菌的筛选及鉴定[J]. 食品科学, 2013, 34(17): 150-155. DOI:10.7506/spkx1002-6630-201317033.
[5] 骞宇, 阚建全, 赵欣, 等. 青藏高原自然发酵牦牛酸奶中乳酸菌的抗氧化能力的研究[J]. 食品工业科技, 2014, 35(3): 119-122.
[6] RENYE J R, SOMUKUTI J A, PAUL G A, et al. Characterization of antilisterial bacteriocins produced by Enterococcus faecium and Enterococcus durans isolates from Hispanic-style cheeses[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(2): 261-268. DOI:10.1007/s10295-008-0494-7.
[7] BEDNORZ C, GUENTHER S, OELGESCHLAGER K, et al. Feeding the probiotic Enterococcus faecium strain NCIMB 10415 to piglets specifically reduces the number of Escherichia coli pathotypes that adhere to the gut mucosa[J]. Applied and Environmental Microbiology, 2013, 79(24): 7896-7904. DOI:10.1128/AEM.03138-13.
[8] PIENIZ S, ANDREAZZA R, ANGHINON T, et al. Probiotic potential, antimicrobial and antioxidant activities of Enterococcus durans strain LAB18s[J]. Food Control, 2014, 37(1): 251-256. DOI:10.1016/ j.foodcont.2013.09.055.
[9] 许珂, 魏萍. 益生菌作用机制的研究进展[J]. 中国微生态学杂志, 2009, 21(1): 90-92. DOI:10.3969/j.issn.1003-8701.2002.01.012.
[10] AVRAM H L, STOCK J, PRRLESAK A, et al. E. durans strain M4-5 isolated from human colonic flora attenuates intestinal inflammation[J]. Diseases of the Colon & Rectum, 2010, 53(12): 1676-1686. DOI:10.1007/ DCR.0b013e3181f4b148.
[11] YANAGIDA F, CHEN Y, ONDA T, et al. Durancin L28-1A, a new bacteriocin from Enterococcus durans L28-1, isolated from soil[J]. Letters in Applied Microbiology, 2005, 40(6): 430-435. DOI:10.1111/j.1472-765X.2005.01693.x.
[12] RAMAKRISHNAN V, GOVEAS L C, HALAMI P M, et al. Kinetic modeling, production and characterization of an acidic lipase produced by Enterococcus durans NCIM5427 from fish waste[J]. Journal of Food Science and Technology, 2015, 52(3): 1328-1338. DOI:10.1007/s13197-013-1141-5.
[13] de PALENCIA P F, FERNÁNDEZ M, MOHEDANO M L, et al. Role of tyramine synthesis by food-borne Enterococcus durans in adaptation to the gastrointestinal tract environment[J]. Applied and Environmental Microbiology, 2011, 77(2): 699-702. DOI:10.1128/AEM.01411-10.
[14] 包秋华. 甘肃和四川省牦牛奶制品中乳酸菌的多样性研究[D]. 呼和浩特: 内蒙古农业大学, 2012: 35-46.
[15] NEJATI F, GATTO V, CASTIONI A, et al. Genetic diversity of enterococci from Iranian home-made artisanal dairy products[J]. Dairy Science and Technology, 2015, 95(2): 151-165. DOI:10.1007/s13594-014-0193-2.
[16] dos SANTOS K M, VIEIRA A D S, SALLES H O, et al. Safety, beneficial and technological properties of Enterococcus faecium isolated from Brazilian cheeses[J]. Brazilian Journal of Microbiology, 2015, 46(1): 237-249. DOI:10.1590/S1517-838246120131245.
[17] PIENIZ S, de MOURA T M, CASSENEGO A P V, et al. Evaluation of resistance genes and virulence factors in a food isolated Enterococcus durans with potential probiotic effect[J]. Food Control, 2015, 51(3): 49-54. DOI:10.1016/j.foodcont.2014.11.012.
[18] BELGUESMIA Y, CHIOSET Y, RABESONA H, et al. Antifungal properties of durancins isolated from Enterococcus durans A5-11 and of its synthetic fragments[J]. Letters in Applied Microbioogy, 2013, 56(4):237-244. DOI:10.1111/lam.12037.
[19] DU L H, SOMKUTI G A, RENYE J A. Molecular analysis of the bacteriocin-encoding plasmid pDGL1 from Enterococcus durans and genetic characterization of the durancin GL locus[J]. Microbiology, 2012, 158(6): 1523-1532. DOI:10.1099/mic.0.055624-0.
[20] 李正, 李健, 刘淇, 等. 黏红酵母表面黏附蛋白及肠黏液受体的初步研究[J]. 水产学报, 2008, 32(6): 939-944. DOI:10.3321/ j.issn:1000-0615.2008.06.016.
[21] 曾东, 王益平, 倪学勤, 等. 鲤益生菌筛选及部分菌株对鲤前肠黏液的体外黏附作用[J]. 中国水产科学, 2009, 16(3): 427-433. DOI:10.3321/j.issn:1005-8737.2009.03.016.
[22] 马玉龙, 许梓荣, 尤萍, 等. 乳酸杆菌对病原菌黏附肉鸡肠黏液的影响[J]. 中国预防兽医学报, 2004, 26(3): 207-210. DOI:10.3969/ j.issn.1008-0589.2004.03.012.
[23] AMEL A M, FARIDA B, DJAMILA S, et al. Anti-adherence potential of Enterococcus durans cells and its cell-free supernatant on plastic and stainless steel against foodborne pathogens[J]. Folia Microbiologica, 2015, 60(4): 357-363. DOI:10.1007/s12223-014-0367-6.
[24] 王延树, 张芳. 血凝和血凝抑制试验操作要领[J]. 中国动物保健, 2009, 11(8): 75-76. DOI:10.3969/j.issn.1008-4754.2009.08.021.
[25] 赵世云, 赵新新, 苏华荔, 等. 猪外周血T淋巴细胞增殖反应MTT检测方法的建立[J]. 中国畜牧兽医, 2010, 37(12): 35-38.
[26] MOLINA M A, DÍAZ A M, HESSE C, et al. Immunostimulatory effects triggered by Enterococcus faecalis CECT7121 probiotic strain involve activation of dendritic cells and interferon-gamma production[J]. PLoS ONE, 2015, 10(5): e0127262. DOI:10.1371/journal.pon e.0127262.
[27] CAPCAROVA M, WEISS J, HRNCAR C, et al. Effect of Lactobacillus fermentum and Enterococcus faecium strains on internal milieu, antioxidant status and body weight of broiler chickens[J]. Journal of Animmal Physiology and Animal Nutrition, 2010, 94(5): e215-e224. DOI:10.1111/j.1439-0396.2010.01010.x.
[28] 王永, 杨维仁, 张桂国. 饲粮中添加屎肠球菌对断奶仔猪生长性能、肠道茵群和免疫功能的影响[J]. 动物营养学报, 2013, 25(5): 1069-1076. DOI:10.3969/j.issn.1006-267x.2013.05.023.
[29] 石超. 传统发酵牦牛酸奶中降胆固醇乳酸菌的筛选及其对高脂模型大鼠的益生作用[D]. 兰州: 兰州大学, 2014: 64-77.
[30] RAMAKRISHNAN V, BALAKRISHNAN B, RAI A K, et al. Concomitant production of lipase, protease and enterocin by Enterococcus faecium NCIM5363 and Enterococcus durans NCIM5427 isolated from fish processing waste[J]. International Aquatic Research, 2012, 4(1): 1-14. DOI:10.1186/2008-6970-4-14.
Identification of Enterococcus durans Isolated from Naturally Fermented Yak Milk and Its Probiotic Potentials
HUANG Jian, TONG Jingjing, YUE Hua, TANG Cheng*
(College of Life Science and Technology, Southwest Minzu University, Chengdu 610041, China)
This study aimed to screen new probiotics from naturally fermented yak milk. We separated and identified four Enterococcus durans strains by bacterial cultivation, gene sequence alignment and biochemical analysis. These four strains shared 99.4%-99.9% genetic homology by comparison of th eir 16S rRNA sequences with those of eight other E. durans isolates previously reported and were clustered into a separate branch by phylogenetic analysis. Among these isolates, E. durans SWUN5857 exhibited the most robust resistance to acidic and bile salts and could greatly adhere to intestinal mucus in different segments of the intestinal tract in Kunming mice, especially in lower intestines. Moreover, it inhibited the growth of pathogenic Escherichia coli ((17.0 ± 0.3) mm) and Salmonella ((18.0 ± 0.2) mm), and it was also sensitive to common antibiotics in vitro. Mice gavaged with SWUN5857 for a short term showed a significant body weight gain (P < 0.01) and an increase in immune organ indexes. Besides, this treatment also signif i cantly promoted the animal humoral and cellular immunity level (P < 0.01) and enhanced the secretion of intestinal mucosa SIgA (P < 0.01). In conclusion, E. durans SWUN5857 can successfully adapt to the gastrointestinal condition and improve animal growth performance and immunological function, being, therefore, a promising candidate probiotic.
yak milk yogurt; Enterococcus durans; identification; probiotic properties
10.7506/spkx1002-6630-201712007
TS201.3;TS252.54
A
1002-6630(2017)12-0043-07
黄坚, 童京京, 岳华, 等. 牦牛发酵酸奶中耐久肠球菌的筛选鉴定和益生特性[J]. 食品科学, 2017, 38(12): 43-49.
10.7506/spkx1002-6630-201712007. http://www.spkx.net.cn
HUANG Jian, TONG Jingjing, YUE Hua, et al. Identification of Enterococcus durans isolated from naturally fermented yak milk and its probiotic potentials[J]. Food Science, 2017, 38(12): 43-49. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712007. http://www.spkx.net.cn
2016-09-06
中央高校基本科研业务费专项(2015NZYQN32);“十二五”国家科技支撑计划项目(2012BAD13B06)
黄坚(1984—),男,讲师,博士,研究方向为兽医临床微生物学。E-mail:huangjian.1122@163.com
*通信作者:汤承(1965—),男,教授,博士,研究方向为兽医临床微生物学。E-mail:tangcheng101@163.com

