彩色羧基荧光微球的制备
张小燕 周齐洋 江苏省医疗器械检验所 (南京 210012)
彩色羧基荧光微球的制备
张小燕 周齐洋 江苏省医疗器械检验所 (南京 210012)
采用活性溶胀种子无皂乳液聚合法制备了表面修饰有羧基的彩色且在特定激发下释放荧光的聚苯乙烯微球。采用乳液聚合首先制备尺寸均一的苯乙烯纳米小球作为可溶胀活性种子,采用丙烯酰化的染料分子作为共聚单体,从而制备得到有色苯乙烯微球。所得到的有色微球进一步作为种子,通过溶胀法负载稀土配合物进行荧光标记,并再次通过乳液聚合使其包裹在微球内。为了便于生物分子偶联,在聚合过程中引入甲基丙烯酸作为功能化共聚单体,从而使所得微球表面被羧基功能化。
标记 无皂乳液聚合 彩色 荧光 羧基化
聚合物微球因其形态结构稳定、粒径分布窄、比表面积大、表面吸附性强等特点在生命科学、生物医学等领域得到广泛的应用,如细胞表面抗原检测,血流分析,吞噬功能检测,凝集试验为代表的诊断检测,药物筛选等[1-3]。聚合物微球本身为白色,对比度不强,不易被检测,但对微球进行染料或荧光标记,成为带有色彩或荧光信号的微球时,易于检测。尤其是对基于聚苯乙烯微球的胶乳凝集试验,有色微球更易于观察,从而大大提高检测的灵敏度[4]。通过控制有色染料或荧光物质的量,可制备出彩色或荧光强度编码的微球,这样的信号编码微球为抗原分型、药物筛选等高通量检测提供了一种高效便捷的手段[5-6]。例如,聂书明教授课题[7]组用两种不同颜色的量子点掺杂在树脂微球中,通过控制每种颜色量子点的用量制备出30种不同比例的荧光微球,在不同的微球表面修饰特定的抗体/抗原,就可以通过混合微球实现对靶标分子的高通量筛选。目前大多选用有机荧光染料分子,通过物理吸附、包覆,化学嫁接到微球表面或者以荧光染料分子为共聚单体,以共聚的方式固定到微球,制得荧光编码微球[8-10]。但是传统的有机荧光分子由于荧光发射峰宽而不对称,不同荧光分子之间易因发射峰重叠而造成干扰,在一定程度上限制了荧光编码微球的应用。部分稀土元素,因其荧光量子产率高、Stokes位移大、光稳定性好、发射峰窄、荧光寿命长等优点,被广泛应用于生物成像、生物分子检测等研究领域[11-13]。另一方面,为了进一步丰富微球的可编码范围,同时减少因掺杂多种稀土配合物而造成各荧光信号减弱的影响,荧光与可见色彩搭配组合可提供一种新的思路。
在此,我们分别以苏丹红Ⅰ和Eu为色彩染料和荧光标记物,用以验证制备这种双重标记的聚苯乙烯微球的方法。苏丹红Ⅰ在溶液中呈橙黄色,而Eu在360nm紫外线激发下发出红色荧光。通过两次溶胀种子无皂乳液聚合,制备出显橙黄色且在紫外线激发下发出红色荧光的聚苯乙烯微球。我们相信通过控制不同标记物的量,将可获得容量巨大的编码微球库。
1.材料与方法
1.1 一般资料
苯乙烯、二乙烯基苯、购自Acros公司,碱洗除阻聚剂后减压蒸馏;菲-9-甲酸甲酯、9-乙酰菲、过硫酸铵、苏丹红Ⅰ、丙烯酰氯,领苯二甲酸正丁酯(DBP)、均购于Sigma-Aldrich公司;六水合三氯化铕(EuCl3·6H2O),购于鱼台县清达精细化工厂;氨基钠、三氯甲烷、四氢呋喃(THF),邻菲罗啉(phen)、硅胶层析柱、苯、己烷,均购于阿拉丁公司;盐酸、氢氧化钠、十二烷基磺酸钠(SDS),购于北京鼎国生物技术有限责任公司;以上材料均为分析纯。日立S4800场发射扫描电子显微镜;上海棱光技术有限公司970 CRT荧光分光光度计;上海让奇T-6紫外吸收分光光度计,英国马尔文Zetasizer Nano ZSP纳米粒度电位仪。
1.2 方法
1.2.1 聚苯乙烯种子微球的制备。通过无皂乳液聚合法制备聚苯乙烯微球:在带有冷凝管、机械搅拌器的500mL三口瓶中加入200mL水和10mL精制苯乙烯,通入氮气加热搅拌;水浴升温至75˚C时,加入引发剂过硫酸铵(APS)(100mg过硫酸铵溶于5mL纯水中),继续搅拌反应20h,得到均一的白色乳液即为聚苯乙烯微球(PSt)。产物离心收集,超纯水水清洗6次,最后超声重悬水中,采用差重法测定固含量。
1.2.2 彩色聚苯乙烯微球的制备。可聚合彩色染料单体丙烯酰基苏丹红Ⅰ(Acrylated Sudan,AS)根据文献[4]报道的方法制得。根据文献[4,14,15]报道的方法,采用活性溶胀种子聚合法制备橙黄色聚苯乙烯微球。DBP与0.25%的SDS水溶液混合,超声至均匀乳液,将聚苯乙烯种子微球置于DBP乳液中在30˚C水浴中搅拌溶胀24h。然后把含有苯乙烯(St)、二乙烯基苯(DVB)、可聚合染料单体AS的乳液加到种子悬浮液中,搅拌溶胀24h。混合液在氮气保护下搅拌升温至75˚C,温度稳定后,加入引发剂APS,聚合24h,产物通过离心收集并用乙醇和水洗4次。
1.2.3 羧基荧光微球的制备。稀土Eu配合物根据文献报道[16]制得。在浓度为20mg/mL的PSt乳液中加入SDS溶液,使其终浓度为0.25%wt。称取60mg Eu配合物,溶于1mL苯乙烯中,并加入至50mL PSt悬浮液,超声乳化后,避光机械搅拌48h,通入N2,升温至75˚C,加入300mg过硫酸铵进行聚合反应。反应2h后,补加1mL St和0.3mL甲基丙烯酸(MAA),继续反应6h。结束反应后离心收集产物,洗涤6次,即为羧基荧光微球。样品进行喷金处理,通过扫描电子显微镜(SEM)进行观察,微球表面电荷通过zeta电位进行测定,检测时,取微球悬浮于水中并充分稀释。每个样品测三次,取平均值。
1.2.4 羧基荧光胶乳表面羧基含量测定。在聚合过程中引入甲基丙烯酸,微球表面被羧基功能化,使微球能与生物分子偶联。羧基的含量用电导率法测得[17]:取一定量聚苯乙烯微球悬浮液,加入一定量的0.01M的NaOH溶液中和微球表面羧基,使其pH为11左右,在磁力搅拌下用0.01M的HCl溶液返滴定,直到样品的pH为3结束,计算羧基含量。
2.结果与讨论
双重编码微球的制备路径如图1所示,通过无皂乳液聚合制备尺寸均一的苯乙烯纳米小球作为可溶胀活性种子,然后采用丙烯酰化的苏丹红Ⅰ作为共聚单体,制备橙黄色苯乙烯微球。将所得微球作为种子,溶胀负载稀土配合物进行荧光标记,通过乳液聚合使其包裹在微球内。

图1. 表面羧基功能化的彩色荧光微球的制备路径示意图

图2. (a)苏丹红Ⅰ的紫外-可见吸收光谱;(b)Eu配合物的紫外-可见吸收光谱;(c)Eu配合物的荧光光谱。

图3. (a)聚苯乙烯种子微球,(b)苏丹红标记彩色微球,(c)经双重标记的荧光微球的SEM照片。照片中scalebar长度为300nm。
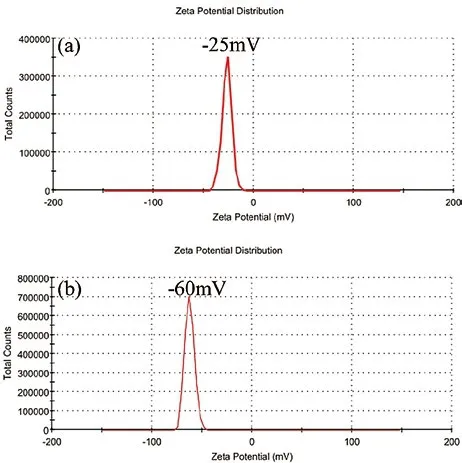
图4. 聚苯乙烯微球在水中的zeta电位:(a)苏丹红标记的彩色微球,(b)双重标记的荧光微球。
苏丹红Ⅰ是一种颜色鲜艳的油溶性染料,固体呈红色,在低浓度溶液中呈橙黄色,常被用作汽油、机油、鞋油、蜡等产品的染色。如图2a所示,苏丹红Ⅰ在470nm左右有最大吸收,而稀土Eu配合物在这一波长没有吸收(图2b),Eu配合物在600nm以上有狭窄的荧光发射峰,最强荧光在615nm左右(图2c)。选用苏丹红Ⅰ和Eu配合物的组合,不会因为紫外吸收谱的重叠产生干扰,同时也避免了苏丹红Ⅰ的吸收谱和Eu配合物的发射谱重叠而导致荧光减弱。因此,由这两种物质标记制得的微球可以采用470nm处紫外吸收强度(苏丹红Ⅰ)和615nm处荧光强度作为两组检测信号。通过控制二者的比例,可制得编码微球。
聚苯乙烯种子微球、丙烯酰基苏丹红Ⅰ标记橙黄色微球以及苏丹红和Eu配合物双重标记的荧光微球的SEM照片分别如图3(a)、(b)、(c)所示。所制备的种子微球直径约为150nm,第一次溶胀并聚合后微球直径约为200nm,第二次溶胀并进行乳液聚合后,微球直径增加到约260nm。SEM照片表明,在最优条件下制备的微球表面光滑,球形形貌均匀,尺寸均一。随着种子溶胀乳液聚合的进行,微球尺寸分布有所变化,但整体单分散性仍较好。
微球分散在水中后,通过zeta电位进行表征,其结果如图4所示。在第二次种子聚合引入共聚单体甲基丙烯酸(MAA)前,微球的zeta电位为-25mV,这是由于引发剂为阴离子型自由基,引发剂过硫酸铵在分解后产生的阴离子结合在聚合物末端,并暴露在聚合物微球表面所致。在引入MAA后,微球的zeta电位降低到约-60mV,表明表面所带负电荷明显增多。

图5. 电导率法测定荧光微球表面羧基含量
为了定量测定微球表面羧基的密度,采用电导滴定法对所制备的微球进行测定,滴定曲线如图5所示[18]。滴定初期(阶段Ⅰ),HCl中和样品悬浮液中的过量NaOH,逐步消耗的OH-电导率比Cl-强,从而使整个体系的电导率下降。HCl完全中和游离的NaOH时,体系的电导率达到最低。继续滴加HCl,其中的H+与微球表面的COO-结合使其质子化生成弱酸。这一阶段由于HCl滴加而引入的Cl-流动性比带电微球大,从而使整个体系电导率有所增加,这一阶段电导率曲线相对比较平缓(阶段Ⅱ)。当乳液体系中的COO-都已经质子化形成COOH后,继续滴加HCl将直接导致体系电导率上升(阶段Ⅲ)。
聚合物微球表面羧基含量根据公式(1)进行计算所得约为1.2mmol/mg。

3.结论
本文分别以苏丹红Ⅰ和Eu为色彩染料和荧光标记物,通过两次溶胀种子无皂乳液聚合成功制备出有色染料和荧光物质双重标记的表面羧基功能化的聚苯乙烯微球。微球在无激发光激发的状态下呈现橙黄色,而360nm紫外线激发下发出红色荧光。两种标记物分别可提供470nm处紫外吸收和615nm处荧光作为检测信号。我们有理由相信,通过控制两种标记物的含量,可以制备出双重信号编码的功能化微球,为生物分子检测、药物筛选等领域研究提供有力工具。
参考文献
[1] S. W. Bae, W. H. Tan, J. I. Hong. Fluorescent dye-doped silica nanoparticles:new tools for bioapplications[J]. Chem. Commun, 2012,48(17):2270-2282.
[2] V. Holzapfel, A. Musyanovych, K. Landfester, et al. Mailänder. Preparation of Fluorescent Carboxyl and Amino Functionalized Polystyrene Particles by Miniemulsion Polymerization as Markers for Cells[J]. Macromol. Chem. Phys, 2005,206(24):2440-2449.
[3] H Nhung Tran, THL Nghiem, TDV Thi, et al. Dye-doped silica-based nanoparticles for bioapplications[J]. Adv. Nat. Sci. Nanosci. Nanotechnol, 2013,4(4):43001-43014.
[4] 李倩, 陈新福, 张政朴. 带羧基单分散彩色微球的制备[J]. 高等学校化学学报, 2008,29(2):399-403.
[5] Y. -P. Ho, M. C. Kung, S. Yang, et al. Multiplexed hybridization detectionwith multicolor colocalization of quantum dot nanoprobes [J]. Nano Lett, 2005,5(9):1693-1697.
[6] Liu JB, Yang XH, He XX, et al. Fluorescent nanoparticles for chemical and biological sensing [J]. Science China Chemistry, 2011,54(8):1157-1176.
[7] X. H. Gao, S. M. Nie. Doping Mesoporous Materials with Multicolor Quantum Dots[J]. J. Phys. Chem. B, 2003,107(42):11575-11578.
[8] M. -T. Charreyre, P. Zhang, M. A. Winnik, et al. Adsorption of Rhodamine 6G onto Polystyrene Latex Particles with Sulfate Groups at the Surface [J]. J. Colloid Interface Sci, 1995,170(2):374-382.
[9] F. Tronc, M. Li, J. Lu, et al. Fluorescent polymer particles by emulsion and miniemulsion polymerization [J]. J. Polym. Sci, 2003,41(6):766-778.
[10] Zhang Z, Long Y, Pan J, et al. Preparation of fuorescence-encoded microspheres in a core-shell structure for suspension arrays [J]. J. Mater. Chem, 2009,20(6):1179-1185.
[11] K. Binnemans. Lanthanide-based luminescent hybrid materials[J]. Chem. Rev, 2009,109(9):4283-4374.
[12] Lee YI . Fluorescence Spectroscopy of Polymer Systems Doped with Rare-Earth Metal Ions and Their Complexes [J]. Appl. Spectrosc. Rev, 2010,45(6):409-446.
[13] 李哲峰, 张洪杰. 稀土有机配合物电致发光研究进展[J]. 高等学校化学学报, 2008,29(12):2597-2608.
[14] A. Tuncela, M. Tuncelb, B. Erguna, et al. Carboxyl carrying-large uniform latex particles [J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2002,197(1-3):79-94.
[15] Q. C. Wang, F. Švec, J. M. J. Fréchet. Fine control of the porous structure and chromatographic properties of monodisperse macroporous poly(styrene-co-divinylbenzene) beads prepared using polymer porogens [J]. Journal of Polymer Science Part A:Polymer Chemistry, 1994,32(13):2577–2588.
[16] Jiang X, Jen KY, Huang D, et al. The effect of ligandConjugation length on europium complex performance in light-emitting diodes[J]. Synthetic metals, 2002,125(3):331-336.
[17] 秦学, 秦守磊, 周雷激. 羧基聚苯乙烯微球的单分散制备及表征[J]. 广东化工, 2011,38(223):12-13.
[18] 郭丰梅, 姚金水, 范瑞, 等. 用电导滴定法测定聚丙烯酸酯乳液中的羧基分布[J]. 齐鲁工业大学学报, 2014,28(3):66-68.
The Preparation of Colorfulcarboxyl Fluorescent Microsphere
ZHANG Xiao-yan ZHOU Qi-yang Jiangsu Province Medical Instrument Testing Institute (Nanjing 210012)
In this paper we report the preparation of colored polymer beads that possess carboxyl groups on the surface and emit fuorescence under excitation by UV with specifc wavelength, through active swollen seeds based soap-free emulsion polymerization. Uniform polystyrene nano-spheres are frstly synthesized by emulsion polymerization and utilized as swellable seeds, onto which the co-polymerization of styrene and acrylated dye molecules produces colored polystyrene beads.The as-obtained polymer beads then act as seeds for loading of rare earth ion Eu complex and the following polymerization to encapsulate the Eu complex as well as incorporation of carboxyl group to facilitate coupling of biomolecules.
encoded, soap-free emulsion polymerization, colored, fuorescent, carboxylate
1006-6586(2017)09-0045-04
TQ325.2
A
2017-03-09

