黄酒中多糖稳定性研究
李 琴,赵一丁,叶林林,刘兴泉,何志平
(浙江农林大学农业与食品科学学院,浙江杭州310000)
黄酒中多糖稳定性研究
李 琴,赵一丁,叶林林,刘兴泉,何志平
(浙江农林大学农业与食品科学学院,浙江杭州310000)
利用苯酚硫酸法和直接滴定法直接测定黄酒中多糖在不同贮存温度、光照、煎酒温度、煎酒时间、酒精度、酸度和pH值条件下的稳定性。结果表明,黄酒多糖耐热性、耐光性较差,对低酒精度、乳酸、柠檬酸等稳定性较弱,对低温和酒精的耐受性较好。
黄酒多糖; 稳定性; 影响因素
自古以来就有“黄酒有千层脚”的俗语,由此看来,黄酒的稳定性只是相对的[1]。影响黄酒稳定性的因素主要分为生物性和非生物性,尤其是后者[2],主要影响因素为蛋白质、多酚、金属离子、溶氧等[3]。大量研究表明,多糖具有抗肿瘤[4]、抗凝血[5-6]、抗氧化[7]、吸附病原菌[8]、提高免疫力[9]等功能。沈赤[10]利用水提醇沉法提取了黄酒多糖,经研究得知,黄酒多糖对小鼠免系统具有调节作用,阻碍了S180癌细胞的增长,调节小鼠肠道菌群。彭金龙等[11]研究发现黄酒多糖具有体外抗氧化活性。黄酒成分复杂,在贮存过程中,其理化指标也随之不断改变,本文试研究贮存温度、光照、煎酒温度和时间、酒精度、酸度和pH值7个指标对成品黄酒多糖的稳定性的影响。
1 材料与方法
1.1 材料、试剂及仪器
黄酒:浙江会稽山绍兴酒股份有限公司绍兴加饭酒(生产日期:2009年6月10日,规格:10 L)。
试剂:苯酚,AR,西陇化工有限公司;硫酸,GR,永华化学科技有限公司;硫酸铜、酒石酸钾钠、氢氧化钠、葡萄糖、盐酸、柠檬酸、小苏打、乳酸、氧化钙均为AR,国药集团化学试剂有限公司;食用酒精购买于临安卡尔生物科技有限公司。
仪器:北京普析通用仪器有限责任公司,T6可见光分光光度计;国华电器有限公司,HH-4数显恒温水浴锅;梅特勒-托利多仪器有限公司,AL104电子天平;嘉兴市欣欣仪器设备有限公司,万用电热器;上海森信实验仪器有限公司,DGG-9053AD电热恒温鼓风干燥箱;博西华家用电器有限公司,BCG-212冰箱;宁波莱福科技有限公司,PGX智能光照培养箱;上海雷磁公司,PHS-3C酸度计;四川蜀玻有限责任公司,250 mL蓝口瓶。
1.2 实验方法
(1)贮藏温度。取9支250 mL蓝口瓶,分为3组,每组平行3次。每瓶盛200 mL黄酒。分别放于4℃冰箱,25℃恒温箱,60℃烘箱,避光贮藏,30 d后取出。
(2)光照。取6支250 mL蓝口瓶,分为2组,每组平行3次。每瓶盛200 mL黄酒。分别透光与锡纸包裹避光,放于同样自然光线良好的空间,30 d后取出。
(3)煎酒温度。取15支250 mL蓝口瓶,分为5组,每组平行3次。每瓶盛200 mL黄酒。一组对照,其余组分别经40℃、60℃、80℃、100℃水浴1 h,煮完取出,待温度降为常温,摇匀静置,并用量筒精确测量每瓶酒的体积并记录,后同时放入25℃恒温箱避光贮藏,30 d后取出。
(4)煎酒时间。取15支250 mL蓝口瓶,分为5组,每组平行3次。每瓶盛200 mL黄酒。一组对照样,其余组分别80℃水浴15 min、30 min、45 min、60 min,煮完取出,处理方法同(3),后同时放入25℃恒温箱避光贮藏,30 d后取出。
(5)酒精度。取12支250 mL蓝口瓶,分为4组,每组平行3次。分别用纯净水与食用酒精将黄酒酒精度调为8.0%vol、16.0%vol、24.0%vol、32.0%vol。后同时放入25℃恒温箱,30 d后取出。
(6)总酸。取15支250 mL蓝口瓶,分为5组,每组平行3次。每瓶盛200 mL黄酒。分别用乳酸和氧化钙将黄酒总酸调整为2 g/L、4 g/L、6 g/L、8 g/L、10g/L。后同时放入25℃恒温箱,30 d后取出。
(7)pH值。取12支250 mL蓝口瓶,分为4组,每组平行3次。每瓶盛200 mL黄酒。分别用柠檬酸和小苏打将黄酒pH值分别调为3、4、5、6。然后同时放入25℃恒温箱,30 d后取出。
1.3 检测方法
1.3.1 糖分的检测方法
总糖含量测定:苯酚-硫酸法,以葡萄糖作为标准品。
还原糖含量测定:GB/T 5009.7—2008,以葡萄糖作为标准品。
多糖含量测定:多糖=总糖-还原糖。
1.3.2 酒精度的检测方法
参考GB/T 13662—2008。
1.3.3 酸度的检测方法
参考GB/T 13662—2008。
1.3.4 pH值的检测方法
参考GB/T 13662—2008。
2 结果与讨论
2.1 苯酚硫酸法的标准曲线
苯酚硫酸法的标准曲线见图1。

图1 苯酚硫酸法标准曲线
2.2 黄酒样品的基本理化指标测定(表1)
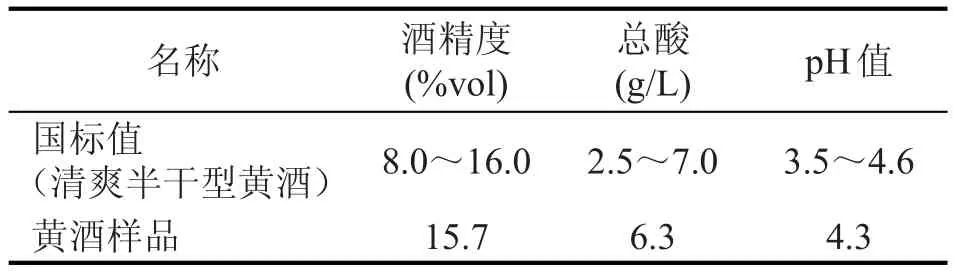
表1 黄酒样品的基本理化指标的测定结果
2.3 黄酒样品的多糖稳定性分析
2.3.1 贮藏温度对黄酒多糖稳定性的影响(图2)
由图2可以看出,对照组(25℃)的总糖与60℃组在p=0.05水平下有显著性差异,与4℃组无差异;3组之间的还原糖与多糖含量差异不显著。高温组的4种糖含量均低于低温组,可能原因是糖本身在高温条件下易降解生成一些酸性混合物,例如甲酸和乙酞丙酸,酸性混合物作为催化剂促进糖分溶解[12]。
2.3.2 光照对黄酒多糖稳定性的影响(图3)
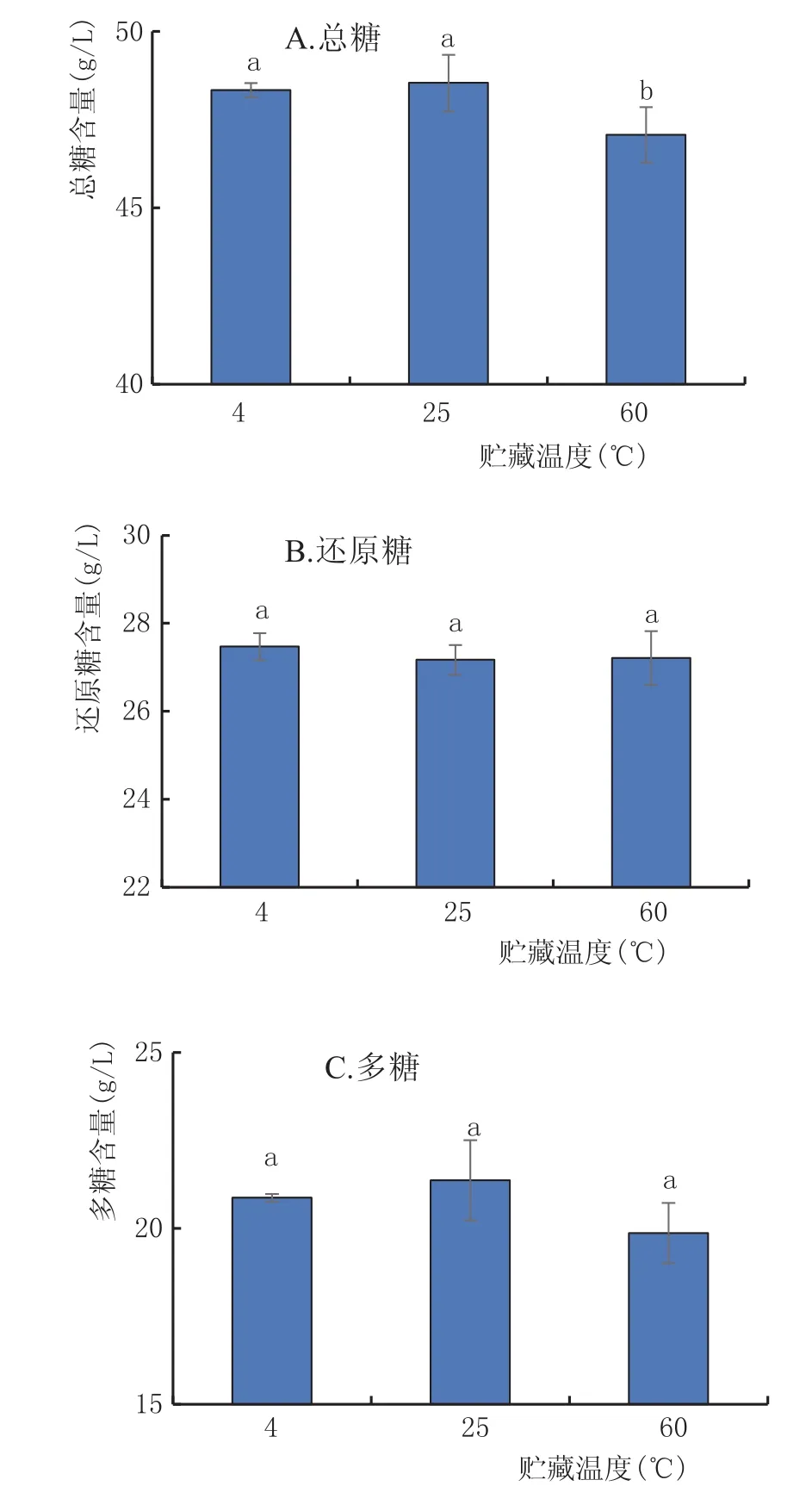
图2 不同贮藏温度下黄酒中糖分的变化
图3为黄酒在避光和透光两种条件下储存30 d,30 d内白天气温25℃左右,昼夜温差10℃左右,晴天为20 d左右,光线良好。由图3可知,透光组与避光组的总糖、还原糖与多糖的含量在p=0.05水平下均存在显著性差异,可见,光照促进黄酒多糖的水解。
2.3.3 煎酒温度对黄酒多糖的影响(图4)
由图4可知,40℃、60℃、80℃、100℃4组与对照组(25℃)之间,总糖、还原糖和多糖在p=0.05水平上均存在显著性差异,100℃组的还原糖、多糖含量与对照组(25℃)之间在p=0.01水平上存在极显著差异。可见,60℃煎酒1 h的状态下,黄酒糖分最为稳定,而100℃时多糖分解最快。
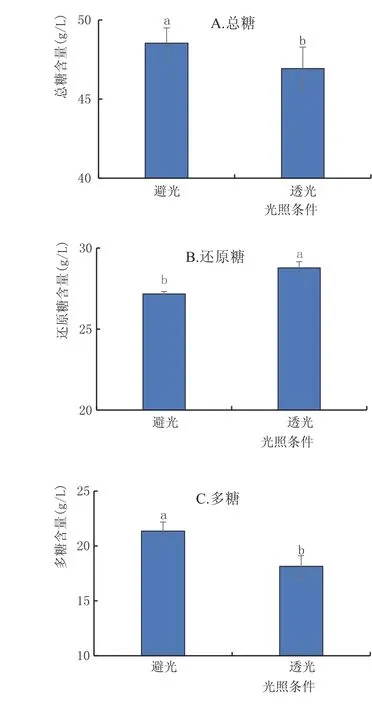
图3 不同光照条件下黄酒中糖分的变化
2.3.4 煎酒时间对黄酒多糖稳定性的影响(图5)
由图5可知,15 min、30 min、45 min、60 min 4组与对照组(0 min)之间,总糖与还原糖在p=0.05水平下存在显著性差异,15 min、30 min、45 min组的多糖与对照组(0 min)之间在p=0.05水平下无显著性差异。对照组(0 min)与60 min的多糖含量之间在p=0.01水平下存在极显著差异。可见,在一定时间范围内,水浴60 min时黄酒多糖稳定性最差。
2.3.5 酒精度对黄酒多糖稳定性的影响(图6)
由图6可知,4组之间总糖含量在p=0.05水平下无显著性差异,对照组(16%vol)的还原糖、多糖与8%vol组在p=0.01水平下均有极显著差异。陈志宝等[13]研究乙醇浓度对6种中药多糖的沉积量时发现,随着乙醇浓度升高,沉积量都是增加的。可见,随着酒精度升高,对黄酒中糖分的分解并不明显,黄酒的稀释会促进多糖的分解。
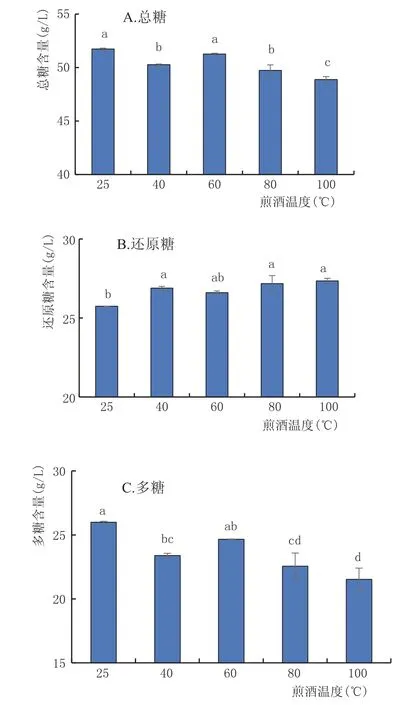
图4 不同煎酒温度对黄酒中糖分的影响
2.3.6 总酸对黄酒多糖稳定性的影响(图7)
图7为不同酸度对黄酒糖分的影响,由于调酸度所用的物质是乳酸和氧化钙,所以认为是乳酸和氧化钙对糖分稳定性的影响。由图7可知,对照组(6 g/L)与2 g/L、4 g/L、8 g/L、10 g/L组的总糖在p= 0.01水平下均存在极显著差异,多糖在p=0.05的水平下存在显著性差异。但是2 g/L和4 g/L的样品因为氧化钙的添加出现酸败的情况,故不作讨论,8 g/L和10 g/L的样品感官正常,所以,乳酸更促进糖分水解。
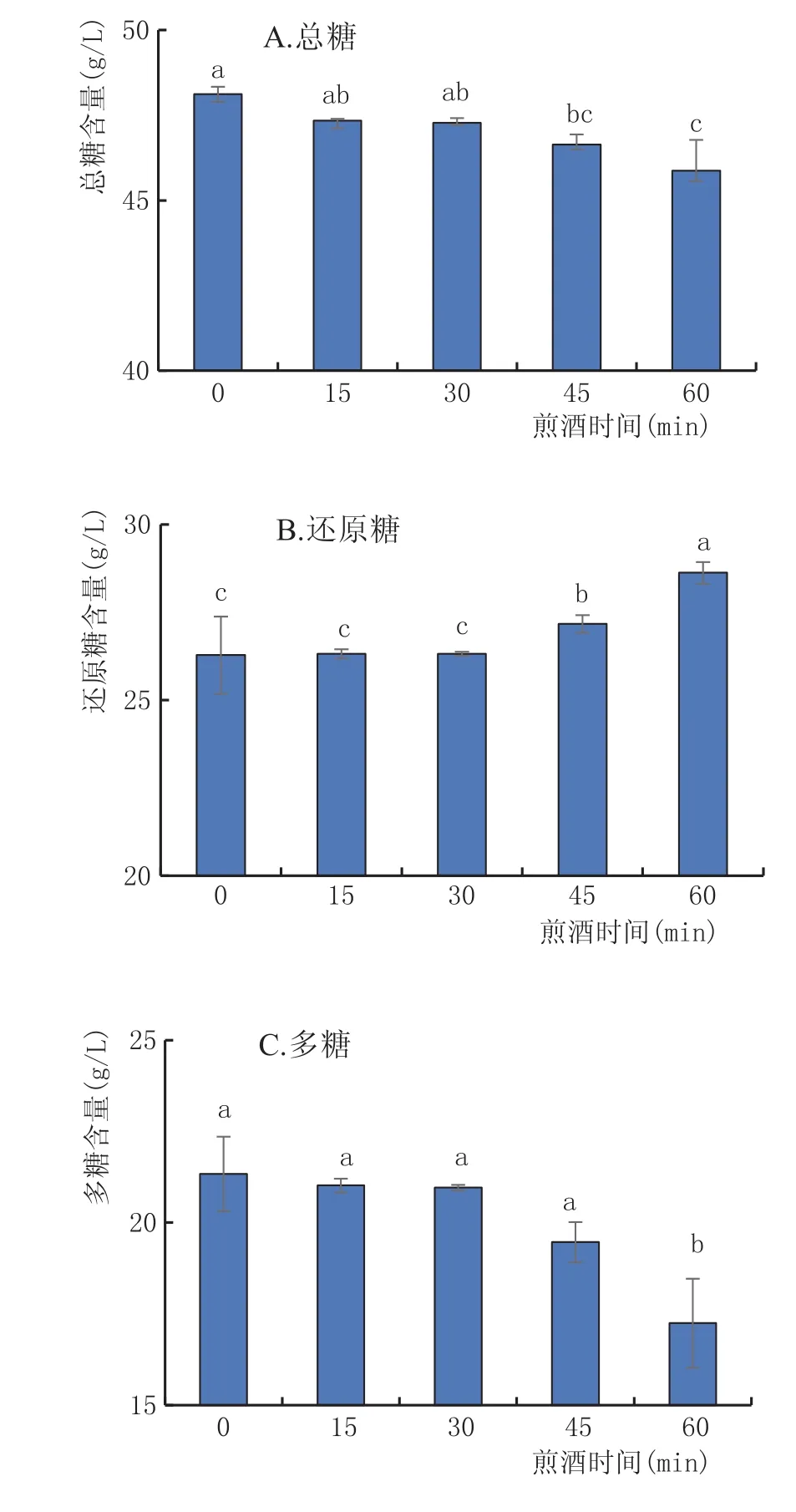
图5 不同煎酒时间对黄酒中糖分的影响
2.3.7 pH值对黄酒多糖稳定性的影响(图8)
由图8可知,pH值在3~6的范围内糖分变化不明显,只有对照组(pH4)的总糖与pH3组在p= 0.05水平下存在显著性差异,其余均无显著性差异。可见酸性pH值相对来讲更促进水解。由于pH值是用柠檬酸和小苏打进行调整的,可以说,柠檬酸比小苏打更能促进多糖的水解。
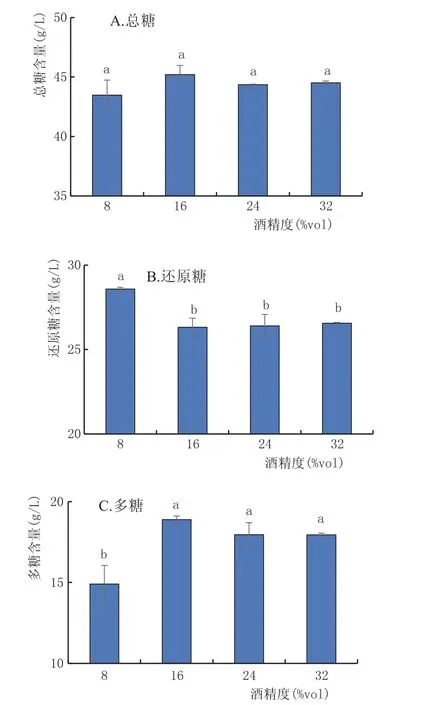
图6 不同酒精度对黄酒中糖分的影响
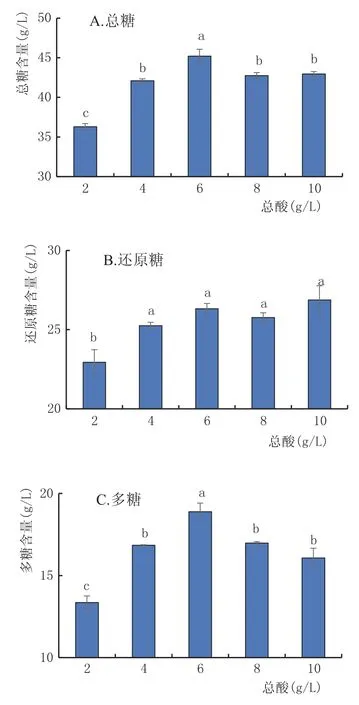
图7 不同总酸对黄酒中糖分的影响

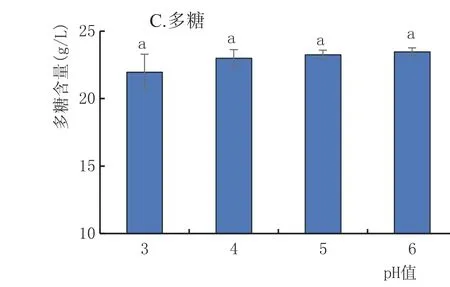
图8 不同pH值对黄酒中糖分的影响
3 小结
研究结果表明:黄酒多糖对高温、光照以及酸性条件较为敏感,而酒精度以及一定范围内的碱性条件对黄酒多糖的稳定性影响不大。可见,黄酒在生产和贮存过程中拥有合理的理化指标,适宜的煎酒温度和时间,通风、避光、适温贮存,可以降低活性多糖的分解和损失,保证黄酒多糖的功能性和有效性。
[1] 周春倩.黄酒稳定期的探讨[J].中国酒,1996(3):58-59.
[2] 朱建航,帅桂兰,赵光鳌,等.微滤技术提高黄酒胶体稳定性的探讨[J].工业微生物,1999,29(3):33-35.
[3] 王一菲,林峰,蔡小芸.黄酒非生物稳定性主要影响因素的研究[J].嘉兴学院学报,2012,24(3):66-69.
[4] FUNAYAMA M,NISHIKAWAA,SHINODA T,et al. Immunochemical determinant of Candida parapsilosis[J]. Carbohydr res,1983,117:229-239.
[5] MCLELLAN D S,JURD K M.Anticoagulants from marine algae[J].Blood coagul fibrinolysis,1992,3(1):69-77.
[6] WANG S C,BLIGH S W A,SHI S S,et al.Structural features and anti-HIV-1 activity of novel polysaccharides from red algae Gruteloupia longifolia and Gruteloupia filicina[J].Int j macromol,2007,41(4):369-375.
[7] 林静雅,刘邻渭,严陇兵,等.枣酒渣多糖的提取和体外抗氧化性研究[J].中国食品学报,2012,12(9):21-26.
[8] HU S H,WANG J C,LIEN J L,et al.Antihyperglycemic effect of polysccharide from fermented broth of Pleurotus citrinopileatus[J].Appl microbiol biotechnol, 2006,70:107-1l3.
[9] 刘印华,赵志强,李树义,等.黄芪多糖对免疫功能影响的体内实验研究[J].河北医药,2015,37(4):485-487.
[10] 沈赤.绍兴黄酒多糖的分离提取、生物活性及其对肠道微生物的影响[D].无锡:江南大学,2014.
[11] 彭金龙,毛健,黄桂东,等.黄酒多糖体外抗氧化活性研究[J].食品工业科技,2012,33(20):94-97.
[12] 张义明.还原糖和无机盐对蔗糖热稳定性的影响研究[J].贵州工学院学报,1994,24(2):42-45.
[13] 陈志宝,蔡亚平,张爽.乙醇浓度对六种中药多糖的累积沉积量的变化考察[J].黑龙江八一农垦大学学报, 2012,24(1):20-22.
Stability of Polysaccharide in Yellow Rice Wine
LI Qin,ZHAO Yiding,YE Linlin,LIU Xingquan and HE Zhiping
(School of Agricultural and Food Science,Zhejiang Agriculture and Forestry University,Hangzhou,Zhejiang 310000,China)
The stability of polysaccharide in yellow rice wine under different conditions,such as different storage temperature,illumination,wine boiling temperature,wine boiling time,alcohol content,acidity,and different pH value,was evaluated by use of phenol sulfuric acid method and direct titration method.The results showed that,polysaccharide had poor heat resistance and light resistance, besides,it had poor tolerance to low alcohol content,lactic acid and citric acid,but it had good tolerance to low temperature and high alcohol content.
polysaccharide in yellow rice wine;stability;influencing factors
TS262.4;TS261.7;TS261.4
A
1001-9286(2017)06-0065-06
10.13746/j.njkj.2017054
2017-03-10
李琴(1988-),E-mail:923418788@163.com。
何志平,E-mail:hzhping@163.com。
优先数字出版时间:2017-05-04;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170504.0853.005.html。

