咖啡因通过Caspase通路促进胃癌细胞凋亡的研究
刘寒旸, 宋 军, 周 艳, 汤黎明
(南京医科大学附属常州第二人民医院 胃肠病中心, 江苏 常州, 213000)
咖啡因通过Caspase通路促进胃癌细胞凋亡的研究
刘寒旸, 宋 军, 周 艳, 汤黎明
(南京医科大学附属常州第二人民医院 胃肠病中心, 江苏 常州, 213000)
目的 探讨咖啡因对于胃癌细胞的抑制效果及作用机制。方法 本研究预设了分组和药物处理浓度,采用细胞培养和细胞计数的方法检测了胃癌细胞株的增殖活力,利用流式细胞仪分析胃癌细胞凋亡水平和细胞周期情况,通过目的基因扩增法(PCR)和蛋白免疫印迹法(Western blot)检测凋亡相关的基因和蛋白。结果 咖啡因处理后显著抑制了胃癌细胞生长和生存活力,并且通过Caspase-9/-3通路促进胃癌细胞的凋亡。结论 咖啡因处理能有效促进胃癌细胞的凋亡。
咖啡因; 胃癌; 凋亡; Caspase
胃癌是世界上十大恶性肿瘤之一,具有较高的癌症相关死亡率。在亚洲,胃癌占新发癌症病例的约60%[1]。胃癌发生机制研究[2]显示,一些已知的通路如wnt/β-catenin, NF-κB和PI3K/Akt等,这些通路受到复杂的调控,在胃癌发生的不同环节起作用。作为凋亡的直接效应蛋白, Caspase-9是细胞自身凋亡通路中的关键一环。Caspase-9激活成为具有活性的剪切形式,并激活下游家族Caspase-3的形成活性剪切体,直接介导细胞凋亡的发生[3]。咖啡因是一种甲基黄嘌呤衍生物,流行病学调查和基础研究[4-7]报道了咖啡因在抗癌中的潜在作用,在一些组织器官(卵巢,乳腺,肝脏,大脑等)中,咖啡因通过影响或调控肿瘤相关通路蛋白PTEN、PI3K/Akt、p53和mTOR等来抑制肿瘤细胞生长并促进凋亡。仅有极少数的研究[8-9]认为Caspase家族蛋白,尤其是Caspase-9和Caspase-3在咖啡因抑癌过程中起到重要作用。本研究探讨浓度梯度下的咖啡因对癌细胞的增殖、凋亡的作用效果,现报告如下。
1 材料与方法
1.1 主要试剂
咖啡因购于Sigma公司(美国),胎牛血清(FBS)和无血清培养基(1640)购于Gibco公司(美国)。流式细胞试剂盒购于BD Biosciences(美国)。总RNA提取试剂盒,实时荧光定量PCR试剂盒购于Takara(大连)。Z-LEHD-FMK(Caspase-9特异性抑制剂)、Z-DEVD-FMK (Caspase-3特异性抑制剂)购于Biovision(美国)。细胞计数试剂盒(CK8)购于Dojindo(日本)。蛋白免疫印迹人抗体购于Cell Signaling Technology(美国)。
1.2 细胞培养
人类正常胃黏膜细胞株 GES-1, 胃腺癌细胞株 MGC-803, SGC-7901购自中科院上海细胞典藏库。在含10%胎牛血清,青霉素(1×105)和链霉素(100 mg/L)的1640培养基, 37 ℃、5% CO2的培养箱内培养常规3~4 d传代1次。所有实验均采用对数生长期细胞。
1.3 细胞计数和克隆形成实验
将待测的胃癌细胞株MGC-803和SGC-7901消化后用含10%FBS的RPMI 1640培养基终止消化并获取单细胞悬液。通过细胞计数,调整细胞浓度为10 000 个/ml, 以 200 μL/孔接种至 96 孔板,每组设4个复孔,放入37 ℃、5% CO2细胞培养箱孵育。达到预设的时间后,每孔加入20 μL的CCK-8试剂和200 μL完全培养基。酶标仪中选择490 mm波长,测定各孔吸光度值,记录结果并绘制细胞生长曲线。
1.4 流式细胞术检测
细胞用胰酶消化, 4 ℃预冷的PBS洗涤细胞1次, Binding Buffer洗涤1次, Binding Buffer和annexin V的混合液重悬细胞,室温避光孵育15 min, Binding Buffer洗涤1次, Binding Buffer和PI的混合液重悬细胞, 25 ℃避光孵育15 min,每次洗涤或染剂孵育前均经过1 000 r/min离心。采用流式细胞仪进行凋亡检测并分析,以annexin V+/PI-象限的细胞为早期凋亡细胞,记录并计算比例。细胞用胰酶消化, 4 ℃预冷的PBS洗涤细胞1次,加入细胞周期染剂,室温避光孵育20 min, Buffer洗涤1次。采用流式细胞仪进行细胞周期检测并分析G1、S和G2期的比例。
1.5 蛋白提取和Western blot检测
胃癌细胞加入Western及IP细胞裂解液提取总蛋白,用BCA蛋白浓度检测法检测并调节蛋白浓度。用SDS-PAGE电泳,转膜,封闭缓冲液(含5%脱脂奶粉TTBS)封闭,按照适当浓度(工作浓度为1∶1000), 孵育一抗4 ℃过夜, TBST多次漂洗后孵育二抗(工作浓度为1∶2 000), 暗室曝光。记录并分析蛋白条带结果。
1.6 统计学分析
采用SPSS 16.0统计学软件对各实验结果数据进行分析,实验结果均用均数±标准差表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 咖啡因对胃癌细胞株的生长和增殖的抑制作用存在浓度依赖性
用预设浓度0.5、1、2、4和8 mmol/L的咖啡因处理MGC-803和SGC-7901细胞,设置未用药处理的胃癌细胞株作为空白对照组。本研究还设置了5-氟尿嘧啶(5-FU)处理组来评估咖啡因的作用效果,作为实验对照组。检测细胞增殖水平,图1结果显示在2株胃癌细胞中,咖啡因处理24 h后细胞活力和增殖水平下降。在药物浓度达到4 mmol/L及以上(4、8 mmol/L)时,2株胃癌细胞的增殖率下降到了50%以下。作者对比5-氟尿嘧啶处理组,以半最大浓度抑制量(IC50)浓度为基准,选取0~2 mmol/L浓度区间(1、2 mmol/L)为实验浓度, 2 mmol/L为有效抑制浓度,用于后续实验研究。以上实验结果提示,咖啡因能够有效抑制胃癌细胞株(MGC-803和SGC-7901)的增殖水平。此外,咖啡因的抑制作用存在浓度依赖。
2.2 咖啡因能抑制细胞周期进程并促进胃癌细胞凋亡
本研究使用了流式细胞学和蛋白免疫印迹的检测方法,检测胃癌细胞的凋亡水平和细胞周期。结果显示,与空白对照组相比咖啡因处理胃癌细胞后G0/G1期细胞数量比例增加而S期细胞数量比例减少。另外,用药组之间的G0/G1期和S期的细胞数量比例差异较小,不存在统计学意义。蛋白免疫印迹检测细胞周期蛋白(p21、Cyclin D1和CDK4), 结果显示,与空白对照组相比2株胃癌细胞在咖啡因(2 mmol/L)处理后p21蛋白水平出现了上调而Cyclin D1蛋白水平出现下调,而CDK4表达水平变化不显著。胃癌细胞株尤其是SGC-7901在咖啡因处理后凋亡水平得到了上调,早期凋亡区间细胞数比例随着药物浓度而上升。此外,五氟尿嘧啶(5-FU)处理组胃癌细胞的凋亡水平与2 mmol/L咖啡因处理组结果高度类似。以上实验结果提示,咖啡因能导致胃癌细胞株细胞周期阻滞在G0/G1期,同时也升高了胃癌细胞株的凋亡水平。进一步说明了咖啡因潜在的抑癌作用。


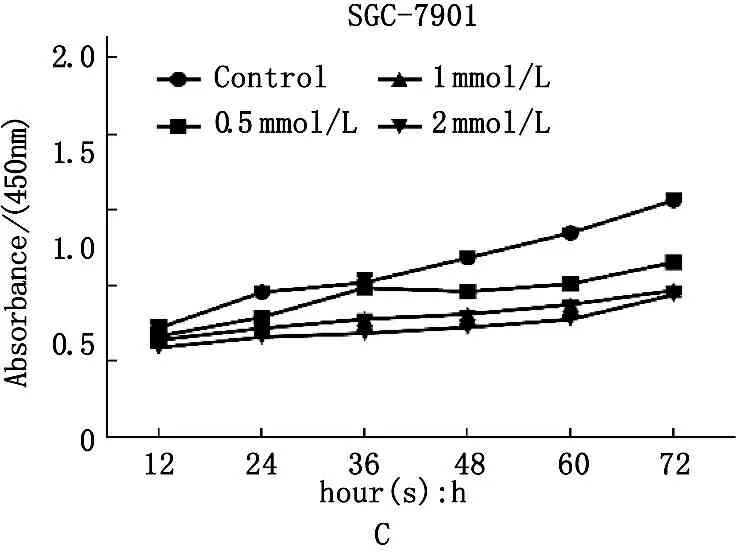

图1 细胞计数实验显示咖啡因抑制胃癌细胞株增殖
2.3 咖啡因通过激活Caspase-9/-3通路介导胃癌细胞凋亡
细胞实验和流式细胞学的结果初步证明了咖啡因对胃癌细胞的抑制作用,本研究进一步探索抑癌作用和细胞凋亡的机制。本研究通过蛋白免疫印迹法检测凋亡高度相关的Caspase家族效应的Caspase-9/-3及上游凋亡相关家族蛋白(Bcl-2, Bad和Bax等)。咖啡因能激活胃癌细胞Caspase-9/-3的激活形式(Cleaved-Caspase-9/3)以及Cyt-c的表达量。此外,促凋亡家族蛋白的表达也被咖啡因的影响,与空白对照组相比, Bcl-2表达量出现下调而Bax表达量上调,而Bad的表达量变化无明显差异。而对比同细胞株的不同浓度组,上述蛋白表达量变化在相对高浓度咖啡因(2 mmol/L)处理组较为明显。本研究引入Caspase-9和Caspase-3特异性抑制剂 Z-LEHD-FMK和Z-DEVD-FMK, 进一步验证咖啡因介导凋亡的机制通路,结果显示,对比空白对照组和实验对照组的细胞增殖水平, Caspase特异性抑制剂的处理一定程度上反转了咖啡因抑制增殖的作用。以上实验结果提示,咖啡因尤其是有效剂量浓度(2 mmol/L)能显著影响凋亡相关蛋白的表达,而Caspase-9/3相关通路在咖啡因抑癌中起关键作用。
3 讨 论
咖啡因具有神经激动作用,其能提高机体的警觉性、兴奋性,促进机体觉醒和保持清醒,还能增强认知能力和疼痛耐受力等[10]。除了这些瞬时效应,最近的一些报道[11]强调,咖啡因摄入具有许多长期的积极的神经作用,如预防老年性痴呆的发展和认知能力下降,改善阿尔茨海默病和帕金森病患者的疾病进展[12-13]。此外,咖啡因通过抑制磷酸二酯酶(PDE)活性增加cAMP水平,运动员经常通过大量摄入咖啡因来改善身体机能和降低体质量[14]。荟萃分析和前瞻性研究[15- 16]表明,长期定量摄入咖啡因可以降低2型糖尿病发病的风险。咖啡因能通过调节血糖水平、体内胰岛素-血糖平衡、胰岛细胞炎症和炎性介质来降低2型糖尿病风险[17]。此外还有报道说明,咖啡因通过抑制肿瘤发生,肿瘤细胞的增殖、浸润和转移来起到潜在的抗癌作用。相关的回顾性和前瞻性研究[18-19]表明,长期的摄入含咖啡因的咖啡能降低癌症发病率和死亡率。
本研究论证了咖啡因处理能抑制胃癌细胞(MGC-803和SGC-7901)的生长并介导细胞凋亡。咖啡因在体外胃癌细胞系中展现了抗癌的效果,这一效果存在浓度依赖性(尤其在药物浓度大于1 mmol/L时)和时间相关性[20-21]。本研究检测了咖啡因处理后胃癌细胞的细胞周期的变化。细胞周期是细胞持续不间断的增殖活动必要过程,细胞周期主要受Cyclin-CDK复合物调控,这一复合物包含了p21 CDK相关蛋白(CIP1)、激酶抑制蛋白(Kips: p27 KIP1, p57 KIP2)和CDK4抑制因子 (INK4s: p16 INK4a, p15 INK4b, p18 INK4c, p19 INK4d)等。细胞周期G1期是细胞可以响应胞外信号的时期,细胞的增殖程度取决于增殖性和抗增殖信号的平衡。本研究中,咖啡因将胃癌细胞MGC-803和SGC-7901细胞周期阻滞在G0/G1期,调控了Cyclin-CDK复合物的蛋白表达量,这也进一步验证了咖啡因通过影响细胞增殖内部机制而非直接杀伤细胞来抑制细胞生长。此外,本研究发现咖啡因影响了Bcl-2、Bax、Cyt-c以及下游Caspase-9/-3(激活形式)的表达,以此产生了促进胃癌细胞凋亡的作用。Bcl-2、Bax是凋亡相关因子家族成员, Cyt-c是细胞经典能量代谢中的关键因子,它们可以调控下游的Caspase家族蛋白并促进激活形式的生成,直接加速细胞凋亡的进程。
本研究就咖啡因对胃癌细胞的抑制增殖和促进凋亡作了一定的研究,论证了咖啡因潜在的抗癌作用。药物的剂量控制是平衡药效和安全性的关键环节。本研究也关注了咖啡因剂量问题,作为药物或食品摄入达到稳定有效的作用的同时,也不能超过机体能耐受的最大剂量。本研究根据浓度梯度实验结果,选取了1 mmol/L和2 mmol/L浓度作为研究浓度,发现这2个浓度咖啡因处理胃癌细胞无论对于细胞表型或是蛋白基因的表达都存在作用(尤其是2 mmol/L浓度),同时这样的浓度选择也避免了实验细胞株由于药物毒性或者理化性质而直接死亡。根据相关基础研究[22-23]报道, 1~2 mmol/L的体液浓度量咖啡因相当于每日摄入1~2杯正常咖啡因含量咖啡的摄入。如果咖啡因作为癌症预防性长期摄入,除了咖啡因无法耐受的或是神经、心血管疾病的人群,这一摄入剂量能够被广泛接受,存在临床使用的可行性。
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA: a cancer journal for clinicians, 2015, 65(2): 87-108.
[2] SHI J, QU Y P, HOU P. Pathogenetic mechanisms in gastric cancer[J]. World journal of gastroenterology, 2014, 20(38): 13804-19.
[3] KIM B, SRIVASTAVA S K, KIM S H. Caspase-9 as a therapeutic target for treating cancer[J]. Expert opinion on therapeutic targets, 2015, 19(1): 113-27.
[4] AL-ANSARI M M, ABOUSSEKHRA A. Caffeine mediates sustained inactivation of breast cancer-associated myofibroblasts via up-regulation of tumor suppressor genes[J]. PloS one, 2014, 9(3): e90907.
[5] BESSLER H, SALMAN H, BERGMAN M, et al. Caffeine alters cytokine secretion by PBMC induced by colon cancer cells [J]. Cancer investigation, 2012, 30(2): 87-91.
[6] KU B M, LEE Y K, JEONG J Y, et al. Caffeine inhibits cell proliferation and regulates PKA/GSK3beta pathways in U87MG human glioma cells[J]. Molecules and cells, 2011, 31(3): 275-9.
[7] MIWA S, SUGIMOTO N, SHIRAI T, et al. Caffeine activates tumor suppressor PTEN in sarcoma cells[J]. International journal of oncology, 2011, 39(2): 465-72.
[8] LIU J D, SONG L J, YAN D J, et al. Caffeine inhibits the growth of glioblastomas through activating the caspase-3 signaling pathway in vitro[J]. European review for medical and pharmacological sciences, 2015, 19(16): 3080-8.
[9] MATSUOKA S, MORIYAMA T, OHARA N, et al. Caffeine induces apoptosis of human umbilical vein endothelial cells through the caspase-9 pathway[J]. Gynecological endocrinology: the official journal of the International Society of Gynecological Endocrinology, 2006, 22(1): 48-53.
[10] SOLINAS M, FERRE S, YOU Z B, et al. Caffeine induces dopamine and glutamate release in the shell of the nucleus accumbens[J]. The Journal of neuroscience: the official journal of the Society for Neuroscience, 2002, 22(15): 6321-4.
[11] CORLEY J, JIA X, KYLE J A, et al. Caffeine consumption and cognitive function at age 70: the Lothian Birth Cohort 1936 study[J]. Psychosomatic medicine, 2010, 72(2): 206-14.
[12] LINDSAY J, LAURIN D, VERREAULT R, et al. Risk factors for Alzheimer′s disease: a prospective analysis from the Canadian Study of Health and Aging[J]. American journal of epidemiology, 2002, 156(5): 445-53.
[13] SHEN Z X. Brain cholinesterases: II. The molecular and cellular basis of Alzheimer′s disease[J]. Medical hypotheses, 2004, 63(2): 308-21.
[14] HURSEL R, WESTERTERP-PLANTENGA MS. Catechin- and caffeine-rich teas for control of body weight in humans[J]. The American journal of clinical nutrition, 2013, 98(Suppl 6): 1682-93s.
[15] HAMER M, WITTE D R, MOSDOLA, et al. Prospective study of coffee and tea consumption in relation to risk of type 2 diabetes mellitus among men and women: the Whitehall II study[J]. The British journal of nutrition, 2008, 100(5): 1046-53.
[16] SARTORELLI D S, FAGHERAZZI G, BALKAU B, et al. Differential effects of coffee on the risk of type 2 diabetes according to meal consumption in a French cohort of women: the E3N/EPIC cohort study[J]. The American journal of clinical nutrition, 2010, 91(4): 1002-12.
[17] AKASH M S, REHMAN K, CHEN S. Effects of coffee on type 2 diabetes mellitus[J]. Nutrition, 2014, 30(7/8): 755-63.
[18] HASHIBE M, GALEONE C, BUYS SS, et al. Coffee, tea, caffeine intake, and the risk of cancer in the PLCO cohort [J]. British journal of cancer, 2015, 113(5): 809-16.
[19] WU S, HAN J, SONG F, et al. Caffeine Intake, Coffee Consumption, and Risk of Cutaneous Malignant Melanoma[J]. Epidemiology (Cambridge, Mass), 2015, 26(6): 898-908.
[20] FERNANDEZ M J, LOPEZ A, SANTA-MARIA A. Apoptosis induced by different doses of caffeine on Chinese hamster ovary cells[J]. Journal of applied toxicology: JAT, 2003, 23(4): 221-4.
[21] ITO K, NAKAZATO T, MIYAKAWA Y, et al. Caffeine induces G2/M arrest and apoptosis via a novel p53-dependent pathway in NB4 promyelocytic leukemia cells[J]. Journal of cellular physiology, 2003, 196(2): 276-83.
[22] ALTMAN R D, LANG A E, POSTUMA R B. Caffeine in Parkinson′s disease: a pilot open-label, dose-escalation study[J]. Movement disorders: official journal of the Movement Disorder Society, 2011, 26(13): 2427-31.
[23] LEE I A, LOW D, KAMBA A, et al. Oral caffeine administration ameliorates acute colitis by suppressing chitinase 3-like 1 expression in intestinal epithelial cells[J]. Journal of gastroenterology, 2014, 49(8): 1206-16.
Caffeine promotes apoptosis of gastric cancer by Caspase pathway
LIU Hanyang, SONG Jun, ZHOU Yan, TANG Liming
(CenterforGastrointestinalDisease,ChangzhouSecondPeople′sHospitalAffiliatedtoNanjingMedicalUniversity,Changzhou,Jiangsu, 213000)
Objective To investigate anti-cancer effects and mechanism of caffeine on promoting apoptosis of gastric cancer. Methods The viability and proliferation of gastric cancer cells were evaluated by harvesting and counting cells at preset time points after treatment with specific concentrations of caffeine. Flow cytometry was performed to assess cell cycle dynamics and apoptosis. Western blot analysis was used to detect the activity of the above signalling pathway. Results Caffeine treatment significantly suppressed GC cell growth and viability and induced apoptosis by enhancing the Caspase-9/3 pathway. Conclusion Caffeine can effectively promote the apoptosis of gastric cancer cells.
caffeine; gastric cancer; apoptosis; Caspase
2017-02-26
汤黎明, E-mail: 1315513977@qq.com
R 735.2
A
1672-2353(2017)13-040-05
10.7619/jcmp.201713011

