可得然胶对肌球蛋白凝胶冻融稳定性的影响
王培森
李倩如1,2
江文韬1,2
缪 松1,2,3
张龙涛1,2,3
郑宝东1,2
(1. 福建农林大学食品科学学院,福建 福州 350002;2. 中爱国际合作食品物质学与结构设计研究中心,福建 福州 350002;3. 替格斯食品研究中心,爱尔兰 科克市)
可得然胶对肌球蛋白凝胶冻融稳定性的影响
王培森1,2
李倩如1,2
江文韬1,2
缪 松1,2,3
张龙涛1,2,3
郑宝东1,2
(1. 福建农林大学食品科学学院,福建 福州 350002;2. 中爱国际合作食品物质学与结构设计研究中心,福建 福州 350002;3. 替格斯食品研究中心,爱尔兰 科克市)
为了探索可得然胶对鱼糜制品冻融稳定性的影响及作用机理,以肌球蛋白凝胶为模型,研究可得然胶的添加对其循环冻融过程中凝胶强度、持水率的影响,并通过低场核磁共振(LF-NMR)、傅里叶红外光谱(FT-IR)、扫描电镜(SEM)等手段分别测定添加可得然胶对肌球蛋白凝胶水分分布、分子间作用力、微观结构的影响,探讨作用机理。结果表明:添加1%可得然胶可提高肌球蛋白凝胶的凝胶强度和保水性,减缓循环冻融过程中凝胶强度和持水率的降低。添加可得然胶可增强肌球蛋白内部的氢键作用,使蛋白凝胶形成密实的三维网络结构,降低肌球蛋白凝胶中不同组分水的流动性,同时降低不易流动水向自由水的转化量,从而使蛋白凝胶冻融稳定性和持水率得到提高。
肌球蛋白;冻融处理;可得然胶;稳定性
冻品是鱼糜制品最常见的产品形式,由于冷藏、运输和销售过程中一些无法避免的因素所引起的温度波动,会使鱼糜制品的凝胶强度、质构特性下降,影响产品质量和食用品质。添加亲水性胶体被证明可提高蛋白凝胶类食品的品质,并可在一定程度上缓解温度波动对鱼糜制品的损伤[1-4]。
可得然胶是由β-1,3-糖苷键组成的线性无分枝结构,无味、无臭、无色的微生物胶,1989年首先在日本投入商业生产。由于其独特的功能,如热凝胶特性等,被广泛应用于食品行业中[5]。Funami等[6]研究可得然胶对猪肉糜热特性、凝胶特性和流变特性影响的结果表明,在75 ℃下可得然胶与猪肉可以形成较强的凝胶结构,同时明显提高了猪肉凝胶的保水性。励慧敏等[7]研究发现,添加0.5%的可得然胶可以显著提高猪肉丸口感、风味、结构、咀嚼性以及综合评分。胡亚琴等[8-9]研究了可得然胶在带鱼鱼糜中的添加效果,发现添加可得然胶能改善带鱼肌肉蛋白的凝胶性能。但鱼糜、肉糜制品成分的复杂性限制了对可得然胶添加效果作用机理的探讨。
肌球蛋白是鱼肌肉蛋白质中最重要且含量最多的一种蛋白质,占肌原纤维蛋白的 50%~55%,占鱼肌肉总蛋白的30%以上[10]。肌球蛋白也是肌原纤维蛋白中唯一一种可单独形成良好凝胶的蛋白[11],是鱼糜制品形成稳定凝胶结构的主要成分,其凝胶特性直接影响产品的质量。目前未见可得然胶与肌球蛋白的凝胶作用以及凝胶冻融稳定性的研究。
本试验以肌球蛋白为材料,制备肌球蛋白凝胶,以循环冻结—解冻模拟鱼糜制品在物流过程的温度波动,研究可得然胶的添加效果,并探讨其作用机理,旨在为冷冻鱼糜制品冻融稳定性的提高提供理论参考。
1 材料与方法
1.1 材料与试剂
红罗非鱼:个体质量(500±100) g,福州永辉超市购得;
可得然胶(CUD):纯度≥98.0%,货号A1049,美国Amresco公司;
NaN3、Tris、KCl、EGTA、KHCO3、MgCl2、盐酸、醋酸镁、β-巯基乙醇:分析纯。
1.2 主要仪器设备
搅拌机:MJ-25BM05A型,广东精品电器制造有限公司;
高剪切分散乳化机:FA-25型,法国弗鲁克(上海)有限公司;
高速冷冻离心机:JA-26型,美国贝克曼有限公司;
质构测试仪:TA-XTplus型,英国Stable Micro System公司;
核磁共振分析仪:PQ001型,上海纽迈电子科技有限公司;
红外光谱仪:Vertex 70 FTIR型,法国弗鲁克有限公司;
扫描电子显微镜:JSM-6380LV型,日本电子有限公司。
1.3 方法
1.3.1 凝胶的制备 肌球蛋白的提取参考Park等[12]的方法,采用双缩脲法测定蛋白质浓度,用0.6 mol/L KCl溶液调整蛋白质溶液至40 mg/mL。可得然胶以1 g/100 g的比例添加到肌球蛋白溶液作为处理,相同浓度的纯肌球蛋白溶液为对照。样品在 10 000 r/min 均质 1 min,4 ℃静止过夜后,取10 mL分别加入到25 mL烧杯,水浴锅中以2 ℃/min的升温速率从 20 ℃加热到 80 ℃并于 80 ℃保温20 min。用流动水冷却至室温并于 4 ℃过夜。
1.3.2 循环冻融 样品放置于-18 ℃的环境下冷冻18 h后于室温(25 ℃±1 ℃)下解冻6 h,计为1个冻融循环。肌球蛋白及其与可得然胶的混合凝胶样品分别进行1,2,3,4,5次的循环冻融[13],取样测定。
1.3.3 持水率的测定 参照文献[14],按式(1)计算持水率。试验设置 6 个平行样品。

(1)
式中:
WHC——持水率,%;
W1——离心前样品质量,g;
W2——除去水分后的样品质量,g。
1.3.4 凝胶强度的测定 采用TA.XTPlus型物性测试仪GMIAGelatine程序的压缩模式测试[15]。探头型号:P0.5,测前速度:2 mm/s,测试速度:1 mm/s,测后速度:2 mm/s,形变量:40%,触发力:5 g;触发类型:自动。
1.3.5 低场核磁共振(LF-NMR)检测 质子共振频率为 18.183 MHz,磁体强度0.43 T,测量温度为 32 ℃。大约2~4 g样品放入直径25 mm核磁管,而后放入分析仪中。自旋—自旋弛豫时间T2用Carr-Purcell-Mebiboom-Gill(CPMG)序列进行测量,参数设置:TW(重复采样等待时间)为8 000 ms,TE(回波时间)为0.8 ms,NS(扫描次数)为4,NECH(回波个数)为12 000,P1(90°脉宽)为5 μs,P2(180°脉宽)为10.4 μs,PRG(前置放大倍数)为3,得到的图为指数衰减图形。CMPG 指数衰减曲线用仪器自带的 MultiExp InvAnalysis 软件进行反演,得到T2值。
1.3.6 傅里叶红外光谱( FT-IR) 检测 将冻融处理的凝胶冻干后取1~3 mg,溴化钾压片。傅里叶光谱扫描范围 4 000~400 cm-1,分辨率 4 cm-1,室温下重复扫描 16 次。扫描结果采用 Origin 7.0 作图。
1.3.7 SEM扫描电镜观察 样品切成 3 mm×3 mm×2 mm 的薄片,放入 4%甲醛和 2.5%戊二醛混合溶液(体积比1∶1)中固定2 h;用 0.1 mol/L 的磷酸盐缓冲液(pH 7.2)漂洗5~10 次,再用乙醇(30%~100%)和丙酮(100%)溶液梯度脱水,每次各 10 min;用冷风除去易挥发的有机溶剂后,冷冻干燥 15 h;喷金,用电子显微镜观察。
2 结果与讨论
2.1 循环冻融对凝胶强度的影响
凝胶强度是衡量肉制品凝胶品质的重要物理参数。本课题组前期试验证明0.25%~1.00%的可得然胶均可显著提高肌球蛋白凝胶的凝胶强度和持水率,添加量为1%时效果最佳。由图1可知,添加可得然胶可显著提高肌球蛋白凝胶的凝胶强度。在冻融过程中,肌球蛋白及其与可得然胶的混合凝胶的凝胶强度随冻融次数的增多而降低,但添加可得然胶组高于对照组,说明可得然胶可显著提高肌球蛋白的凝胶性能和冻融稳定性。Angela Hunt等[16]报道了卡拉胶添加量为0.25%~1.00%的阿拉斯加鳕鱼鱼糜凝胶的破断力随冻融次数的增加而降低,整体凝胶强度呈下降趋势,与本试验基本一致。
2.2 循环冻融对凝胶持水率的影响
蛋白凝胶持水能力与静电作用、疏水作用、氢键、范德华力、凝胶水分分布与流动性及微观结构等有关[17]。由图2可知,未冻融时,可得然胶—肌球蛋白混合凝胶的持水率高于肌球蛋白组。丁丽丽等[18]研究发现,0.4%的可得然胶添加量即可使鱼糜制品的压出水分从4.5%降低至2.5%,提高了鱼糜制品的持水率,与本试验结果一致。反复冻融会导致凝胶内部三维网络结构损伤,凝胶中的水分流失,持水率下降。肌球蛋白凝胶及其与可得然胶的混合凝胶的持水率随冻融次数的增多而降低,但添加可得然胶组的持水率均高于未添加组,可得然胶的添加减缓了肌球蛋白凝胶冻融过程中持水率的降低。肖旭华[19]研究发现,鱼糜凝胶的持水率随冻融次数的增加而降低,与本试验结果类似;鱼糜凝胶在反复冻融过程中,冰晶不断形成和消失,对三维凝胶网络有一定的破坏作用,使其截留水分的能力降低。

图1 冻融次数对肌球蛋白凝胶强度的影响Figure 1 Effects of freeze-thaw cycles on the gel strength of myosin

图2 冻融次数对肌球蛋白凝胶持水率的影响Figure 2 Effect of freeze-thaw cycles on the Water holding capacity of the myosin gel
2.3 LF-NMR测试
弛豫时间可以反映水分的自由度,弛豫时间越短说明水分与底物结合越紧密,弛豫时间越长说明水分越自由。对CPMG脉冲序列得到的衰减曲线进行多指数拟合后(图3、4),发现T2在1~10 000 ms的弛豫时间分布上出现了4个峰,T213.511~9.326 ms、T2228.48~151.99 ms、T23174.75~811.13 ms、T241 232.85~2 477.08 ms,分别对应结合水、中度不易流动水、不易流动水、自由水4种水分,与Qin等[20-21]的报道一致。图3、4为经过5次冻融后肌球蛋白凝胶及肌球蛋白—可得然胶凝胶的T2图谱。由表1可知,循环冻融过程中T21、T22、T23、T24的弛豫时间呈增大趋势,表明混合凝胶经过多次冻融循环后,凝胶中水分受到的束缚力降低,4种不同状态水分的流动性增大,可能是凝胶在冻融过程中凝胶三维网状结构受到冰晶的破坏,使凝胶内部整体平均孔径变大,水分在凝胶网络中自由流动的空间增大。

M代表肌球蛋白凝胶;0FT、1FT、3FT、5FT分别代表0、1、3、5次冻融
图3 5次循环冻融对肌球蛋白凝胶T2的影响
Figure 3 Effect of five times freeze-thaw cycles on the distribution of theT2relaxation times of myosin gel

M代表肌球蛋白凝胶;CUD代表可得然胶;0FT、1FT、3FT、5FT分别代表0、1、3、5次冻融
图4 5次循环冻融对肌球蛋白—可得然胶凝胶T2的影响
Figure 4 Effect of five times freeze-thaw cycles on the distribution of theT2relaxation times of myosin-curdlan gel
各峰的峰面积百分比可以用来表示不同组分水分占总水分的比例。表2为冻融处理前后T21、T22、T23、T24的面积百分比。T21代表的是凝胶结构中与蛋白质结合最紧密的结合水,在循环冻融过程中变化量较小。T22、T23代表中度不易流动水和不易流动水,可将二者统一定义为不易流动水,T24为自由水,由图3、4和表2可知,在循环冻融的过程中部分不易流动水转化为自由水,可得然胶的添加减少了不易流动水的转化量。此结果与冻融过程中肌球蛋白凝胶的持水率变化规律相符合。

表1 冻融过程中T2弛豫时间的变化Table 1 The change of T2 relaxation times in freeze-thaw cycles treatment ms

表2 冻融过程中T21、T22、T23、T24的面积百分比变化Table 2 T21, T22, T23, T24 area percentage of freeze-thaw cycle treatment %
2.4 FT-IR测试
由图5和表3可知,肌球蛋白及其与多糖的混合凝胶的红外特征峰有PK1,3 430 cm-1(酰胺A带,N—H伸缩振动);PK2,2 930 cm-1;PK3,1 652 cm-1(酰胺I带,C═O伸缩振动);PK4,1 540 cm-1(酰胺II带,N—H弯曲振动);PK5,1 066 cm-1[22-23]。未加入和加入可得然胶组的峰位与峰型基本一致,说明可得然胶的添加对肌球蛋白的骨架结构基本没有影响,未发生蛋白质基团的改变。酰胺A(3 000~3 500 cm-1)带通常被用来评估和分析蛋白质分子与水分子之间的相互作用[24],CUD 的添加使得 PK1 位移至较低的波数(3 312 cm-1),表明肌球蛋白分子中氢键作用增强[25],从而提高了凝胶强度和持水率。

M代表肌球蛋白;CUD代表可得然胶;5FT代表第5次冻融

图5 冻融处理前后肌球蛋白凝胶的傅里叶红外扫描图谱Figure 5 FT-IR spectra dates of myosin gel befoe and after freeze-thaw cycle treatment表3 冻融前后肌球蛋白凝胶红外光谱数据†Table 3 FT-IR spectral data for myosin gel before and after freeze-thaw cycles cm-1
† M代表肌球蛋白;CUD代表可得然胶;5FT代表第5次冻融。
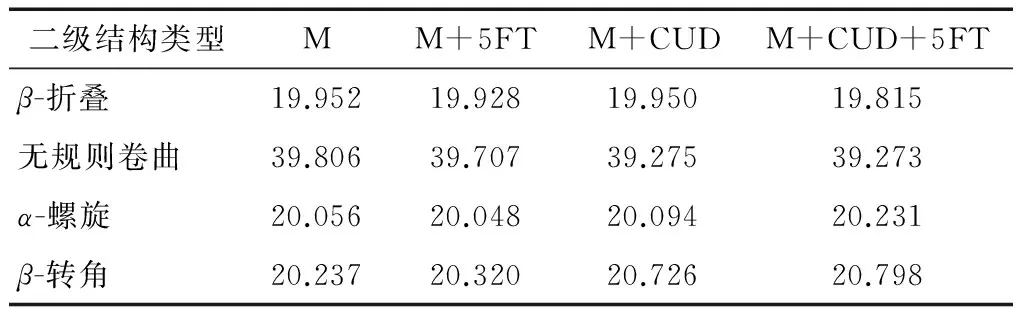
蛋白质二级结构是通过其主链上C═O和N—H间的氢键作用来维持,FT-IR经常被用来检测分析蛋白二级结构的变化。酰胺I带(1 600~1 700 cm-1)常被用来确认并分析蛋白质的二级结构。酰胺I带的红外吸收主要与C═O或C═N的伸缩振动有关,其中,1 610~1 639 cm-1被认为是β-折叠结构;1 640~1 660 cm-1被认为是无规则卷曲(C═O与水形成氢键);1 661~1 680 cm-1被认为是α-螺旋结构;1 681~1 700 cm-1被认为β-转角结构[26]。为了获得更加详细的蛋白质二级结构变化的信息,利用傅里叶自去卷积化对酰胺I带进行处理,然后对红外光谱上的酰胺I带进行高斯曲线拟合,得到的结果见表4。由表4可知,β-折叠、无规则卷曲、α-螺旋结构、β-转角结构的含量基本上无较大的变化,说明可得然胶的引入没有改变肌球蛋白的二级结构,并且冻融过程中也没有涉及到蛋白质二级结构的变化。
表4 可得然胶对肌球蛋白冻融前后二级结构的影响†
Table 4 Effects of CUD on secondary structures of myosin before and after freeze-thaw cycles
%
† M代表肌球蛋白;CUD代表可得然胶;5FT代表第5次冻融。
2.5 微观结构分析
三维网状结构是影响凝胶的凝胶强度、保水性等的重要因素[27]。凝胶网络结构的形成是蛋白质变性所引起的,该作用导致了分子间共价键和非共价键相互作用,包括二硫键和疏水键等[28]。由SEM结果可知,未添加可得然胶的肌球蛋白形成的凝胶网络孔洞较大且分布散乱,孔径大小不一,形状不规则,结构粗糙(图6 A1)。添加1%的可得然胶—肌球蛋白混合凝胶结构致密,孔洞分布均匀,孔径较小(图6 B1)。孔洞分布有序、孔径较小的凝胶网络凝胶强度较大;分布杂乱、孔径较大的凝胶强度较小[29]。因此,推测这是可得然胶—肌球蛋白混合凝胶强度大于纯的肌球蛋白凝胶的原因。
凝胶的冻结和解冻都伴随着其内部网络结构中冰结晶的出现和消失,每一次的冻融过程都会对凝胶造成不同程度的损伤。5次冻融后,纯肌球蛋白凝胶的网络结构基本完全崩溃,产生了更大的孔洞和裂缝(图6 A2)。添加1%可得然胶的肌球蛋白凝胶冻融5次后的内部结构微观图像(图6 B2)显示,冻融使胶体原有的规则纤细的网络变成混乱粗糙且具有较大孔洞的结构,以及断裂的纤维束。凝胶中的可冻结水冻结时体积变大,导致小的网孔结构破坏。解冻时,临近的网孔结构中的水分汇集,再次冻结时形成了较大的冰晶,对凝胶三维网络结构进一步的损伤。因此,反复冻融后,凝胶结构完全崩溃。添加的可得然胶参与了蛋白质凝胶的形成过程,两者之间发生相互作用,形成了交联度高、结构牢固、韧性强的网络结构,在一定程度上可以缓解冻融过程中冰晶对凝胶结构的破坏。

A1(肌球蛋白)、B1(肌球蛋白+CUD)为冻融处理前的扫描电镜图片;A2(肌球蛋白)、B2(肌球蛋白+CUD)为冻融处理后的扫描电镜图片
图6 肌球蛋白凝胶冻融处理前后的微观结构图
Figure 6 SEM of myosin gel befoe and after freeze-thaw cycle treatment
3 结论
5次循环冻融处理后,添加1%的可得然胶使肌球蛋白凝胶的凝胶强度和持水率分别由对照组的12.3 g、32.99%增大至25.8 g、62.2%。凝胶中不易流动水的含量由47.43%增大至59.5%,自由水含量由51.67%降低至39.55%。同时,胶体的引入增强了肌球蛋白分子间氢键作用,与肌球蛋白形成交联度高,结构致密,孔洞均匀的网络结构,提高了肌球蛋白凝胶的凝胶强度和持水率,有效地缓解冻融过程中冰晶对凝胶结构的破坏,减缓冻融过程中凝胶强度及持水率的降低。因此,可得然胶可以作为一种提高冻融稳定性的添加物应用在鱼糜制品的生产中。
[1] LI Xin-ke, XIA Wen-shui. Effects of chitosan on the gel properties of salt-soluble meat proteins from silver carp[J]. Carbohydrate Polymers, 2010, 82(3): 958-964.
[2] CHIN K B, GO M Y, XIONG You-ling. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel: Effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572.
[3] PATRASCU L, DOBRE I, ALEXE P. K-carrageenan effects on texture characteristics of meat emulsified sistems[J]. Studia Universitatis Babes-Bolyai Chemia, 2010, 55(3): 75-82.
[4] AYADI M A, KECHAOU A, MAKNI I, et al. Influence of carrageenan addition on turkey meat sausages properties[J]. Journal of Food Engineering, 2009, 93(3): 278-283.
[5] BS K, KIM J L J, IY L, et al. Curdlan gels as protein drug delivery vehicles[J]. Biotechnology Letters, 2000, 22(14): 1 127-1 130.
[6] FUNAMI T, YADA H, NAKAO Y. Thermal and rheological properties of curdlan gel in minced pork gel[J]. Food Hydrocolloids, 1998, 12(1): 55-64.
[7] 励慧敏, 杨柳. 大豆组织蛋白用于猪肉丸加工工艺优化[J]. 食品与机械, 2014, 30(4): 207-210.
[8] HU Ya-qin, LIU Wen-juan, YUAN Chun-hong, et al. Enhancement of the gelation properties of hairtail (Trichiurus haumela) muscle protein with curdlan and transglutaminase[J]. Food Chemistry, 2015, 176: 115-122.
[9] WU Chun-hua, YUAN Chun-hong, CHEN Shi-guo, et al. The effect of curdlan on the rheological properties of restructured ribbonfish (Trichiurus spp.) meat gel[J]. Food Chemistry, 2015, 179: 222-231.
[10] NISHITA K, KIMURA S, WATABE S. Structure-Function Relationships of Muscle Proteins from Fish and Shellfish[J]. Nihon-suisan-gakkai-shi, 1994, 60(4): 541-541.
[11] 周佺, 郭善广, 蒋爱民, 等. 肌肉盐溶蛋白热诱导凝胶特性研究进展[J]. 食品与机械, 2009, 25(3): 129-131.
[12] PARK J W, LANIER T C. Scanning Calorimetric Behavior of Tilapia Myosin and Actin due to Processing of Muscle and Protein Purification[J]. Journal of Food Science, 1989, 54(1):49-51.
[13] SHIROODI S G, RASCO B A, LO Y M. Influence of Xanthan-Curdlan Hydrogel Complex on Freeze-Thaw Stability and Rheological Properties of Whey Protein Isolate Gel over Multiple Freeze-Thaw Cycle[J]. Journal of Food Science, 2015(7): 1 498-1 505.
[15] ZHOU Yan-zi, CHEN Cong-gui, CHEN Xing, et al. Contribution of three ionic types of polysaccharides to the thermal gelling properties of chicken breast myosin[J]. Journal of Agricultural & Food Chemistry, 2014, 62(12): 2 655-2 662.
[16] HUNT A, PARK J W. Alaska Pollock Fish Protein Gels as Affected by Refined Carrageenan and Various Salts[J]. Journal of Food Quality, 2013, 36(1): 51-58.
[17] MORENO H M, CARBALLO J, BORDERAS J. Application of response surface methodology to study the effect of different calcium sources in fish muscle-alginate restructured products[J]. Ciência E Tecnologia De Alimentos, 2011, 31(1): 209-216.
[18] 丁丽丽, 郭宏明, 吴俊, 等. 可得然胶在淡水鱼糜制品中的应用研究[J]. 食品工业科技, 2015, 36(17): 262-264.
[19] 肖旭华. 米渣及米渣蛋白对鲢鱼糜凝胶特性和冻融稳定性的影响[D]. 武汉: 华中农业大学, 2014: 60-61.
[20] QIN Hao, XU Peng, ZHOU Cun-liu, et al. Effects of l -Arginine on water holding capacity and texture of heat-induced gel of salt-soluble proteins from breast muscle[J]. Lebensmittel-Wissenschaft und-Technologie, 2015, 63(2): 912-918.
[21] GOETZ J, KOEHLER P. Study of the thermal denaturation of selected proteins of whey and egg by low resolution NMR[J]. LWT-Food Science and Technology, 2005, 38(5): 501-512.
[22] CARBONARO M, NUCARA A. Secondary structure of food proteins by Fourier transform spectroscopy in the mid-infrared region[J]. Amino Acids, 2010, 38(3): 679-690.
[23] PERISIC N, AFSETH N K, OFSTAD R, et al. Monitoring Protein Structural Changes and Hydration in Bovine Meat Tissue Due to Salt Substitutes by Fourier Transform Infrared (FTIR) Microspectroscopy[J]. Journal of Agricultural & Food Chemistry, 2011, 59(18): 10 052-10 061.
[24] ANDREEVA A E, KARAMANCHEVA I R. Insight into the secondary structure of chloramphenicol acetyltransferase type I : Computer analysis and FT-IR spectroscopic characterization of the protein structure[J]. Journal of Molecular Structure, 2001, 565-566(2): 177-182.
[25] BARTH A. Infrared spectroscopy of proteins[J]. Biochimica Et Biophysica Acta, 2007, 1 767(9): 1073-1 101.
[26] PEREZMATEOS M, MONTERO P. Contribution of hydrocolloids to gelling properties of blue whiting muscle[J]. European Food Research and Technology, 2000, 210(6): 383-390.
[27] HAN Min-yi, WANG Peng, XU Xing-lian, et al. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J]. Food Research International, 2014, 62: 1 175-1 182.
[28] MA Fei, CHEN Cong-gui, ZHENG Lei, et al. Effect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl2, andκ-carrageenan[J]. Meat Science, 2013, 95(1): 22-26.
[29] BALANGE A, BENJAKUL S. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2009, 113(1): 61-70.
Effects of curdlan on the freeze-thaw stability of myosin gel
WANGPei-sen1,2
LIQian-ru1,2
JIANGWen-tao1,2
MIAOSong1,2,3
ZHANGLong-tao1,2,3
ZHENGBao-dong1,2
(1.CollegeofFoodScience&FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China;2.China-IrelandInternationalCooperationLaboratoryofFoodsMaterialScienceandStructuralDesign,Fuzhou,Fujian350002,China; 3.TeagascFoodResearchCentre,Moorepark,Fermoy,Co.Cork,Ireland)
In order to investigate the effects and mechanization of curdlan on the free-thaw stability of surimi, gel strength and water holding capacity of myosin gel model in freeze-thaw cycles were observed. The intermolecular force, water distribution and microstructure were determined by LF-NMR, FT-IR and SEM respectively. The result showed that 1% curdlan increased the gel strength and water holding capacity and alleviated the reduction of gel strength and water holding capacity during freezing and thawing cycle. The addition of curdlan strengthened the hydrogen bonding inter myosin,which led to the formation of a compact three-dimensional network structure of myosin gel. Moreover, the liquidity of different components of water and the immobile water shifted into free water decreased, and the freeze-thaw stability and water holding capacity were increased.
myosin; freeze-thaw cycles; curdlan
王培森,男,福建农林大学在读硕士研究生。
张龙涛(1979—),男,福建农林大学副教授,博士。 E-mail:zlongtao@hotmail.com
2017—03—21
10.13652/j.issn.1003-5788.2017.05.006

