B16细胞与HaCaT细胞体外共培养模型的建立
朱祯慧, 朱丽清, 陈金妹, 林娇芬, 潘裕添
(闽南师范大学 菌物产业工程技术中心, 福建 漳州 363000)
B16细胞与HaCaT细胞体外共培养模型的建立
朱祯慧, 朱丽清, 陈金妹, 林娇芬, 潘裕添*
(闽南师范大学 菌物产业工程技术中心, 福建 漳州 363000)
初步建立小鼠黑色素瘤细胞(B16细胞)和人永生化角质形成细胞(HaCaT细胞)的共培养模型,利用熊果苷和8-甲氧补骨脂素(8-MOP)对此模型进行作用验证.使用10%DMEM完全培养基对B16细胞和HaCaT细胞进行培养,尝试不同的细胞接种顺序和细胞接种浓度构建共培养模型;将不同浓度的熊果苷和8-MOP作用到共培养模型中,通过测细胞毒性、黑色素含量和酪氨酸酶含量来验证模型的可靠性.结果表明,细胞接种顺序对共培养模型没有影响,采用B16细胞数量:HaCaT细胞数量为1∶4为最终细胞接种浓度比例;当熊果苷为100μg/mL时对黑色素含量和酪氨酸酶含量达到最高抑制效果;当8-MOP为20μg/mL时对黑色素含量和酪氨酸酶含量达到最高促进效果,均与单独B16细胞实验结果趋势一致.有效构建了B16细胞和HaCaT细胞共培养模型,并且可以将该模型运用于筛选抑制/促进黑色素药物中.
B16细胞; HaCaT细胞; 共培养模型; 熊果苷; 8-MOP
0 引言
人类的表皮黑素单元由黑素细胞和角质形成细胞共同作用组成,在人类的日常生活中起着重要的作用,正常情况下,一个表皮黑素单位由一个黑素细胞和周围约36个角质形成细胞相接触组成[1,2].B16细胞是美白剂筛选重要细胞模型,但由于体外单种细胞培养仍旧不可避免的与人体细胞的生理环境有所差异[3,4],因此,为了弥补现代单种细胞培养的局限性,B16细胞与角质细胞共培养成为研究热点.自Halaban首次成功建立黑素细胞和角质形成细胞的体外共培养模型[5],众多建立在此模型基础上的共培养模型也相继涌现,考虑到人黑素细胞较难培养,实验成本较大[6],因此本实验构建了小鼠黑色素瘤细胞(B16细胞)和人永生化角质细胞(HaCaT细胞)的共培养模型,并且使用熊果苷和8-甲氧补骨脂素(8-MOP)两种完全不同作用效果的药物,通过检测细胞毒性[7,8],黑色素含量和酪氨酸酶活性等指标验证其对所建模型的影响,实验结果对肌肤美白作用物质的筛选具有重要的科学参考和应用价值.
1 材料和方法
1.1 材料
1.1.1 细胞株
小鼠黑色素瘤细胞(B16 细胞),购自中国科学院上海细胞库.
人永生化角质形成细胞( HaCaT 细胞),购自中国科学院上海细胞库.
1.1.2 主要试剂
DMEM (12800) ,0.25% Trypsin-EDTA(1X),购自上海鲁汶生物科技有限公司; CellTiter 96AQueous One Solution Cell Proliferation Assay ,购自普洛麦格(北京)生物科技有限公司;熊果苷,分析纯,购自东京化成工业株式会社;8-甲氧补骨脂,分析纯,购自西格玛奥德里奇中国有限公司;考马斯亮蓝G250,分析纯,购自国药集团化学试剂有限公司.
1.1.3 主要仪器
HF safe生物安全柜,购自力康生物医疗科技控股有限公司;Celculture CO2INCUBATOR,购自新加坡艺思高科技(上海)有限公司;Centrifuge 5810 R,购自艾本德中国有限公司;Infinite M 200 PRO 全波长酶标仪,购自上海迪奥生物科技有限公司.
1.2 实验方法
1.2.1 细胞培养
采用10% DMEM完全培养基对B16细胞和HaCaT细胞进行常规培养,将培养至对数生长期的细胞分别消化,离心,重悬后细胞计数稀释至5×104个/mL[9],按照实验要求进行接种.
1.2.2 共培养模型建立[6]
(1)细胞接种顺序对共培养模型的影响:将相同细胞浓度的B16细胞和HaCaT细胞悬液备好,分为A组:先接种5 mL B16细胞,培养24 h后接种5 mL HaCaT细胞;B组:先接种 5 mL HaCaT细胞,培养24 h后接种5 mL B16细胞;C组:先接种2.5 mL B16细胞和2.5 mL HaCaT细胞,培养24 h后依旧接种2.5 mL B16细胞和2.5 mL HaCaT细胞.继续培养24 h后拍照观察是否有影响.
(2)细胞接种浓度对共培养模型的影响:将相同细胞浓度的B16细胞和HaCaT细胞悬液备好,分别按B16细胞数量:HaCaT细胞数量为1∶1、1∶2、1∶3、1∶4、1∶5、1∶10接种培养.拍照观察.
1.2.3 熊果苷和8-MOP对共培养模型的影响
(1)MTS法检测细胞毒性[10]:将生长状态良好的B16细胞消化,离心,重悬后调整细胞浓度为5×104个/mL,按照每孔100μL接种于96孔板中,24 h后每孔加药100μL,熊果苷浓度分别为10μg/mL、50μg/mL、100μg/mL、200μg/mL、500μg/mL,以不加药组作为空白对照.分别加药培养24 h、48 h、72 h后每孔加入20μL MTS,37 ℃孵育2 h后进行酶标仪检测,酶标仪参数设定为:中速振荡30 s,静置10 s,检测波长490 nm.
分别对HaCaT细胞和共培养细胞测细胞毒性,方法同上.
细胞相对增殖率(%)=[(细胞加药组Abs值-加药培养基Abs值)/(空白对照组Abs值-培养基Abs值)]*100%
(2)熊果苷和8-MOP对共培养细胞的黑色素含量影响[11]:将生长状态良好的共培养细胞消化,离心,重悬后调整细胞浓度为30×104个/mL,按照每孔0.5 mL接种于24孔板,重复接种两块板,24 h后每孔加药1 mL,熊果苷浓度分别为10μg/mL,50μg/mL,100μg/mL,以不加药组作为空白对照.加药培养24 h,将一块24孔板的培养基吸弃,冰PBS洗三遍,按照每孔加入1 mL 1mol/L NAOH含10% DMSO的溶液,80 ℃加热1 h,酶标仪490 nm处测试得到B1值;同时对另一块24孔板吸弃培养基后,按照每孔0.5 mL培养基, 再加入50μL MTS,继续培养2.5 h,酶标仪490 nm处测试得到B2值以作校正.对单独B16细胞进行相同实验操作用作对照组.
黑色素含量=吸光度值B1/吸光度值B2
操作方法同上.8-MOP浓度分别为5μg/mL,10μg/mL,20μg/mL,以不加药组作为空白对照.对单独B16细胞进行相同实验操作用作对照组.
(3)熊果苷和8-MOP对共培养细胞的酪氨酸酶活性影响[12]:将生长状态良好的共培养细胞消化,离心,重悬后调整细胞浓度为30×104个/mL,培养24 h后加药,熊果苷浓度分别为10μg/mL,50μg/mL,100μg/mL,以不加药组作为空白对照.加药培养24 h,旧液去除,冰PBS洗三遍,向细胞沉淀中加入5倍细胞沉淀体积的0.05 mol/L PBS,重悬细胞,-20 ℃放置30 min.回温,速冻速溶5次,4 ℃条件下高速离心9 000 rpm,15 min两次得上清液即为所需酶液.测量时向780μL 100 mmol/L PBS中加入200μL 5mmol/L L-DOPA,37 ℃水浴加热10 min,然后加入20μL酶液,37 ℃水浴加热5 min,酶标仪475 nm处测试得到T1值.用考马斯亮蓝测蛋白法对酶液进行测量得到T2值以作校正.OD值与酪氨酸酶活性呈正相关.对单独B16细胞进行相同实验操作用作对照组.
酪氨酸酶活性=吸光度值T1/吸光度值T2
操作方法同上.8-MOP浓度分别为5μg/mL,10μg/mL,20μg/mL,以不加药组作为空白对照.对单独B16细胞进行相同实验操作用作对照组.
2 结果与讨论
2.1 细胞接种顺序对共培养模型的影响结果
不同细胞接种顺序对共培养模型影响的结果如图1所示.由图1可知,细胞接种顺序不同培养相同时间后,各组细胞均正常生长且细胞形态没有明显区别.培养48 h后,三组均可见到两种细胞接触共存贴壁生长.因此,为了后续实验的便捷,采用直接两种细胞同时混合接种的方式进行实验.
同时,实验还可明显观察到,B16细胞具有明显的突触,其突触伸长触及HaCat细胞上,B16细胞突触是成熟黑色素小体的转运的一条高速通路,可见共培养模型对于研究B16和HaCat细胞间的黑色素的转运具备可行性.
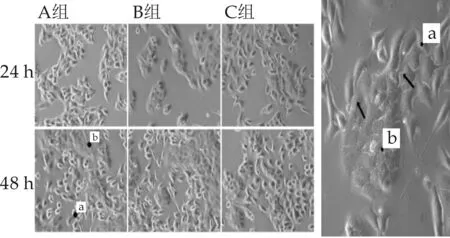
a:B16细胞,体积较小,形状不规则;b:HaCaT细胞,体积较大,偏圆形;箭头:B16细胞突触连接到HaCaT细胞,共同生长图1 不同接种顺序对细胞共培养模型影响结果(100×)
2.2 细胞接种浓度对共培养模型的影响结果
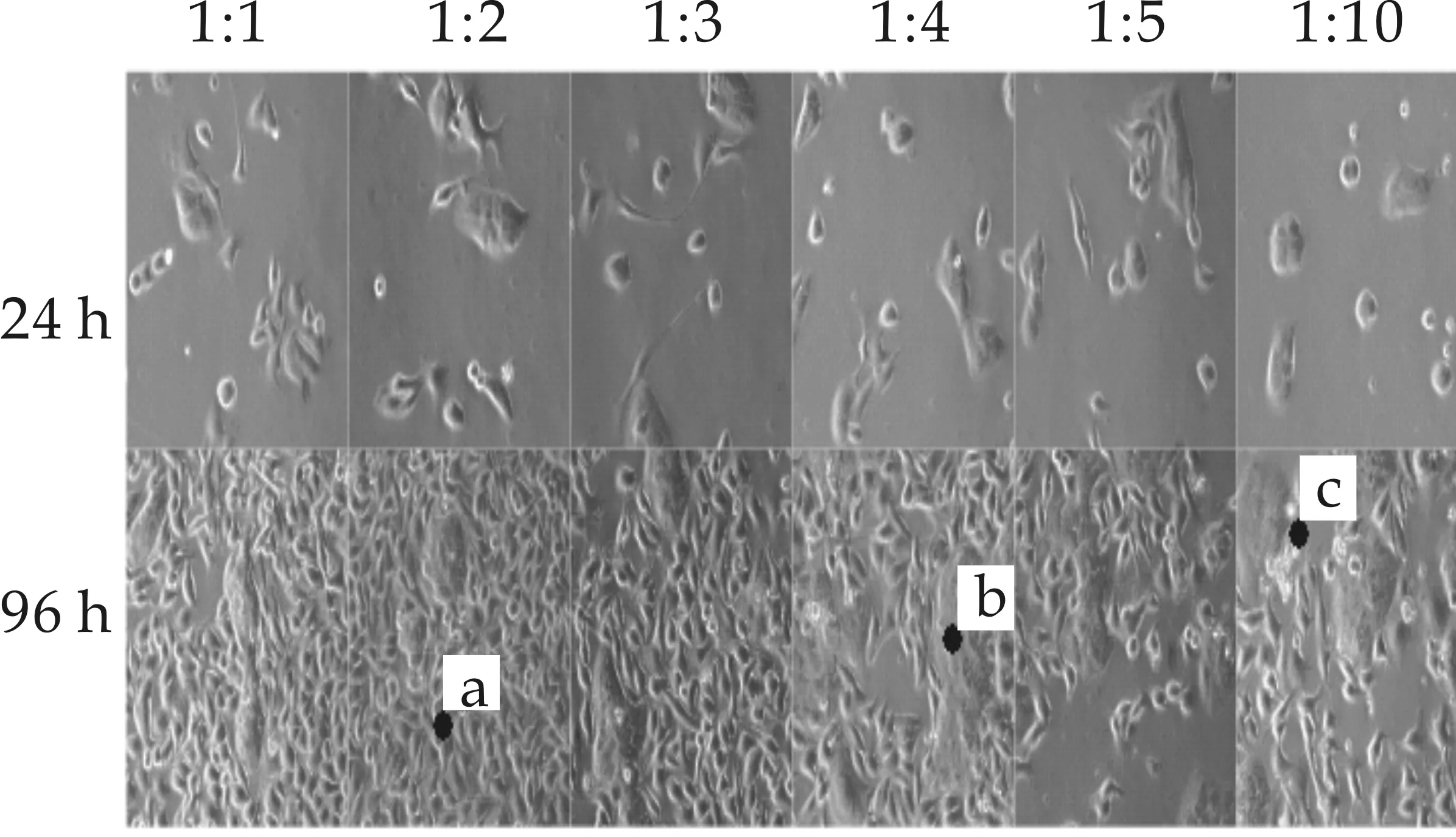
不同细胞接种浓度对细胞共培养模型影响的结果如图2所示.由图2可知,在相同的细胞浓度条件下,当B16细胞数量∶HaCaT细胞数量分别为1∶1、1∶2、1∶3、1∶4时,共培养细胞相互接触生长,细胞形态正常,基本没有死细胞;而当B16细胞数量∶HaCaT细胞数量分别为1∶5、1∶10时,可以看到,96 h时共培养细胞生长状态不佳,有部分细胞已经死亡,漂浮在培养基上层.随着HaCaT细胞接种数量的增加,96 h时共培养模型中的HaCaT细胞数量则越多,由于人类表皮黑色单元中角质细胞数量较多于黑色细胞数量,因此,HaCaT细胞数量越多则越接近人类的正常比例,符合实验目标.因此,选择B16细胞数量∶HaCaT细胞数量为1∶4作为后续的实验浓度比例.
2.3 熊果苷和8-MOP对共培养细胞模型影响结果
2.3.1 细胞毒性检测结果
由表1可知,随着熊果苷作用浓度和作用时间的增加,其对B16细胞和HaCaT细胞的抑制作用明显;尤其在作用时间为72 h时,不同浓度的熊果苷对B16细胞均有极显著抑制(P<0.001),其中当熊果苷作用浓度为500μg/mL时细胞毒性达到2级[13];随着熊果苷作用浓度和作用时间的增加,其对共培养细胞的抑制作用与单独培养的B16细胞和HaCaT细胞毒性趋势一致,因此可以确定共培养不改变两种细胞对熊果苷的作用效应趋势.
a:B16细胞,体积较小,形状不规则;b:HaCaT细胞,体积较大,偏圆形;c:死亡细胞,呈悬浮状态;箭头:B16细胞突触连接到HaCaT细胞,共同生长

(a)两种细胞接种24 h,B16未生长出触角,HaCaT细胞成团生长,均处于生长阶段,还未接触生长 (b)两种细胞接种48 h,B16细胞已经生长出触角且向HaCaT细胞连接生长
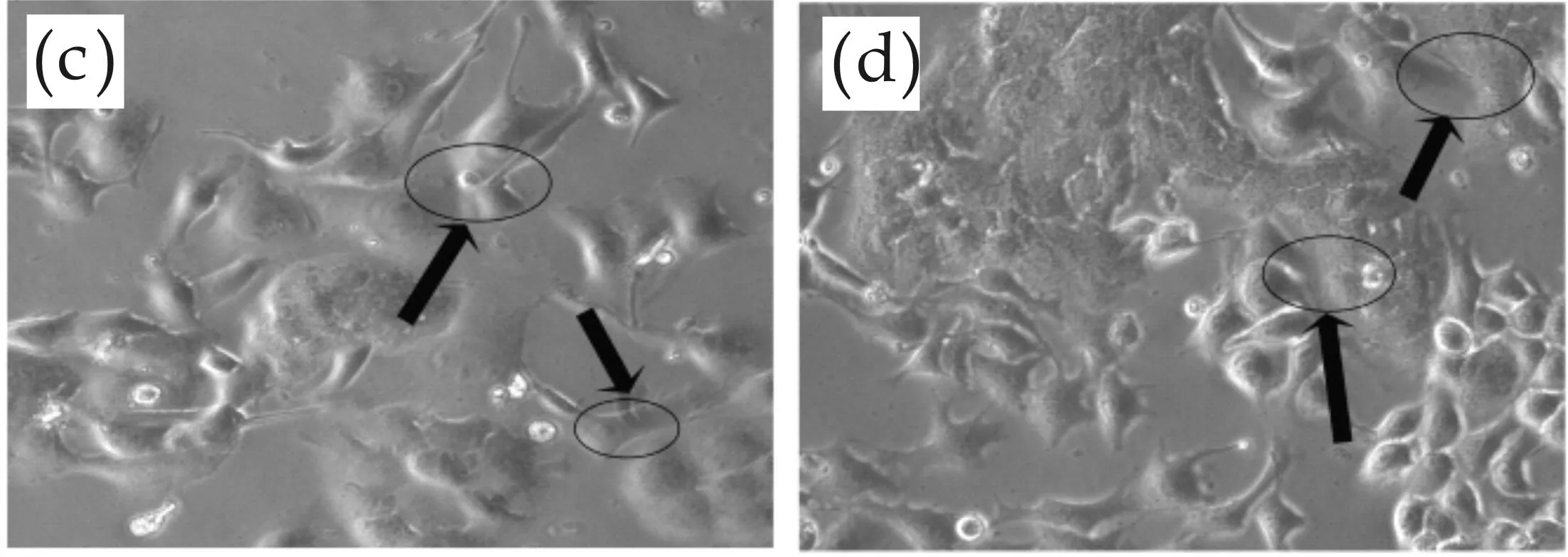
(c)两种细胞接种72 h,B16细胞与HaCaT细胞生长状态均已成熟且接触生长,B16细胞的触角融合于HaCaT细胞内 (d)两种细胞接种96 h,B16细胞和HaCaT细胞连接生长,细胞数量很多且聚集生长,细胞之间分界不明图2 不同接种浓度对细胞共培养模型影响结果(100×)

细胞模型熊果苷浓度/(μg/mL)细胞相对增殖率/%24h48h72hB16细胞1099.2187±2.882890.6890±2.4861 79.0542±1.5666***5097.2115±1.508688.7868±2.541377.9094±2.1035***10095.6813±1.170588.6129±3.492572.2601±1.8774***20095.6628±1.468287.2123±2.757471.1007±2.1001***50089.0364±1.1866*67.0537±0.8912***66.7830±1.6798***HaCaT细胞1099.2668±2.203298.1524±2.3431 98.1289±1.2007 5099.2942±3.823897.7528±2.147987.8746±1.4388**10092.7019±3.011396.1350±2.040386.3302±2.1419**20088.6573±3.397689.4089±1.994278.3121±1.4999***50087.2105±2.087181.7585±2.224074.8310±1.6469***共培养细胞1099.6932±2.169792.2838±3.1074 89.1651±0.9807***5093.9872±2.303986.3991±3.616786.0897±1.3613***10093.9379±3.147286.1874±2.646385.7270±1.7506***20091.4788±2.558485.7116±4.0892*84.5416±1.2222***50081.8800±3.2283*75.3033±1.6258**72.0431±1.1281***
*表示不同浓度加药组与空白对照组之间的显著性:P*<0.05,P**<0.01,P***<0.001.
由表2可知,随着8-MOP作用浓度的增加,在不同的时间点,8-MOP对三种细胞模型均有抑制增殖,因此可以确定共培养不改变两种细胞对8-MOP的作用效应.当作用时间为72 h时,8-MOP均对共培养细胞有抑制效果比B16细胞和HaCaT细胞单独作用明显显著,且除当8-MOP作用浓度为30μg/mL外均具有浓度依赖性.
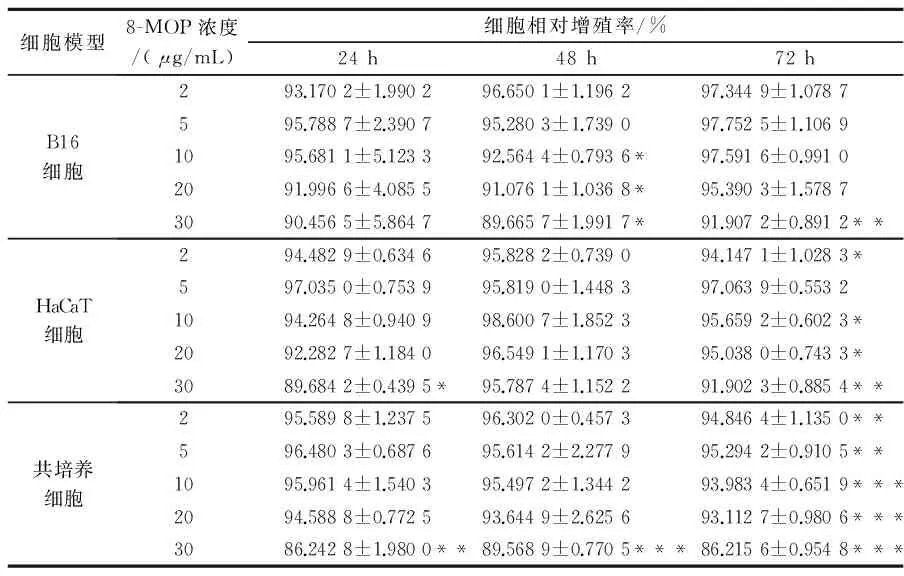
表2 不同浓度和作用时间的8-MOP对细胞模型增殖率影响结果
2.3.2 熊果苷和8-MOP对培养细胞的黑色素含量影响结果
不同浓度的熊果苷对共培养细胞的黑色素含量影响结果如图3所示.由图3可知,随着熊果苷作用浓度的增加,共培养细胞的黑色素含量逐渐减少,当加药组与空白组对比时,在熊果苷作用浓度为50μg/mL时,对共培养细胞已经有了显著的抑制黑色素生成效果(P<0.01).与相同浓度的熊果苷对单独B16细胞作用趋势一致,说明共培养细胞模型适合对熊果苷之类的美白剂进行筛选.

图3 不同浓度的熊果苷对共培养细胞的黑色素含量影响结果
不同浓度的8-MOP对共培养细胞的黑色素含量影响结果如图4所示.由图4可知,随着8-MOP作用浓度的增加,共培养细胞的黑色素含量逐渐增加,当加药组与空白组对比时,加药组的共培养细胞均有显著的促黑效果(P<0.001).说明共培养细胞模型可以对8-MOP之类的促黑药进行筛选.
2.3.3 熊果苷和8-MOP对培养细胞的酪氨酸酶活性影响结果
不同浓度的熊果苷对共培养细胞的酪氨酸酶活性影响结果如图5所示.由图5可知,随着熊果苷浓度的增加,其对共培养细胞的酪氨酸酶活性抑制作用越明显,并具有浓度依赖性.在熊果苷作用浓度为100μg/mL时,其对酪氨酸酶活性抑制的作用最为显著(P<0.001).与相同浓度的熊果苷对单独B16细胞作用趋势一致且变化更明显,说明共培养细胞模型可以对熊果苷之类的阳性药进行筛选.
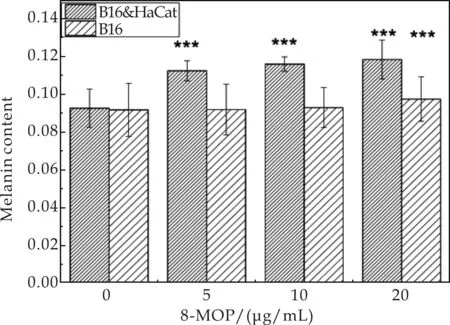
图4 不同浓度的8-MOP对共培养细胞的黑色素含量影响结果
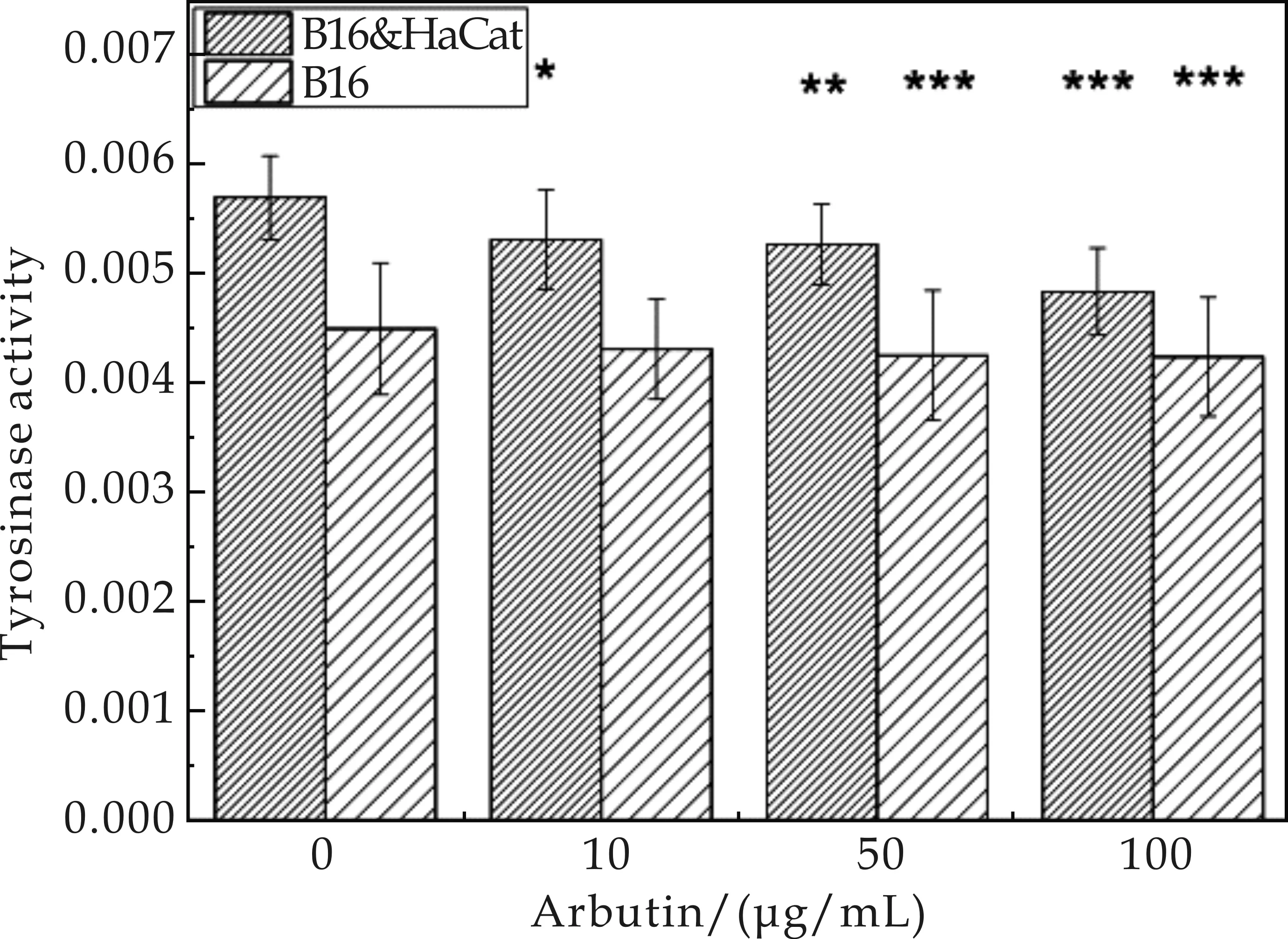
图5 不同浓度的熊果苷对共培养细胞的酪氨酸酶活性影响结果
不同浓度的8-MOP对共培养细胞的酪氨酸酶活性影响结果如图6所示.由图6可知,随着8-MOP浓度的增加,其对共培养细胞的酪氨酸酶活性促进作用越明显,尤其在8-MOP作用浓度为20μg/mL时,其对酶活性促进的作用最为显著(P<0.001).说明共培养细胞模型可以对8-MOP之类的促黑药进行筛选.
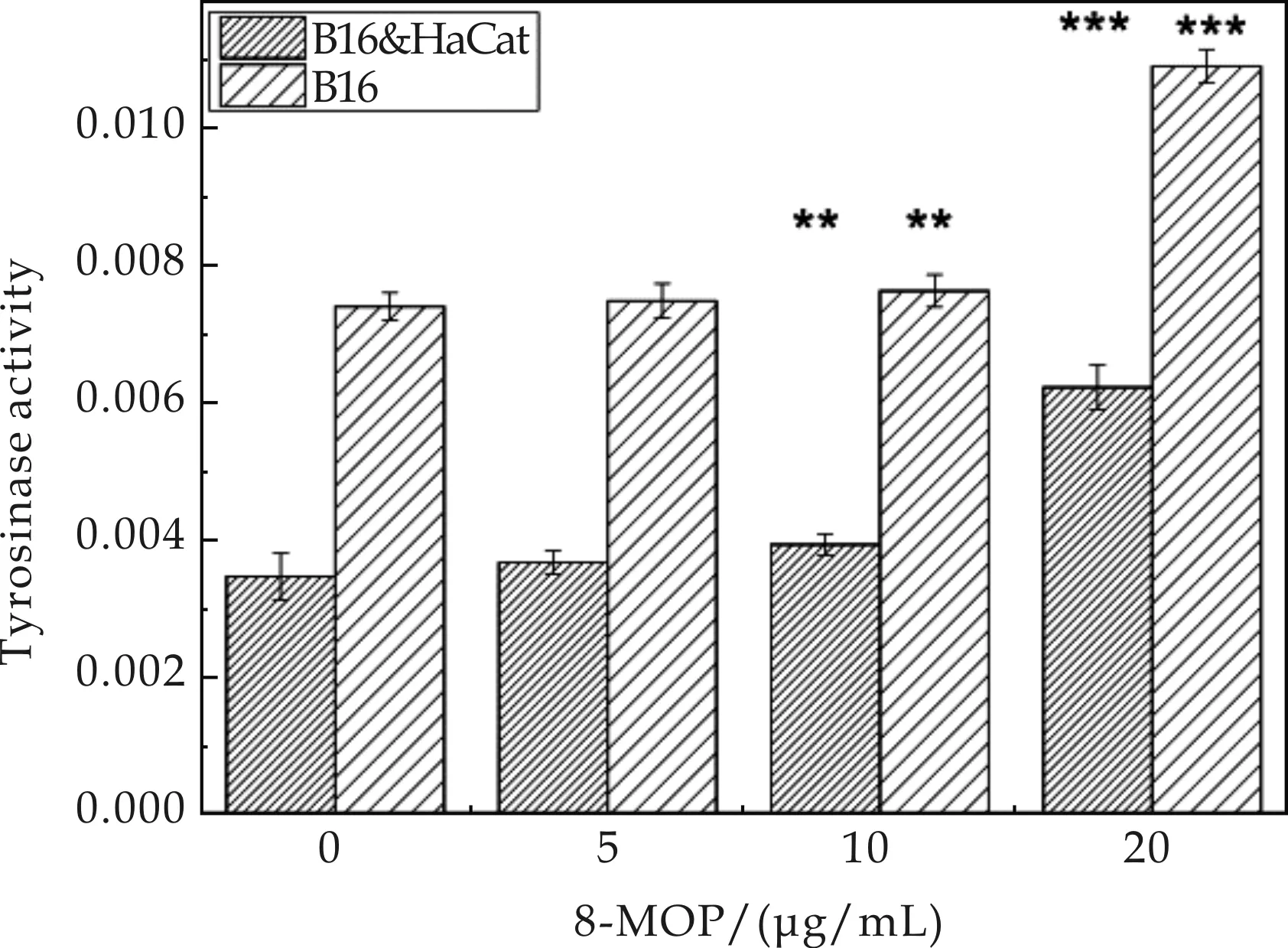
图6 不同浓度的8-MOP对共培养细胞的酪氨酸酶活性影响结果
3 结论
细胞共培养模型是科学研究的需要,通过建立细胞共培养模型,不仅可以直接观察细胞之间的相互作用,而且从最大程度上模拟人体正常的生理状态,从而弥补了单种细胞培养不相似人体细胞结构的遗憾[14].本实验采用两种细胞直接接触培养的方法[15],考虑到人体黑色素细胞较难培养,为节约实验成本,因此选择了鼠源黑色素瘤细胞与人源角质细胞进行共培养,通过对两种细胞接种顺序和细胞接种浓度的不同,首先构建最符合人体要求的共培养模型,实验得到两种细胞的接种顺序对共培养模型的构建并没有影响,细胞的生长状态均良好;在细胞接种浓度探索实验中发现当B16细胞与HaCaT细胞数目比为1∶4时,共培养模型可以在维持正常生长的状态下尽量达到研究的合理要求.然后运用熊果苷和8-MOP对细胞共培养模型与单种细胞培养进行作用效果比较,验证共培养模型筛选药物的结果与单种细胞筛选药物的结果是否一致[16,17],发现其结果与单独B16细胞作用趋势一致.因此,本实验建立的共培养模型可以作为更有效的仿真方法来对肌肤美白或者促黑素药物进行筛选.
[1] 马慧军,赵 广.皮肤色素沉着发生机制的研究进展[J].中国美容医学杂志,2006,15(9):1 090-1 092.
[2] Yoon T J,Hearing V J.Co-culture of mouse epidermal cells for studies of pigmentation[J].Pigment Cell Research,2003,16(2):159-163.
[3] 王天晔,王兴焱,陈巧云,等.细胞共培养技术在美白药物研究中的应用及前景[J].中国美容医学杂志,2010,19(9):1 401-1 403.
[4] 吴新星,姜兴涛,余汉谋,等.细胞培养技术在美白功效评价中的应用[J].日用化学品科学,2015,38(11):39-41.
[5] Halaban R,Langdon R,Birchall N,et al.Basic fibroblast growth factor from human keratinocytes is a natural mitogen for melanocytes[J].Journal of Cell Biology,1988,107(4):1 611-1 619.
[6] 解士海.人表皮黑素细胞—角质形成细胞共培养及11种化合物对黑素沉着的影响研究[D].北京:中国协和医科大学,2006.
[7] Arung E T,Yoshikawa K,Shimizu K,et al.The effect of chlorophorin and its derivative on melanin biosynthesis[J].Holzforschung,2005,59(5):514-518.
[8] Costantino V V,Lobosgonzalez L,Ibaez J,et al.Dehydroleucodine inhibits tumor growth in a preclinical melanoma model by inducing cell cycle arrest,senescence and apoptosis[J].Cancer Letters,2016,372(1):10-23.
[9] 陈易彬,徐 锦,王 敏,等.黑木耳甲醇提取物抑制黑色素的研究[J].食品工业科技,2015(21):111-114.
[10] Cory A H,Owen T C,Barltrop J A,et al.Use of an aqueous soluble tetrazolium/formazan assay for cell growth assays in culture[J].Cancer Communications,1991,3(7):207-210.
[11] 郭殷锐,李沁莹,张广唱,等.马鞭草经皮透过液对B16黑色素瘤细胞的作用[J].中药新药与临床药理,2016,27(1):19-22.
[12] 黄海潮,郑公铭,王如意,等.柯里拉京对B16细胞增殖及酪氨酸酶活性的抑制作用[J].日用化学工业,2016,46(1):44-47.
[13] 王 昕,施嬿平,朱雪涛,等.医用聚酯类材料的细胞毒性试验[J].生物医学工程研究,2003,22(2):39-40.
[14] 罗 云,孙桂波,秦 蒙,等.细胞共培养技术在医药研究中的应用[J].中国中药杂志,2012,37(22):3 345-3 349.
[15] 李 拉,陈文庆,朱敬先,等.直接接触共培养技术在体外探索细胞间相互作用的应用研究[J].中国运动医学杂志,2013,32(4):337-342.
[16] 刘邦民,张 涓,陶春蓉,等.验方祛斑汤对A375人黑素瘤细胞黑素合成的影响[J].时珍国医国药,2009,20(1):209-210.
[17] 雷铁池,朱文元,夏明玉,等.8-甲氧补骨脂素对小鼠黑素瘤细胞黑素生成的调节及相关信号转导研究[J].中华皮肤科杂志,1999,32(2):115-118.
【责任编辑:陈 佳】
Construction of the co-culture model of B16 cells and HaCaT cells in vitro
ZHU Zhen-hui, ZHU Li-qing, CHEN Jin-mei, LIN Jiao-fen, PAN Yu-tian*
(The Engineering Technological Center of Mushroom Industry, Minnan Normal University, Zhangzhou 363000, China)
The co-culture model of Murine Melanoma cells (B16 cells) and human keratinocytes (HaCaT cells) was established,and the effect of the model by arbutin and 8-MOP.B16 cells and HaCaT cells were cultured in 10% DMEM medium.Different inoculation sequences of cell and inoculation concentrations of cell were used to construct co-culture model.After arbutin and 8-MOP were added to the model,the cytotoxicity,melanin content and tyrosinase activity were measured to verify the reliability of the model.The results showed that the sequences of cell inoculation had no effect on the co-culture model;B16 cells was co-culture with HaCaT cells as 1∶4 ratio;the highest inhibitory effect of arbutin on the melanin content and tyrosinase activity at the concentration of 100μg / ml;the 8-MOP had the lowest inhibitory effect on melanin content and tyrosinase activity at the concentration of 20μg / ml,all of these like as the previous study of only B16 cells.The co-culture model of B16 cells and HaCaT cells was established effectively in this study and it can be used to screen the drugs of promoting or inhibiting melanin.
B16 cells; HaCaT cells; co-culture; arbutin; 8-MOP
2017-03-12
福建省科技厅青年科技创新项目(2015J05071)
朱祯慧(1992-),女,山西临汾人,在读硕士研究生,研究方向:天然产物通讯作者:潘裕添(1969-),男,福建漳州人,教授,研究方向:天然产物,xmpyt@sina.com
2096-398X(2017)04-0132-06
Q2-3
A

