新疆野核桃F1表型性状与SSR标记连锁分析
李勤霞++张萍

摘要:以新疆伊犁巩留县平底圆核桃、椭圆核桃及其杂种F1,以及随机选取的60份野核桃种质资源为研究材料,对其表型性状、SSR遗传多样性及其亲缘关系进行分析和评价。研究发现,8个表型性状在群体中呈连续分布,与其正态分布曲线拟合较好,彼此之间具有相关性。变异系数表明各个性状的变异均超过10%,说明个体间的表型值变异较大。进一步对其进行主成分分析,表明株高、茎粗、最大叶长、最小叶长、最小叶宽这5个指标是引起野核桃表型差异较大的因子。通过10对多态性高的SSR引物共检测出35个等位变异位点,变异范围在2~6之间,平均每对SSR引物可检测到3.5个等位位点。遗传相似系数(GS)变异范围为0.51~0.95。GS值在0.55水平上的UPGMA聚类分析可将供试的野核桃种质资源划分成Ⅰ、Ⅱ、Ⅲ、Ⅳ共4个组。丰富的遗传变异可为野核桃遗传改良及分子育种提供依据。
关键词:野核桃;遗传多样性;SSR标记;表型性状
中图分类号: S664.101文献标志码: A
文章编号:1002-1302(2017)09-041-05
生物体遗传多样性的实质是其在遗传物质组成、结构上的变异,表现在群体、个体、组织、细胞、分子水平等不同层次上[1]。以往人们常根据植株形态鉴定杂交子代,但形态学鉴定周期较长,易受栽培环境影响,具有很大的局限性。近年发展起来的基于物种DNA水平的分子标记技术,具有不易受环境影响、引物信息共享、鉴定速度快等优点,是鉴定杂交子代的有力手段[2]。于是,将形态学与分子手段相结合的研究方法随之兴起[3],如对不同类型小豆的SSR标记及其性状进行研究[4],对大豆[Glycine max (L.) Merr]农艺性状与SSR标作进行研究[5],以及对桃(Amygdalus persica L.)的形态特征进行研究[6-8]等,类似研究较多。
新疆野核桃(Juglans regia)为胡桃科胡桃属植物,是栽培核桃的直系祖先,具有许多优良的遗传特性,在我国仅分布于新疆伊犁巩留县野核桃沟自然保护区内,是我国珍贵的天然野生资源。新疆野核桃不仅是我国重要的野生核桃资源,更是研究栽培核桃起源、进化、自然选择不可多得的原始材料。曾有报道,遗传多样性越高或遗传变异越丰富,林木对环境变化的适应能力也就越强,而遗传多样性的降低或消失将导致林木在适应、繁殖方面产生衰退,同时抵抗力也会下降[9-10]。新疆野核桃作为一种重要的林木,对其遗传多样性的研究显得尤为重要。目前,关于新疆野核桃的研究较多,王肇延对其DNA的提取方法以及野核桃遗传多样性进行了研究[11];王磊等对野核桃的形态特征进行了研究[12];袁海涛利用野核桃的表型基础数据全面构建了新疆野核桃的基础数据库,并对其构建野核桃核心种质的方法进行了研究[13];张维等对其种群动态进行了研究[14],但對表型性状还没有进行较深入研究,而表型性状不仅是遗传多样性的组成部分,更为野核桃的遗传育种提供了依据。因此,本研究将野核桃的表型性状及SSR标记的多态性相结合,以期了解其表型性状的同时,更加全面地了解其形态多样性的来源。
1材料与方法
1.1试验材料
材料选自新疆伊犁河谷地巩留县西北部的野核桃沟,2014年5月下旬选取2棵长势较好且表型性状差异较大的野核桃树(父本:平底圆核桃,母本:椭圆核桃,两树相隔50 m左右)进行人工授粉杂交,待果实成熟后,将F1种子移栽到新疆乌鲁木齐县花卉生产基地内,共计培养幼苗368株。
1.2研究方法
1.2.1表型性状的选取
从培养的F1幼苗中随机选取60[CM)]株进行测量,所取性状包括株高、茎高、茎粗、最大叶长、最大叶宽、最小叶宽、最小叶长、侧枝长。所有数据均使用游标卡尺测量。单位均为cm。
1.2.2DNA提取与SSR试验过程
在苗期提取上述60株对应幼苗的嫩叶DNA,经0.8%琼脂糖凝胶电泳检测DNA的大小及降解情况,并用UVP凝胶成像系统对电泳的琼脂糖凝胶观察和拍照。将各材料的DNA浓度稀释至30 ng/μL,于 -20 ℃ 冰箱保存备用。
试验所用的20对SSR引物的碱基序列来源于NCBI网站公布的核桃SSR引物,由华大科技生物公司合成。对亲本材料进行SSR引物筛选,试验选出PCR扩增条带清晰、重复性好、多态性丰富的引物10对用于进一步分析。
参照王肇延SSR反应体系和程序[11],经优化后确定反应体系为10 μL,其中包括Mg2+ 2.5 mmol/L、引物 0.25 μmol/L、dNTPs 0.18 mmol/L、Taq酶0.5 U,模板DNA约为30 ng。PCR扩增程序为94 ℃预变性3 min;94 ℃变性 30 s,56 ℃退火1 min,72 ℃延伸40 s,共30个循环;最后 72 ℃ 延伸9 min,4 ℃保存。PCR扩增反应在Thermal Cycler S1000型PCR仪上进行。扩增反应结束后,每个反应体系中加入2 μL的溴酚蓝。用8%的非变性聚丙烯酰胺电泳技术对产物进行分离检测。每样品点样2.5 μL,用DYY-6C型电泳仪在65 mA恒电流下电泳约2 h,取下凝胶在摇床上进行银染处理(固定液摇洗13 min;加AgNO3溶液,摇床银染 10 min;后再用双蒸水清洗2次,洗去残留的AgNO3;显色液倒入直至出现清晰的条带后终止反应,最后用双蒸水冲洗 2~3次),结果拍照保存。
1.3数据统计分析
利用SPSS 18.0软件对F1代个体表型性状进行遗传变异统计和分析。统计参数包括平均值、最大值、最小值、方差、标准差、偏度、峰度、变异系数,并绘制频率分布图。利用 Excel 对每对SSR引物扩增的多个等位位点上有带的赋值为“1”,无带的赋值为“0”。采用NTSYS-pc2.1软件按照非加权配对平均法(UPGMA)和SHAN程序进行聚类分析。统计等位位点数、多态性位点数和多态性信息含量(PIC)参数值,无多态性的条带未统计。采用SPSS 18.0对野核桃SSR标记基因型与株高、茎高、茎粗等性状进行连锁分析,利用Pearson相关系数判断SSR标记与株高、茎粗、最大叶长等相关性状的关联度是否显著。[HJ1.57mm]
2结果与分析
2.1F1代群体表型性状遗传变异
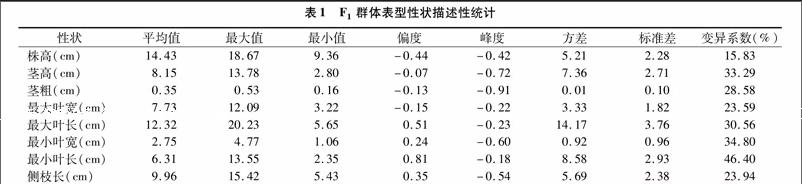
F1群体表型性状在个体间存在差异(表1)。其中,株高最大值是18.67 cm,最小值9.36 cm,标准差2.28 cm,变异系数15.83%。茎高最大值13.78 cm,最小值2.80 cm,标准差2.71 cm,变异系数33.29%。茎粗最大值0.53 cm,最小值 0.16 cm,标准差0.10 cm,变异系数28.58%。最大叶宽最大值12.09 cm,最小值3.22 cm,标准差1.82 cm,变异系数 23.59%。最大叶长最大值20.23 cm,最小值5.65 cm,標准差3.76 cm,变异系数30.56%。最小叶宽最大值4.77 cm,最小值1.06 cm,标准差0.96 cm,变异系数34.80%。最小叶长最大值13.55 cm,最小值2.35 cm,标准差2.93 cm,变异系数46.40%。侧枝长最大值15.42 cm,最小值5.43 cm,标准差2.38 cm,变异系数23.94%。F1个体间差异明显,不同表型性状的变异系数为15.83%~46.40%,变异程度最小的是株高,最大的为最小叶长。各个性状的变异均超过10%,说明个体间的表型值变异较大。
株高、茎高、茎粗、最大叶宽的偏度均为负值,分别为 -0.44、-0.07、-0.13、-0.15,表示柱形图向正态分布区域右侧偏斜。而最大叶长、最小叶宽、最小叶长、侧枝长的偏度均为正值,分别是0.51、0.24、0.81、0.35。其中,最小叶长峰度的绝对值最小,说明其离散程度最小,茎粗的峰度绝对值最大,说明其离散程度最大。8个表型性状的偏度和峰度的绝对值均小于1,符合正态分布的特点(表1、图1)。
2.2表型性状的相关性及主成分分析
2.2.1相关性分析
各性状之间除最小叶长外,相关性多数较明显,其中,株高与茎高、茎粗、最大叶宽及侧枝长呈极显著正相关,与最大叶长及最小叶宽呈显著正相关,与最小叶长的相关性不显著;茎高与株高、茎粗、最大叶宽及侧枝长呈极显著正相关,与最大叶长、最小叶长呈显著正相关,与最小叶宽相关性不显著;茎粗与株高、茎粗、最大叶宽、最大叶长及侧枝长呈极显著正相关,与最小叶宽呈显著相关,与最小叶长相关性不显著;最大叶宽与株高、茎高、茎粗、最小叶宽及侧枝长呈极显著正相关,与最大叶长、最小叶长相关性不显著;最大叶长与茎粗、最小叶长呈极显著正相关,与株高、茎高呈显著正相关,与最大叶宽、最小叶宽及侧枝长相关性不显著;最小叶宽与最大叶宽呈极显著正相关,与株高及茎粗呈显著正相关,与茎高、最大叶长、最小叶长及侧枝长相关性不显著;最小叶长与最大叶长呈极显著正相关,与茎高呈显著正相关,与其他指标相关性均不明显;侧枝长与株高、茎高、茎粗及最大叶宽呈极显著正相关,与其他指标相关性不显著(表2)。
2.2.2主成分分析
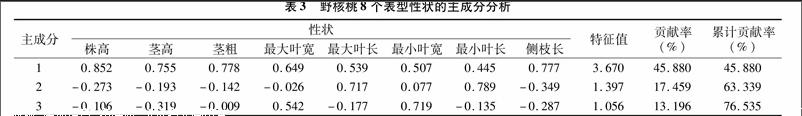
通过变异系数分析,表明野核桃表型性状差异大小不同,在此基础上,对8个表型性状进行了主成分分析,从而获得了这些性状之间的特征值、贡献率及累计贡献率。研究发现,前3个主成分的累积贡献率达到了76535%, 足以反映出原始因子所代表的大部分信息。在第1主成分中,株高、茎粗的绝对值较大;第2主成分中,最大叶长、最小叶长绝对值较大;第3主成分中,最小叶宽的绝对值较大(表3)。通过这3个主成分分析可以确定:株高、茎粗、最大叶长、最小叶长、最小叶宽这5个指标是引起野核桃表型差异较大的因子。
2.3野核桃SSR标记分析
试验利用13对SSR引物对野核桃进行分析,共筛选出10对多态性高的SSR引物,对60份野核桃种质群体进行扩增,并对等位位点数、多态位点数以及多态性信息含量(PIC)等进行多样性统计(表4)。10对SSR引物扩增得到的基因片段长度在100~450 bp, PCR 扩增总计得到35个等位变异位点,等位位点数在2~6之间,平均每对SSR引物可以检测到3.5个等位位点数。多态信息含量(PIC值)变化范围为0.332~0.736,平均为0.494。
2.4SSR聚类分析
通过10对多态性SSR引物分析,60份野核桃材料的遗传相似系数(GS)变异范围为0.51~0.95,平均值为0.642。其中个体1和3的GS值最大(0.85), 表明两者的亲缘关系很近。根据材料间的遗传相似系数,采用UPGMA法对野核桃[CM(25]种质进行聚类分析(图2),利用10对SSR标记将60份野核桃种质相互区分,在GS值为0.55水平上将所有的材料划分成Ⅰ、Ⅱ、Ⅲ、Ⅳ共4个组,Ⅰ组包括了36份种质材料,Ⅱ组包括6份种质材料,Ⅲ组则包括了7份种质材料,Ⅳ组包括11份种质材料。
2.5SSR标记与表型性状的连锁分析
标记与性状之间的连锁分析,是根据标记位点的基因型以及数量性状的表型对个体进行显著性检验,差异显著则说明标记与数量性状存在关联[15]。试验共检测到与8个表型性状相连锁的SSR标记位点5个,其中与茎粗相关的标记是SSR4,与最大叶长相关的标记有2个,分别是SSR5、SSR7;与最小叶宽相关的标记有2个,分别是SSR4、SSR9;与最小叶长相关的标记是SSR10(表5)。
3讨论
遗传多样性是种质资源研究、保护和开发利用的基础,不仅具有一定的理论意义,还具有重要的实际意义,对于揭示物种演化过程和进化潜能、了解群体遗传结构及多态性水平有重要价值,也为物种起源的研究、亲本的选配、品种的分类、保护等多个方面提供了依据。
3.1野核桃表型性状分析
表型性状具有直观性的特点,对遗传多样性的研究及物种演化过程和进化潜能、了解群体遗传结构及多态性有重要价值,并为物种起源研究、亲本的选配、品种的分类及保护等提供依据[16]。本试验通过对野核桃表型性状的研究,表明F1群体的8个表型性状均呈正态分布,且这些性状均可进行后续作图群体的QTL分析[17-18],也说明了这些性状可能为多基因控制的数量性状[19]。相关性分析表明,各性状之间除最小叶长外,其他性状相互之间相关性多显著或极显著,尤其是株高、茎高、茎粗、最大叶宽与其他性状之间,以及它们相互之间的相关性多显著或极显著。变异系数结果表明个体间差异明显,不同表型性状的变异系数在15.83%~46.40%之间,变异程度最小的是株高(15.83%),最大的为最小叶长(4640%)。各个性状的变异均超过10%,说明个体间的表型值变异较大,反映出即使是同一条件下,由于遗传漂变、自然选择、基因突变、基因流等遗传变异因素的影响,个体的表型仍有较大的差异,同时也说明,表型具有可塑性,由生境及内部遗传变异共同影响[20-21]。为了进一步探究引起野核桃表型变异的主要因素,进行了主成分分析,结果表明,株高、茎粗、最大叶长、最小叶长、最小叶宽这5个指标是引起野核桃表型差异较大的因子,可以为以后野核桃的相关研究提供依据,丰富的表型性状多样性为野核桃的品种选育和遗传育种的亲本选择提供了丰富的种质资源。
3.2野核桃SSR遗传多样性分析
SSR标记可从DNA水平上鉴定杂种真伪,具备周期短、重复性高、不受时间和生长环境影响等优点。利用该方法辅助选择杂种,可提高真杂种的选择效率,有助于促进育种进程。另外,SSR标记具备鉴定苗期真杂种的特点,所以利用SSR标记辅助创建遗传群体,可以确保所创建群体遗传来源的可靠性[22]。本试验对单个群体中的个体进行了聚类分析,结果表明,60个个体分成4大类,亲缘关系最近的只有1对,即个体1号和5号,表明不同的单株之间即使给予相同的外部条件进行培养,其遗传多样性仍较为丰富。因此,可以得知各个单株即使分布在很近的地域范围,同处在相同或相近的气候和地域环境条件下,各自的遗传背景却仍存在一定的多样性[23]。
3.3野核桃表型性状与SSR标记相关性分析
本研究中通过对60份野核桃种质资源基于遗传距离的聚类分析,在GS值0.54水平上将所有的材料划分成Ⅰ、Ⅱ、Ⅲ、Ⅳ共4组,说明野核桃不同单株之间存在较大的遗传差异。进一步研究发现,表型性状分析与SSR标记分析聚类的结果具有显著或极显著的相关性。岁立云等在对中华称猴桃和美味称猴桃红肉类型称猴桃调查研究中发现,2种称猴桃亲缘关系较近,有按地理来源优先聚类的趋势,且果实性状数据和AFLP数据之间具有极显著的相关性[24]。这说明同一个地理地域来源的野核桃种质资源SSR分子标记上的遗传多样性在一定程度上可以反映表型性状上的多样性。
总之,本试验通过对野核桃表型形态及SSR标记的综合研究,发现野核桃的表型形态丰富,不仅是受到自然选择、环境等因素的影响,同时也是遗传变异所导致的结果。因此,今后在对野核桃进行品种改良和遗传育种工作过程中,其表型性状和分子标记上表现出的丰富的遗传变异,可以为野核桃繁育、改良及产业发展提供有价值的参考依据。
参考文献:
[1]Zilber-Rosenberg I,Rosenberg E. Role of microorganisms in the evolution of animals and plants:The hologenome theory of evolution[J]. Fems Microbiology Reviews,2008,32(5):723-735.
[2]周文才,侯静,郭炜,等. 基于SSR标记的美洲黑杨杂交子代的鉴定[J]. 南京林业大学学报(自然科学版),2015(3):45-49.
[3]赵波,叶剑,金文林,等. 不同类型小豆种质SSR标记遗传多样性及性状关联分析[J]. 中国农业科学,2011,44(4):673-682.[HJ1.65mm]
[4]张军,赵团结,盖钧镒. 大豆育成品种农艺性状QTL与SSR标记的关联分析[J]. 作物学报,2008,34(12):2059-2069.
[5]Yamamoto T,Shimada T S,Imai T,et al. Characterization of morphological traits based on a genetic linkage map in peach[J]. Breeding Science,2001,51(4):271-278.
[6]陈氏秋江,党小景,刘强明,等. 水稻籽粒性状的SSR关联分析[J]. 中国水稻科学,2014(3):243-257.
[7]Aranzana M J,Abbassi E K,Howard W,et al. Genetic variation,population structure and linkage disequilibrium in peach commercial varieties[J]. BMC Genetics,2010,11(11):69.
[8]Barnaud A,Lacombe T,Doligez A. Linkage disequilibrium in cultivated grapevine,Vitis vinifera L.[J]. Theoretical and Applied Genetics,2006,112(4):708-716.
[9]季维智,宿兵. 遗传多样性研究原理与方法[M]. 杭州:浙江科技出版社,1999.
[10]Booy G,Hendriks R J J,Smulders M J M,et al. Genetic diversity and the survival of population[J]. Plant Biology,2000,2(4):379-395.
[11]王肇延. 新疆野核桃资源及遗传多样性的分析[D]. 乌鲁木齐:新疆农业大学,2011.
[12]王磊,李霞,杨辽,等. 新疆野核桃种质资源数量分类研究[J]. 北方园艺,1998(1):5-7.
[13]袁海涛. 新疆野核桃种质资源基础数据库的建立与核心种质构建方法研究[D]. 乌鲁木齐:新疆农业大学,2012.
[14]张维,焦子伟,尚天翠,等. 新疆西天山峡谷海拔梯度上野核桃种群统计与谱分析[J]. 应用生态学报,2015,26(4):1091-1098.
[15]Ovilo C,Pérezenciso M,Barragán C,et al. A QTL for intramuscular fat and back fat thickness is located on porcine chromosome 6[J]. Mammalian Genome,2000,11(4):344-346.
[16]解新明,云錦凤. 植物遗传多样性及其检测方法[J]. 中国草地,2000(6):51-59.
[17]赵文明,孟庆雷,王付娟,等. 玉米株型主要性状作图群体分析[J]. 安徽农业科学,2007,35(31):9876-9877.
[18]李博. 毛白杨与毛新杨转录组图谱构建及若干性状的遗传学联合分析[D]. 北京:北京林业大学,2009.
[19]张红梅,刘小红,罗绮,等. 玉米RIL群体的主要株型性状调查研究[J]. 吉林农业科学,2009,34(5):10-11,17.
[20]Nevo E. Evolution of genome-phenome diversity under environmental stress[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(11):6233-6240.
[21]Li J Q,Guo Y S,Franois R. Environmental hetetogeneity and population variability of sclerophyllous oaks(Quercus sec. suber)in East Himalayan region[J]. Forestry Studies in China,2000,2(1):1-15.
[22]陈静,胡晓辉,石运庆,等. 花生品种间杂种F1代的SSR标记分析[J]. 核农学报,2009,23(4):617-620,625.
[23]汤佳乐,黄春辉,吴寒,等. 野生毛花猕猴桃果实表型性状及SSR遗传多样性分析[J]. 园艺学报,2014,41(6):1198-1206.
[24]岁立云,刘义飞,黄宏文. 红肉猕猴桃种质资源果实性状及AFLP遗传多样性分析[J]. 园艺学报,2013,40(5):859-868.

