卵巢颗粒细胞中胰岛素和雄激素对芳香化酶和5α-还原酶1影响的研究
张璐,李安迪,2,杨楠,2,蒋葭葭,孙玉洁,2*
(1.南京医科大学基础医学院细胞生物学系,南京 211166;2.江苏省人类功能基因组学重点实验室,南京 211166)
卵巢颗粒细胞中胰岛素和雄激素对芳香化酶和5α-还原酶1影响的研究
张璐1,李安迪1,2,杨楠1,2,蒋葭葭1,孙玉洁1,2*
(1.南京医科大学基础医学院细胞生物学系,南京 211166;2.江苏省人类功能基因组学重点实验室,南京 211166)
目的 研究卵巢颗粒细胞中胰岛素对睾酮激素转化过程的影响。 方法 选用人卵巢颗粒细胞瘤样细胞系(KGN)作为研究对象。应用RT-PCR分析KGN细胞在梯度睾酮(1.25、2.5、5、10、20 ng/ml)及胰岛素(1、10、100 ng/ml)处理4 h后CYP19a1和5RD5A1 mRNA水平;Western-blot检测高浓度睾酮(10、20 ng/ml)及梯度胰岛素处理KGN细胞24 h后芳香化酶和5α-还原酶1蛋白水平;同步收集上清,应用放射性免疫法及酶联免疫法检测培养液上清睾酮、雌二醇及双氢睾酮的浓度。 结果 胰岛素剂量依赖性地上调CYP19a1的表达和活性,增加睾酮向雌二醇的转化;同时抑制5RD5A1的表达和活性,抑制睾酮向双氢睾酮的转化;转化比例改变但消耗水平不变,导致睾酮的异常累积。 结论 高雄激素环境下,胰岛素可通过影响睾酮转化酶促使睾酮转化异常。本实验为高胰岛素及高雄激素水平在卵巢微环境相互作用加剧PCOS病程提出了可能的机制。
颗粒细胞瘤样细胞系; 胰岛素; 睾酮; 芳香化酶; 5α-还原酶1
(JReprodMed2017,26(7):711-717)
在卵巢颗粒细胞中,睾酮不仅可以向雌二醇转化,也可向双氢睾酮转化。5α-还原酶1是将卵巢和其他组织中的睾酮转化为双氢睾酮的关键酶,由5RD5A1基因所编码。5RD5A1发挥功能的最适pH比较广泛[14-15],而5RD5A2是在一个狭窄的酸性最适pH下发挥功能[15-16],在卵巢中5α-还原酶1为主要作用酶。5α-还原酶1表达水平和活性降低会导致睾酮向双氢睾酮的转化被抑制,因而推断可能这条转化途径发生异常导致PCOS患者卵巢局部出现睾酮异常累积。另据报道,大约60%~70%的PCOS患者具有胰岛素抵抗的症状并伴随有代偿性的高胰岛素血症[17-18],卵泡在高胰岛素环境下对FSH刺激的敏感性明显增强,使颗粒细胞合成过多的雌二醇。而胰岛素对于睾酮向双氢睾酮转化的影响目前缺少明确报道。PCOS患者具有高雄激素水平的同时也伴随着高胰岛素水平,因而猜想高胰岛素水平能够导致雄激素转化异常,本研究选择卵巢颗粒细胞瘤样细胞系作为研究对象,探讨高胰岛素水平是否在促进睾酮向雌二醇转化的同时抑制睾酮向双氢睾酮的转化导致睾酮的异常累积。
材料和方法
一、材料
1.研究对象:人颗粒细胞瘤样细胞系(Human granulose-like tumor cell line,KGN),由母义明教授惠赠。
2.主要试剂:DMEM/F12(1:1)培养基(GIBCO,美国);胎牛血清(GIBCO,美国);β-Actin抗体(Sigma,美国);芳香化酶抗体(Santa Cruz,美国);5α-还原酶1抗体(Abcam,美国);HRP标记的羊抗兔IgG二抗(Santa Cruz,美国);HRP标记的羊抗鼠IgG二抗(Santa Cruz,美国);HRP标记的兔抗羊IgG二抗(Santa Cruz,美国);睾酮,胰岛素(Sigma,美国)。
二、方法
1.人颗粒细胞瘤样细胞系KGN培养:KGN细胞以10%胎牛血清的DMEM/F12培养基(青霉素200 U/ml;链霉素100 μg/ml)条件培养于37 ℃、5% CO2培养箱中。细胞密度达到90%时,应用含0.02% 乙二胺四乙酸(EDTA)·Na2的0.1% 胰酶消化,终止消化后细胞以3×105个/孔种于3.5 cm皿中。待细胞贴壁后,换含0.2% BSA的无酚红的DMEM/F12饥饿培养12 h。分别按照空白对照组、梯度浓度胰岛素(1、10、100 ng/ml)处理组、梯度浓度睾酮(1.25、2.5、5、10、20 ng/ml)进行加药,处理4 h和24 h用于检测CYP19a1和5RD5A1 mRNA及蛋白水平的变化;睾酮 (10、20 ng/ml)和胰岛素(1、10、100 ng/ml)合并处理4 h及24 h进行相同检测;24 h组同步检测培养液上清中睾酮、雌二醇及双氢睾酮的浓度。
对于物流配送企业来说,在高水平地满足客户对时间要求的前提下实现配送成本最低是其追求的主要目标,这就需要通过物流配送路径优化来实现。从配送中心到特定客户配送活动可以通过运用科学的物流配送路径优化,实现企业的人工调度和车辆安排合理化,使得其运作效率更高的情况下,配送成本也能够得到很好的控制,使物流配送企业获得更有持续发展能力、更健康的发展前景。
2.RNA提取和实时荧光定量聚合酶链反应(Real-time PCR):采用Trizol法提取RNA,测浓度后以500 ng为模板按照逆转录试剂盒(PrimeScriptTMRT Master Mix,TAKARA,日本)说明书进行逆转录,获得cDNA。以cDNA为模板进行RT-PCR,检测CYP19a1和5RD5A1 mRNA表达水平。Real-time PCR按照(Roche Fast Start Universal SYBR Green Master,Roche,瑞士)说明书进行,计算方法如下:ΔCt=Ct(目的基因)—Ct Actin;ΔΔCt=ΔCt(处理组)—ΔCt(对照组);转录水平=2-ΔΔCt×100%。引物合成序列如表1所示。
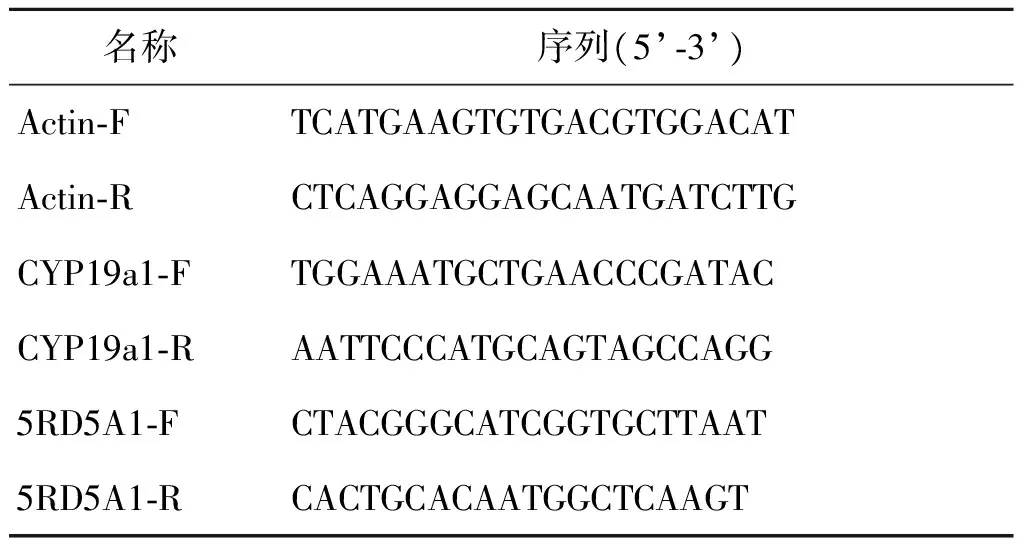
表1 引物序列
3.蛋白质印迹检测(Western blot):细胞经RIPA裂解液裂解提取蛋白,全程在冰上操作,运用BCA蛋白检测法对蛋白进行定量检测,经SDS-PAGE电泳后转PVDF膜,室温5%脱脂牛奶封闭1 h。然后加入一抗4℃孵育过夜,再加入HRP标记的二抗室温孵育1 h。化学发光成像系统(Chemiscope 350V,上海勤翔)检测,Quantity One软件对条带进行灰度扫描检测。目的蛋白的灰度值除以内参蛋白的灰度值校正误差,得到目的蛋白相对表达量。
4.放射性免疫实验及酶联免疫吸附实验:处理细胞的上清液经收集后以12 000 r/min在4℃离心10 min,取上清分装冻存在-80℃。睾酮及雌二醇水平采用I125标记的放射性免疫法测定,依照购于中国北方生物技术有限公司试剂盒说明书,使用γ测量仪检测。双氢睾酮采用酶联免疫吸附试验检测,按说明书的步骤使用酶标仪检测(BioTek,美国),检测试剂盒购于美国ALPCO公司。
三、统计学方法
实验数据应用SPSS 20.0进行统计学分析。多组间比较采用单因素方差分析(one-way ANOVA)进行比较,组内两两之间比较采用q检验;以P≤0.05为差异有统计学意义。
结 果
一、胰岛素对KGN细胞CYP19a1和5RD5A1表达的影响
使用单纯的梯度浓度胰岛素(1、10、100 ng/ml)处理KGN细胞4 h,胰岛素浓度的选择以低于、近似及高于人的生理浓度胰岛素为参照[19]。结果发现10及100 ng/ml的胰岛素能够显著上调CYP19a1的mRNA表达(P<0.05),而5RD5A1的mRNA表达没有明显变化(P>0.05)(图1A);梯度浓度的胰岛素处理KGN细胞24 h时,检测芳香化酶以及5α-还原酶1的蛋白表达水平(图1B),胰岛素(10、100 ng/ml)能够上调芳香化酶蛋白水平的表达(P<0.05),而且剂量依赖性下调5α-还原酶1蛋白水平的表达(P<0.05)(图1C)。结果提示,胰岛素上调CYP19a1 mRNA和蛋白水平的表达,对5RD5A1的mRNA水平无显著影响,但能够抑制其蛋白水平的表达。

A:Real-time PCR检测梯度浓度胰岛素处理KGN细胞4 h后 CYP19a1及5RD5A1 mRNA水平;B~C:Western blot检测梯度浓度胰岛素处理KGN细胞24 h的芳香化酶和5-α还原酶1的蛋白水平;与胰岛素0 ng/ml处理组比较,*,#P<0.05,**,##P<0.01 图1 胰岛素处理KGN细胞中CYP19a1和 5RD5A1 mRNA及蛋白水平
二、睾酮对KGN细胞CYP19a1及5RD5A1表达的影响
应用梯度浓度睾酮(1.25、2.5、5、10、20 ng/ml)处理KGN细胞4 h,CYP19a1的mRNA水平呈睾酮剂量梯度依赖性升高,在5、10、20 ng/ml剂量组均有显著上升(P<0.05);而5RD5A1的mRNA并没有明显变化(P>0.05)(图2A)。同样的,选取梯度浓度睾酮处理KGN细胞24 h,检测睾酮对芳香化酶及5α-还原酶1蛋白水平的影响(图2B),结果显示随着浓度的升高,睾酮对芳香化酶及5α-还原酶1均显示剂量依赖性上调作用(P<0.05)(图2C)。

A:Real-time PCR检测梯度浓度睾酮处理KGN细胞4 h后CYP19a1和5RD5A1的mRNA水平;B~C:Western blot检测梯度浓度睾酮处理KGN细胞24 h芳香化酶及5α-还原酶1的表达水平;与睾酮0 ng/ml处理组比较,*,#P<0.05,**,##P<0.01睾酮换算至法定单位nmol/L,系数为0.0347图2 睾酮处理KGN细胞中CYP19a1和 5RD5A1 mRNA及蛋白水平
三、高雄激素环境下,胰岛素对KGN细胞CYP19a1及5RD5A1表达的影响
使用高浓度睾酮(10、20 ng/ml)模拟高雄激素环境,合并梯度浓度胰岛素(1、10、100 ng/ml)处理KGN细胞4 h和24 h,检测CYP19a1和5RD5A1的mRNA及蛋白水平的表达。结果显示高浓度睾酮存在的情况下,胰岛素处理能够进一步剂量依赖性上调CYP19a1基因的表达(P<0.05)(图3A);同时剂量依赖性下调5RD5A1 mRNA的表达(图3B)。与mRNA结果一致,Western blot(图3 C、D、E)结果显示高胰岛素浓度能够促进芳香化酶蛋白水平的表达(P<0.05),且在睾酮20 ng/ml处理组更明显;同时剂量依赖性抑制5α-还原酶1蛋白水平的表达(P<0.05),同样在高浓度睾酮20 ng/ml处理组更为明显。
四、高雄激素环境下胰岛素对睾酮转化作用的影响
在睾酮(10、20 ng/ml)合并梯度浓度胰岛素(1、10、100 ng/ml)处理24 h情况下,同步收集了细胞培养上清,检测睾酮及睾酮的两个转化产物(雌二醇和双氢睾酮)的水平。结果显示,上清中雌二醇的水平随着胰岛素浓度呈剂量依赖性增加(P<0.05)(图4C);双氢睾酮的浓度在睾酮(20 ng/ml)处理时随着胰岛素浓度增高而降低(P<0.05)(图4B);而细胞培养上清未经转化的剩余睾酮浓度在梯度胰岛素处理的情况下并没有明显的差异(P>0.05)(图4A)。
讨 论
PCOS是影响育龄期妇女最常见的内分泌紊乱性疾病,主要表现在雄激素过多及排卵功能障碍,同时也存在胰岛素抵抗及高胰岛素血症等代谢异常。目前胰岛素抵抗在PCOS作用多集中在外周及经典的靶器官,卵巢局部雄激素水平与胰岛素抵抗的相互关系仍待研究。
胰岛素抵抗被认为是PCOS发病的核心因素,具有胰岛素抵抗的患者会伴随有代偿性的高胰岛素血症。据报道,PCOS患者外周血中的胰岛素水平和雄激素水平呈正相关关系[20],然而两者在卵泡液中的相关性并不明确。高水平的胰岛素可以刺激促性腺激素细胞激活而介导雌鼠不育;抑制胰岛素信号之后可以明显改善肥胖诱导的雌鼠不育[21]。在卵巢中,胰岛素的作用包括促进激素合成、刺激葡萄糖代谢、影响基因转录等。据报道,高胰岛素能够直接刺激卵巢膜细胞中雄激素合成酶—P450C17,促进雄激素生成[12];同时能够降低雄激素结合球蛋白的产生[9],从而增加游离睾酮的浓度。其机制可能是通过胰岛素作用于垂体的胰岛素受体,增强黄体生成素释放并促进卵巢[10]和肾上腺[11]分泌雄激素。另有实验证实二甲双胍—胰岛素增敏剂—可改善高胰岛素血症,进而降低雄激素水平,最终导致雌二醇水平的降低,促进卵泡有序生长[7,22]。在卵巢颗粒细胞中,胰岛素能够上调芳香化酶的表达,促进睾酮向雌二醇的转化[23],而这种刺激作用可能是由胰岛素生长因子受体直接调节的。

A:Real-time PCR检测高浓度睾酮合并胰岛素处理KGN细胞中CYP19a1的mRNA水平;B:Real-time PCR检测高浓度睾酮合并胰岛素处理KGN细胞中5RD5A1的mRNA水平;C~E:Western blot检测高雄激素水平下胰岛素处理KGN细胞的芳香化酶及5α-还原酶1的表达水平;与胰岛素0 ng/ml处理组比较,*,#P<0.05,**,##P<0.01,睾酮换算至法定单位nmol/L,系数为0.0347图3 高雄激素环境下胰岛素处理KGN细胞中CYP19a1和5RD5A1 mRNA和蛋白水平

A:培养液上清中睾酮的浓度;B:培养液上清中双氢睾酮的浓度;C:培养液上清中雌二醇的浓度;与胰岛素0 ng/ml处理组比较,*,#P<0.05,**,##P<0.01 睾酮换算至法定单位nmol/L,系数为0.0347图4 高雄激素环境下胰岛素对睾酮转化作用的影响
高胰岛素与高雄激素血症一直是研究的热点。睾酮也会影响到一些组织和细胞的胰岛素敏感性,在培养女性脂肪细胞和子宫内膜细胞时发现睾酮能够降低细胞对葡萄糖的摄取,不论是在胰岛素基底水平还是较高水平都有这种作用[24-25]。所以高胰岛素和高雄激素之间是相互影响的。雄激素对于卵巢正常功能的发挥和女性生殖能力是必须的,对卵泡募集和生长具有促进作用,但过量的雄激素可致大量卵泡闭锁。在高浓度的睾酮长期处理的鼠模型中,出现了大量卵泡闭锁的现象[4],与PCOS妇女人群出现的多囊卵巢类似。关于PCOS的高雄激素血症的发病机制目前有多种解读,主要为高胰岛素血症、卵巢膜细胞的活性过度增强造成的雄激素合成过多。而本研究对睾酮的转化与高雄激素水平的维持增加了新的认识。
总之,本研究结果表明,在高雄激素环境的卵巢颗粒细胞中,高胰岛素一方面上调CYP19a1基因和蛋白的表达,促进睾酮向雌二醇的转化;另一方面抑制5RD5A1基因和蛋白的表达,睾酮向双氢睾酮的转化被抑制;睾酮转化成雌二醇和双氢睾酮的比例改变,但消耗并未增加,造成睾酮的异常“累积”。根据本结果可以推断,卵巢局部高胰岛素是导致卵巢局部维持高雄激素水平和高雌激素水平的重要诱因,为PCOS患者卵巢局部的高雄激素微环境的产生提出了新的机制,未来可在临床中进行进一步的验证。
[1] Azziz R,Woods KS,Reyna R,et al.The prevalence and features of the polycystic ovary syndrome in an unselected population[J].J Clin Endocrinol Metab,2004,89:2745-2749.
[2] Knochenhauer ES,Key TJ,Kahsar-Miller M,et al.Prevalence of the polycystic ovary syndrome in unselected black and white women of the southeastern United States:a prospective study[J].J Clin Endocrinol Metab,1998,83:3078-3082.
[3] Azziz R,Sanchez LA,Knochenhauer ES,et al.Androgen excess in women:experience with over 1000 consecutive patients[J].J Clin Endocrinol Metab,2004,89:453-462.
[4] Sen A,Prizant H,Light A,et al.Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microRNA-125b expression[J].Proc Natl Acad Sci USA,2014,111:3008-3013.
[5] Chen MJ,Chou CH,Chen SU,et al.The effect of androgens on ovarian follicle maturation:Dihydrotestosterone suppress FSH-stimulated granulosa cell proliferation by upregulating PPARgamma-dependent PTEN expression[J].Sci Rep,2015,5:18319.
[6] Carmina E,Lobo RA.Prevalence and metabolic characteristics of adrenal androgen excess in hyperandrogenic women with different phenotypes[J].J Endocrinol Invest,2007,30:111-116.
[7] Moran C,Knochenhauer E,Boots LR,et al.Adrenal androgen excess in hyperandrogenism:relation to age and body mass[J].Fertil Steril,1999,71:671-674.
[8] Chen MJ,Yang WS,Chen CL,et al.The relationship between anti-Mullerian hormone,androgen and insulin resistance on the number of antral follicles in women with polycystic ovary syndrome[J].Hum Reprod,2008,23:952-957.
[9] Barnes RB,Rosenfield RL,Burstein S,et al.Pituitary-ovarian responses to nafarelin testing in the polycystic ovary syndrome[J].N Engl J Med,1989,320:559-565.
[10] Suikkari AM,MacLachlan V,Montalto J,et al.Ultrasonographic appearance of polycystic ovaries is associated with exaggerated ovarian androgen and oestradiol responses to gonadotrophin-releasing hormone agonist in women undergoing assisted reproduction treatment[J].Hum Reprod,1995,10:513-519.
[11] Ibanez L,Hall JE,Potau N,et al.Ovarian 17-hydroxyprogesterone hyperresponsiveness to gonadotropin-releasing hormone (GnRH) agonist challenge in women with polycystic ovary syndrome is not mediated by luteinizing hormone hypersecretion:evidence from GnRH agonist and human chorionic gonadotropin stimulation testing[J].J Clin Endocrinol Metab,1996,81:4103-4107.
[12] Ryan KJ,Smith OW.Biogenesis of steroid hormones in the human ovary[J].Recent Prog Horm Res,1965,21:367-409.
[13] Dumesic DA,Abbott DH.Implications of polycystic ovary syndrome on oocyte development[J].Semin Reprod Med,2008,26:53-61.
[14] Jenkins EP,Hsieh CL,Milatovich A,et al.Characterization and chromosomal mapping of a human steroid 5 alpha-reductase gene and pseudogene and mapping of the mouse homologue[J].Genomics,1991,11:1102-1112.
[15] Jenkins EP,Andersson S,Imperato-McGinley J,et al.Genetic and pharmacological evidence for more than one human steroid 5 alpha-reductase[J].J Clin Invest,1992,89:293-300.
[16] Wilson JD,Griffin JE,Russell DW.Steroid 5 alpha-reductase 2 deficiency[J].Endocr Rev,1993,14:577-593.
[17] Russell DW,Wilson JD.Steroid 5 alpha-reductase:two genes/two enzymes[J].Annu Rev Biochem,1994,63:25-61.
[18] Russell DW,Berman DM,Bryant JT,et al.The molecular genetics of steroid 5 alpha-reductases[J].Recent Prog Horm Res,1994,49:275-284.
[19] Poretsky L,Seto-Young D,Shrestha A,et al.Phosphatidyl-inositol-3 kinase-independent insulin action pathway(s) in the human ovary[J].J Clin Endocrinol Metab,2001,86:3115-3119.
[20] Moran LJ,Teede HJ,Noakes PM,et a1.Sex hormone binding globulin,but not testosterone,is associated with the metabolic syndrome in overweight and obese women with polycystic ovary syndrome[J].J Endocrinol Invest,2013,36:1004-1010.
[21] Brothers KJ,Wu S,DiVall SA,et al.Rescue of obesity-induced infertility in female mice due to a pituitary-specific knockout of the insulin receptor[J].Cell Metab,2010,12:295-305.
[22] Fedorcsak P DP,Storeng R,Tanbo T,et al.The impact of obesity and insulin resistance on the outcome of IVF or ICSI in women with polycystic ovarian syndrome[J].Hum Reprod,2001,16:1086-1091.
[23] Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group.Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J].Fertil Steril,2004,81:19-25.
[24] Smith OW,Ofner P,Vena RL.In vitro conversion of testosterone-4-14C to androgens of the 5alpha-androstane series by a normal human ovary[J].Steroids,1974,24:311-315.
[25] McNatty KP,Makris A,Reinhold VN,et al.Metabolism of androstenedione by human ovarian tissues in vitro with particular reference to reductase and aromatase activity[J].Steroids,1979,34:429-443.
[编辑:罗宏志]
《生殖医学杂志》与明锐思成(北京)信息科技有限公司深度合作
《生殖医学杂志》编辑委员会与明锐思成(北京)信息科技有限公司双方进行深度战略合作,利用各自在其业务领域的优势,在内容建设、学术推广、媒体宣传、活动会议等方面进行广泛全面合作。
生殖医学空间
生殖医学空间是生殖医学领域关注人数最多、最有影响力的微信公众平台之一,生殖医学空间致力于为生殖专科医生提供最前沿的生殖资讯会议信息、最实用的临床诊疗干货、最有价值的专家经验分享、最丰富的行医心路历程。

好孕帮医生版APP
好孕帮医生版APP是一款专注为生殖医学专科医生服务的移动客户端,提供患者管理、随诊转诊、学术交流、会议播报等功能,是生殖医学专科医生临床与科研的有力助手。

欢迎广大读者注册关注。
《生殖医学杂志》编辑部
Double-faced functions of insulin on CYP19a1 and 5RD5A1 under hyperandrogenism in ovarian granulosa cell
ZHANGLu1,LIAn-di1,2,YANGNan1,2,JIANGJia-jia1,SUNYu-jie1,2*
1.DepartmentofCellBiology,NanjingMedicalUniversity,Nanjing2111662.KeyLaboratoryofHumanFunctionalGenomicsofJiangsuProvince,Nanjing211166
Objective:To explore the effect of insulin on the aromatase (CYP19A1) and 5α-reductase1 (5RD5A1) under hyperandrogenism during the process of testosterone (T) transformation.
Methods:The mRNA expression levels of CYP19A1 and 5RD5A1 were measured by quantitative real-time PCR after 4 hours treatment of gradient insulin(1,10,100 ng/ml)and T (1.25,2.5,5,10,20 ng/ml) in KGN cells,and the protein expression of aromatase and 5α-reductase1 were detected by Western blot.Meantime,the supernatants of the cells were collected,and then T and estradiol(E2) levels were detected by radioactive immunoassay (RIA),and dihydrotestosterone (DHT) was measured with enzyme linked immunosorbent assay (ELISA).
Results:Insulin enhanced the aromatase expression in a concentration dependent manner.And this effect was elevated under the environment of high levels of T (10 and 20 ng/ml),thus increasing the conversion of T to E2.Meanwhile,higher concentration of insulin suppressed the conversion of T to DHT through down-regulation of 5RD5A1 mRNA and protein level.The double effects lead to abnormal accumulation of testosterone.
Conclusions:High level of insulin defects T transformation process by affecting the aromatase and 5α-reductasse1.Our data offered a possible mechanism which interaction between hyperinsulinemia and hyperandrogenism exacerbates polycystic ovary syndrome (PCOS) condition.
KGN cell; Insulin; Aromatase; 5α-reductase 1; Testosterone
10.3969/j.issn.1004-3845.2017.07.018
2017-03-06;
2017-03-19
国家科技部重点973 项目(2012CBA01306)
张璐,女,山东滕州人,硕士,细胞生物学专业.(*
,Email:yujiesun@njmu.edu.cn)

