腺病毒冻干条件的改进研究
傅晖+顾菁

摘 要 目的:提高腺病毒制品的稳定性。方法:采用冷冻干燥技术制备腺病毒冻干制剂。结果:腺病毒冻干制品在 4 ℃放置12个月,活性(病毒滴度)下降不超过10%。结论:改进后的腺病毒冻干制剂在临床上作为基因治疗的载体有较好的应用前景。
关键词 腺病毒 冷冻干燥 稳定性
中图分类号:R944 文献标识码:A 文章编号:1006-1533(2017)13-0067-03
Preliminary research for the preparation of adenovirus lyophilized reagent
FU Hui*, GU Jing
(Shanghai Sunway Biotech Co., Ltd., Shanghai 201206, China)
ABSTRACT Objective: To improve the stability of adenovirus in lyophilized reagent. Methods: Adenovirus reagent was lyophilized by freeze-drying method. Results: The activity of adenovirus was decreased less than 10% in lyophilized reagent after it was stored at 4 ℃ for 12 months. Conclusion: The improved adenovirus lyophilized reagent possesses better application prospects in clinic as a vector for gene therapy.
KEY WORDS adenovirus; freeze-drying; stability
随着基因治疗研究的逐渐深入,作为其基础的病毒载体研究有了突飞猛进的发展。采用病毒载体的基因转移技术治疗人类疾病不仅在进行实验室研究,而且已进入到临床试验阶段[1]。腺病毒因其对人致病性小且不诱导癌变,宿主细胞广,繁殖滴度高,装载容量大,而成为近年来病毒载体研究热点[2-3]。但是腺病毒制品对温度较为敏感,给运输、保存带来較大困难,这在很大程度上限制了其在临床上的应用[4]。作为一种传统技术,冷冻干燥广泛应用于食品、医药、疫苗等[5-8],采用此技术可较好地保持产品原有的理化性质和生物活性,且有效成分损失极少,产品因含水量低而易于长期保存。近年来,国外陆续出现将冷冻干燥技术应用到病毒疫苗及腺病毒制剂研究中的报道[9-11]。目前腺病毒的保存条件为PBS缓冲液于-20 ℃以下保存,经我们研究发现,在这种条件下的腺病毒在25 ℃保存8 h及4 ℃保存24 h活性均下降10倍左右,而且反复冻融也会大大降低它的病毒滴度。为此我们做了冷冻干燥的条件改进研究,以便更好地方便临床应用。
1 材料与方法
1.1 材料
蔗糖(分析纯,Sigma公司);甘露醇注射液(药用辅料,浙江东华生物科技有限公司);明胶(BR,上海明胶厂);L-半胱氨酸(原料药,成都嘉叶生物科技有限公司);人血白蛋白(莱氏血制品公司)。
LYO-0.5冷冻真空干燥机(上海东富龙科技股份有限公司);UV1800紫外分光光度计(岛津公司);XSP200生物显微镜(深圳市西派克光学仪器有限公司)。
1.2 方法
采用传统冷冻干燥方法,先将制品在-40 ℃条件下预冻至-35 ℃,真空度为2.3 Pa,每 2 h温度上升 5 ℃,至 28 ℃左右保持 3 h。冻干保护剂组分为:4%明胶、5%甘露醇、20%人血白蛋白及蔗糖,本研究通过改变冻干保护剂中蔗糖浓度(1%、3%、5%)制备成不同的腺病毒样品冷冻干燥,比较冻干前后腺病毒颗粒数及活性变化,从而选择理想的冻干保护剂。
1.3 稳定性研究
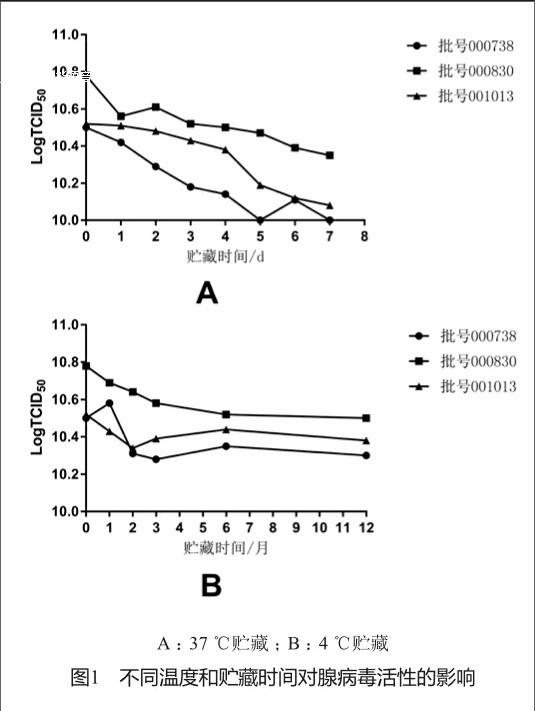
该腺病毒冻干制品保存条件为-20 ℃以下,为了研究冻干制剂与我们现有工艺(水针剂-20 ℃保存)的质量比较,我们选择了加速实验,根据《中国药典》2015年版“稳定性实验指导原则”,我们选择了一个高温实验(人体温度37 ℃),另一个选择了上述指导原则规定的低温保存药品的加速试验温度(4 ℃),具体稳定性研究方案如下:
将腺病毒冻干制品置于37 ℃贮藏1~7 d,比较其活性变化。
将腺病毒冻干制品置于4 ℃,贮藏1、2、3、6和12个月,比较其活性变化。
1.4 活性检测方法
用TCID50方法检测活性:根据病毒颗粒数稀释样品,在96 孔板上每孔加入100 ml各梯度稀释液,每个梯度重复8孔,另留8孔作为空白对照,然后每孔加入293细胞悬液100 ml,细胞密度:5.0×105个/ml。置37 ℃、5% CO2浓度的培养箱内培养14 d,用Karber法计算病毒滴度,计算公式为:lgTCID50=L-D(S-0.5) 。式中L为最高稀释度的对数;D为稀释度对数之间的差;S为阳性孔比率总和。
用OD260法检测病毒颗粒数。样品中加入裂解液,以紫外分光光度计测260 nm吸光度值。依公式:腺病毒颗粒/ml=A值×稀释倍数×1012计算腺病毒颗粒数。
2 结果
2.1 冻干可行性研究
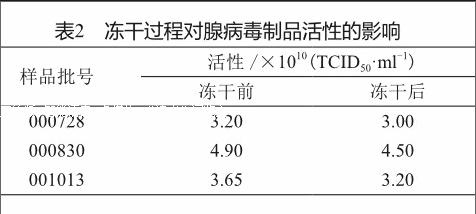
通过改变冻干保护剂的糖浓度对冻干制品的影响发现(表1),当冻干保护剂中蔗糖浓度为3%时,既能保证腺病毒冻干制品水分合格,又能保证其病毒颗粒数及活性处于较高的状态,并经3次冻干实验,发现冻干前后制品活性变化较小(表2),认为腺病毒冻干制品的研究是有可行的。


2.2 稳定性研究
对3批腺病毒冻干制品进行37 ℃高温实验,发现在37 ℃放置7 d,活性下降不超过10%。4 ℃加速实验发现,在4 ℃放置12 个月,活性下降也不超过10%(图1)。
3 讨论
腺病毒的外壳由 252 个亚单位组成,腺病毒的亚单位在冻干时需维持其本身结构才能有效保持其活性[12-13]。影响腺病毒冻干保存效果的因素很多,例如保护剂、冻干过程参数(预冻温度、降温速率、干燥温度和真空度等),相比之下,保护剂对冻干保存效果的影响最为突出。
冷冻干燥会使腺病毒经历低温和脱水两个激烈的物理变化过程,对腺病毒造成大规模损伤,最终导致病毒死亡或者影响生物功能的正常发挥,因此用冷冻干燥法保存腺病毒必须添加合适的保护剂。通过对自然界无水生命在低温和干燥环境下存活机理的研究,生物学家发现糖类,特别是双糖由于具有替代水分子以及形成玻璃态的能力[14-15],在冻结和干燥过程中对微生物有很好的保护作用,是非常有效的保护剂。本研究选择一种双糖(蔗糖)作为保护剂,比较糖浓度对腺病毒冻干保存的保护效果。
有研究结果表明冻干制品的稳定性与其水分密切相关[16],只有将腺病毒冻干制品的水分控制在中国药典2015年版三部规定的范围内,才能保证其稳定性,而蔗糖的浓度对于腺病毒冻干制品水分的控制是至关重要的,蔗糖浓度低,不能保证腺病毒冻干制品的活性,蔗糖浓度高,冻干制品的水分又难以控制。因此保护剂中选择一个合适的蔗糖浓度,对腺病毒冻干制品水分控制极为重要。本研究用三种不同的蔗糖浓度作为冻干保护剂时,发现蔗糖含量在3%时对腺病毒活性的影响最小,而且用3%蔗糖浓度作为保护剂的腺病毒冻干制品,在37 ℃及4 ℃稳定性较好。近两年有使用混合糖类作为血小板冻干制品的保护剂研究[17],但混合糖作为腺病毒冻干的保护剂效果还有待继续研究。
另外,冻干条件对于水分的控制也比较重要。冻干过程一般包括预冻、升华干燥(第一阶段干燥)、解吸干燥(第二阶段干燥)。在研究腺病毒的冻干条件时,发现预冻十分重要[8],在预冻阶段,降温速度越快越好,这主要还是由冻干机的降温性能决定的,而在此阶段中,要掌握适宜的预冻时间,以确保抽真空前所有的产品均已冻实,这样就不致因抽真空而喷瓶,并且能减少“粗结晶”(的出现,最终利于水分的控制。而在升华干燥阶段,最关键的是要考虑在适宜的时间内使制品干燥成型,那就必须获得最适宜的热量以确保腺病毒制品的升华,这与真空度密切相关[18]。真空度<10 Pa,并在升华干燥阶段将制品温度维持在5 ℃为最好。在解吸干燥阶段,主要是去除产品的结合水分,应尽量将产品温度迅速上升到设定的最高温度,温度过低,不能控制水分,温度过高,对于腺病毒来说,又有失活的可能,在此阶段将制品温度维持在 28 ℃左右是最佳的。
参考文献
[1] 刘永靖, 陈飞虎, 于奇, 等. 腺病毒载体携带人TRAIL基因治疗H446小细胞肺癌的体外实验研究[J]. 中国药理学通报, 2007, 23(6): 755-759.
[2] 袁子国, 张秀香, 高胜言, 等. 腺病毒载体的研究进展与展望[J]. 吉林畜牧兽医, 2008, 29(1): 13-14.
[3] 胡奇婵, 陈玥, 王丽, 等. 腺病毒载体用于基因治疗的研究进展[J]. 解放军医药杂志, 2011, 23(5): 76-80.
[4] 哈小琴, 王澜, 劳妙芬, 等. 贮存温度对携带HGF基因的重组腺病毒Ad-HGF稳定性的影响[J]. 军事医学, 2004, 28(1): 16-18.
[5] 靖宁, 伍秀兰, 梁家辉. 真空冷冻干燥对病毒含量的影响[J]. 农业科技与信息, 2007(2): 47-47.
[6] 李睿, 徐斌, 王弢. 冻干乙型脑炎减毒活疫苗的冻干工艺优化研究[J]. 微生物学免疫学进展, 2009, 37(2): 7-11.
[7] 王冰, 朱薇婕, 鄭竺晶, 等. 丹参水溶性有效部位冻干工艺优化[J]. 中成药, 2009, 31(5): 782-784.
[8] 刘嘉, 刘汉清. 冻干技术及其在中药冻干制剂中应用的研究进展[J]. 中国医药技术经济与管理, 2007(5): 34-42.
[9] 黄卫新, 朱莲, 吴海光, 等. 不同进箱温度对冻干甲肝疫苗的影响[J]. 中国高等医学教育, 2013(4): 121-121.
[10] 吕文利, 赵新华, 李毅, 等. 冻干参数对疫苗质量的影响[J]. 中国生物制品学杂志, 2015, 28(11): 1118-1120.
[11] 张海霞, 冯若飞, 王丹, 等. 脑心肌炎病毒的体外细胞增殖培养及其冻干保存试验[J]. 中国兽医科学, 2012(11): 1128-1132.
[12] Croyle MA, Cheng X, Wilson JM. Development of formulations that enhance physical stability of viral vectors for gene therapy[J]. Gene Ther, 2001, 8(17): 1281-1290.
[13] Croyle MA, Roessler BJ, Davidson BL, et al. Factors that influence stability of recombinant adenoviral preparations for human gene therapy[J]. Pharm Dev Technol, 1998, 3(3): 373-383.
[14] Cardona S, Schebor C, Buera MP, et al. Thermal stability of invertase in reduced-moisture amorphous matrices in relation to glassy state and trehalose crystallization[J]. Food Sci, 1997, 62(1): 105-112.
[15] Crowe JH, Oliver AE, Hoekstra FA, et al. Stabilization of dry membranes by mixtures of hydroxyethyl starch and glucose: the role of vitrification[J]. Cryobiology, 1997, 35: 20-30.
[16] 徐斌, 王弢, 周园, 等. 麻疹减毒活疫苗冻干工艺的优化[J]. 中国生物制品学杂志, 2010, 23(12): 1343-1346.
[17] 吴学忠, 吕蓉, 李素萍, 等. 血小板冷冻干燥基础保护剂添加不同含量的不同糖类的实验研究[J]. 国际输血及血液学杂志, 2015, 38(3): 221-226.
[18] 郭玺权, 李宁, 陈宁. 冻干制剂工艺的探索[J]. 药学进展, 1999, 23(4): 234-237.

