人参花蕾对D-半乳糖大鼠骨代谢的影响
张新乐,巫旭娜,陈文双,陈春玲,许碧莲,,邹丽宜,吴 铁
(广东医学院1.药理学教研室、2.广东天然药物研究与开发重点实验室、3.生理学教研室,广东 湛江 524023)
人参花蕾对D-半乳糖大鼠骨代谢的影响
张新乐1,巫旭娜1,陈文双2,陈春玲3,许碧莲1,2,邹丽宜1,吴 铁1
(广东医学院1.药理学教研室、2.广东天然药物研究与开发重点实验室、3.生理学教研室,广东 湛江 524023)
目的 建立D-半乳糖致♂大鼠骨丢失动物模型,采用骨形态计量学方法、生物力学等观察人参花蕾对大鼠骨组织的影响,并探讨其作用机制。方法 3月龄的清洁级♂ SD大鼠53只,随机分为5组,其中正常组13只,正常组颈背部皮下注射生理盐水5 mL·kg-1·d-1,其余组颈背部皮下注射D-半乳糖100 mg·kg-1·d-1。正常组(NS)和模型组(DG)给予溶剂对照,其余组分别予:阳性药物组(司坦唑醇0.54 mg·kg-1·d-1+吡拉西坦432 mg·kg-1·d-1, CP)、低剂量人参花蕾组GF(L)(0.486 g·kg-1·d-1)、高剂量人参花蕾组GF(H)(2.43 g·kg-1·d-1),均灌胃给药,连续14周。测量胫骨上段松质骨和胫骨中段皮质骨骨组织形态计量学参数;检测大鼠右侧股骨(三点弯曲法)的生物力学性能,检测左侧股骨骨钙、磷以及骨胶原的含量。结果 与DG组比较,低、高剂量的人参花蕾分别使胫骨上段的骨小梁数量增加,骨小梁分离度减少,每毫米破骨细胞数和破骨细胞贴壁长度减少。与DG组比较,低、高剂量人参花蕾组胫骨中段的皮质面积百分率增加、骨髓面积百分数下降。与DG组比较,低、高剂量人参花蕾组股骨BWW/BW明显降低,弹性载荷增加。结论 低、高剂量的人参花蕾能有效对抗D-半乳糖所致的大鼠胫骨上段和中段骨的丢失,机制与抑制破骨细胞的骨吸收有关,但对股骨无机质丢失的预防作用不明显。
人参花蕾;D-半乳糖;骨质疏松;骨组织形态计量学;生物力学;♂大鼠
骨质疏松症(osteoporosis)是一种系统性骨病,特征是骨量减少和骨的微细结构破坏。随着我国老年人口的增加,老年性骨质疏松症发病率处于上升趋势,在中国乃至全球都是一个值得关注的健康问题。骨质疏松临床表现为骨的脆性增加,骨折的风险增加[1]。促进骨形成的药物较适合于老年性骨质疏松[2],该类药物应用较多的有氟化物和甲状旁腺激素。氟化物虽己在临床上应用30多年,但仍有争议,副作用较多,长期口服除了会增加压力性骨折发生的风险,还会引起胃肠刺激、外周关节痛等不良反应,所以应避免长期用药[3]。而甲状旁腺激素作为一种单链多肽激素,不可避免会出现一些相关副作用,包括一过性血钙升高、高尿钙、高尿酸血症及促进肿瘤生长等。因此,如何改进药物和用药方案,减轻药物的不良反应是一个有待于解决的问题。
D-半乳糖是用于建立衰老模型的经典物质,我们课题组发现D-半乳糖也能使大鼠骨丢失。骨的丢失是属于低转换型的[4],在病理生理上与老年性骨质疏松有诸多相似之处,所以本实验以D-半乳糖复制老年性骨质疏松模型。人参花蕾为人参的干燥未开放的伞形花序,主要成分为人参皂苷,含量比人参高6~8倍。也有研究表明,人参最有价值的药用部位并不是人参根,而是人参花蕾[5]。我们课题组的研究显示,人参可以有效防治由于去卵巢、糖皮质激素、四氯化碳和D-半乳糖等因素导致的骨丢失,并可以增强骨的力学性能[6]。这些研究提示了人参有抗骨质疏松的药理作用,我们推测人参花蕾也能防治骨质疏松,然而目前仍未见相关的报道。
1 材料与方法
1.1 实验动物 53只3月龄清洁级SD♂大鼠,由广东省医学实验动物中心提供(合格证号:2006A015),体质量(201±20)g。
1.2 药品与仪器 人参花蕾浸膏:广东东莞广发药业有限公司,批号:070130;D-半乳糖:国药集团化学试剂有限公司,批号:F20061025; 脑复康(吡拉西坦):广州康奇力药业有限公司,批号:061002;康力龙(司坦唑醇):广西南宁白会药业集团有限公司,批号:070101;盐酸四环素荧光标记物:上海新亚制药厂;钙黄绿素:Sigma Chemical Co., USA; Goldner′s染料试剂:Sigma Chemical Co., USA。低速锯:Buehler LTD.USA;LEICA2155硬组织切片机:德国LEICA公司;858 Mini Bionix型材料测试系统:MTS,USA。
1.3 老年性骨质疏松模型的建立及药物分组 53只3月龄清洁级SD♂大鼠,适应性饲养1周后,以数字表法随机分为正常组(13只)、模型组、阳性药物组、人参花蕾低、高剂量组,每组10只。除正常组颈背部皮下注射生理盐水5 mL·kg-1·d-1外,其余组颈背部皮下注射D-半乳糖100 mg·kg-1·d-1。正常组(NS)和模型组(DG)给予溶剂对照,阳性药物组给予司坦唑醇0.54 mg·kg-1·d-1+吡拉西坦432 mg·kg-1·d-1(CP),低剂量人参花蕾GF(L)(0.486 g·kg-1·d-1)、高剂量人参花蕾GF(H)(2.43 g·kg-1·d-1,),均灌胃给药,造模的同时开始给药,连续14周。所有大鼠在处死前d 14、13和d 4、3分别皮下注射盐酸四环素(25 mg·kg-1)和钙黄绿素(5 mg·kg-1)进行荧光标记。全自由摄食,每周称体重1次,并按体重变化调整给药量。实验结束时,大鼠麻醉后心脏抽血处死,取左侧胫骨上段、第5腰椎和胫骨中段,按文献[7]方法进行不脱钙包埋后,分别制成骨切片和骨磨片,通过半自动图像分析系统进行骨组织形态计量学测量;分析大鼠右侧股骨(三点弯曲法)的生物力学性能用858 Mini Bionix型材料测试系统;将左侧股骨烘干、消化,分成两份,检测其骨磷、钙以及骨胶原的含量。
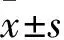
2 结果
2.1 各组大鼠体重的变化 由Fig 1可见,与正常组(NS)比较,模型组(DG)大鼠到第8、10、12、14周时,体重增加明显(P<0.05),说明此剂量的D-半乳糖在实验后期可引起大鼠体重增加。使用CP治疗后,D-半乳糖大鼠体重在第2周有所增加,第12、14周减轻明显(P<0.05),提示CP可以抑制D-半乳糖大鼠体重的增加。GF高、低剂量第2周的体重明显高于D-半乳糖大鼠(P<0.05),但对其余时间点无明显影响(P>0.05),提示GF对D-半乳糖大鼠体重影响不大。与CP组比较,GF高、低剂量组第12~14周体重均高于CP组(P<0.01),说明人参花蕾抑制D-半乳糖大鼠体重的作用不及复方司坦唑醇。2.2 各组大鼠胫骨上段形态计量学静态和吸收参数的变化 人参花蕾对D-半乳糖大鼠胫骨上段骨组织形态的影响见Fig 2。正常组(Fig 2A)大鼠胫骨上段的骨小梁排列紧密、连续性好、粗细均匀。DG组(Fig 2B)的骨小梁结构明显细小、稀疏,出现大片空白骨髓区。阳性药物组(Fig 2E)的骨小梁较模型组明显增多、增粗,连续性有所恢复。人参花蕾低剂量组(Fig 2C)、人参花蕾高剂量组(Fig 2D)的骨小梁致密、粗、长,且分布均匀,连续性较好,较模型组有了明显的改善。

Fig 1 Effects of GF on body weight in DG rats(±s)
*P<0.05,**P<0.01vsNS;△P<0.05,△△P<0.01vsDG;#P<0.05,##P<0.01vsCP
人参花蕾对D-半乳糖大鼠胫骨上段骨组织计量学中静态参数骨小梁面积百分数(%Tb.Ar)、骨小梁宽度(Tb.Th)、骨小梁数目(Tb.N)、骨小梁分离度(Tb.Sp)和骨吸收参数破骨细胞周长百分率(%Oc.S.Pm)、每毫米破骨细胞数(Oc.N/mm)的影响见Tab 1。与NS组相比,DG组Oc.N/mm与%Oc.S.Pm分别增加了102.9%(P<0.01)和113.3%(P<0.01),而%Tb.Ar、Tb.Th分别降低了30.1%(P<0.01)、10.2%(P<0.05),Tb.Sp增加了38.7%(P<0.01)。说明D-半乳糖使大鼠胫骨上段松质骨的破骨细胞的数量增加,骨小梁数量减少,微观结构疏松退化。与DG组相比,CP的%Tb.Ar、Tb.N分别升高了57.8%(P<0.01)、45.0%(P<0.01),Tb.Sp减少了36.1%(P<0.01),Oc.N/mm和%Oc.S.Pm分别减少了65.9%(P<0.01)和68.8%(P<0.01)。GF(L)、GF(H)分别使D-半乳糖大鼠胫骨上段松质骨的%Tb.Ar增加36.3%(P<0.05)和44.1%(P<0.01),Tb.Sp减少了24.7%(P<0.05)和27.2%(P<0.01);GF(L)组的Oc.N/mm和%Oc.S.Pm分别减少了55.1%(P<0.05)和65.6%(P<0.01),GF(H)组的Oc.N/mm和%Oc.S.Pm分别减少了77.5%(P<0.01)和84.4%(P<0.01)。说明复方司坦唑醇和高、低剂量的人参花蕾抑制了骨吸收,均可有效预防D-半乳糖对大鼠胫骨上段松质骨显微结构的破坏。
2.3 各组大鼠胫骨上段形态计量学动态参数的变化 人参花蕾对D-半乳糖大鼠胫骨上段骨组织形态计量学中动态参数荧光周长百分数(%L.Pm)、骨矿化沉积率(MAR)及3种骨形成率指标(BFR/BS、BFR/BV、BFR/TV)的影响见Tab 2。与NS组相比,DG组的动态参数无明显变化。

Fig 2 Trabecular area in tibia(Masson-Goldner Trichrome staining, ×10)
A:NS group;B:DG group;C:GF(L) group;D:GF(H) group; E: CP group
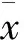
Tab 1 Effects of GF on static histomorphometric and absorption parameters of PTM in DG rats(±s)
*P<0.05,**P<0.01vsNS;△P<0.05,△△P<0.01vsDG;#P<0.05vsCP
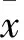
Tab 2 Effects of GF on dynamic histomorphometric parameters of PTM in DG rats(±s)
△P<0.05vsDG

Fig 3 Cortical bone area in tibia(×10)
A: NS group; B: DG group; C: GF(L) group; D: GF(H) group; E: CP group
2.4 各组大鼠胫骨中段皮质骨静态参数的变化 人参花蕾对D-半乳糖大鼠胫骨中段皮质骨形态的影响见Fig 3。人参花蕾对D-半乳糖大鼠胫骨中段皮质骨静态参数皮质骨面积(Ct.Ar)、皮质骨面积百分数(%Ct.Ar)、骨髓腔面积百分数(%Ma.Ar)的影响见Tab 3。由Tab 3、Fig 3可知,与NS组比较,DG组大鼠的静态参数%Ct.Ar下降4.0%(P<0.01),%Ma.Ar增加16.4%(P<0.01),提示D-半乳糖使大鼠胫骨中段皮质骨面积比例缩小,骨髓腔扩大,说明D-半乳糖可引起大鼠皮质骨骨量丢失。与DG组比较, CP组的%Ct.Ar、%Ma.Ar无明显变化,提示复方司坦唑醇对D-半乳糖大鼠胫骨中段的皮质骨骨量丢失的作用不大。与DG组比较,GF(L)组的%Ct.Ar增加3.6%(P<0.05)、%Ma.Ar下降12.3%(P<0.05),GF(H)组的Ct.Ar增加10.2%(P<0.05)、%Ct.Ar增加3.8%(P<0.05)、%Ma.Ar下降12.8%(P<0.05)。说明高、低剂量的人参花蕾均可有效预防D-半乳糖引起的大鼠胫骨中段皮质骨骨量丢失。与CP组比较,GF(L)、GF(H)的作用明显强于CP(P<0.05)。
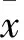
Tab 3 Effects of GF on static histomorphometric parameters of Tx in DG rats(±s)
**P<0.01vsNS;△P<0.05vsDG;#P<0.05vsCP
2.5 各组大鼠胫骨中段皮质骨动态参数的变化 人参花蕾对D-半乳糖大鼠皮质骨动态参数骨外膜的骨外膜荧光周长百分数(%P-L.Pm)、骨外膜骨矿化沉积率(P-MAR)、骨外膜骨形成率(P-BFR/BS)及骨内膜的骨内膜荧光周长百分数(%E-L.Pm)、骨内膜骨矿化沉积率(E-MAR)、骨内膜骨形成率(E-BFR/BS)的影响,见Tab 4。与NS组相比,DG组大鼠皮质骨内、外膜的动态参数无明显变化(P>0.05),提示D-半乳糖对大鼠皮质骨内、外膜的骨形成无明显作用。
2.6 各组大鼠股骨物理指标的变化 人参花蕾对D-半乳糖大鼠股骨湿重(BWW)、干重(BDW)、湿重/体重比(BWW/BW)、干重/体重比(BDW/BW)、长度(BL)和宽度(BD)的影响见Tab 5。与NS组比较,DG组大鼠股骨BL和BD无明显变化,BWW/BW、BDW/BW明显降低(P<0.05),提示D-半乳糖使大鼠股骨的重量降低,但对股骨的形状改变不大。与DG组比较,CP组大鼠股骨BDW/BW明显增加(P<0.05),BWW/BW有增加趋势,但差异无统计学意义(P>0.05);GF(L)和GF(H)组的BWW/BW比DG、CP组明显降低,BDW/BW比CP组明显降低。组间的BD、BL无明显变化。提示CP可以有效预防D-半乳糖所致大鼠股骨重量的降低,但GF(L)、GF(H)未能有效预防大鼠股骨重量的降低。
2.7 各组大鼠股骨生化指标的变化 人参花蕾对D-半乳糖大鼠股骨的Hyp(骨羟脯氨酸/骨干重)、Ca (骨钙含量/骨干重)、P (骨磷含量/骨干重)、Ca/Hyp(钙/羟脯氨酸含量比值)的影响见Tab 6。与NS组比较,DG组大鼠股骨骨钙含量下降明显(P<0.05),提示D-半乳糖可使大鼠无机质骨钙明显丢失。与DG组比较,CP、GF(L)和GF(H)组的Ca值无明显变化,提示各药物组未能有效预防D-半乳糖所致的无机质丢失。
2.8 各组大鼠股骨生物力学参数的变化 人参花蕾对D-半乳糖大鼠股骨: 弹性载荷(elastic load)、最大载荷(maximum load)、断裂载荷(break load)、刚度(stiffness)系数、弯曲能量(bending energy)等指标的影响见Tab 7。与NS组比较,DG组大鼠股骨的弹性载荷下降了10.4%(P<0.05),提示D-半乳糖可降低大鼠股骨的骨强度。与DG组相比,CP组和GF(H)组的弹性载荷分别增加了11.4%(P<0.05)、17.9%(P<0.01),提示复方司坦唑醇和高剂量的人参花蕾可增强D-半乳糖大鼠股骨的骨强度。
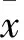
Tab 4 Effect of GF on dynamic histomorphometric parameters of Tx in DG rats(±s)
△P<0.05vsDG
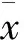
Tab 5 Effects of GF on femur configuration in DG rats(±s)
*P<0.05,**P<0.01vsNS;△P<0.05vsDG;#P<0.05,##P<0.01vsCP
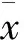
Tab 6 Effects of GF on biochemical index of femur in DG rats(±s)
*P<0.05vsNS
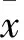
Tab 7 Effects of GF on vitodynamics of femur in DG rats(±s)
*P<0.05vsNS;△P<0.05,△△P<0.01vsDG;#P<0.05vsCP
3 讨论
老年性骨质疏松症为低转换型骨质疏松,主要是由于老年人骨代谢中骨重建处于负平衡,一方面破骨细胞对骨的吸收增强,另一方面成骨细胞活性衰退、分裂增殖缓慢,骨形成因子合成代谢受阻,导致骨形成率降低,骨量丢失。由Tab 1、Fig 2的结果可见,D-半乳糖组大鼠胫骨上段松质骨的骨量明显减少、骨小梁分离度明显增加,而密度明显降低;破骨细胞活性增加,骨吸收活跃,加速了骨质溶解。由Tab 2的结果可见,反映骨形成的参数变化不明显。以上变化显示D-半乳糖可使胫骨上段松质骨结构发生明显变化,与临床老年性骨质疏松的特点相似。此作用与大鼠皮下注射D-半乳糖后缺乏睾酮有关[8]。睾酮可以在骨内转化为二氢睾酮,可间接合成蛋白促使骨内胶原形成,使钙、磷等矿物质更好地沉积在骨内,有助于骨生成。
由Tab 3和Fig 3的结果可见,模型组大鼠的骨髓腔扩大,皮质骨面积比例下降,提示D-半乳糖可引起大鼠皮质骨骨量丢失。由Tab 4的结果可见,模型组大鼠皮质骨内、外膜的动态参数无明显变化,提示D-半乳糖对大鼠胫骨中段皮质骨骨量的影响与其内、外膜的骨形成无关,具体机制有待进一步研究。
由Tab 5的结果可见,模型组大鼠股骨的长度和宽度无明显变化,但是单位体重中股骨的湿重、干重明显下降,提示D-半乳糖可使♂大鼠股骨骨的生长不受抑制,但是骨量明显丢失。由Tab 6的结果可见,D-半乳糖组大鼠骨钙含量明显降低,提示大鼠皮下注射D-半乳糖后使无机质含量减少,骨质成分结构和比例发生改变。由Tab 7的结果可见,模型组大鼠股骨的弹性载荷下降,其他指标无明显变化,提示D-半乳糖可降低股骨的骨强度,但对外在硬度和韧性无明显影响。
本研究结果发现,阳性药物组能使D-半乳糖大鼠胫骨上段松质骨的骨量增加,股骨重量明显增加,增加股骨的骨强度。阳性药物组是由吡拉西坦和司坦唑醇组成的复方制剂,司坦唑醇为人工合成的蛋白同化类固醇类药,主要药理作用是促进蛋白质合成、抑制蛋白质异生、促使钙磷沉积和减轻骨髓抑制,促进骨合成[9]。司坦唑醇还能防止糖皮质激素所致的大鼠骨量丢失和增强其力学性能[10]。吡拉西坦是一种脑修复药物,能促进脑内ATP合成,可促进乙酰胆碱合成,并正增强神经兴奋的传导,具有促进脑内代谢作用[11],可对抗D-半乳糖引起的中枢神经元老化。
本研究结果表明,高、低剂量的人参花蕾均可使D-半乳糖大鼠胫骨上段松质骨的骨量明显增加、骨小梁密度明显增加,而分离度明显降低;破骨细胞活性降低,骨吸收减弱,反映骨形成的参数变化不明显。说明高、低剂量的人参花蕾均可有效预防D-半乳糖对大鼠胫骨上段松质骨的骨丢失和显微结构的破坏,主要是通过抑制骨吸收实现的,不明显影响骨形成。另高、低剂量的人参花蕾均可使D-半乳糖大鼠胫骨中段皮质骨面积比例增加,骨髓腔面积比例缩小,说明高、低剂量的人参花蕾均可有效预防D-半乳糖引起的大鼠胫骨中段的皮质骨骨量丢失。高、低剂量的人参花蕾对D-半乳糖大鼠股骨有机质和无机质影响不大,使股骨重量减轻,股骨的弹性载荷明显增加。其防治骨质疏松的机制可能如下:①人参花蕾的主要成分为人参皂苷[12],由于人参皂苷有促进细胞增殖和动物生长发育的作用[13],提示人参皂苷抗骨质疏松作用可能与其刺激成骨细胞的活性,促进骨形成有关。文献报道[14],人参皂苷能诱导人源骨髓间充质干细胞向成骨细胞分化,增强成骨分化的人源骨髓间充质干细胞的造血作用,成骨细胞骨形成与骨髓造血密切相关,造血活跃部位其骨形成率和骨再建也高。②人参皂苷具有抗氧化和清除自由基等作用[15],避免自由基大量积累,保护胶原分子免被破坏,导致骨中矿物质沉积,提高机体对钙的吸收和利用,促进新骨的矿化形成,防治骨质疏松。 本研究结果表明,人参花蕾以低剂量0.486 g·kg-1·d-1和高剂量2.43 g·kg-1·d-1给药14周可以有效预防D-半乳糖(100 mg·kg-1·d-1)所致♂大鼠骨丢失,高剂量与低剂量效果相仿。低、高剂量人参花蕾之间比较无统计学意义,提示人参花蕾两个剂量的作用效果相似,在0.486~2.43 g·kg-1·d-1剂量范围内没有剂量相关性。人参花蕾的剂量相关性还有待于进一步的探索。
(致谢:本文实验主要是在广东天然药物研究与开发重点实验室和药理学教研室完成的,谨此向帮助和指导课题研究的老师和同学表示衷心的感谢!)
[1] 刘 波,谢 珍,徐 彭. Sirt1与骨质疏松症的研究进展[J].中国药理学通报,2013,29(8):1054-6.
[1] Liu B,Xie Z,Xu P. Research progress of Sirt1 and osteoporosis[J].ChinPharmacolBull, 2013,29(8):1054-6.
[2] Ip T P, Leung J, Kung A W. Management of osteoporosis in patients hospitalized for hip fractures[J].OsteoporosInt,2010,21(4):S605-14.
[3] Bouletreau P H,Bost M,Fontanges E,et al. Fluoride exposure and bone status in patients with chronic intestinal failure who are receiving home parenteral nutrition[J].AmJClinNutr,2006,83(6):1429-37.
[4] 罗红梅,崔 燎,吴 铁. D-半乳糖对雄性大鼠腰椎骨密度和血清睾酮含量的影响[J].中国临床药理学与治疗学, 2005,10(6):670-3.
[4] Luo H M, Cui L, Wu T. Effects of D-galactose on lumber vertebra density and serum testosterone concentration in male rats[J].ChinJClinPharmacolTher,2005,10(6):670-3.
[5] 胡 广.人参花蕾的药用价值远超人参[J]. 家庭中医药,2005,4:55.
[5] Hu G. Ginseng flower buds of medicinal value more batter than ginseng[J].FamChinMed, 2005,4:55.
[6] 林思恩,吴 铁. 人参防治骨质疏松的研究进展[J].实验研究, 2012, 14(25):41-3.
[6] Lin S E, Wu T. Ginseng research progress of prevention and treatment of osteoporosis[J].ExpStudy, 2012, 14(25):41-3.
[7] 崔 燎,吴 铁. 骨质疏松药理学-动物实验与图谱[M]. 北京: 科学出版社,2011.
[7] Cui L, Wu T.Osteoporosisofpharmacology-theanimalexperimentandmap[M]. Beijing: Science Press, 2011.
[8] 罗红梅, 崔 燎, 吴 铁. D-半乳糖对不同性别大鼠骨形态计量学的影响[J]. 中国药理学通报, 2004,20(10):1182-5.
[8] Luo H M,Cui L,Wu T. The different effects of D-galactose on bone histomorphometry in different gender rats[J].ChinPharmacolBull, 2004,20(10):1182-5.
[9] 邹丽宜,吴 铁,崔 燎. 复方司坦唑醇抗泼尼松性大鼠骨质疏松作用研究[J]. 中国药理学通报,2004,20(9):1045-9.
[9] Zou L Y, Wu T, Cui L. Effects of compound stanozolol in prednisone-induced osteoporosis rats[J].ChinPharmacolBull, 2004,20(9):1045-9.
[10]廖进民,吴 铁,李青南,等.司坦唑醇对实验性骨质疏松症大鼠骨密度和力学性能的影响 [J].第一军医大学学报,2003,23(11):1117-20.
[10]Liao J M,Wu T,Li Q N, et al. Effect of stanozolol on bone mineral density and bone biomechanical properties of osteoporotic rats[J].JFirstMilMedUniv, 2003:23(11):1117-20.
[11]张 喻,肇玉明,王晓良,等. 干细胞治疗阿尔茨海默病的研究进展及挑战[J].中国药理学通报,2015,31(7):889-94.
[11]Zhang Y, Zhao Y M, Wang X L, et al. Advance and challenges in stem cell therapy for Alzheimer′s disease[J].ChinPharmacolBull, 2015,31(7):889-94.
[12]张金秋,夏 娟,孙光芝,等. RP-HPLC法测定人参花中11个人参皂苷含量[J]. 药物分析杂志,2015,35(9):1596-600.
[12]Zhang J Q,Xia J,Sun G Z,et al. Determination of 11 kinds of ginsenosides from Ginseng Bud by RP-HPLC[J].ChinJPharmAnal,2015,35(9):1596-600.
[13]Attele A S, Wu J A, Yuan C S. Ginseng pharmacology:multiple constituents and multiple actions[J].BiochemPharmacol,l999,58(11): 1685-93.
[14]尹利明,赵燕娜,杜文喜,等. 人参总皂苷增强成骨分化的间充质干细胞促造血作用研究[J].中国药理学通报,2015,31(1):45-9.
[14]Yin L M, Zhao Y N, Du W X,et al. Total saponins of panax ginseng enhances the effect of osteoblast differentiation from mesenchymal stem cell on promoting hematopoiesis[J].ChinPharmacolBull, 2015,31(1):45-9.
[15]李 茜,张彦敏,关 月,等.人参皂苷Rgl对大鼠肠缺血/再灌注损伤的影响[J].中国药理学通报,2010,26(3):358-61.
[15]Li Q, Zhang Y M, Guan Y, et al. Effect of ginsenoside Rgl on gut injury following intestinal ischemia/reperfusion in rats[J].ChinPharmacolBull, 2010,26(3):358-61.
* * * * * * * * * * * * * * * * * * * * *
欢迎投稿!欢迎垂询!
Effects of ginseng flower bud on bone metabolism in rats induced by D-galactose
ZHANG Xin-le1, WU Xu-na1, CHEN Wen-shuang2, CHEN Chun-ling3, XU Bi-lian1,2, ZOU Li-yi1, WU Tie1
(1.DeptofPharmacology;2.GuangdongKeyLabforResearchandDevelopmentofNaturalDrugs;3.DeptofPhysiology,GuangdongMedicalCollege,ZhanjiangGuangdong524023,China)
Aim To investigate the skeletal effects of ginseng flower bud(GF) on osteopenia induced by D-galactose using histomorphometry and biomechanical properties.Methods Fifty three-month-old male Sprague-Dawley rats were randomly divided into five groups. Rats in NS group(NS) were treated with NS(5 mL·kg-1·d-1) by subcutaneous injection and daily oral gavage with vehicle as control. Rats in the other four groups were given D-galactose at the dose of 100 mg·kg-1·d-1by subcutaneous injection. Solvent control was performed between NS and DG: gastric irrigation with distilled water of 10 mL·kg-1·d-1. Other groups were: CP was gastric irrigated with integrated medicine(stanozolol 0.54 mg·kg-1·d-1+piracetam 432 mg·kg-1·d-1), GF(L) with ginseng flower bud of 0.486 g·kg-1·d-1and GF(H) with ginseng flower bud of 2.43 g·kg-1·d-1for 14 weeks. The longitudinal proximal tibial metaphyseal(PTM), the fifth lumbar vertebral body(LVB) and tibial shaft(Tx) sections were performed undecalcifiedly and used for bone histomorphometric analysis. 858 Mini Bionix materials testing system was used to analyze the biomechanic properties of right femur via three-point bending test. The left femur was dried and assimilated, whose bone calcium(Ca), phosphate(P) content and bone hydroxyproline content were tested.Results Compared with D-glagatose group, in PTM of D-galactose treated rats, the %Tb.Ar was increased both in GF(L) and GF(H) treated groups. While the Tb.Sp was decreased. %Oc.S.Pm and Oc.N/mm decreased in GF(L), and those in GF(H) were decreased as well. In Tx, %Ct.Ar was raised, while %Ma.Ar was decreased in GF(L) and GF(H). The elastic load of femur was increased.Conclusions Compared with DG group, there are significant differences in bone histomorphometry of Tx and PTM in all doses of GF, but no significant changes are detected in hydroxyproline, Ca, and P content of femur.
ginseng flower bud; D-galactose; osteoporosis; bone histomorphometry; biomechanical properties; male rat
2017-04-07,
2017-05-06
国家自然科学基金资助项目(No 81373499);湛江市财政资金科技专项竞争性分配项目(No 2013A01025);广东省中医药局科研项目(No 20151262)
张新乐(1979-),女,硕士,讲师,研究方向:骨质疏松的药物防治,E-mail:CCLE2011@163.com; 邹丽宜(1975-),女,硕士,副教授,硕士生导师,研究方向:骨质疏松的药物防治,通讯作者,E-mail:442516867@qq.com; 吴 铁(1955-),男,教授,硕士生导师,研究方向:骨质疏松的药物防治,通讯作者,E-mail:wutie2@163.com
时间:2017-7-7 11:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.044.html
10.3969/j.issn.1001-1978.2017.08.022
A
1001-1978(2017)08-1152-07
R-332;R282.71;R336;R681.022