钙诱导花生蛋白纳米颗粒的制备及其工艺优化
陈 雪, 石爱民,刘红芝, 刘 丽,王 强*
(1.沈阳农业大学 食品学院,辽宁 沈阳 110161;2.中国农业科学院 农产品加工研究所,北京100193)
钙诱导花生蛋白纳米颗粒的制备及其工艺优化
陈 雪1,2, 石爱民2,刘红芝2, 刘 丽2,王 强*2
(1.沈阳农业大学 食品学院,辽宁 沈阳 110161;2.中国农业科学院 农产品加工研究所,北京100193)
花生蛋白作为大宗优质的植物蛋白质,资源丰富,营养价值高,具有良好的开发潜能。以花生分离蛋白为基质材料制备花生分离蛋白纳米颗粒,并优化其最佳制备工艺。通过纳米激光粒度仪及透射电子显微镜(TEM)对纳米颗粒的粒径及形态进行表征。结果表明,制备的纳米颗粒球形圆整,分散性好,粒径分布较窄,平均粒径为(94.66±0.53)nm。以花生蛋白为原料制备纳米颗粒,不仅可拓宽花生蛋白应用领域,也为开发蛋白纳米颗粒新剂型提供一定的研究基础。
花生分离蛋白;纳米颗粒;纳米激光粒度仪;透射电子显微镜
纳米颗粒是指粒径小于1μm的球状胶体颗粒,其根据材料可分为生物降解型和非生物降解型两类[1]。目前,生物降解型纳米颗粒被广泛应用于生物医学领域,其主要作为药物/营养素的递送载体。蛋白质是由各种氨基酸组成的具有空间结构的高分子聚合物,不仅具有可生物降解、无毒、无免疫原性、病人耐受和生物利用度高等特点,且来源广泛[2],是理想的生物降解型材料,因此成为许多纳米颗粒制备的主要研究对象,如白蛋白、酪蛋白、胶原蛋白等动物蛋白质已成功应用于纳米颗粒的制备[3-6]。然而,以植物蛋白质为基质材料制备纳米颗粒的报道相对较少,目前,应用于纳米颗粒制备的植物蛋白质有大豆分离蛋白、玉米醇溶蛋白等[7-8]。
花生蛋白是一种优质的植物蛋白资源,含有人体必需的8种氨基酸、维生素和矿物质等营养素,抗营养因子含量低,营养价值高,是一种极具开发潜力的优质植物蛋白质[9]。本研究中以花生分离蛋白为基质材料,利用钙离子诱导合成花生蛋白纳米颗粒,所制备的纳米颗粒球形圆整、分散性好,平均粒径为(94.66±0.53)nm。
1 材料与方法
1.1 原料及所用仪器
花生分离蛋白:作者所在实验室自制;无水氯化钙(分析纯):国药集团化学试剂有限公司产品;氢氧化钠、盐酸均为分析纯。
90-4型数显控温磁力搅拌器,上海振荣科学仪器有限公司产品;DK-S24型电热恒温水浴锅,上海精宏实验设备有限公司产品;纳米激光粒度仪,英国马尔文仪器有限公司产品;H-7500型透射电子显微镜,日本日立公司产品。
1.2 花生蛋白纳米颗粒的制备
称取一定质量的花生分离蛋白粉溶于去离子水中,配成一定浓度的花生分离蛋白溶液,0.5mol/L NaOH将pH调至实验值。将上述溶液在85℃条件下水浴加热30 min,静置冷却至室温后,用HCl将pH调至7.0。向溶液中加入一定量的CaCl2溶液,定容使最终蛋白质浓度为初始蛋白质浓度的1/2,室温下静置过夜。
1.3 花生蛋白纳米颗粒的性质考察
1.3.1 动态光散射分析 将制备的花生分离蛋白纳米溶液用纳米激光粒度仪检测纳米颗粒的粒径大小及分布,测定温度为25℃。
1.3.2 透射电子显微镜表征 取一滴纳米颗粒溶液加到覆有聚乙烯醇缩甲醛脂膜的铜网上,铜网水平放置 2~3min使分子聚集体沉积到网面上,用滤纸吸去表面多余溶液,之后滴加体积分数2%的醋酸双氧釉溶液对纳米颗粒进行负染2 min,将铜网在滤纸上放置 3 min使充分染色并吸取多余的染液,干燥后用透射电子显微镜观察并拍照。
1.3.3 正交设计筛选最佳制备工艺
1)单因素水平设置。根据预试验,本试验将重点考察制备过程中可能影响花生分离蛋白纳米颗粒粒径及分布的最终蛋白质浓度、实验pH及CaCl2浓度3个因素,设置水平分别为:最终蛋白质质量浓度:1、3、5、7、9 mg/mL;实验pH值:8、9、10、11、12;CaCl2浓度:2.5、3.5、5.0、6.5、7.5mmol/L。
2)正交实验设计。在单因素试验的基础上,按L15(33)进行正交设计(表1)。并采用SAS 9.0统计分析软件处理数据、回归方程方差分析,各因素对花生分离蛋白纳米颗粒粒径及分布影响程度分析。

表1 正交设计因素水平表Table 1 Orthogonal factor levels
2.1 单因素实验
2.1.1 实验pH对花生蛋白纳米颗粒粒径的影响酸性实验条件下,花生蛋白其等电点产生沉淀而影响实验结果,故本研究中选择碱性条件作为实验研究的pH范围。固定花生蛋白最终质量浓度为3 mg/mL,CaCl2浓度为5 mmol/L,分别在不同实验pH值条件下制备花生蛋白纳米颗粒,对粒径进行测定,结果见图1。随着实验pH值的逐渐增大,纳米颗粒的粒径呈先减小后增大的趋势,在pH值11时达到最小。花生蛋白的等电点在4.5左右,pH为碱性时,花生蛋白带负电荷。此外,在碱性条件下,蛋白质会发生水解,蛋白质分子中氨基酸残基的侧链基团或多肽链会发生断裂,而随着pH的升高,蛋白质的水解程度也逐渐增大[10]。在本实验中,体系的粒径呈先减小后增大的趋势,这可能是由于在pH 8~11时,随着pH的升高,水解后得到的分子链段越来越小,从而使得形成的蛋白颗粒的粒径呈下降趋势;当pH过高时,可能使得已形成的蛋白颗粒的表面电荷发生改变,引起蛋白颗粒间的相互聚集,从而使得体系的粒径呈增大的趋势。
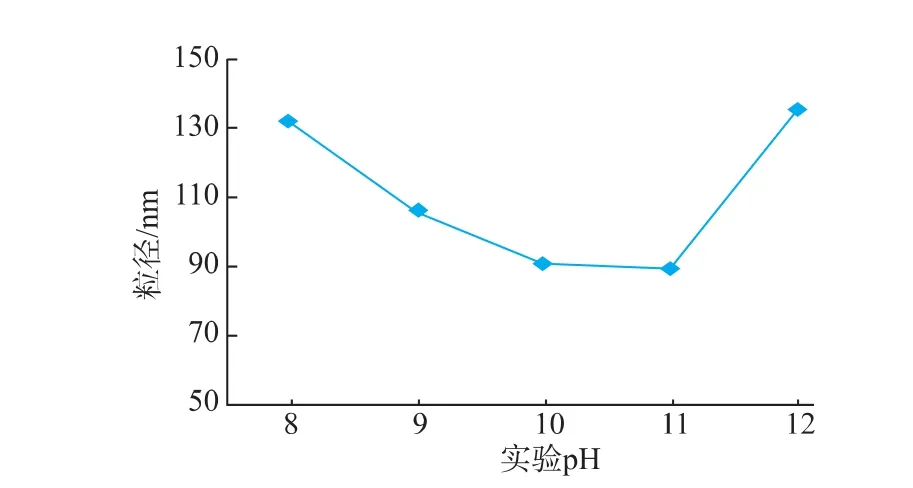
图1 实验pH值对花生蛋白纳米颗粒粒径的影响Fig.1 Effect of pH on the particle size of peanut protein nanoparticles
2.1.2 CaCl2浓度对花生蛋白纳米颗粒粒径的影响固定实验pH值为11,花生蛋白最终质量浓度为3 mg/mL,分别在不同CaCl2浓度条件下制备花生蛋白纳米颗粒,对粒径进行测定,结果见图2。随着CaCl2浓度的逐渐增大,纳米颗粒的粒径呈先减小后增大的趋势,在CaCl2浓度为5mmol/L时达到最小。这可能是由于蛋白质经水解后得到的分子链段上存在与Ca2+相互作用的结合位点,当体系的Ca2+浓度逐渐增加时,使得越来越多的分子链段与其相互作用,促进分子链段的稳定折叠,从而诱导结构紧凑、粒径较小的蛋白质聚集体的形成;当Ca2+浓度过高时,过多的Ca2+可能进一步与蛋白质聚集体相互作用,从而使得体系的粒径呈增大的趋势。有研究表明,水解后的蛋白质由于氨基酸残基的暴露,可与高价态的金属离子相互作用而形成具有稳定网络结构的蛋白分子聚集体[11],本实验所得与该结论相似。
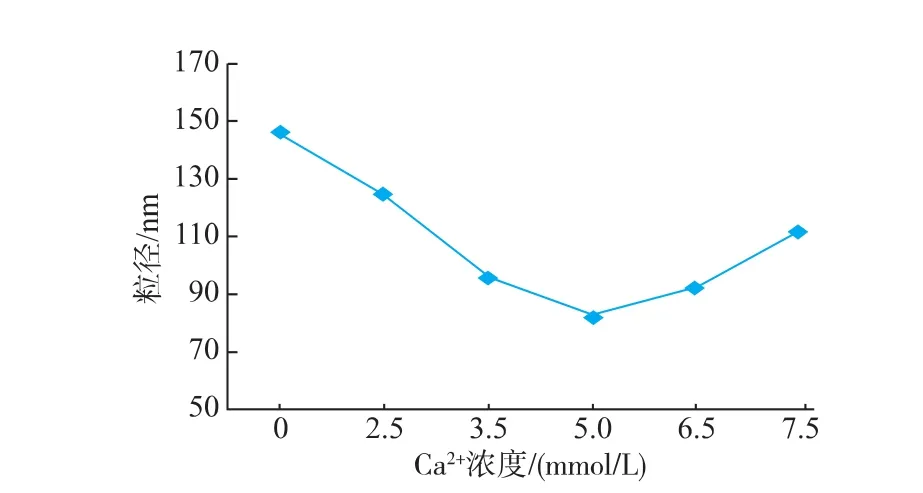
图2 Ca2+浓度对花生蛋白纳米颗粒粒径的影响Fig.2 Effect of Ca2+concentration on the particle size of peanut protein nanoparticles
2.1.3 最终蛋白质浓度对花生蛋白纳米颗粒粒径的影响 固定实验pH值为11,CaCl2浓度为5 mmol/L,分别在不同最终蛋白质浓度条件下制备花生蛋白纳米颗粒,对粒径进行测定,结果见图3。随着蛋白质浓度的逐渐增大,纳米颗粒的粒径呈先减小后增大的趋势,在蛋白质最终质量浓度为3mg/mL时达到最小。分析其原因,可能是由于在实验pH及Ca2+浓度确定的条件下,蛋白质质量浓度为3mg/mL时,体系恰好达到平衡状态,而当蛋白质质量浓度增加时,体系中没有足够的Ca2+与蛋白质分子链段相互作用,导致多余的蛋白质分子间相互作用形成较大蛋白质聚集体从而使得体系的平均粒径有所增大。

图3 蛋白质质量浓度对花生蛋白纳米颗粒粒径的影响Fig.3 Effect of protein concentration on the particle size of peanut protein nanoparticles
2.2 正交实验结果
基于单因素实验,以实验pH 11、最终蛋白质质量浓度3mg/mL、CaCl2浓度5mmol/L为零水平,设计3因素3水平正交试验,以纳米颗粒的粒径为响应值,分析各因素对纳米颗粒粒径的影响,结果如表2所示。
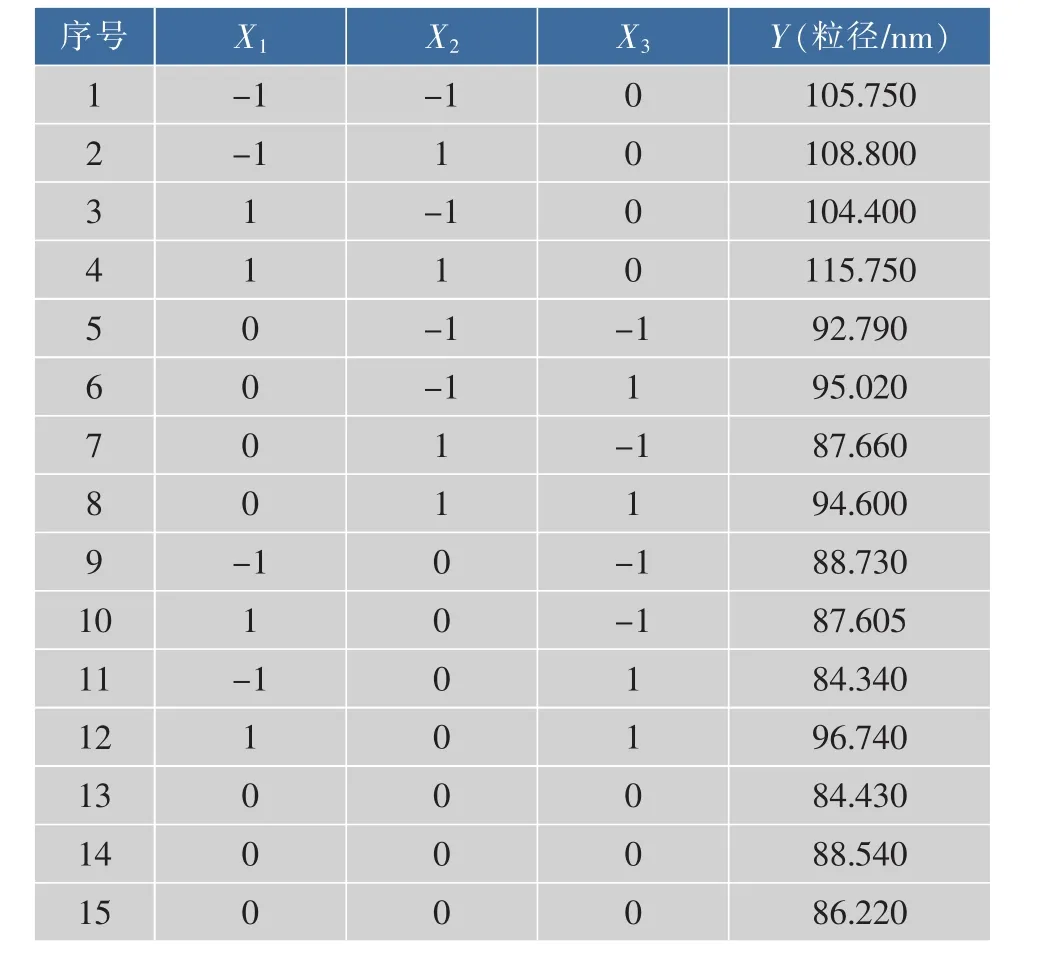
表2 正交实验设计及结果Table 2 Results of the orthogonal design
2.2.1 回归方程的建立与检验 根据试验结果,利用SAS 9.0统计分析软件,建立纳米颗粒粒径Y与各影响因素X间的二次回归方程,并对结果进行方差分析,见表3。
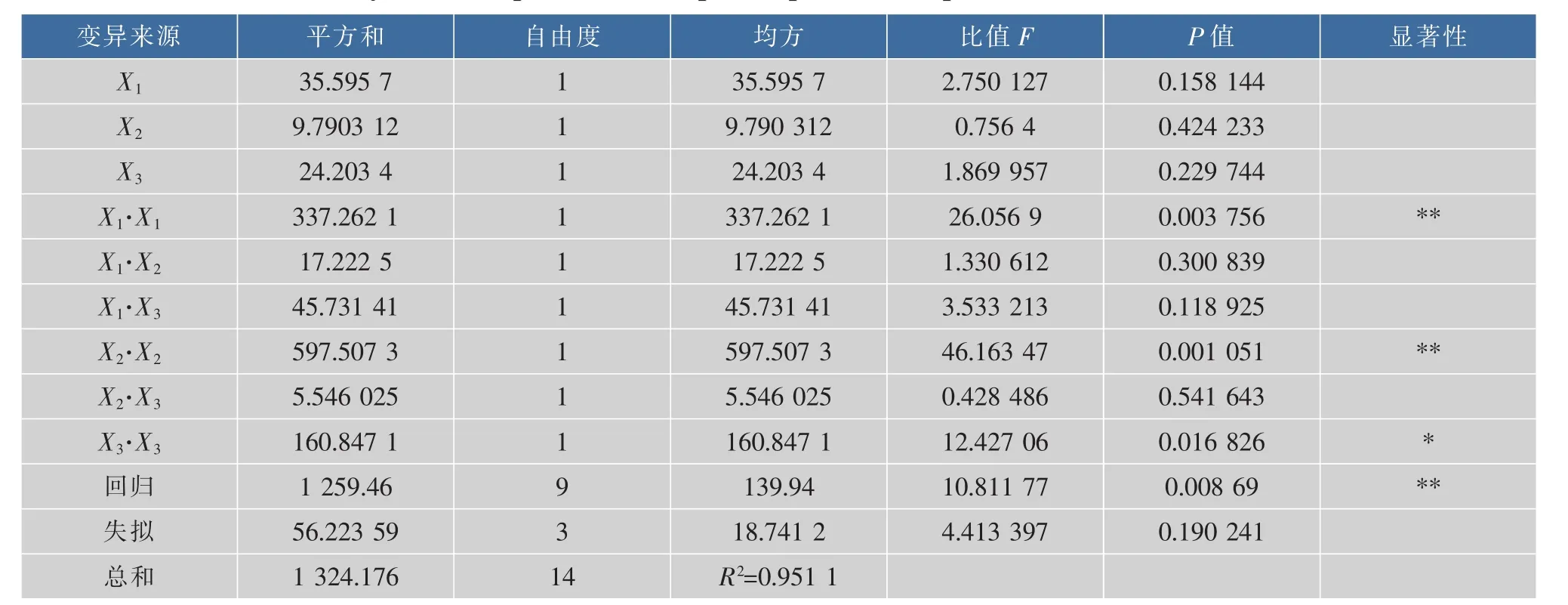
表3 各因子组合花生分离蛋白纳米颗粒粒径方差分析表Table 3 Variance analysis for the particle size of peanut protein nanoparticles from different factor combinations
经SAS数据处理,采用多项式回归分析方法进行实验数据拟合,得到的二次多项式如式(1):
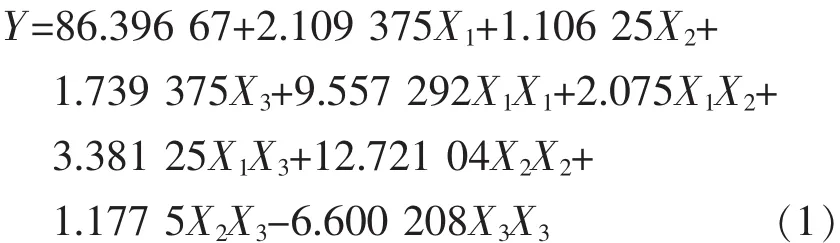
由方差分析可知,回归方程的显著性检验F值为10.811 77(P=0.008 69<0.01),表明回归方程在试验点上的拟合度达到极显著水平;失拟性检验F值为4.413 397(P=0.190 241>0.05),表明差异不显著,回归方程无失拟因素存在;且回归模型相关系数R2=0.951 1,说明模型成立且可靠。
剔除α=0.05显著水平不显著项后,简化后的回归方程如式(2):
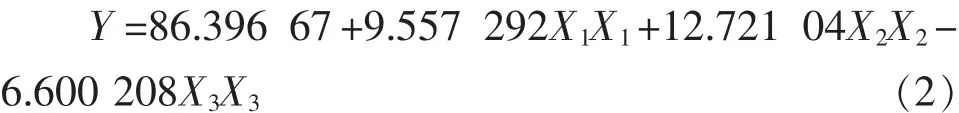
2.2.2 各因素影响程度分析 各因素的F值可反映出其对试验指标的重要性,比值F越大,表明对试验指标的影响越大。由表3可知,比值FX1=2.750 127,FX2=0.756 4,FX3=1.869 957,即各因素对花生分离蛋白纳米颗粒粒径的影响程度大小顺序为:实验pH>CaCl2浓度>花生分离蛋白最终质量浓度。
2.2.3 回归模型的验证 经SAS软件统计分析,花生分离蛋白纳米颗粒的最佳理论制备工艺参数为:实验pH 10.94,花生分离蛋白最终质量浓度2.98 mg/mL,CaCl2浓度5.05mmol/L。此条件下花生分离蛋白纳米颗粒的理论预测粒径为89.638 33 nm,置信区间为[83.620 0,95.656 6]。为验证所分析结果是否可靠,在上述最优条件下进行3次重复试验,得到花生分离蛋白纳米颗粒的粒径为(94.66±0.53)nm,在置信区间范围内,可知实际值与理论值相符。透射电子显微镜观察发现,花生分离蛋白纳米颗粒粒径均一,具有较好的分散性及圆整度(见图4)。
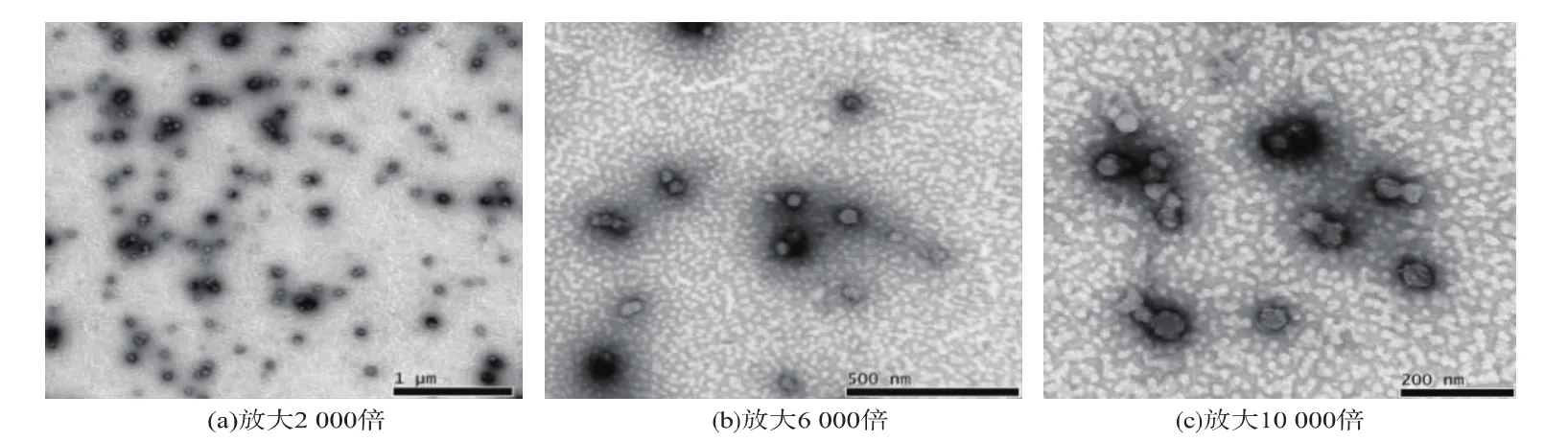
图4 花生蛋白纳米颗粒的透射电子显微镜图片Fig.4 Transm ission electron m icroscopy image of peanut protein nanoparticles
4 结语
通过条件优化,利用钙离子诱导法成功制备了花生分离蛋白纳米颗粒。制得的花生分离蛋白纳米颗粒具有良好的分散性、粒度分布均一,平均粒径为(94.66±0.53)nm。本研究中,花生蛋白纳米颗粒的制备具有操作简单、无有毒试剂使用等优点,因此,在新型递送载体领域,其极具作为药物/营养素递送载体的应用潜力。
[1]COOMBES A G A,LIN W,O'HAGEN D T,et al.Preparation of protein m icrospheres,films and coatings:U.S.Patent 6,592,844[P].2003-7-15.
[2]王强.花生加工品质学[M].北京:中国农业出版社,2013.
[3]SILVA R,FERREIRA H,CARVALHO A C,etal.Proteinm icrospheres as suitable devices for piroxicam release[J].Colloids and Surfaces B:Biointerfaces,2012,92:277-285.
[4]BRESLAUER D N,MULLER S J,LEE L P.Generation of monodisperse silk microspheres prepared w ith m icrofluidics[J]. Biomacromolecules,2010,11(3):643-647.
[5]ZENG Ying,XIAO Suyao,CHEN Xuexiang,etal.Preparation and characterization of casein-glucose conjugatesmicrospheres[J]. Science and Technology of Food Industry,2013,34(12):238-242.(in Chinese)
[6]JAHANSHAHIM,SANATIM H,HAJIZADEH S,etal.Gelatin nanoparticle fabrication and optimization of the particle size[J]. Physica Status Solidi(a),2008,205(12):2898-2902.
[7]TENG Z,LUO Y,WANG Q.Nanoparticles synthesized from soy protein:preparation,characterization,and application for nutraceuticalencapsulation[J].Journal of Agricultural and Food Chem istry,2012,60(10):2712-2720.
[8]MULLER V,PIAIJF,FAJARDO A R,etal.Preparation and characterization of zein and zein-chitosanmicrospheresw ith great prospectiveofapplication in controlled drug release[J].Journal of Nanomaterials,2011,2011:10.
[9]王强.花生生物活性物质概论[M].北京:中国农业大学出版社,2012.
[10]JIXiaoman,MA Chuanguo,WANGWei,etal.Effectofmodification on physicochemical properties of proteins[J].Cereals& Oils,2015,28(1):16-19.(in Chinese)
[11]ZHANG J,LIANG L,TIAN Z,etal.Preparation and in vitro evaluation of calcium-induced soy protein isolate nanoparticles and their formationmechanism study[J].Food Chem istry,2012,133(2):390-399.
Optim ization for the Preparation of Calcium-Induced Peanut Protein Nanoparticles
CHEN Xue1,2, SHIAimin2, LIU Hongzhi2, LIU Li2, WANGQiang*2
(1.College of Food Science,Shenyang Agricultural University,Shenyang 110161,China;2.Institute of Agro-Food Science and Technology Chinese Academy of Agricultural Sciences,Beijing 100193,China)
Peanutprotein,as a high quality vegetable protein,rich in resources and high nutritional value,and it has good development potential.Nanoparticles were synthesized from peanut protein isolate,and optim ized their preparation process.The size and spherical shape of nanoparticleswere characterized bynanolasergranulometer and transm ission electron m icroscopy (TEM).The results show that the nanoparticleswere achieved w ith good dispersibility,round shape and narrow particle size distribution.The average particle sizewas(94.66±0.53)nm.The preparation of nanoparticles from peanut protein notonly can broaden the field of peanut protein application,butalso provide a basis for the developmentofnew formulationsof protein nanoparticles.
peanut protein isolate,nanoparticles,nano laser granulometer,transm ission electron microscope(TEM)
TQ 201
A
1673—1689(2017)05—0494—05
2015-05-20
国家国际科技合作专项项目(2012DFA31400);中国农业科学院科技创新工程项目(CAAS-ASTIP-201X-IAPPST)。
*通信作者:王 强(1965—),男,北京人,工学博士,研究员,博士研究生导师,主要从事粮油加工与副产物综合利用研究。
E-mail:wangqiang06@caas.cn
陈雪,石爱民,刘红芝,等.钙诱导花生蛋白纳米颗粒的制备及其工艺优化[J].食品与生物技术学报,2017,36(05):494-498.

